Post-pericardiotomy syndrome. Comparing the experiences of our hospital with the literary data
█ Original article
DOI: 10.26430/CHUNGARICA.2017.47.6.431
Authors:
Lugosi Péter1, Simon Attila1, Bölcsföldi T. Barbara2, Alipour Shahpour1, Herrfurth Dóra1, Veress Gábor1
1Állami Szívkórház, Balatonfüred
2Pécsi Tudományegyetem Általános Orvostudományi Kar, Pécs
Summary
The post-pericardiotomy syndrome (PPS) is a common complication in patients who have undergone surgery that involves opening the pericardium, often diagnosed during the rehabilitation. The prevention and the treatment are controversial to this day. In our investigation we have studied the prevention and the treatment strategy and the new onset of atrial fibrillation by 85 (mean age: 64.7±12.3; 51 men) patients.
Results: In 27 patients (31.8%) occurred PPS. The preventive non-steroidal anti-inflammatory drugs (NSAIDs) did not affect the appearance of the syndrome (32.4% vs. 31.2%, N.S.). In most cases, PPS responded well to conservative therapy. In only 2.4% of our patients developed severe PPS. The new onset atrial fibrillation was significantly more common in the PPS group (22.2% vs. 3.4%, p<0.01).
Conclusion: PPS is a common but relatively benign disease. There are positive studies only with colchicine for prevention of PPS. NSAID, colchicin, or possibly steroid therapy may be useful for its treatment. The postoperative atrial fibrillation is often associated with PPS. Its appearance should cause the suspicion of the clinician to PPS and urgent echocardiography is needed in the first 3 postoperative months.
ISSUE: CARDIOLOGIA HUNGARICA | 2017 | VOLUME 47, ISSUE 6
Összefoglalás
A postpericardiotomiás szindróma (PPS) a nyitott szívműtétek gyakori, sokszor a rehabilitáció alatt felismerésre kerülő szövődménye, amelynek megelőzése és kezelése mind a mai napig vita tárgyát képezi. Vizsgálatunkban az Intézményünkbe érkező 85 (átlagéletkoruk: 64,7±12,3 év; 51 férfi) szívműtött betegnél alkalmazott megelőzési, illetve kezelési gyakorlat mellett az újonnan megjelenő pitvarfibrilláció gyakoriságát is vizsgáltuk.
Eredmények: 27 betegnél (31,8%) jelentkezett PPS. A megelőzésre használt nem szteroid gyulladásgátló (NSAID) terápia nem befolyásolta a PPS kialakulását (37 NSAID-ot nem szedő beteg esetén 32,4%, 48 NSAID-ot szedő beteg esetén 31,2%, NS). A PPS többségében konzervatívan volt kezelhető, mindössze a betegek 2,4%-ában alakult ki súlyos, más osztályra való áthelyezést igénylő PPS. Az újonnan jelentkező pitvarfibrilláció lényegesen gyakoribb volt a PPS-csoportban (22,2% vs. 3,4%, p<0,01).
Következtetés: A PPS gyakori, de viszonylag jóindulatú betegség. Megelőzésére csak a colchicinnel rendelkezünk pozitív vizsgálatokkal. Kezelésében NSAID, colchicin, esetleg szteroid használható. A posztoperatív pitvarfibrilláció gyakran társul PPS-hez, jelentkezése fel kell, hogy keltse a klinikus gyanúját a PPS-re, amely sürgős echokardiográfiát tesz szükségessé az első 3 posztoperatív hónapban.
Bevezetés
A postpericardiotomiás szindróma (PPS) a pericardium megnyitásával járó nyitott szívműtétek gyakori, mintegy 10-40%-ban előforduló szövődménye, ami kihat mind a műtő intézetben, mind a rehabilitáció során történő betegellátásra. Leggyakrabban a beavatkozást követő első 6 hét során kell számolnunk a tünetegyüttes megjelenésével (1, 2).
A szindróma egyértelmű patomechanizmusa még nem tisztázott, de a betegek szérumában előforduló szívizomellenes antitestek – amelyek a pericardium sérülése kapcsán megjelenő antigének ellen irányulnak – alapján autoimmun folyamatot feltételeznek a hátterében (1).
A postpericardiotomiás szindróma diagnózisa felállítható, ha az alábbi tünetek közül legalább kettő jelen van (3):
- a pleura, illetve a pericardium gyulladásos megbetegedése kapcsán megjelenő, mással nem magyarázható lázas állapot,
- perikardiális vagy pleurális fájdalom,
- perikardiális vagy pleurális dörzszörej,
- pleurális folyadék,
- perikardiális folyadék.
A perikardiális folyadék önmagában is igen gyakran előforduló szövődmény, hisz a nyitott szívműtétek után akár 85%-ban is számíthatunk kisebb-nagyobb mennyiségű folyadék felhalmozódására a szívburokban (4).
A diagnózis alapkövét a fizikális vizsgálat mellett elsősorban a gyulladásos markerek (C-reaktív Protein [CRP]) meghatározása, EKG, mellkasröntgen mellett a pleura, illetve a szív ultrahangos vizsgálata szolgáltatja. Utóbbi olcsó, noninvazív, könnyen elérhető, és a szindróma legrettegettebb szövődményének, a perikardiális tamponád kimutatásának hatékony és gyors módszere. A perikardiális folyadék mennyiségét (echoszegény terület az epicardium és parietális pericardium között) diasztolé végén javasolt meghatározni mm-ben. 10 mm alatt kevés, 10-20 mm között közepes, 20 mm fölött nagy mennyiségű perikardiális folyadékról beszélünk (1. ábra).
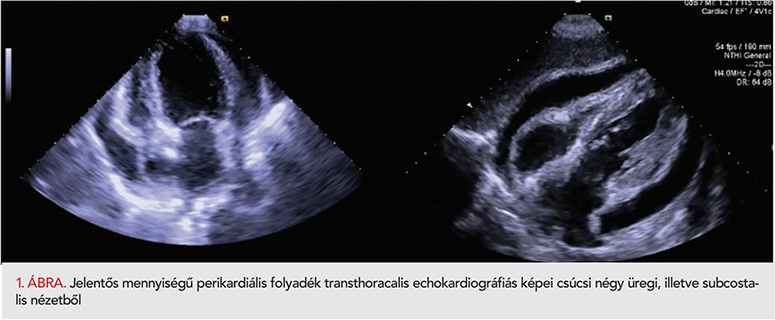
Az a tény, hogy ezen gyakran előforduló kórkép megelőzési és kezelési stratégiája egyaránt vita tárgyát képezi, arra sarkallt bennünket, hogy vizsgáljuk a PPS előfordulási gyakoriságát, valamint a műtő intézetek által alkalmazott megelőző, illetve a rehabilitáció során folytatott gyógyszeres kezelési stratégiát, illetve azok hatékonyságát.
Beteganyag és módszer
2016-os retrospektív elemzésünkben a balatonfüredi Állami Szívkórház IV. Kardiológiai Rehabilitációs Osztályán 2015. december és 2016. június között nyitott szívműtét utáni korai rehabilitációs kezelésen részt vevő betegek adatait dolgoztuk fel. Összesen 85 beteget azonosítottunk (átlagéletkoruk: 64,7±12,3 év, 51 férfi), akiknél aorto-koronáriás bypass graft (ACBG)-, billentyűműtét vagy ezek kombinációja, illetve négy esetben egyéb szívműtét (pitvari szeptumdefektus – ASD – zárás, pulmonalis homograft-implantáció és jobb kamrai kiáramlás reszekció, Bentall-, illetve David-műtét) történt.
Minden betegnél végeztünk transthoracalis echokardiográfiás vizsgálatot, és megtörténtek a gyulladásos paraméterek laborvizsgálatai a kezelés során. PPS jelentkezésénél a klinikum függvényében ismételtük a szív-, illetve pleura ultrahangos, valamint mellkasröntgen-vizsgálatokat és követtük a laboratóriumi eltérések alakulását. Elemeztük a PPS egyes elemeinek előfordulási arányát, valamint az ezzel kapcsolatba hozható paroxizmális pitvarfibrilláció jelentkezési gyakoriságát a rehabilitáció során. Adatainkat IBM SPSS 22-es verziójú statisztikai program segítségével dolgoztuk fel, amelynek során leíró statisztikákat, folytonos változók összehasonlításához kétmintás t-próbát, kategóriaváltozók megoszlásának elemzéséhez chi2-próbát használtunk. Szignifikánsnak a p<0,05-ös szignifikanciaszintet tekintettük.
Eredmények
A rehabilitációra (átlagosan 10±9 nappal a szívműtét után) betegeink 56,5%-a érkezett NSAID-terápiával, leggyakrabban naproxennel. 27 betegnél (31,8%) észleltük a PPS kialakulását. Közülük 26 betegnél fordult elő pleuralis folyadék, 2 esetben perikardiális dörzszörej, 26 esetben perikardiális folyadék. Mással nem magyarázható lázas állapotot viszont egy alkalommal sem észleltünk. 5 (5,9%) enyhe (kevés folyadék tünet nélkül) és 20 (23,5%) közepesen súlyos (kp. mennyiségű folyadék és/vagy tünet) formában jelentkező eset mellett 2 alkalommal (2,4%) fordult elő súlyos, más osztályra áthelyezést igénylő eset. A betegek jellemzőit az 1. táblázatban tüntetjük föl. Az érkezési gyulladásos markerek nem jelezték előre a PPS kialakulását, továbbá az antikoaguláns terápia meglétével sem találtunk szignifikáns összefüggést.

Gyakrabban észleltük viszont a pitvarfibrilláció kialakulását PPS előfordulása esetén (22,2% vs. 3,4%, p<0,01) (2. ábra).

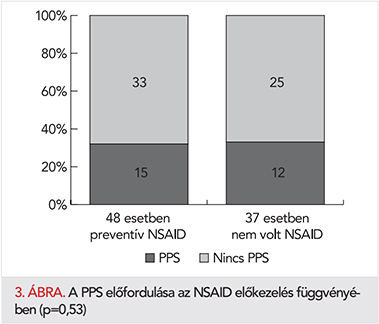
Az érkezéskor szedett NSAID nem befolyásolta a PPS kialakulását a rehabilitációs kezelés alatt (37 NSAID-ot nem szedő beteg esetén 32,4%, 48 NSAID-ot szedő beteg esetén 31,2%, NS.) (3. ábra). A PPS észlelésekor 11 betegnél (40,7%) kezdtünk NSAID-ot, NSAID-váltásra 3 esetben (11,1%) került sor, változatlan dózist alkalmaztunk 9 betegnél (33,3%), dózisemelés pedig 4 esetben (14,8%) történt. Colchicint 5 (18,5%), szteroidot 1 betegnél (3,7%) alkalmaztunk, vízhajtót pedig 17 esetben (63%) adtunk.
Megbeszélés
Elemzésünk alátámasztja azt az eddigi egyetlen – mintegy 202 ACBG-műtéten átesett beteg adatait feldolgozó retrospektív – tanulmány eredményét, amely arra hívta fel a figyelmet, hogy a posztoperatív pitvarfibrilláció gyakrabban társul postpericardiotomiás szindrómával (5).
Adataink alapján a preventív céllal adott NSAID nem volt képes csökkenteni a később megjelenő postpericardiotomiás esetek arányát. Eredményeink alapján így nem tudjuk megerősíteni annak a közleménynek az adatait, amelyben felvetették a diclofenac protektív szerepét a PPS kialakulásában (6). Nemzetközi tanulmányok metaanalízise alapján sem az acetilszalicilsav (ASA), sem pedig a kortikoszteroidok nem tudtak a placebóhoz képest szignifikáns előnyt felmutatni a PPS prevenciójában (7).
Mindezidáig csak a colchicinről bizonyosodott be, hogy műtétet követően, preventív céllal adva biztonságos és hatásos szer a PPS prevenciójában, illetve az azzal összefüggő komplikációk súlyosságának a mérséklésében (COPPS) (2). A már műtét körüli (perioperatív) időszakban elkezdett colchicin terápia szintén mérsékelni tudta a szindróma előfordulási gyakoriságát (COPPS-2), viszont mindehhez szignifikánsan gyakrabban előforduló, főleg gasztrointesztinális mellékhatások társultak, ugyanakkor a pleuralis/perikardiális folyadék, valamint a pitvarfibrilláció megjelenését nem volt képes csökkenteni (8).
A postpericardiotomiás szindróma megelőzéséhez hasonlóan annak kezelése is vita tárgyát képezi. A 2015-ös perikardiális betegségekkel foglalkozó ESC-ajánlás I. osztályú indikációként javasolja a nem szteroid gyulladáscsökkentők alkalmazását a tünetek, illetve a rekurrencia csökkentésére (3). Ugyanakkor a 2010-ben publikált POPE-vizsgálatban a diclofenac nem tudta befolyásolni a perikardiális folyadék mennyiségét a placebóhoz képest (9). Mindemellett különösen kérdéses az NSAID-ok alkalmazása tünetmentes betegeknél a kedvezőtlen mellékhatásprofil miatt (3).
Az ASA vagy NSAID-terápia colchicinnel való kiegészítését az ESC ajánlása II.a osztályú indikációval javasolja, annak ellenére, hogy a 2015-ös POPE-2-vizsgálatban ez a szer sem tudta csökkenteni a perikardiális folyadék mennyiségét a placebóhoz képest (10).
Gyakran fordulunk a napi gyakorlatban az előbbi kezelések kortikoszteroidokkal történő kiegészítéséhez is, ugyanakkor ezen gyógyszercsoport postpericardiotomiás szindrómában történő alkalmazásáról a fenti ajánlás nem tesz említést. Alkalmazása mindenesetre akut pericarditisben is csak másodvonalbeli szerként, II.a szintű indikációval – ASA/NSAID vagy colchicin hatástalansága, illetve kontraindikációja esetén – alacsony dózisban javasolt (amennyiben az infekciós eredet kizárható, illetve ha specifikus indikáció pl. autoimmun betegség áll fenn) (3).
Ugyanakkor a súlyos, tamponád veszéllyel járó esetekben a sürgős sebészeti beavatkozás (pericardium punkció vagy fenesztráció) nem megkerülhető I. osztályú C-szintű ajánlás az ESC 2015-ös perikardiális betegségekkel foglalkozó ajánlása szerint (3). Életet veszélyeztető perikardiális tamponád az esetek csak kevesebb, mint 2%-ában fordul elő. Erre az echokardiográfiás vizsgálat során a szívüregeken, elsősorban a jobb szívfélen (késő diasztoléban a jobb pitvaron, illetve kora diasztoléban a jobb kamrán) gyakran benyomatot is okozó jelentős mennyiségű perikardiális folyadék, az abnormális kamrai szeptummozgás, a mitrális beáramlási görbe sebességének légzésszinkron ingadozása (>25%-os csökkenés belégzésben) mellett a tág, légzéssel alig változó átmérőjű vena cava inferior, illetve a legsúlyosabb esetekben a „swinging heart” jelensége hívhatja fel a figyelmet (3). Fontos megjegyezni, hogy a tünetek kifejlődésében a folyadék abszolút mennyisége mellett annak kialakulásának a gyorsasága is jelentős szereppel bír.
A kevesebb mennyiségű perikardiális folyadék a legtöbb esetben pár héten belül spontán felszívódik (csak ritkán perzisztál 6 hónapon túl), konstriktív pericarditis kifejlődésével pedig az esetek kb. 3%-ában kell számolnunk (1, 3).
Következtetések
Adataink a nemzetközi vizsgálatok eredményeivel egybecsengően azt mutatják, hogy napjainkban a postpericardiotomiás szindróma megelőzésére és kezelésére használt gyógyszereink nem egyértelműen hatásosak. A jelentős mennyiségű – fenyegető perikardiális tamponáddal járó – perikardiális folyadékgyülemmel bíró betegeinket így minél előbb szívsebészeti osztályra kell (vissza)juttatnunk. Ennek időben történő felismerésében a gondos fizikális vizsgálat, szívultrahangos követés, testsúly és laborkontroll mellett nagyon fontos szerephez jut a szívritmus, illetve a pulzus rendszeres ellenőrzése a vizitek során, ugyanis vizsgálatunk alapján a paroxizmális pitvarfibrilláció szignifikánsan gyakrabban fordult elő postpericardiotomiás szindrómában. Friss műtött betegeinknél megjelenő új keletű pitvarfibrilláció előfordulása esetén mindenképp gondoljunk arra, hogy annak hátterében esetleg egy jelentős mennyiségű perikardiális folyadék húzódhat meg.
Irodalom
1. Silvana M. Horenstein, et al. Postpericardiotomy Syndrome Differential Diagnoses – Emedscape 2015 Dec 10. https://emedicine.medscape.com/article/891471-overview
2. Imazio M, et al. COlchicine for the Prevention of the Post-pericardiotomy Syndrome (COPPS): a multicentre, randomized, double-blind, placebo-controlled trial. Eur Heart J 2010 Nov; 31(22): 2749–54. https://doi.org/10.1093/eurheartj/ehq319
3. Yehuda Adler, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). European Heart J 2015; 36: 2921–2964. https://doi.org/10.1093/eurheartj/ehv318
4. Weitzman LB, et al. The incidence and natural history of pericardial effusion after cardiac surgery – an echocardiographic study – Circulation 1984; 69: 506–511. https://doi.org/10.1161/01.CIR.69.3.506
5. Utkan Sevük, et al. Relationship Between Early Post-Pericardiotomy Syndrome and Atrial Fibrillation After Cardiac Surgery. Koşuyolu Heart Journal 2016; 19(2): 85–90 https://doi.org/10.5578/khj.20950
6. Utkan Sevük, et al. Role of diclofenac in the prevention of postpericardiotomy syndrome after cardiac surgery. Vasc Health and Risk Manag 2015 Jun 30; 11: 373–8. https://doi.org/10.2147/VHRM.S85534
7. Imazio M, et al. Meta-analysis of randomized trials focusing on prevention of the postpericardiotomy syndrome. Am J Cardiol 2011 Aug 15; 108(4): 575–9. https://doi.org/10.1016/j.amjcard.2011.03.087
8. Imazio M, et al. Colchicine for prevention of postpericardiotomy syndrome and postoperative atrial fibrillation: the COPPS-2 randomized clinical trial. JAMA. 2014 Sep 10; 312(10): 1016–23. https://doi.org/10.1001/jama.2014.11026
9. Meurin P, et al. Nonsteroidal anti-inflammatory drug treatment for postoperative pericardial effusion: a multicenter randomized, double-blind trial. Ann Intern Med 2010 Feb 2; 152(3): 137–43. https://doi.org/10.7326/0003-4819-152-3-201002020-00004
10. Meurin P, et al. Colchicine for Post-Operative Pericardial Effusion: Preliminary Results of the POPE-2 Study. J Am Coll Cardiol 2015 Sep 8; 66(10): 1198–9. https://doi.org/10.1016/j.jacc.2015.05.078