Antiarrhythmic effect of polyunsaturated fatty-acid rich diet: evaluation of experimental and clinical findings
█ Review
DOI: 10.26430/CHUNGARICA.2017.47.suG.64
Authors:
Leprán István
Szegedi Tudományegyetem, Farmakológiai és Farmakoterápiai Intézet, Szeged
Summary
It is widely accepted that an increased consumption of polyunsaturated fatty acids provide antiatherogenic, antithrombotic, antiinflammatory, platelet aggregation inhibitory, blood pressure and plasma triglyceride concentration decreasing effect. Much less information is available about the potential antiarrhythmic effect of these compounds. The aim of the present paper is to review the literature about the effect and possible mechanism of n-3 and n-6 type unsaturated fatty acids in arrhythmias in experimental animals and in clinical investigations.
ISSUE: CARDIOLOGIA HUNGARICA | 2017 | VOLUME 47, SUPPLEMENTUM G
Összefoglalás
Széles körben elfogadott a többszörösen telítetlen zsírsavak fokozott bevitelének antiaterogén, antitrombotikus, gyulladásgátló, trombocitaaggregációt-gátló, vérnyomás- és plazma trigliceridcsökkentő hatása. Jóval kevesebb információ áll rendelkezésre, hogy ezen zsírsavak miként befolyásolják a különböző eredetű aritmiákat. Jelen összefoglaló célja az n-3 és n-6 családba tartozó telítetlen zsírsavak antiaritmiás hatásaival kapcsolatos állatkísérletes és humánvizsgálatok eredményeinek áttekintése, a hatás lehetséges mechanizmusának megbeszélése.
Többszörösen telítetlen zsírsavakban dús diéta
A táplálkozási szokások megváltozása révén az ember egyre kevesebb növényi eredetű terméket, ezzel párhuzamosan egyre több állati eredetű táplálékot fogyaszt. Fokozódik a táplálékkal elfogyasztott zsír, különösen a telített zsírsavakat tartalmazó zsiradék mennyiségének bevitele. Feltételezések szerint ez a táplálkozásbeli változás is oka az iszkémiás szívbetegségek miatti magas halálozásnak, amely hazánkban a harmadik legmagasabb Európában, ezzel megelőzve valamennyi környező országot (1).
Az emlősök, beleértve az embert, maguk is képesek glükózból, illetve aminosavakból szintetizálni a telített és az egyszeresen telítetlen zsírsavakat. A többszörösen telítetlen zsírsavak előanyagait, a linolsavat (18:2, n-6) és az alfa-linolénsavat (18:3, n-3) az emlősök szervezete nem képes előállítani, a táplálékkal kerülnek felvételre, ún. esszenciális zsírsavak. A linolsav fő forrása a növényi eredetű táplálék, napraforgóolaj, kukoricacsíra-olaj, szójaolaj. Az n-6 szériába tartozó hosszabb szénláncú, többszörösen telítetlen zsírsav-származékok már az emlősök szervezetében is keletkeznek linolsavból, lánc elongáció és deszaturáció révén (1. ábra). Az arachidonsav (20:4, n-6) állati eredetű húsokban, tojásban, tejben is előfordul. Az n-3 szériába tartozó zsírsavak előanyaga az alfa-linolénsav, amely nagyobb mennyiségben található egyes repceolaj fajtákban, a szójaolajban, illetve a táplálkozási célra nem alkalmazott lenolajban. Hosszabb szénláncú származékai, az eikozapentaénsav (EPA; 20:5, n-3) és docosahexaensav (DHA; 20:6; n-3), a táplálékban nagyobb mennyiségben csak a halakban fordulnak elő.
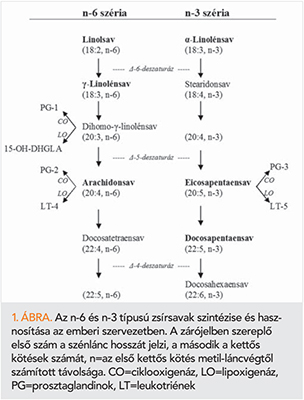
Az 1970-es években Dyerberg és Bang (2, 3) megfigyelései azt mutatták, hogy a grönlandi eszkimók körében – az átlag dán populációhoz hasonlítva – igen alacsony a szív-ér rendszeri megbetegedések előfordulása. A fő különbséget abban látták, hogy az eszkimók sok tengeri eredetű, magas n-3 tartalmú zsírsavakat tartalmazó táplálékot (hal, fóka, bálna) fogyasztanak, míg a dán populáció hasonlóan magas zsiradék fogyasztása főleg telített zsírokból áll. Az azóta eltelt időszak alatt számos vizsgálat igazolta az n-3 típusú zsírsavak fokozott bevitelének antiaterogén, antitrombotikus, gyulladásgátló, trombocitaaggregációt gátló, vérnyomás- és plazma trigliceridcsökkentő hatásait.
Jóval kevesebb vizsgálat foglalkozott az n-6 típusú zsírsavak hasonló hatásaival, illetve ezen hatások esetleges antiaritmiás következményeivel. A Keys és munkatársai által kezdeményezett, 7 országot érintő (Seven Countries Study) populációs mortalitási vizsgálatsorozat 50 év időtartamot átölelő értékelése szerint az összes halálozás fordítottan arányos a növényi olajok fogyasztásával (4). Jelen rövid összefoglaló munkában a telítetlen zsírsavak esetleges antiaritmiás hatásait kívánjuk áttekinteni állatkísérletes és humán vizsgálatok alapján.
Állatkísérletes vizsgálatok
Az említett humán populációs vizsgálatok számos állatkísérletes munkát indítottak el, amelyeknek célja a statisztikai eredmények igazolása, az ok-okozati kapcsolat és az esetleges hatásmechanizmus kutatása volt.
Korábbi vizsgálataink szerint a telítetlen zsírsavdús diéta, amit fokozott napraforgóolaj bevitellel értünk el, javította a szívizominfarktus túlélési esélyeit patkányban – egy olyan állatfajban, amely nem hajlamos a lipidanyagcsere-zavarok miatti ateroszklerotikus érelváltozásokra (5). Ezeket az eredményeinket mások is igazolták patkányban (6, 7) és majomban (8, 9). Vizsgálatainkat folytatva bizonyítottuk, hogy a telítetlen zsírsavdús diéta rövid ideig tartó szívizom-iszkémiát követő reperfúzió után is védőhatást mutat (10). A linolsavban dús diéta hatására csökkent a kamrai aritmiák időtartama és a kamrafibrilláció előfordulása, emelkedett a túlélési arány. A telítetlen zsírsavakban dús diéták antiaritmiás hatása nem a plazma koleszterinkoncentráció csökkentésével volt összefüggésben. Patkányban, hasonlóan más nem humán emlősökhöz, a fiziológiás plazma koleszterinkoncentráció alacsonyabb, mint az emberben. Ez az érték, illetve a HDL/LDL-koleszterin-frakció aránya nem változott jelentősen kísérleteinkben az 1 hónapig tartó diéták hatására.
További állatkísérletes vizsgálatok alátámasztják, hogy az n-3 típusú zsírsavakban dús diéta fogyasztása szintén jelentős mértékben csökkenti a koronária artéria lekötéssel létrehozott aritmiák gyakoriságát és javítja a túlélés esélyeit (11, 12). Ezen vizsgálatok során tisztított halolajban dús tápot fogyasztottak az állatok. Az antiaritmiás hatás eléréséhez a halolajat az elfogyasztott energia 5%-ában is elegendő volt alkalmazni, míg az n-6 típusú diéta esetén 10% napraforgóolaj eredményezett hasonló mértékű védelmet.
A telítetlen zsírsavdús diéta hatásában szerepet játszó mechanizmusok
Membránszerkezet-változások
A táplálékkal szervezetbe kerülő n-3 és n-6 típusú esszenciális zsírsavak, valamint az egyszeresen telítetlen és a telített zsírsavak nem csak szubsztrátként szerepelnek a mitokondriális béta-oxidációban. A diéták hatására jellegzetes átépülés figyelhető meg a membrán foszfolipoidok zsírsav összetételében (5, 13, 14). A különböző hosszúságú és telítettségi fokú zsírsavak meghatározzák a membrán fizikokémiai sajátságait, a membránhoz kötött fehérjék (receptorok, enzimek, ioncsatornák) mozgását, konformációs változását. Ezen keresztül számos sejtfunkciót is befolyásolnak.
Ioncsatorna- és receptormoduláció
A zsírsavak membrán alkotóként, az ioncsatorna mikrokörnyezetének befolyásolása révén, illetve szabad formában, az ioncsatornához való kötődés révén befolyásolhatják a membránon keresztül történő ionmozgásokat (15). A kezdeti elektrofiziológiai vizsgálatok során főként in vitro, akut kezelés formájában alkalmazott szabad zsírsavak hatását tanulmányozták. Ezen vizsgálatok általános megállapítása volt, hogy az n-3 és n-6 családba tartozó többszörösen telítetlen zsírsavak egyaránt dózisfüggő módon csökkentették a sejtbe irányuló feszültségfüggő nátriumáramot (INa) (16, 17), a feszültségfüggő L-típusú kalciumáramot (Ica,L) (18, 19). A különböző, repolarizációban szerepet játszó ionáramokat szintén gátolták a telítetlen zsírsavak: pl. a tranziens kifelé irányuló káliumáramot (Ito) (17, 19, 20), a repolarizáló káliumáram ultragyors komponensét (IKur) (17), a késői egyenirányító káliumáramot (IK) (19, 21) és a Na-Ca cseremechanizmust (INCX) (22). A telített (pl. sztearinsav, 18:0) és egyszeresen telítetlen zsírsavaknak (pl. olajsav, 18:1, n-9) ilyen hatásai nem voltak kimutathatók.
Számos technikai problémát vet fel a különböző zsírsavdús diéták hatására létrejövő membrán átépülés ioncsatornákra gyakorolt hatásainak vizsgálata, hiszen a sejt izolálás során alkalmazott módszerek maguk is befolyásolhatják az ioncsatornák membrán-mikrokörnyezetét. Ennek megfelelően kevesebb és egymásnak sokszor ellentmondó eredmények találhatók az irodalomban. A diétás kezelések után pl. nem volt kimutatható INa (23, 24) és IKr (24) gátlás. Jelentős csökkenést találtak viszont ilyen körülmények között is az IK1, IKs, Ica,L és az INCX-áramokban (23, 24).
A rendelkezésre álló irodalmi adatok összegzéseként megállapítható, hogy a többszörösen telítetlen zsírsavszármazékok in vitro akut elektrofiziológiai hatásai feltehetően nem specifikus hatások, hiszen a különböző származékok (18:2, n-6-tól 22:6, n-3-ig) egyaránt gátolni képesek az egymástól eltérő ioncsatornákat. Kérdéses, hogy ez a mechanizmus milyen szerepet játszik akkor, amikor a károsodás helyén (pl. iszkémiás inzultus) lokálisan szabadulnak fel a zsírsavak a membránból. További vizsgálatokat igényel, hogy az ionmozgások megváltozásának eredőjeként az antiaritmiás, vagy az aritmogén hatás kerül előtérbe. A repolarizáló kálium-áramok gátlása fokozza az EKG QT-szakasz variabilitását és növeli a polimorf kamrai aritmiák, a ’torsades de pointes’ kialakulásának veszélyét (25). A telítetlen zsírsavdús diéták ilyen irányú hatását kísérletes körülmények között nem vizsgálták. Szintén nincs arra vonatkozó adat, hogy a különböző QT-szakasz nyújtó és ezért aritmogén hatású gyógyszerek mellékhatását miként befolyásolja a telítetlen zsírsavdús diéta.
A telítetlen zsírsavdús diéták eredményeként, a membrán átépülés hatására egyes sejtmembránhoz kötött enzimek aktivitása is megváltozik (26, 27), illetve a ß-adrenerg receptorválasz csökkenése figyelhető meg (8, 28).
Egyéb, biológiailag hatékony metabolitok képződése
Az n-3 típusú telítetlen zsírsavban dús diéták hatásaként az eikozanoidok és egyéb zsírsavszármazékok szintézise az értágító prosztanoidok képzése irányába tolódik (29). Az eikozanoidok elsősorban a 20 szénatomot tartalmazó zsírsavakból ciklooxigenáz (pl. prosztaglandinok, tromboxán, prosztaciklin), illetve lipoxigenáz (leukotriének) úton keletkező termékek (1. ábra).
Dyerberg és munkatársai korai eredményei szerint (3) az EPA-ból keletkező tromboxán (TxA3) kevésbé potens trombocitaaggregátor és érszűkítő hatású, mint az arachidonsavból keletkező termék (TxA2). Ugyanakkor a két prosztaciklin származék (PGI3 és PGI2) hatékonysága közel megegyezik. Ez az arányeltolódás magyarázhatja a halolajdiéta vérzési időt nyújtó, antitrombotikus és antiiszkémiás hatását is (3, 30).
Ezen jól ismert zsírsaveredetű mediátorok mellett számos egyéb, biológiailag aktív oxidációs terméket azonosítottak, amelyek a lipoxigenáz, az aszpirinrezisztens ciklooxigenáz, vagy a citokrom P450 epoxigenáz úton keletkeznek (31). Az így létrejövő mediátorok (resolvin, maresin, protectin) hozzájárulhatnak a telítetlen zsírsav dús diéták hatásához, szerepet játszanak a gyulladásos reakcióban és a gyulladásos folyamat megszüntetésében (32), ezen keresztül az aritmia szubsztrátum kialakulásának csökkentésével az aritmiák megelőzésében. A különböző típusú zsírsavakból keletkező oxidációs termékek hatásának tisztázása, a diétás változtatás hatására létrejövő módosulása további vizsgálatokat igényel.
PPAR-aktiváció
A telítetlen zsírsavdús diéták hatására a szérum lipoprotein összetétel előnyösen változik. Így pl. csökken a plazma triglicerid-koncentráció, az összkoleszterinszint és ezen belül az LDL-koleszterinfrakció is csökken. Ezek a változások együttesen csökkentik az ateroszklerotikus érelváltozásokat és ezek szövődményeit, így jelentős szerepük lehet a szívizominfarktus elsődleges prevenciójában.
A telítetlen zsírsavakban dús diéták antiaritmiás hatása azonban nem minden esetben hozható összefüggésbe a plazma koleszterinkoncentráció csökkentésével. Patkányban, hasonlóan más nem humán emlősökhöz, a fiziológiás plazma koleszterinkoncentráció alacsonyabb, mint az emberben. Ez az érték, illetve a HDL/LDL-koleszterin-frakció aránya nem változott jelentősen kísérleteinkben sem az 1 hónapig tartó diéták hatására.
A zsírsavak számos sejtmagreceptor és transzkripciós faktor természetes ligandjai, amelyek szabályozzák a gén expressziót. Így befolyásolják pl. a lipidmetabolizmust, a glükóz-anyagcserét és a gyulladásos folyamatokat. A telítetlen zsírsavak a peroxiszoma proliferációt aktiváló receptor (PPARα) aktiválása révén fokozzák a zsírsavak sejtbe való transzportját és a zsírsav-oxidációt (33). Az EPA aktiválja a protein-kináz-A-t, ami csökkenti a kontraktilitást és elősegíti a relaxációt. Ez a kombinált hatás, akut iszkémiás körülmények között energiamegtakarítást eredményezhet és hozzájárulhat az antiaritmiás hatáshoz (34).
A fenti folyamatok vizsgálata főként in vitro rendszerekben, a zsírsavak akut kezelés formájában való hozzáadásával történtek. Kevéssé ismert, hogy a diéta formában való alkalmazás esetén, a membrán zsírsav-összetétel átépülése révén, milyen szerepe lehet ezen mechanizmusoknak az anyagcsere áthangolásában, az akut iszkémiás inzultushoz való alkalmazkodásban (35).
Humán epidemiológiai vizsgálatok
A többszörösen telítetlen zsírsavak fogyasztásának előnyös kardiovaszkuláris hatásaira Dyerberg és munkatársai úttörő populációs vizsgálatai hívták fel a figyelmet, amely szerint az ateroszklerózis és a szívmegbetegedések előfordulása igen ritka a sok halat fogyasztó grönlandi eszkimók között. Ezeket a korai megállapításokat sok kritika érte, amelyeket Fodor és munkatársai (36) közleménye részletez összefoglalóan. A leggyakrabban említett hiányosság az akkoriban Grönlandon elérhető halálozási statisztikák megbízhatatlansága volt, ami alapjaiban kérdőjelezte meg a korrelációs megállapítást. A korai epidemiológiai vizsgálatok alátámasztására számos további populációs és randomizált kontrollvizsgálatot indítottak. Epidemiológiai és klinikai vizsgálatok is azt mutatják, hogy a táplálék kis mennyiségű halolajjal való kiegészítése csökkenti a koronária-megbetegedések mortalitását és csökkenti a halálozást szívizominfarktus esetén (37, 38).
Az n-6 típusú zsírsavak fogyasztását és hatását illetően széles körben elfogadott, hogy az emberi faj kialakulása kezdetén olyan táplálékot fogyasztott, amelynek n-6/n-3 zsírsavainak aránya 1:1 volt. Ez az arány jelentősen emelkedett a modern korban, az iparszerű mezőgazdasági termelés általánossá válásával. Ezzel párhuzamosan emelkedett a szív-ér rendszeri megbetegedések miatti halálozás – amiből a kettő közötti ok-okozati összefüggésre lehet következtetni (39).
Újabb, nagyszámú népességet érintő több évtizedes vizsgálat eredményeként a többszörösen telítetlen zsírsavak közül a linolsav fogyasztása mutatta a legszorosabb negatív korrelációt a kardiovaszkuláris halálozással (40). Farvid és munkatársai (41) 11 kohorsz vizsgálat eredményeit összesítették metaanalízisükben. Megállapításuk szerint a linolsavnak a telített zsírsavak rovására történő fokozott bevitele dózisfüggően csökkentette a keringési betegségek rizikóját és a kardiovaszkuláris halálozást. Ezek a vizsgálatok nem támasztják alá azt a véleményt, hogy az n-6 típusú zsírsavak fokozott fogyasztása veszélyt jelent a keringési megbetegedések kialakulása során.
Másodlagos prevenció
A telítetlen zsírsavak étrendszerű fogyasztásával kapcsolatos humán epidemiológiai vizsgálatok során számos, nehezen kontrollálható körülmény befolyásolja az eredményeket. Az elfogyasztott hal eredete (tengeri vagy édesvízi), minősége (higany és klórozott szénhidrogénekkel való szennyezettsége), az elkészítés módja (sütés, főzés) mind befolyásolja, esetleg rontja a védőhatás kialakulását (42, 43, 44). Ezért a másodlagos prevenció során a szív-ér rendszeri betegek intervenciós kezelésére standardizált, tisztított olajkészítmények hatását vizsgálták.
Ezek közül a legjelentősebb a GISSI-Prevenzione tanulmány (45), amely szerint a vizsgálatba bevont infarktust túlélő betegek körében a kapszulában fogyasztott halolaj a kezelés elkezdését követően már 6 hónappal 57%-kal csökkentette a hirtelen szívhalál relatív gyakoriságát, a kontrollcsoporthoz képest.
Újabb vizsgálatok azonban nem igazolták teljes egészében a kezdeti eredményeket. Alexander és munkatársai (46) metaanalízisükben több randomizált kontrollvizsgálat (összesen kb. 93 ezer beteg), illetve kohorsz vizsgálat (összesen kb. 732 ezer) beteg adatait értékelték. A randomizált kontrollvizsgálatok metaanalízise szerint az n-3 típusú zsírsavak kiegészítő fogyasztása kis mértékben (statisztikailag nem szignifikáns módon) csökkentette a szív-ér rendszeri halálozást. Ez a csökkentő hatás jelentősebb (statisztikailag szignifikáns mértékű) volt a magas rizikójú betegek esetén – ha a szérum triglicerid, vagy az LDL-koleszterol-koncentráció a normáltartománynál magasabb. A hosszabb ideig tartó és nagyobb betegszámot tartalmazó kohorsz vizsgálatok metaanalízise jelentősebb (18%), statisztikailag szignifikáns kardiovaszkuláris mortalitás csökkenést mutatott (46).
Ramsden és munkatársai újraértékelték a „Minnesota Coronary Experiment” adatai és módosították a korábbi következtetéseket. A telített zsírsavakban gazdag táplálék helyett linolsavban dús táplálék (kukoricacsíra-olaj, illetve ezzel dúsított margarin) fogyasztását ajánlották betegeiknek. A diétás változtatás eredményesen csökkentette a szérum koleszterinkoncentrációt, de ez az egyébként önmagában védőhatásúnak vélt változás nem mutatkozott meg az összes-, illetve a kardiovaszkuláris halálozás csökkenésében (47). Hasonló következtetésre jutott Hamley (48) is vizsgálatai eredményeként. A megfelelően kontrollált, randomizált utánkövetéses vizsgálatokon alapuló metaanalízisének végső következtetése szerint a telített zsírsavdús diéta n-6 típusú telítetlen zsírsavakra való váltása nem csökkentette szignifikáns mértékben a kardiovaszkuláris és a teljes halálozást.
Másodlagos prevenció – Malignus kamrai aritmiák
A GISSI Prevenzione-vizsgálatban (45) tapasztalt teljes mortalitáscsökkenést főként a hirtelen szívhalál, a malignus kamrai aritmiák kialakulásának csökkenésével magyarázták. Aarsetøy és munkatársai szerint a szívizominfarktus akut fázisában vörösvértestekben mért EPA+DHA-tartalom jelentősen alacsonyabb volt azokban a betegekben, akiknél kamrafibrilláció alakult ki az első 6 órában (49). Más vizsgálatok szerint a defibrillátor-beültetés előtt alkalmazott fokozott n-3 zsírsav-bevitel (fokozott halfogyasztás, intravénás infúzió) csökkentette a kamrai tachycardia indukálhatóságát (50, 51). Christensen és munkatársai (52) defibrillátor beültetésen átesett betegeknél követték a kamrafibrilláció és a kamrai tachycardia előfordulását. A 98 betegen végzett, 12 hónapos utánkövetéses vizsgálat során az aritmiák előfordulása fordított arányosságot mutatott a szérum n-3 zsírsavak mennyiségével. Ezen megállapítások értékét gyengíti, hogy kisszámú beteganyagon történtek a vizsgálatok, ami a nagy betegpopulációra való kiterjeszthetőséget korlátozza.
Szintén defibrillátor-átültetésen átesett, de nagyobb számú beteganyagon 3 tanulmányban vizsgálták a kapszulázott halolajjal történő kezelés antiaritmiás hatását. A 3 randomizált kontrollvizsgálat metaanalízise nem támasztotta alá az n-3 típusú zsírsavval történő kezelés kamrai aritmiák ellen védő hatását, nem csökkent a kamrai aritmiák megjelenéséig eltelt idő (53).
Másodlagos prevenció – Pitvarfibrilláció
Mozaffarian és munkatársai (54) populációs, kohorsz vizsgálatai szerint negatív összefüggés mutatható ki a táplálék n-3 zsírsav-tartalma és a szívelégtelen betegekben előforduló pitvarfibrilláció gyakorisága között. Ezt követően néhány kisebb betegszámot érintő, rövid ideig tartó, randomizált kontrollvizsgálatot is végeztek, amelyek szintén védőhatást igazoltak. Így pl. elektromos kardioverziót követően, az antiaritmiás kezelés (amiodaron, sotalol) ellenére visszatérő pitarfibrilláció gyakorisága csökkent a kapszulázott halolaj fogyasztása esetén (55, 56). A további tanulmányok azonban nem igazoltak védő hatást a pitvarfibrilláció kialakulásával szemben. Zhang és munkatársai (57) szívműtétet (billentyűműtét, koronária bypass) követő pitvarfibrillációt vizsgáló 7 kisebb randomizált klinikai tanulmány metaanalízisét végezte. Ezek alapján a beavatkozás előtt elkezdett fokozott telítetlen zsírsavbevitel nem csökkentette szignifikáns mértékben a pitvarfibrilláció gyakoriságát. Szintén negatív a következtetése a legfrissebb kohorsz vizsgálatokat értékelő metaanalízisnek: a hosszú követési időszak (4–17,6 év) alatt sem volt összefüggés az n-3 zsírsavbevitel (fokozott halfogyasztás, vagy halolaj kapszula formájában) és a pitvarfibrilláció gyakorisága között (58).
Következtetések
Számos biztató, antiaritmiás hatást igazoló kísérletes és klinikai tanulmány után jelenleg a szakirodalom óvatosan foglal állást a telítetlen zsírsavak antiaritmiás hatásait, ilyen irányú alkalmazhatóságát illetően. Általában elfogadott, hogy tartós, preventív fogyasztásuk csökkenti a kardiovaszkuláris események és a hirtelen szívhalál előfordulását. Ebben az esetleges közvetlen antiaritmiás hatás mellett a telítetlen zsírsavak antiaterogén, antitrombotikus, gyulladásgátló, trombocitaaggregációt gátló, vérnyomás és plazma trigliceridcsökkentő hatásának is szerepe van.
A gyakran tapasztalható eltérő végkövetkeztetések feltehetően az eltérő aritmiamechanizmusokra vezethetők vissza. Számos állatkísérlet és humán prevenciós vizsgálat utal arra, hogy a telítetlen zsírsavak közvetlenül, vagy közvetett módon csökkentik az akut szívizom-iszkémia során kialakuló, életet veszélyeztető kamrai aritmiák súlyosságát. Ez a hatás feltehetően a plazmában keringő szabad zsírsavaknak, az iszkémia következtében lokálisan felszabaduló zsírsavaknak, illetve a membrán szerkezeti átalakulásának köszönhetők. Szívizom-iszkémia során a fokozott foszfolipáz-A2-aktiválódás miatt nagy mennyiségű telítetlen zsírsav szabadul fel a membrán foszfolipidekből. Ezek nemcsak szubsztrátként szolgálnak a különböző mediátorok szintéziséhez és a szignalizációs folyamatokhoz, hanem közvetlen antiaritmiás hatást is eredményezhetnek a feszültségfüggő ioncsatornák befolyásolásával.
Az infarktuson átesett betegek másodlagos prevenciójában azonban nem igazolt egyértelműen a malignus kamrai aritmiák kialakulását csökkentő hatás. Ilyen körülmények között, elektromos defibrillátor beültetése után, iszkémia kialakulására nincs idő, mivel a készülék már az aritmiás esemény indulásakor megszünteti azokat. Szintén hatástalanságot igazol a vizsgálatok többsége a pitvarfibrilláció kezelésében, akár a szívelégtelenség szövődményeként alakult ki, akár szívműtétet követően. Ezek a vizsgálatok azt mutatják, hogy a betegpopuláció megválasztása nagymértékben befolyásolja a telítetlen zsírsavdús diéták sikerességét.
Nehezíti a diétás változások értékelését a kardiovaszkuláris rizikófaktorok kezelésére eredményesen alkalmazott gyógyszerek (pl. statinok, angiotenzin konvertáz gátlók) széles körű alkalmazása, illetve a szívizominfarktus akut ellátásának javulása. Ezzel a kontrollcsoport is változhat a vizsgálat során és az így csökkent általános rizikó mellett a telítetlen zsírsavbevitellel nyújtott többlet védőhatás kevésbé érvényesül, nem éri el a statisztikailag szignifikáns értéket.
További gondot okoz a betegpopulációban megelőzően alkalmazott diéta egészséges életmód-propaganda miatti változatossága, az alkalmazott olaj minősége, szennyezettsége, dózisa. Európában az egy főre jutó átlag halfogyasztás évente 24,7 kg. Magyarországon a halfogyasztás igen alacsony (2014-ben 4,6 kg), az európai rangsorban az utolsó helyen szerepelünk (59). Így hazánkban a különböző zsírsavak szervezetben való vetélkedése során már kis mennyiségű n-3 típusú zsírsav többletbevitel is jelentős változást eredményezhet a szervezetben. Ugyanakkor az elfogyasztott halfélék zsírsavösszetétele az utóbbi időben, a zárt, iparszerű tenyésztési módszerek általánossá válásával egyre inkább az n-6 típus irányába tolódik, az n-3 zsírsav-tartalom csökken (60). A halfélékben felhalmozódó szennyezőanyagok (higany, dioxin, policiklusos aromás vegyületek) tovább ronthatják a szív-ér rendszeri védőhatást (43). Ezek a szennyezőanyagok a különböző táplálék-kiegészítőként forgalmazott halolaj készítményekbe is belekerülhetnek. Táplálék formában az elkészítés módja (sütés, főzés stb.) károsíthatja a többszörösen telítetlen zsírsavakat (44), ráadásul a keletkező oxidációs termékek kifejezetten károsító hatásúak.
Mindezen hiányosságokra tekintettel, további, jól kontrollált, megfelelően válogatott beteganyagon végzett vizsgálatokra van szükség annak megállapítására, hogy mely típusú telítetlen zsírsavszármazékok, milyen feltételek között alkalmazhatók az antiaritmiás hatás érvényesítésére.
Támogatók
Készült a GINOP-2.3.2-15-2016-00040 (MYOTeam) kutatási pályázat támogatásával.
Irodalom
1. EUROSTAT. Causes of death EUROSTAT 2017. http://ec.europa.eu/eurostat/statisticsexplained/index.php/Causes_of_death_statistics. Published 2017. https://doi.org/10.1016/S0140-6736(71)91658-8
2. Bang HO, Dyerberg J, Nielsen AB. Plasma lipid and lipoprotein pattern in Greenlandic West-coast Eskimos. Lancet (London, England) 1971; 1(7710): 1143–1145. https://doi.org/10.1016/S0140-6736(78)91505-2
3. Dyerberg J, Bang HO, Stoffersen E, et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis? Lancet (London, England) 1978; 2(8081): 117–119. https://doi.org/10.1080/07853890.2017.1372622
4. Menotti A, Kromhout D, Puddu PE, et al. Baseline fatty acids, food groups, a diet score and 50-year all-cause mortality rates. An ecological analysis of the Seven Countries Study. Ann Med 2017; 49: 718–727.
5. Leprán I, Nemecz G, Koltai M, et al. Effect of a linoleic acid-rich diet on the acute phase of coronary occlusion in conscious rats: influence of indomethacin and aspirin. J Cardiovasc Pharmacol 1981; 3: 847–853.
6. McLennan PL, Abeywardena MY, Charnock JS. Influence of dietary lipids on arrhythmias and infarction after coronary artery ligation in rats. Can J Physiol Pharmacol 1985; 63: 1411–1417. https://doi.org/10.1139/y85-232
7. Chan P, Tsai SK, Chiang BN, et al. Trilinolein reduces infarct size and suppresses ventricular arrhythmias in rats subjected to coronary ligation. Pharmacology 1995; 51: 118–126. https://doi.org/10.1159/00013932410.1159/000139324
8. McLennan PL, Abeywardena MY, Charnock JS, et al. Dietary lipid modulation of myocardial beta-adrenergic mechanisms, Ca2+-dependent automaticity, and arrhythmogenesis in the marmoset. J Cardiovasc Pharmacol 1987; 10: 293–300.
9. Charnock JS. Lipids and cardiac arrhythmia. Prog Lipid Res 1994; 33: 355–385. https://doi.org/10.1016/0163-7827(94)90023-X
10. Leprán I, Szekeres L. Effect of dietary sunflower seed oil on the severity of reperfusion-induced arrhythmias in anesthetized rats. J Cardiovasc Pharmacol 1992; 19: 40–44.
11. McLennan PL, Abeywardena MY, Charnock JS. Reversal of the arrhythmogenic effects of long-term saturated fatty acid intake by dietary n-3 and n-6 polyunsaturated fatty acids. Am J Clin Nutr 1990; 51: 53–58.
12. Sargent CA, Riemersma RA. Polyunsaturated fatty acids and cardiac arrhythmia. Biochem Soc Trans 1990; 18: 1077–1078. https://doi.org/10.1042/bst0181077
13. Kramer JK. Comparative studies on composition of cardiac phospholipids in rats fed different vegetable oils. Lipids 1980; 15: 651–660. https://doi.org/10.1007/BF02534015
14. Charnock JS, Abeywardena MY, McMurchie EJ, et al. The composition of cardiac phospholipids in rats fed different lipid supplements. Lipids 1984; 19: 206–213. https://doi.org/10.1007/BF02534799
15. Elinder F, Liin SI. Actions and mechanisms of polyunsaturated fatty acids on voltage-gated ion channels. Front Physiol 2017; 8: 43. https://doi.org/10.3389/fphys.2017.00043
16. Xiao YF, Kang JX, Morgan JP, et al. Blocking effects of polyunsaturated fatty acids on Na+ channels of neonatal rat ventricular myocytes. Proc Natl Acad Sci U S A 1995; 92: 11000–11004. https://doi.org/10.1073/pnas.92.24.11000
17. Li G-R, Sun H-Y, Zhang X-H, et al. Omega-3 polyunsaturated fatty acids inhibit transient outward and ultra-rapid delayed rectifier K+ currents and Na+ current in human atrial myocytes. Cardiovasc Res 2009; 81: 286–293. https://doi.org/10.1093/cvr/cvn322
18. Xiao YF, Gomez AM, Morgan JP, et al. Suppression of voltage-gated L-type Ca2+ currents by polyunsaturated fatty acids in adult and neonatal rat ventricular myocytes. Proc Natl Acad Sci U S A. 1997; 94: 4182–4187. https://doi.org/10.1073/pnas.94.8.4182
19. Macleod JC, Macknight ADC, Rodrigo GC. The electrical and mechanical response of adult guinea pig and rat ventricular myocytes to omega-3 polyunsaturated fatty acids. Eur J Pharmacol 1998; 356: 261–270. https://doi.org/10.1016/S0014-2999(98)00528-7
20. Bogdanov KY, Spurgeon HA, Vinogradova TM, et al. Modulation of the transient outward current in adult rat ventricular myocytes by polyunsaturated fatty acids. Am J Physiol 1998; 274: H571–9.
21. Honoré E, Barhanin J, Attali B, et al. External blockade of the major cardiac delayed-rectifier K+ channel (Kv1.5) by polyunsaturated fatty acids. Proc Natl Acad Sci U S A. 1994; 91: 1937–1941. https://doi.org/10.1073/pnas.91.5.1937
22. Ander B, Hurtado C, Raposo C, et al. Differential sensitivities of the NCX1.1 and NCX1.3 isoforms of the Na+-Ca2+ exchanger to α-linolenic acid. Cardiovasc Res. 2007; 73: 395–403. https://doi.org/10.1016/j.cardiores.2006.09.013
23. Leifert WR, Jahangiri A, Saint DA, et al. Effects of dietary n-3 fatty acids on contractility, Na+ and K+ currents in a rat cardiomyocyte model of arrhythmia. J Nutr Biochem 2000; 11: 382–392. https://doi.org/10.1016/S0955-2863(00)00094-2
24. Verkerk AO, van Ginneken ACG, Berecki G, et al. Incorporated sarcolemmal fish oil fatty acids shorten pig ventricular action potentials. Cardiovasc Res 2006; 70: 509–520. https://doi.org/10.1016/j.cardiores.2006.02.022
25. Lengyel Cs, Varró A, Tábori K, Papp JGy, Baczkó I. Combined pharmacological block of IKr and IKs increases short-term QT interval variability and provokes torsades de pointes. Br J Pharmacol 2007; 151: 941–951. https://doi.org/10.1016/0304-4165(83)90119-8
26. McMurchie EJ, Abeywardena MY, Charnock JS, et al. Differential modulation of rat heart mitochondrial membrane-associated enzymes by dietary lipid. Biochim Biophys Acta 1983; 760: 13–24. https://doi.org/10.1016/0005-2736(84)90249-9
27. Abeywardena MY, McMurchie EJ, Russell GR, et al. Response of rat heart membranes and associated ion-transporting ATPases to dietary lipid. Biochim Biophys Acta 1984; 776: 48–59.
28. Wince LC, Hugman LE, Chen WY, et al. Effect of dietary lipids on inotropic responses of isolated rat left atrium: attenuation of maximal responses by an unsaturated fat diet. J Pharmacol Exp Ther 1987; 241: 838–845. https://doi.org/10.1016/0090-6980(79)90065-0
29. de Deckere EA, Nugteren DH, ten Hoor F. Influence of type of dietary fat on the prostaglandin release from isolated rabbit and rat hearts and from rat aortas. Prostaglandins 1979; 17: 947–955. https://doi.org/10.1172/JCI112147
30. von Schacky C, Fischer S, Weber PC. Long-term effects of dietary marine omega-3 fatty acids upon plasma and cellular lipids, platelet function, and eicosanoid formation in humans. J Clin Invest 1985; 76: 1626–1631. https://doi.org/10.1194/jlr.M047357
31. Fischer R, Konkel A, Mehling H, et al. Dietary omega-3 fatty acids modulate the eicosanoid profile in man primarily via the CYP-epoxygenase pathway. J Lipid Res 2014; 55: 1150–1164. https://doi.org/10.1038/nature13479
32. Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature 2014; 510: 92–101. https://doi.org/10.1016/j.semcdb.2012.01.003
33. Poulsen LC, Siersbæk M, Mandrup S. PPARs: Fatty acid sensors controlling metabolism. Semin Cell Dev Biol. 2012; 23: 631–639. https://doi.org/10.1113/jphysiol.2007.132753
34. Szentandrássy N, Pérez-Bido MR, Alonzo E, et al. Protein kinase A is activated by the n-3 polyunsaturated fatty acid eicosapentaenoic acid in rat ventricular muscle. J Physiol 2007; 582: 349–358. https://doi.org/10.1016/j.biochi.2015.10.013
35. Griffin TM, Humphries KM, Kinter M, et al. Nutrient sensing and utilization: Getting to the heart of metabolic flexibility. Biochimie 2016; 124: 74–83. https://doi.org/10.1016/j.cjca.2014.04.007
36. Fodor JG, Helis E, Yazdekhasti N, et al. “Fishing” for the origins of the “Eskimos and Heart Disease” story: facts or wishful thinking? Can J Cardiol 2014; 30: 864–868. https://doi.org/10.1016/S0140-6736(89)90828-3
37. Burr ML, Fehily AM, Gilbert JF, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet (London, England) 1989; 2(8666): 757–761. https://doi.org/10.1079/BJN19980107
38. Hornstra G, Barth CA, Galli C, et al. Functional food science and the cardiovascular system. Br J Nutr 1998; 80(S1): S113. https://doi.org/10.1016/j.biopha.2006.07.080
39. Simopoulos AP. Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomed Pharmacother 2006; 60: 502–507. https://doi.org/10.1001/jamainternmed.2016.2417.
40. Wang DD, Li Y, Chiuve SE, et al. Association of specific dietary fats with total and cause-specific mortality. JAMA Intern Med 2016; 176: 1134–1145. https://doi.org/10.1161/CIRCULATIONAHA.114.010236
41. Farvid MS, Ding M, Pan A, et al. Dietary linoleic acid and risk of coronary heart disease: a systematic review and meta-analysis of prospective cohort studies. Circulation 2014; 130: 1568–1578. https://doi.org/10.1161/01.CIR.0000055315.79177.16
42. Mozaffarian D, Lemaitre RN, Kuller LH, et al. Cardiac benefits of fish consumption may depend on the type of fish meal consumed: the Cardiovascular Health Study. Circulation 2003; 107: 1372–1377. https://doi.org/10.1016/j.jnutbio.2006.05.001
43. Virtanen JK, Rissanen TH, Voutilainen S, et al. Mercury as a risk factor for cardiovascular diseases. J Nutr Biochem 2007; 18: 75–85. https://doi.org/10.1111/jai.12212
44. Asghari L, Zeynali F, Sahari MA. Effects of boiling, deep-frying, and microwave treatment on the proximate composition of rainbow trout fillets: changes in fatty acids, total protein, and minerals. J Appl Ichthyol 2013; 29: 847–853. https://doi.org/10.1161/01.CIR.0000014682.14181.F2
45. Marchioli R, Barzi F, Bomba E, et al. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico (GISSI)-Prevenzione. Circulation 2002; 105: 1897–1903. https://doi.org/10.1016/j.mayocp.2016.10.018.
46. Alexander DD, Miller PE, Van Elswyk ME, et al. A meta-analysis of randomized controlled trials and prospective cohort studies of eicosapentaenoic and dcosahexaenoic long-chain omega-3 fatty acids and coronary heart disease risk. Mayo Clin Proc 2017; 92: 15–29. https://doi.org/10.1136/bmj.i1246.
47. Ramsden CE, Zamora D, Majchrzak-Hong S, et al. Re-evaluation of the traditional diet-heart hypothesis: analysis of recovered data from Minnesota Coronary Experiment (1968–73). BMJ 2016; 353: i1246. https://doi.org/10.1186/s12937-017-0254-5
48. Hamley S. The effect of replacing saturated fat with mostly n-6 polyunsaturated fat on coronary heart disease: a meta-analysis of randomised controlled trials. Nutr J 2017; 16: 30. https://doi.org/10.1016/j.resuscitation.2008.04.007
49. Aarsetøy H, Pönitz V, Nilsen OB, et al. Low levels of cellular omega-3 increase the risk of ventricular fibrillation during the acute ischaemic phase of a myocardial infarction. Resuscitation 2008; 78: 258–264. https://doi.org/10.1016/S0140-6736(04)16105-9
50. Schrepf R, Limmert T, Weber PC, et al. Immediate effects of n-3 fatty acid infusion on the induction of sustained ventricular tachycardia. Lancet 2004; 363: 1441–1442. https://doi.org/10.1016/j.amjcard.2007.11.007
51. Metcalf RG, Sanders P, James MJ, et al. Effect of dietary n-3 polyunsaturated fatty acids on the inducibility of ventricular tachycardia in patients with ischemic cardiomyopathy. Am J Cardiol 2008; 101: 758–761. https://doi.org/10.1016/j.eupc.2005.02.118
52. Christensen J, Riahi S, Schmidt E, et al. n-3 Fatty acids and ventricular arrhythmias in patients with ischaemic heart disease and implantable cardioverter defibrillators. Europace 2005; 7: 338–344. https://doi.org/10.1093/eurheartj/ehp003
53. Brouwer IA, Raitt MH, Dullemeijer C, et al. Effect of fish oil on ventricular tachyarrhythmia in three studies in patients with implantable cardioverter defibrillators. Eur Heart J 2009; 30: 820–826. https://doi.org/10.1161/01.CIR.0000138154.00779.A5
54. Mozaffarian D, Psaty BM, Rimm EB, et al. Fish intake and risk of incident atrial fibrillation. Circulation 2004; 110: 368–373. https://doi.org/10.1161/CIRCULATIONAHA.111.022194
55. Nodari S, Triggiani M, Campia U, et al. n-3 polyunsaturated fatty acids in the prevention of atrial fibrillation recurrences after electrical cardioversion: a prospective, randomized study. Circulation 2011; 124: 1100–1106. https://doi.org/10.1016/j.hrthm.2011.11.034.
56. Kumar S, Sutherland F, Morton JB, et al. Long-term omega-3 polyunsaturated fatty acid supplementation reduces the recurrence of persistent atrial fibrillation after electrical cardioversion. Hear Rhythm 2012; 9: 483–491. https://doi.org/10.1016/j.jjcc.2013.06.014.
57. Zhang B, Zhen Y, Tao A, et al. Polyunsaturated fatty acids for the prevention of atrial fibrillation after cardiac surgery: An updated meta-analysis of randomized controlled trials. J Cardiol 2014; 63: 53–59. https://doi.org/10.3390/nu9090955.
58. Li F-R, Chen G-C, Qin J, Wu X. Dietary fish and long-chain n-3 polyunsaturated fatty acids intake and risk of atrial fibrillation: a meta-analysis. Nutrients 2017; 9: 955.
59. EUMOFA. EU Consumer Habits Regarding Fishery and Aquaculture Products. Brussels: European Commission; 2017. https://doi.org/10.1017/S1368980017000696
60. de Roos B, Sneddon AA, Sprague M, et al. The potential impact of compositional changes in farmed fish on its health-giving properties: is it time to reconsider current dietary recommendations? Public Health Nutr 2017; 20: 2042–20.