Az ESC/EACTS 2016. évi, a pitvarfibrilláció ellátására vonatkozó ajánlása
█ ESC guideline
Készítette az Európai Kardiológus Társaság (ESC) pitvarfibrilláció kezeléséért felelős munkacsoportja az Európai Szívritmus Társaság (EHRA) külön hozzájárulásával és az Európai Stroke Szervezet (ESO) támogatásával
Szerzők/A munkacsoport tagjai: Paulus Kirchhof* (elnök) (Egyesült Királyság/Németország), Stefano Benussi*1 (társelnök) (Svájc), Dipak Kotecha (Egyesült Királyság), Anders Ahlsson1 (Svédország), Dan Atar (Norvégia), Barbara Casadei (Egyesült Királyság), Manuel Castella1 (Spanyolország), Hans-Christoph Diener2 (Németország), Hein Heidbuchel (Belgium), Jeroen Hendriks (Hollandia), Gerhard Hindricks (Németország), Antonis S. Manolis (Görögország), Jonas Oldgren (Svédország), Bogdan Alexandru Popescu (Románia), Ulrich Schotten (Hollandia), Bart Van Putte1 (Hollandia), and Panagiotis Vardas (Görögország)
Szakmai bírálók: Stefan Agewall (CPG, kordinátor) (Norvégia), John Camm (CPG, kordinátor) (Egyesült Királyság), Gonzalo Baron Esquivias (Spanyolország), Werner Budts (Belgium), Scipione Carerj (Olaszország), Filip Casselman (Belgium), Antonio Coca (Spanyolország), Raffaele De Caterina (Olaszország), Spiridon Deftereos (Görögország), Dobromir Dobrev (Németország), Jose´ M. Ferro (Portugália),
Gerasimos Filippatos (Görögország), Donna Fitzsimons (Egyesült Királyság) Bulent Gorenek (Törökország), Maxine Guenoun (Franciaország), Stefan H. Hohnloser (Németország), Philippe Kolh (Belgium), Gregory Y. H. Lip (Egyesült Királyság), Athanasios Manolis (Görögország), John McMurray (Egyesült Királyság), Piotr Ponikowski (Lengyelország), Raphael Rosenhek (Ausztria), Frank Ruschitzka (Svájc), Irina Savelieva (Egyesült Királyság), Sanjay Sharma (Egyesült Királyság), Piotr Suwalski (Lengyelország), Juan Luis Tamargo (Spanyolország), Clare J. Taylor (Egyesült Királyság), Isabelle C. Van Gelder (Hollandia), Adriaan A. Voors (Hollandia), Stephan Windecker (Svájc), Jose Luis Zamorano (Spanyolország), és Katja Zeppenfeld (Hollandia)
*Felelős szerzők:
Paulus Kirchhof, Birmingham Egyetem, Kardiovaszkuláris Kutató Intézet, Egyesült Királyság, B15 2TT Birmingham, Wolfson Drive, SWBH NHS trust, UHB NHS trust, IBR, 136. szoba
Tel.: +44 121 4147042, E-mail: p.kirchhof@bham.ac.uk; Stefano Benussi, Kardiovaszkuláris Sebészeti Osztály, Zürichi Egyetemi Kórház, Svájc, 8091 Zürich, Rämistrasse 100, Tel.: +41(0)788933835, E-mail: stefano.benussi@usz.ch.
1Európai Szív-Mellkassebészeti Társaság (European Association for Cardio-Thoracic Surgery, EACTS)
2Európai Stroke Társaság (ESO)
A gyakorlatra vonatkozó irányelvekért felelős ESC Bizottság (CPG) és a Nemzeti Kardiológiai Társaságok Bírálóinak névsora megtalálható a Függelékben.
ESC szervezetek, amelyek részt vettek az útmutató szerkesztésében:
Társaságok: Kardiovaszkuláris Prevenciós és Rehabilitációs Társaság (EACPR), Európai Kardiovaszkuláris Képalkotó Társaság (EACVI), Európai Aritmológiai Társaság (EHRA), Szívelégtelenség Társaság (HFA).
Tanácsadó testületek: Kardiovaszkuláris Ápolók és Egészségügyi Szakdolgozók Testülete, Kardiológiai Gyakorlati Alkalmazás Testülete, Kardiovaszkuláris Alapellátási Testület, Hipertónia Társaság.
Munkacsoportok: Celluláris Szívelektrofiziológia Munkacsoport, Kardiovaszkuláris Farmakoterápiás Munkacsoport, Felnőttkori Congenitalis Szívbetegségek Munkacsoport, Thrombosis Munkacsoport, Billentyűbetegségek Munkacsoport.
Az Európai Kardiológus Társaság (ESC) itt közzétett Útmutatója kizárólag személyes és oktatási felhasználásra készült. Kereskedelmi célú felhasználása nem engedélyezett. Az ESC Útmutató bármely részét tilos lefordítani, vagy bármilyen formában sokszorosítani az ESC előzetes engedélye nélkül. Az engedélyezésre irányuló írásos kérelmet az Oxford Unitversity Pressnek, a European Heart Journal kiadójának kell benyújtani, amely az ESC nevében jogosult kezelni az erre vonatkozó engedélyeket (journals.permissions@oup.com).
Jognyilatkozat. Az ESC Útmutató az Európai Kardiológus Társaság állásfoglalását tükrözi, amely a megírásakor rendelkezésre álló klinikai evidenciák gondos és részletes elemzése alapján került összeállításra. Az ESC nem vállal felelősséget a nemzeti egészségügyi hatóságok által közzétett más hivatalos ajánlásokban vagy irányelvekben foglaltaknak az ESC irányelvekkel ellentétes, azoktól eltérő és/vagy félreérthető tartalmáért, különös tekintettel az egészségügyi források és terápiás stratégiák legjobb felhasználására. Minden egészségügyben dolgozó szakembernek számításba kell vennie és mérlegelnie kell a benne foglaltakat a klinikai gyakorlatban történő döntése meghozatalához, csakúgy, mint a preventív, diagnosztikus vagy terápiás stratégiák kiválasztásánál és alkalmazásánál. Az Útmutató mindazonáltal nem mentesíti az egészségügyi szakembert az egyéni felelősség, a beteggel, szükség esetén a hozzátartozóval vagy gondviselővel történő egyeztetés kötelezettsége alól, az egyes betegekkel kapcsolatos konkrét döntések meghozatalában. Az ESC Útmutató nem mentesíti az egészségügyi szakembereket egy adott helyzetben az illetékes nemzeti egészségügyi hatóságok által kiadott hivatalos legfrissebb ajánlások vagy irányelvek alapos és gondos mérlegelése alól, annak érdekében, hogy minden beteg kezelését tudományosan elfogadott evidenciák alapján végezzék etikai és szakmai kötelezettségüknek megfelelően. Szintén az egészségügyi szakember felelőssége a gyógyszerek és eszközök felírásával és alkalmazásával kapcsolatos előírások és szabályok ismerete, betartása.
Az útmutató összeállításában résztvevő testületek szakértőinek összeférhetetlenségi nyilatkozata megtekinthető az ESC honlapján. http://www.escardio.org/guidelines.
ISSUE: CARDIOLOGIA HUNGARICA | 2017 | VOLUME 47, SUPPLEMENTUM B
Rövidítések és betűszavak
| AAD | antiaritmiás gyógyszerek | |
| ABC | (age, biomarkers, clinical history) életkor, biomarkerek, kórtörténet | |
| ACE | angiotenzin konvertáló enzim | |
| ACS | akut koronária szindróma | |
| PF | pitvarfibrilláció | |
| AFFIRM | Atrial Fibrillation Follow-up Investigation of Rhythm Management | |
| AFNET | German Competence NETwork on Atrial Fibrillation | |
| AngII | angiotenzin-II | |
| AHRE | pitvari magasfrekvenciájú epizódok (atrial high rate episodes) | |
| APACHE-AF | Apixaban versus Antiplatelet drugs or no antithrombotic drugs after anticoagulation-associated intraCerebral HaEmorrhage in patients with Atrial Fibrillation | |
| ARB | angiotenzinreceptor-blokkoló | |
| ARISTOTLE | Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation | |
| ARNI | angiotenzinreceptor neprilisin-gátlás | |
| ARTESiA | Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation | |
| ATRIA | AnTicoagulation and Risk factors In Atrial fibrillation | |
| AV | atrioventrikuláris | |
| AXAFA | Anticoagulation using the direct factor Xa inhibitor apixaban during Atrial Fibrillation catheter Ablation: Comparison to vitamin K antagonist therapy | |
| BAFTA | Birmingham Atrial Fibrillation Treatment of the Aged Study | |
| BMI | testtömegindex | |
| b.p.m. | ütés/perc | |
| CABANA | Catheter Ablation versus Antiaritmic Drug Therapy for Atrial Fibrillation Trial | |
| CABG | koszorúér-bypass graft | |
| CAD | koszorúér-betegség | |
| CHA2DS2-VASc | pangásos szívelégtelenség, magas vérnyomás, életkor ≥75 (kétszeres szorzóval), diabétesz, stroke (kétszeres szorzóval), érbetegség, 65–74 év közötti életkor, nem (női nem) | |
| CHADS2 | szívelégtelenség, magasvérnyomás, életkor, diabétesz, stroke (kétszeres szorzóval) | |
| CI | konfidencia-intervallum | |
| CKD | krónikus vesebetegség | |
| CPG | Gyakorlati Irányelvekért felelős Bizottság | |
| CrCl | kreatinin-clearance | |
| CT | komputertomográfia | |
| CV | kardiovaszkuláris | |
| CYP2D6 | citokróm-P450 2D6 | |
| CYP3A4 | citokróm-P450 3A4 | |
| DIG | Digitalis Investigation Group | |
| EACTS | European Association for Cardio-Thoracic Surgery | |
| EAST | Early treatment of Atrial fibrillation for Stroke prevention Trial | |
| EKG | elektrokardiogram/elektrokardiográfia | |
| EHRA | Európai Szívritmus Társaság (European Heart Rhythm Association) | |
| ENGAGE AF-TIMI | Effective Anticoagulation with Factor Xa Next Generation in Atrial Fibrillation– Thrombolysis in Myocardial Infarction 48 | |
| EORP | EURObservational Research Programme | |
| ESC | Európai Kardiológus Társaság | |
| ESO | Európai Stroke Szervezet | |
| FAST | Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment | |
| FEV1 | erőltetett kilégzési térfogat 1 másodperc alatt | |
| FFP | friss fagyasztott plazma | |
| FXII | XII-es faktor | |
| GDF-15 | növekedési és differenciálódási faktor 15 (growth differentiation factor 15) | |
| GFR | glomeruláris filtrációs ráta | |
| GUCH | felnőttkori veleszületett szívbetegség | |
| HARMONY | A Study to Evaluate the Effect of Ranolazine and Dronedarone When Given Alone and in Combination in Patients With Paroxysmal Atrial Fibrillation | |
| HAS-BLED | magas vérnyomás, rossz vese- vagy májfunkció (1-1 pont), stroke, anamnézisben vérzés vagy arra hajlamosító tényező, ingadozó INR-érték, időskor (>65 év), egyidejűleg drog- és alkoholfogyasztás (1-1 pont) | |
| HEMORR2HAGES | máj- vagy veseérintettség, alkoholfogyasztás, kórtörténetben malignitás, időskor >75 év, csökkent vérlemezkeszám/működés, újabb vérzés kockázata (korábbi vérzés: 2 pont), magas vérnyomás (nem kezelt), anémia, genetikai tényezők (CYP-2C9 polimorfizmus), fokozott elesési kockázat (beleértve a neuropszichiátriai betegségek okozta kockázatnövekedést is), stroke a kórtörténetben | |
| HF | szívelégtelenség | |
| HFmrEF | szívelégtelenség közepesen csökkent eső ejekciós frakcióval | |
| HFpEF | szívelégtelenség megőrzött ejekciós frakcióval | |
| HFrEF | szívelégtelenség csökkent ejekciós frakcióval | |
| HR | kockázati arány | |
| ICD | implantálható kardioverter-defibrillátor | |
| IHD | iszkémiás szívbetegség | |
| IL-6 | interleukin-6 | |
| INR | nemzetközi normalizált ráta | |
| i.v. | intravénás | |
| LA | bal pitvar/bal pitvari | |
| LAA | bal pitvari fülcse | |
| LAAOS | Left Atrial Appendage Occlusion Study | |
| LV | bal kamrai | |
| LVEF | bal kamrai ejekciós frakció | |
| LVH | balkamra-hipertrófia | |
| MANTRA-PAF | Medical ANtiaritmic Treatment or Radio- frequency Ablation in Paroxysmal Atrial Fibrillation | |
| MERLIN | Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary Syndromes | |
| MRA | mineralokortikoidreceptor-antagonista | |
| MRI | mágneses rezonancia képalkotás | |
| NIHSS | National Institutes of Health stroke súlyossági skála | |
| NOAC | nem K-vitamin-antagonista orális antikoaguláns | |
| NOAH | Non vitamin K antagonist Oral anticoagulants in patients with Atrial High rate episodes (NOAH) | |
| NYHA | New York Heart Association | |
| OAC | orális antikoaguláns | |
| OR | esélyhányados | |
| ORBIT | Outcomes Registry for Better Informed Treatment of Atrial Fibrillation | |
| PAFAC | Prevention of Atrial Fibrillation After Cardioversion trial | |
| PAI-1 | plazminogénaktivátor-inhibitor-1 | |
| PCI | percutan koronária-intervenció | |
| PCC | protrombin komplex koncentrátum | |
| PICOT | Population, Intervention, Comparison, Outcome, Time | |
| PREVAIL | Prospective Randomized Evaluation of the Watchman LAA Closure Device In Patients with AF Versus Long Term Warfarin Therapy trial | |
| PROTECT AF | Watchman Left Atrial Appendage System for Embolic Protection in Patients With AF trial | |
| PUFA | többszörösen telítetlen zsírsavak | |
| PVI | pulmonalis vénaizolálás | |
| QoL | életminőség | |
| RACE | Rate Control Efficacy in Permanent Atrial Fibrillation | |
| RATE-AF | Rate Control Therapy Evaluation in Permanent Atrial Fibrillation | |
| RCT | randomizált kontrollált vizsgálat | |
| RE-CIRCUIT | Randomized Evaluation of Dabigatran Etexilate Compared to warfarIn in pulmonaRy Vein Ablation: Assessment of an Uninterrupted periproCedUral antIcoagulation sTrategy | |
| RE-LY | Randomized Evaluation of Long-Term Anticoagulation Therapy | |
| RF | rádiófrekvenciás | |
| ROCKET-AF | Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation | |
| RR | kockázati arány | |
| rtPA | rekombináns szöveti plazminogén-aktivátor | |
| SAMe-TT2R2 | nem (női nem), életkor (>60 év), kórtörténet (az alábbiak közül kettő: magas vérnyomás, diabétesz, MI, PAD, pangásos szívelégtelenség, korábbi stroke, tüdőbetegség, máj- vagy vesebetegség, gyógyszeres kezelés (interakció pl. amiodaronnal), dohányzás (ha 2 éven belül: kétszeres szorzó), rassz (ha nem kaukázusi rasszhoz tartozó: kétszeres szorzó) | |
| SD | standard deviáció | |
| SPAF | Stroke Prevention in Atrial Fibrillation | |
| SR | sinusritmus | |
| TF | szöveti faktor | |
| TIA | tranziens iszkémiás attak | |
| TIMI | Thrombolysis in Myocardial Infarction | |
| TOE | transoesophagealis echokardiográfia | |
| TTR | terápiás tartományban töltött idő | |
| UFH | nem frakcionált heparin | |
| VKA | K-vitamin-antagonista | |
| VT | kamrai tachycardia | |
| VVI | pacemaker-üzemmód (kamrai ingerlés, kamrai érzékelés, intrinszik aktivitás észlelésekor gátolt válasz) | |
| WOEST | What is the Optimal antiplatElet and anti-coagulant therapy in patients with oral anticoagulation and coronary StenTing | |
| WPW | Wolff–Parkinson–White-szindróma |
1. Előszó
Az útmutató feladata összefoglalni és értékelni egy adott betegséggel kapcsolatban az aktuálisan rendelkezésre álló összes evidenciát. Célja, hogy segítse a kezelőorvosokat az adott betegségben szenvedők számára a legmegfelelőbb kezelési mód kiválasztásában, figyelembe véve az adott kezelés eredményességét, valamint az adott betegnél alkalmazott diagnosztikai vagy terápiás eszközök kockázat-haszon arányát. Az útmutató és a benne foglalt ajánlások ugyan a betegellátásban dolgozó egészségügyi szakemberek számára hivatottak elősegíteni a döntéshozatal folyamatát, az adott beteggel kapcsolatos konkrét döntést azonban a felelős egészségügyi szakember(ek)nek kell meghozni a beteggel, szükség esetén a hozzátartozóval vagy gondviselővel történő egyeztetést követően.
Az elmúlt években számos útmutatót készítettek az Európai Kardiológus Társaság (ESC), az Európai Szív-Mellkassebészeti Társaság, valamint más társaságok és szervezetek. Mivel az irányelvek jelentősen befolyásolják a klinikai gyakorlatot, kidolgozásra került egy, az irányelvek megalkotására vonatkozó minőségi kritériumrendszer, amely által a felhasználók számára is átláthatóvá válnak az abban foglalt döntések. Az ESC irányelvek megfogalmazására és kiadására vonatkozó ajánlások az ESC honlapján olvashatók (http://www.escardio.org/Guidelines-&-Education/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Az ESC Útmutató az ESC hivatalos állásfoglalását tartalmazza egy adott témával kapcsolatban, amely rendszeresen frissítésre kerül.
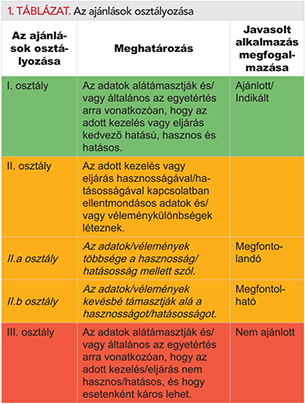
A munkacsoport tagjait az ESC választotta ki az Európai Szívritmus Társaság (EHRA), az EACTS és az ESO azon szakemberei közül, akik részt vesznek az adott betegségben szenvedők ellátásában. A témában elismert szakemberek teljes körű áttekintést nyújtanak az adott betegség ellátásával (diagnosztizálásával, kezelésével, megelőzésével és rehabilitációjával) kapcsolatosan közölt eredményekről az ESC Gyakorlati Irányelvekért felelős Bizottsága (CPG) által meghatározott elveket követve az EACTS és az ESO jóváhagyásával. Kritikusan értékelik a diagnosztikai és terápiás eljárásokat, valamint ezek kockázat-haszon arányát. Ezen felül – amennyiben léteznek erre vonatkozó adatok – az áttekintésben szó esik az adott kezelésnek egy nagyobb betegpopuláció egészségi állapotára gyakorolt várható hatásáról. Az egyes kezelési lehetőségekre vonatkozó adatok bizonyító erejét, valamint az ajánlások erejét előre meghatározott skálák alapján osztályozzák és rangsorolják, amint azt az 1. és 2. táblázat is szemlélteti.

A testületek szakértői nyilatkoztak azokról a kapcsolataikról, amelyek valós vagy lehetséges összeférhetetlenség forrását képezhetik. A nyilatkozatokat egy fájl tartalmazza, amely elérhető az ESC honlapján (http://www.escardio.org/guidelines). A dokumentum megírásának idején az összeférhetetlenség tekintetében bekövetkező változásokról folyamatosan tájékoztatni kellett az ESC-t és az EACTS-ot. A Munkacsoport teljes pénzügyi támogatását az ESC és az EACTS biztosította, az Útmutató kidolgozására az egészségügyi ipar érintettsége nélkül került sor.
Az ESC Gyakorlati Irányelvekért felelős Bizottsága felügyeli és koordinálja a munkacsoportok, szakértői csoportok vagy konszenzus fórumok által kidolgozott új Útmutatók előkészítését. A Bizottság felelős ezen irányelvek vagy nyilatkozatok elfogadási eljárásáért is.
Az ESC Útmutatót a CPG szakértői, külső szakértők – és jelen esetben az EACTS és az ESO által kijelölt szakemberek is – ellenőrzik, ezt követően a szakértői munkacsoport minden tagja jóváhagyja. A CPG, az EACTS és az ESO jóváhagyja a dokumentum végleges formáját, majd ezt követően a European Heart Journalben, a Europace-ben, a European Journal of Cardio-Thoracic Surgery-ben és az International Journal of Stroke-ban (TBC) teszik közzé. Az Útmutató elkészítésénél gondosan mérlegelték a dokumentum összeállításának idején rendelkezésre álló tudományos és orvosi ismereteket, illetve evidenciákat.
Az ESC és EACTS Útmutató kidolgozásakor a cél nem csupán a legfrisebb kutatási eredmények integrálása volt, hanem az ajánlások gyakorlati alkalmazását elősegítő oktatási eszközöknek és programoknak a létrehozása is. Az ajánlások foganatosítását segíti elő a zsebméretű verziók (pocket guidelines), az összefoglaló diák, a lényegi üzenetet tartalmazó összefoglaló brossúrák, a nem szakemberek számára íródott tájékoztató kártyák, valamint a mobil applikációkhoz (pl. okostelefon stb.) készült elektronikus verzió megalkotása. Mindezek az eredeti dokumentum kivonatát tartalmazzák, így ahol az szükséges, hivatkozni kell az ESC honlapján ingyenesen hozzáférhető teljes szövegre. Ezért az ESC nemzeti tagszervezeteit arra ösztönözzük, hogy támogassák, fordítsák le saját nyelvre és alkalmazzák az összes ESC Útmutatót. Az Útmutató bevezetését támogató programokra azért van szükség, mert kimutatták, hogy a klinikai ajánlások teljes körű alkalmazása kedvezően befolyásolja a betegség kimenetelét.
A felmérések és vizsgálatok azt hivatottak ellenőrizni, hogy az Útmutatóban foglalt ajánlásokat követik-e a valóságban a mindennapi gyakorlat során, ugyanis ezzel válik teljessé az a folyamat, amelynek elemeit a klinikai kutatások végzése, az irányelvek kidolgozása és terjesztése, valamint ezeknek a klinikai gyakorlatba történő bevezetése jelentik.
Felhívjuk az egészségügyi szakemberek figyelmét, hogy a döntéshozatal, valamint az azt megelőző, diagnosztikus és terápiás stratégiák kialakítása során, illetve azok alkalmazásakor vegyék figyelembe az ESC és EACTS Útmutatóban foglaltakat. Mindemellett, az ESC és EACTS Útmutató nem mentesíti az egészségügyi szakembert az egyéni felelősség, a beteggel – szükség esetén a hozzátartozóval vagy gondviselővel – történő egyeztetés kötelezettsége alól, az adott beteggel kapcsolatban a beteg egészségi állapotát figyelembe vevő megfelelő és gondos döntés meghozatalában. Szintén az egészségügyi szakember felelőssége a gyógyszerek és eszközök felírásával és alkalmazásával kapcsolatos előírások és szabályok naprakész ismerete, betartása.
2. Bevezető
Annak ellenére, hogy a pitvarfibrilláció ellátása sokat fejlődött, még mindig ez az aritmia számít világszerte az egyik legfőbb kockázati tényezőnek a stroke, a szívelégtelenség, a hirtelen szívhalál, valamint a kardiovaszkuláris halálozás szempontjából. Az elkövetkező években a PF-betegek száma várhatóan meredeken emelkedik. Folyamatosan keletkeznek és kerülnek közlésre az ellátással kapcsolatosan újabb ismeretek, mivel egyre nagyobb az igény a PF-betegek hatékony kezelésére, amely az elmúlt pár évben lényeges fejlődésen ment keresztül. Ezért időszerűnek tűnik a pitvarfibrilláció ellátásáról szóló ESC Útmutató 2. kiadásának megjelentetése.
A PF-betegek ellátása multidiszciplináris feladat, a munkacsoport tagjait különböző részterületekre szakosodott kardiológusokból, szívsebészekből, stroke-ellátásban jártas neurológusokból és szakápolókból válogatták össze. Az Előszóban tárgyalt evidenciák összegzéséhez a munkacsoport a PICOT (Population, Intervention, Comparison, Outcome, Time) módszer alapján három kérdést fogalmazott meg minden releváns témával kapcsolatban. Az ESC ezeknek a kérdéseknek a megválaszolására külső szisztematikus irodalomelemzéseket végzett, ezeknek az eredménye pedig bekerült az ajánlásokba.
Az ESC Útmutató elkészítésére vonatkozó egységes követelmény értelmében (lsd. Előszó) a munkacsoport minden egyes ajánlás vázlatát megvitatta az egyes fejezetről tartott webkonferenciák keretében, majd konszenzus alapján módosította és online szavazásra bocsátotta azokat. Csak azok az ajánlások kerültek bele az Útmutatóba, amelyeket a tagságnak legalább a 75%-a támogatott.
Reméljük, hogy ez a 2016-ban legkorszerűbbnek tekinthető evidenciák alapján elkészült Útmutató hasznos segítséget fog nyújtani a pitvarfibrilláló betegek gondos ellátásához.
3. A pitvarfibrilláció epidemiológiája és hatása a betegekre
3.1 A pitvarfibrilláció incidenciája és prevalenciája
2010-ben a pitvarfibrilláló nők számát 20,9 millióra, a férfiakét pedig 12,6 millióra becsülték világszerte. Az incidencia és a prevalencia aránya a fejlett országokban volt a legmagasabb (1, 2). Négy európai vagy amerikai középkorú felnőttből egynél várható a PF kialakulása (3–5). Az Európai Unióban 2030-ra várhatóan 14-17 millió között lesz a pitvarfibrilláló betegek száma, az újonnan diagnosztizált betegek számát 120 000–215 000 fő/évre becsülik (2, 6, 7). A becslések szerint a PF prevalenciája mintegy 3%-ra tehető a 20 éves vagy annál idősebb felnőtt populációban (8, 9). Az idősek, a magas vérnyomásban, szívelégtelenségben, koszorúér-betegségben (CAD), szívbillentyű-betegségben, elhízásban, diabetes mellitusban vagy krónikus veseelégtelenségben (CKD) szenvedők körében ez a szám pedig még nagyobbra tehető (7, 10–15). A várható prevalencia-növekedés egyrészről a néma PF hatékonyabb felismerésének (16–18), másrészről a növekvő életkornak és a hajlamosító állapotok gyakoribb előfordulásának köszönhető (19).

3.2 A pitvarfibrilláció morbiditása, mortalitása és hatása az egészségügyi ellátórendszerre
A PF önmagában nőknél kétszeresére, férfiaknál pedig 1,5-szeresére (20–22) növeli a báramely okból bekövetkező halálozás kockázatát (3. táblázat). A stroke-halálozást nagymértékben csökkenti a PF-betegek antikoagulálása, míg az egyéb okból (pl. szívelégtelenség, hirtelen szívhalál miatt) bekövetkező kardiovaszkuláris halálozás gyakoriságán nem változtat a jelenleg érvényben lévő, evidenciákon alapuló kezelés folytatása (23). A PF mellett magasabb az egyéb betegségek, mint a szívelégtelenség és a stroke előfordulása (21, 24, 25). Kortárs vizsgálatokból az derült ki, hogy az iszkémiás stroke-ban szenvedő betegek 20-30%-ánál diagnosztizálnak az első eseményt megelőzően, az alatt vagy azt követően PF-et (17, 26, 27). PF-betegeknél gyakran észlelhető agyi fehérállomány-károsodás, kognitívfunkció-romlás (28–30), életminőségromlás (31, 32) és ledált hangulat (33). A PF-betegeknek évente mintegy 10-40%-a szorul kórházi ellátásra (23, 24, 35).

A PF ellátásának közvetlen költsége az Egyesült Királyságban már a teljes egészségügyi kiadás mintegy 1%-át teszi ki, 2008-ban az USA-ban pedig 6-26 milliárd USA-dollárt jelentett (36, 37), amelynek legnagyobb részét a szövődmények ellátásának költsége (pl. stroke) és a kezelési költség (pl. hospitalizáció) tette ki. Amennyiben nem kerül sor időben a betegség hatékony megelőzésére és kezelésére, a költségek drámai növekedése várható.
3.3 Az evidencián alapuló kezelés hatása a várható prognózisra pitvarfibrilláló betegeknél
Az 1. ábra a PF ellátásában mérföldkövet jelentő tudományos eredményeket szemlélteti. A terápia jelentős mértékű fejlődésének ellenére még mindig magas a PF morbiditása. A K-vitamin-antagonistákkal (VKA) és a nem K-vitamin-antagonista szerekkel (NOAC) végzett orális antikoagulálás jelentősen csökkenti a pitvarfibrilláló betegeknél a stroke kialakulását és a halálozást (38, 39). Az egyéb beavatkozások, mint a ritmuskontroll és a frekvenciakontroll javítják ugyan a tüneteket és segítik a szív pumpafunkciójának megőrzését, hosszú távon azonban nem csökkentik a morbiditást és a mortalitást (40, 41).
Randomizált, megfelelően kontrollált kortárs vizsgálatok a stroke éves előfordulási arányát 1,5% körülinek, az éves halálozási rátát pedig 3% körülinek találták a véralvadásgátlóval kezelt PF-betegeknél (40). A valóságban az éves halálozási adatok ettől pozitív és negatív irányban is eltérhetnek (42). A halálokok között ritkábban szerepel a stroke, gyakori viszont a hirtelen szívhalál és a progresszív szívelégtelenség, ami arra utal, hogy az antikoagulálás mellett egyéb beavatkozások is szükségesek (43, 44). A PF hospitalizációs aránya magas: általában a ritmuszavar kezelése, de gyakran a kialakult szívelégtelenség, miokardiális infarktus és a kezeléssel összefüggő szövődmények ellátása céljából kerül sor kórházi felvételre (34, 45).
3.4 A nemek szerepe
Mind a fejlett, mind a fejlődő országokban a PF életkor szerinti incidenciája és prevalenciája alacsonyabb a nők körében. Ezzel szemben a halálozás kockázata a pitvarfibrilláló nőknél hasonló, vagy magasabb, mint a pitvarfibrilláló férfiaknál (1, 46, 47). A stroke-kockázattal rendelkező nőknél (főként idősebb korban) a warfarinnal történő antikoagulálás ellenére (50) is magasabb a stroke-kockázat, mint a hasonló kockázati tényezőkkel rendelkező férfiaknál (48, 49) (ld. 9. fejezet). A diagnosztizált pitvarfibrilláló nőknek jellemzően több tünetük van, mint a férfiaknak, életkorukat tekintve idősebbek és több társbetegségben szenvednek (51, 52). A vérzési kockázat mértéke antikoagulálás mellett egyforma a két nemben (49, 50, 53), a pitvarfibrilláló nők azonban ritkábban részesülnek szakorvosi ellátásban és ritmuskontroll-terápiában, annak ellenére, hogy a katéterabláció vagy a műtéti kezelés kimenetele a férfiakéhoz hasonló mértékű (55, 56). Ezek a megfigyelések arra világítanak rá, hogy a nőknek és a férfiaknak egyformán kell felajánlani a hatékony diagnosztikus és terápiás eljárásokat.

4. Az ellátás patofiziológiai és genetikai szempontjai
4.1 Genetikai hajlam
A PF – főként a korai megjelenésű PF – kialakulásában a kardiovaszkuláris állapottól független örökletes genetikai tényezők is szerepet játszanak (58, 59). Kevés azoknak a fiatal PF-betegeknek a száma, akik genetikai mutáció következtében kialakult örökletes cardiomyopathiában vagy ioncsatorna-rendellenességben szenvednek. Ezek a monogénes öröklődésű betegségek magukban hordozzák a hirtelen szívhalál kialakulásának kockázatát (ld. 6. fejezet). A PF-betegeknek legalább az egyharmada hordoz a PF kialakulására hajlamosító gyakori genetikai variánsokat, jóllehet, ezek relatíve alacsony többletkockázattal járnak. Legalább 14 gyakori genetikai variánsról – több esetben egypontos nukleotid polimorfizmusról – ismert, hogy növeli a PF kialakulásának a kockázatát a populációban (60–62). A legfontosabb variánsok a 4. kromoszóma hosszú karján (4q25) található Pitx2 (paired like homeodomain transcription factor 2) transzkripciós faktort kódoló gén közelében lokalizálódnak (63, 64). Ezek a variánsok akár a 7-szeresére növelhetik a PF kockázatát (64). A PF szempontjából kockázatot jelentő variánsok közül többhöz kardioembóliás vagy iszkémiás stroke kialakulásának a kockázata is társul, valószínűleg a néma PF miatt (ld. 4.1 fejezet) (62, 65, 66). Az ilyen gyakori genetikai variánsokat hordozó egyéneknél a magasabb PF-kockázat hátterében a megváltozott pitvari akciós potenciált (67–70), a pitvari remodellinget és a ritka géndefektusok (61) változó penetranciáját, mint lehetséges kiváltó okokat feltételezik. A jövőre nézve ezeknek a genetikai variánsoknak az azonosítása hasznos segítséget nyújthat a ritmuskontroll- vagy a frekvenciakontroll-terápiára alkalmas betegek kiválasztásában (71–74). Míg a jövőre nézve a genomikai vizsgálatok bevezetése lehetőséget rejt a PF diagnosztikájának és ellátásának fejlesztére (75, 76), jelen pillanatban nem ajánlott rutin genetikai vizsgálatokat végezni a PF-ben előforduló gyakori genetikai variánsok azonosítása céljából (77).
4.2 A pitvarfibrilláció kialakulásáért felelős mechanizmusok
4.2.1 Szerkezeti és ioncsatorna-remodelling a pitvarban
Külső stresszforrások mint a strukturális szívbetegség, a magas vérnyomás, esetleg a diabétesz, de maga a PF is elindítanak egy lassú, de progresszív remodelling folyamatot a pitvarban (2. ábra). A folyamat meghatározó jelenségei a fibroblasztok aktivációja, a fokozott kötőszövet-képződés és a fibrosis (78–80). Mindezek mellett azoknál a PF-betegeknél, akiknél egyidejűleg PF-re hajlamosító állapotok is fennállnak, megfigyelhető a pitvarok zsíros infiltrációja, gyulladásos infiltrátumok képződése, a myocyták hipertrófiája, nekrózis és amyloidosis (81–84). A szerkezeti remodelling az egyes pitvari izomkötegekben elektromos disszociációt és lokális ingerületvezetési zavart eredményez (85), amely kedvez a reentry körök kialakulásának és fenntartja az aritmiát (86). Sok esetben a szerkezeti remodelling megelőzi a PF kialakulását (78). Mivel a folyamat bizonyos elemei idővel visszafordíthatatlanná válnak, a kezelést mihamarabb el kell kezdeni (87). A 4. táblázat összefoglalja PF-ben a pitvari szövetben végbemenő legfontosabb patofiziológiai folyamatokat és az azokra hajlamosító klinikai állapotokat.

A pitvari myocardiumban végbemenő funkcionális és strukturális változások, valamint a stasis (különösen a bal pitvari fülcsében) protrombotikus állapotot idéznek elő. Még a rövid ideig tartó PF is képes károsítani a pitvari myocardiumot, protrombotikus faktorok expresszióját előidézni a pitvari endothelsejtek felszínén, valamint aktiválni a trombocitákat és a gyulladásos sejteket, amelyek egy szisztémás protrombotikus állapot létrejöttéhez vezetnek (88, 89). A véralvadási rendszer pitvari és szisztémás aktivációja lehet a magyarázat arra, hogy a rövid ideig tartó PF miért jelent hosszú távon stroke-kockázatot.

4.2.2 Elektrofiziológiai mechanizmusok
A PF kialakulása utáni első napokban lerövidül a refrakter periódus és a PF-ciklus hossza, amelynek hátterében leginkább a befelé irányító Ca2+-áram down-regulációja és a befelé irányító K+-áram up-regulációja áll (94, 95). Ezzel ellentétben, strukturális szívbetegségben hajlamos megnyúlni a pitvari refrakter periódus. Ez is azt mutatja, hogy az egyes betegekben mennyire sokféle mechanizmus lehet felelős a PF kialakulásáért (96). A különböző Ca2+-szintet szabályozó fehérjék hiperfoszforilációja fokozza a sejtekből a spontán Ca2+-kiáramlást és ezáltal a sejtek aktivitását (97, 98), amely ektópiás gócként szolgál és hozzájárul a PF fenntartásához. Habár a Ca2+-háztartás instabilitásának elméletét nemrégiben megcáfolták (106, 107), mégis szerepe lehet a PF kialakulásában egy strukturálisan átalakult pitvari szövetben és megmagyarázhatja, hogyan vezet a megváltozott autonóm aktivitás PF kialakulásához (80, 105).
4.2.2.1 A PF fokális beindítása és fenntartása
Haissaguerre és munkatársainak (108) úttörő felfedezése volt, hogy a tüdővénákban létrejövő fokális aktivitás PF-epizódot képes kiváltani, a triggerterület ablációjával viszont megszüntethető a PF visszatérése. Mind a triggerelt aktivitás, mind a lokális reentry mechanizmusok a fokális aktivitás mechanizmusai közé tartoznak (109, 110). A gyorsan aktiválódó területek által kiváltott PF hierarchikus szerveződése (111, 112) jellemző paroxizmális PF-ben, nem válogatott beteganyagon vizsgálva azonban ez kevésbé egyértelműen látszik perzisztens PF-ben (113).
4.2.2.2 A „többszörös hullám” hipotézis és a rotorok szerepe a PF kialakulásában
Moe és Abildskov (114) elmélete szerint a PF-et a pitvar szövetében számos, egymástól független hullám látszólag kaotikus, folyamatos terjedése tartja fenn. Amíg a hullámfrontok száma nem csökken egy kritikus szint alá, addig a többszörös hullámok fenntartják az aritmiát. Számos kísérleti és klinikai eredmény támasztja alá a többszörös hullámhipotézist (115). Az összes lokalizált aritmia-forrás (ektópiás fókuszok, rotorok vagy más stabil reentry körök) képes a kiindulási ponttól távolra vezetni a fibrillációs hullámot, amelyet nehéz elkülöníteni a többszörös hullámok által fenntartott PF-től. Mindkét jelenség generálhat rotorokat, amelyeket intrakardiálisan (116, 117) vagy a testfelszínen (117) regisztrálni lehet.
5. A pitvarfibrilláció diagnózisa és időbeli felismerése
5.1 A tünetekkel járó és a néma pitvarfibrilláció
A PF diagnózisának felállításához EKG-regisztrátumra van szükség, amelyen a PF-re jellemző EKG-jelek: a teljesen szabálytalan RR-távolságok és a hiányzó p-hullámok láthatók. Az Útmutatóban szereplő evidenciákat szolgáltató vizsgálatokban a betegbeválasztás feltétele volt az EKG-val dokumentált PF. Megállapodás szerint, PF-nek kell tekinteni azt az aritmiát, amely legalább 30 másodpercen keresztül jelen van egy ritmusszakaszon. A PF-nek szimptómás és aszimptómás (néma) formája is ismert. Sok betegnél mindkét forma előfordul (118–121).
Gyakori a felismerésre nem kerülő (120, 122), súlyos szövődményekkel társuló (pl. stroke, halálozás) néma PF (123–125). A krónikus PF dokumentálásának hatékony és költséghatékony formája egy azonnali EKG-regisztrátum elkészítése (126). A paroxizmális, magától megszűnő PF felismerésére alkalmas technológiák rohamosan fejlődnek (ld. 6.1 fejezet a PF típusainak definiálásáról). Több adat is arra utal, hogy a tartós [pl. stroke után 72 óráig (27, 127), vagy még hosszabb] (18, 128) EKG-monitorozással javul a még nem diagnosztizált PF észlelésének az esélye. A napi gyakorisággal készített rövid EKG-k a 75 év fölötti populációban növelik a PF feltárásának az esélyét (129) (1. web-ábra). Folyamatban lévő vizsgálatok fognak választ adni arra, hogy a PF ilyen formán történő korai felismerése változtat-e az ellátási stratégián (pl. antikoagulálás megkezdése) és javítja-e a prognózist.
A diagnózis felállítását követően is elvégzett EKG-vizsgálatok hasznos információt nyújthatnak az ellátás szempontjából (1) a tünetek jellegének változásáról, új tünetek jelentkezéséről (2), a progresszió gyanújáról, illetve alkalmas lehet (3) a gyógyszerek kamrai működést befolyásoló hatásának monitorozására és (4) a ritmuskontroll céljából alkalmazott antiaritmiás szerek vagy a katéterabláció hatásának monitorozására.
5.2 A néma pitvarfibrilláció szűrése
5.2.1 A pitvarfibrilláció elektrokardiográfiás szűrésea lakosság körében
A nem diagnosztizált PF gyakori jelenség, főként az idősebb populációban és a szívelégtelenségben szenvedő betegek körében (130). A néma PF opportunista szűrése költséghatékonynak tűnik az idősebb populációban (pl. a 65 éveseknél) (131), és hasonló eredményekről számoltak be az egy elvezetéses EKG-monitorozás kapcsán más kockázati tényezőkkel rendelkező betegcsoportoknál is (132, 133). Az idősebb (64 éves átlagéletkorú) populáció szűrésekor a krónikus PF prevalenciáját 2,3%-nak találták a 122 571 megvizsgált betegnél; a szűrést rövid EKG-k készítésével vagy a pulzus tapintásával (amelyet szabálytalan pulzus tapintása esetén EKG-felvétel készítése követett) végezték (134). A 65 év fölöttiek körében 1,4%-ban észleltek korábban nem diagnosztizált PF-et, ami azt jelenti, hogy 70 beteget kell leszűrni ahhoz, hogy 1 betegnél PF-et észleljünk. Ezen eredmények ösztönzőleg hatnak további szisztematikus PF-szűrőprogramok értékelésére a kockázati tényezőkkel rendelkező populációkban.
5.2.2 A paroxizmális pitvarfibrilláció hosszú távú monitorozása
A paroxizmális PF gyakran felfedezetlen marad (120). Egy nem válogatott, 75 év fölötti svéd betegből álló populációban a napi több alkalommal elvégzett EKG-vizsgálat növelte a néma, tünetmentes paroxizmális PF felismerésének a valószínűségét (120, 135). A paroxizmális PF feltárására számos, a beteg által aktivált eszköz (136, 137) és öntapadós elektródával működő Holter-monitorozás alkalmazható mint validált módszer (1. web-ábra) (139). A tünetmentes PF felismerésében az új technológiák (okostelefon tokjába épített EKG-készülék, okos karórák és PF detektálási funkcióval rendelkező vérnyomásmérők) hatékonyságát hivatalosan még nem hasonlították össze a használatban lévő módszerekével (140).
5.2.3 Pacemakerrel és beültetett eszközzel rendelkező betegek
A pitvari elektródával rendelkező beültethető pacemakerek vagy defibrillátorok segítségével folyamatosan monitorozható a pitvarból eredő ritmus. Ezzel a módszerrel azonosíthatóak a magas frekvenciával járó epizódok (AHRE). Az ilyen magas frekvenciával járó epizódok a pacemakerrel rendelkező betegeknél – az adott populáció kockázati profiljától függően –, 10-15%-ban észlelhetőek (141). A magas frekvenciával járó epizódok mellett nagyobb a kockázata a tünetekkel járó PF (kockázati arány [HR]: 5,56, 95%-os konfidencia intervallum [CI]: 3,78–8,17, p<0,001), valamint az iszkémiás stroke és a szisztémás embolizáció (HR: 2,49, 95%-os CI: 1,28–4,85, p=0,007) kialakulásának. A magas frekvenciával járó epizódok mellett alacsonyabbnak tűnik a betegek stroke-kockázata, mint a diagnosztizált PF mellett, emellett nem jelent minden magas frekvenciával járó epizód PF-t (142). A stroke kialakulását megelőző 30 napon belül gyakran nem észlelhető magas frekvenciával járó epizód (143–147). Következésképpen nem egyértelmű, hogy a magas frekvenciával járó epizódok észlelésekor ugyanazon terápiás követelmények szerint kell-e eljárni, mint a PF esetén (148). Az orális antikoagulálás (OAC) eredményessége a magas frekvenciával járó epizódokkal észlelt betegeknél folyamatban lévő klinikai vizsgálatok (pl. az Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation [ARTESiA] [NCT01938248] vizsgálat és a Non vitamin K antagonist Oral anticoagulants in patients with Atrial High rate episodes [NOAH – AFNET 6] [NCT02618577] vizsgálat) tárgyát képezi. A jelenlegi álláspont szerint a pacemakerek és a beültethető eszközök memóriájából folyamatosan ellenőrizni kell a magas frekvenciával járó epizódok előfordulását. Azoknál a betegeknél, akiknél ilyet észlelnek, fel kell mérni a stroke-kockázatot és az EKG segítségével PF irányába vizsgálódni (3. ábra) (149).

5.2.4 A pitvarfibrilláció észlelése stroke-on átesett betegeknél
A rendszeresen végzett EKG-vizsgálatok segítségével a stroke-túlélők 24%-ánál (95%-os CI: 17–31) (151), egy másik metaanalízis szerint pedig 11,5%-uknál (95%-os CI: 8,9%–14,3%) (17) sikerült azonosítani PF-et, de a sikerarány nagymértékben függött a vizsgálat időzítésétől, időtartamától és módszerétől. A PF észlelése nem szokatlan stroke-on átesett, nem válogatott betegeknél (6,2%, 95%-os CI: 4,4–8,3) (128), ám nagyobb valószínűséggel detektálható azoknál a kriptogén stroke-on átesett betegeknél, akiknél loop-rögzítő van beültetve, vagy akiket heteken át EKG-monitoroznak (18, 128, 152). A kriptogén stroke egy olyan kórforma, amelynek alapos kivizsgálást követően sem állapítható meg a kiváltó oka (153). Tágabb értelemben a nem meghatározott eredetű embóliás stroke-ot takarja (154). Több vizsgálatban is sikerült PF-et feltárni azoknál a betegeknél, akiknél a klinikai vizsgálat során egy másik valószínű stroke-kockázati tényezőt (pl. magas vérnyomás, carotis-stenosis) is azonosítottak (27, 127). Ennélfogva az összes olyan iszkémiás stroke-ot túlélő betegnél indokoltnak tűnik a tartós monitorozás, akiknél nincs diagnosztizálva PF.

5.3 A pitvari flutter felismerése az elektrokardiogramon
A jobb pitvari isthmus-dependens flutter jellegzetes EKG-képpel és kamrai ritmussal jelentkezik (158). A pitvari flutter prevalenciája kevesebb, mint egytizede a PF prevalenciájának (159). A pitvari flutter gyakran PF-fel együtt vagy azt megelőzően lép fel (160). Az isthmus-területéről kiinduló flutterben a p-hullámok – főként az inferior elvezetésekben (II, III, aVF) – jellegzetes „fűrészfog”-szerű képet mutatnak. A kamrai frekvencia változó lehet, általában 4:1–2:1, ritkán 1:1 arányú pitvar-kamrai átvezetés figyelhető meg. A stabil 2:1-es arányú átvezetésnél nehéz észlelni a makroreentry tachycardiákat. A vagus-stimuláció és az intravénás adenozin segíthet a pitvari flutter provokálásában. A pitvari flutter ellátását a 12.7 fejezet tárgyalja. Bal vagy jobb pitvari makroreentry tachycardia főként a PF katéterablációját vagy sebészi kezelését követően, illetve nyitott szívműtét után fordul elő (158).
6. A pitvarfibrilláció osztályozása
6.1 A pitvarfibrilláció típusai
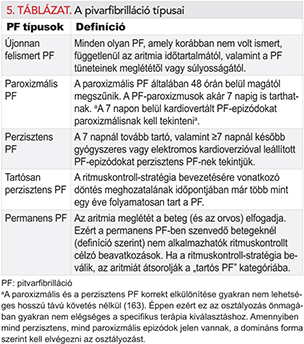
Sok esetben megfigyelhető a PF progressziója a rövid, ritka epizódokból a hosszan tartó, egyre gyakoribbá váló epizódokba. Idővel sok betegnél tartóssá válik a PF. A betegek egy kisebb hányadánál (2-3%) évtizedekig paroxizmális maradhat a PF jellege (161). A paroxizmusos epizódok nem véletlenszerűen, hanem halmozottan jelentkeznek (162). A PF perzisztens formája is visszaalakulhat paroxizmálissá. Sőt, szimptómás PF-betegeknél gyakori az aszimptómás epizódok előfordulása is (120).
A PF megnyilvánulása, időtartama és spontán megszűnése alapján hagyományosan 5 típust különböztetünk meg: az újonnan felismert, a paroxizmális, a perzisztens, a tartósan perzisztens és a permanens PF-et (5. táblázat). Ha paroxizmális és perzisztens PF-epizódok is előfordulnak egy betegnél, a gyakoribb típus alapján kell a klasszifikációt elvégezni. A PF klinikai felosztása a hosszú távon végzett EKG-vizsgálatok alapján nem korrelál a PF epizódok számával (163). Szintén kevés ismeret áll rendelkezésre a tartósan perzisztens PF-ben és a tartós paroxizmális PF-ben szenvedő betegek terápiás válaszáról. Ezen hiányosságok ellenére számos vizsgálatban megkülönböztették egymástól a PF paroxizmális és perzisztens formáját, így még ez a felosztás szolgál néhány ajánlás alapjául.
Léteznek arra vonatkozó evidenciák, hogy a PF-epizódok száma befolyásolhatja a stroke-kockázatot (44, 124, 164) és ennek függvénye lehet a ritmuskontroll-terápiára adott válasz (76, 165). Ezek gyenge evidenciák, ezért terápiás intervenció kiválasztásakor nem szabad nagy hangsúlyt fektetni a PF-epizódok számára, amennyiben az az eljárás egyéb szempontok alapján megfelelő lenne.
6.2 A pitvarfibrilláció típusai a kiváltó okok függvényében
Számos fiziológiás és patológiás állapotban magas a PF kialakulásának a kockázata (2. ábra), a régi „idiopátiás PF” megnevezés félrevezető lehet, ezért kerülendő (166). A PF egy adott típusának hátterében álló kiváltó mechanizmusok egyénenként lényegesen eltérőek lehetnek (6. táblázat) (167). Ez azt sugallja, hogy a betegek osztályozása a PF kialakulásáért felelős mechanizmusok alapján lényeges segítséget nyújthatna a terápia megválasztása szempontjából, figyelembe véve pl. a szíveredetű és a szisztémás társbetegségek fennállását (pl. diabétesz és obesitas) (168), az életmód-tényezőket (pl. a fizikai aktivitás mértékét, a dohányzást, az alkoholfogyasztást) (169, 170), a szív szerkezeti remodellingjének markereit pl. fibrosis (171–173) vagy a PF komplexitásának EKG-jelei) (174) vagy a genetikai hátteret. A 6. táblázat ezt a szakértői konszenzuson alapuló felosztást ismerteti (76, 120, 175), azonban nem sok klinikai alkalmazást alátámasztó evidenciát tartalmaz (176). A PF egyes típusainak pontosabb meghatározásához egyértelműen szükség lenne a legjelentősebb kiváltó tényezőket feltáró szisztematikus vizsgálatokra (176).

6.3 A tünetek okozta betegségteher pitvarfibrillációban
A PF-betegek életminősége lényegesen rosszabb, mint az egészséges kontrolloké. Számos tünettől szenvednek, mint letargia, palpitáció, dyspnoea, mellkasi szorító fájdalom, alvászavar, vagy pszichoszociális distressz (32, 177–180). A gyógyszeres és intervenciós terápiákkal javítható a betegek életminősége (181–185), az egyes módszerek összehasonlításához azonban nincsen elegendő adat (32, 186). Az életminőség felmérését az is korlátozza, hogy a sokféle PF-specifikus életminőség kérdőív nem feleltethető meg egymásnak (187–191). A tünetek felméréséhez, azok súlyosságának értékeléséhez az EHRA tüneti skála (7. táblázat) alkalmazását javasolja az EHRA (192). Ehhez hasonló skálát (the Canadian Cardiovascular Society Severity of Atrial Fibrillation Scale) alkalmaznak Kanadában is (193). Az EHRA-skála egy használatban lévő validált mérőeszköz (194–199). 2014-ben annyiban módosították, hogy az EHRA 2-es csoportot további két alcsoportra osztották az alapján, hogy a tünetek az életminőséget enyhén (2a) vagy mérsékelt fokban (2b) befolyásolják (199). A vizsgálatban a 2b csoportba sorolt tünetekkel („zavaró tünetek”) rendelkező betegek voltak azok, akiknek egészségügyi szempontból előnye származott a ritmuskontroll-terápiából, így ez a változtatás egyfajta határt jelent a terápia kiválasztása szempontjából, feltételezve, hogy ez a besorolástól független is megerősítést nyer. Míg a betegek egy részének (25-40%) egyáltalán nincsenek vagy csak minimális tünetei vannak, addig sokan (15-30%) súlyos vagy az életterüket jelentősen beszűkítő tünetekről számolnak be (194, 196). A módosított EHRA-skála nagy segítséget nyújt a tünetorientált terápiás döntések meghozatalában.


7. A kockázati tényezők és a társuló kardiovaszkuláris betegségek felismerése és kezelése
Számos kardiovaszkuláris betegség és társuló állapot növeli a PF (8. táblázat), a rekurrens PF és a PF-hez társuló szövődmények kialakulásának esélyét. Ezen állapotok felismerése, megelőzésük és kezelésük fontos a PF és a vele járó betegségteher kialakulásának a megelőzésében. Ennélfogva ezen tényezőknek és kezelésüknek az ismerete elengedhetetlen a PF-betegek optimális ellátásához (203, 204).
7.1 Szívelégtelenség
Sok betegnél egyszerre van jelen szívelégtelenség és PF (215–217). A két betegség kockázati tényezői hasonlóak és mindkettőnél közös patofiziológia érvényesül (218). A szívelégtelenség és a PF egymás kiváltó és súlyosbító tényezői is lehetnek a szív szerkezeti remodellingje, a neurohormonális mechanizmusok aktivációja és a balkamra-funkció frekvenciafüggő romlása révén. A PF-fel egy időben – akár megtartott (left ventricular ejection fraction [LVEF] ≥50%), akár csökkent kamrafunkcióval járó (LVEF <40%) (219, 220) – szívelégtelenségben is szenvedő betegeknek rosszabb a prognózisa, beleértve a magasabb mortalitást is (16, 221). A szívelégtelenség kezeléséről szóló legfrissebb ESC Útmutató (222) már külön tárgyalja a szívelégtelenségnek egy új alcsoportját, amelybe a közepesen csökkent ejekciós frakcióval rendelkező (HFmrEF, LVEF: 40-49%) szívelégtelen betegek tartoznak. Ezekről a betegről egyelőre még kevés adat áll rendelkezésre. Az egyidejűleg szívelégtelenségben és PF-ben is szenvedő betegeknél az ellátás célja minden esetben a kedvezőtlen események kialakulásának megelőzése és a jó életminőség fenntartása a bal kamrai ejekciós frakció mértékétől függetlenül (223). Szívelégtelen betegeknél a PF kezelésének általános szempontjai nem különböznek a többi betegekétől, néhány dolgot azonban érdemes figyelembe venni. Szem előtt kell tartani, hogy ezeknél a betegeknél az egyetlen, prognosztikai szempontból bizonyítottan hatékony terápia az antikoagulálás, ezért minden stroke-kockázattal rendelkező beteknél megfelelő orális antikoagulálást kell indítani (ld. 8. fejezet).

7.1.1 Pitvarfibrilláció és csökkent ejekciós frakcióval járó szívelégtelenség
Ahogyan az ESC Útmutatóban részletesen szerepel, a csökkent ejekciós frakcióval járó (HFrEF) szívelégtelenségben szenvedő betegeknél az orális antikoagulálás mellett a szívelégtelenség standard terápiáját kell alkalmazni (222). Ennek a terápiának a részét képezik az angiotenzin konvertáló enzim-inhibitorok (ACEI) vagy az angiotenzinreceptor-blokkolók (ARB), a mineralokortikoid-antagonisták, a defibrillálás, a kardiális reszinkronizációs terápia (218), valamint a kombinált angiotenzinreceptor-neprilizin-gátlás (ARNI) azoknál a betegeknél, akiknél folyamatosan fennállnak a tünetek és képesek tolerálni ACEI vagy ARB szedését (224).
A PF frekvenciájának szabályozását a 9. fejezet tárgyalja részletesen. Röviden összefoglalva, csak a béta-blokkolók és a digoxin adható a HFrEF-betegeknek, mivel a verapamilnak és a diltiazemnek negatív inotrop hatása van. A klinikailag stabil HFrEF-betegeknél általában a béta-blokkolók az elsőként választandók, habár egy egyéni betegadatokat feldolgozó, randomizált kontrollált vizsgálatokat (RCT) összefogó metaanalízis szerint a kiinduláskor PF-ben szenvedő betegeknél a béta-blokkoló kezelés mellett a placebóhoz viszonyítva nem alacsonyabb a halálozás (HR: 0,97, 95%-os CI: 0,83–1,14) (23). A digoxint széles körben használják, azonban PF-betegeknél nem végeztek vele „head-to-head” randomizált kontrollált összehasonlító vizsgálatokat. Egy megfigyeléses vizsgálatokat tömörítő metaanalízis semlegesnek találta a digoxin hatását a halálozásra az egyidejűleg PF-ben és szívelégtelenségben szenvedő betegeknél (korrigált HR a megfigyeléses vizsgálatokból: 0,90, 95%-os CI: 0,70–1,16, párosítási modellel becsült relatív kockázat [RR] a megfigyeléses vizsgálatokból: 1,08, 95%-os CI: 0,93–1,26) (225). Vagyis a HFrEF mellett fennálló PF kezelésére indított kezdeti és kombinált frekvenciakontroll-terápiánál egyénileg mérlegelni kell a beteg jellemzőit és tüneteit. Akut dekompenzált szívelégtelenségben a béta-blokkolók adását későbbre kell halasztani, rossz veseműködésű betegeknél pedig számolni kell azzal, hogy a digoxin felhalmozódik a szervezetben és mellékhatásokat okoz (ld. 9. fejezet).

A súlyos tünetekkel jelentkező, egyidejűleg HFrEF-ben és PF-ben szenvedő betegeknél a frekvenciakontroll mellett szükség lehet ritmuskontroll-terápiára is. Számos, relatíve kis betegszámú kohorsznál és vizsgálatban tett megfigyelés igazolja, hogy a ritmuskontroll-terápiát előnyben kell részesíteni azoknál a betegeknél, akiknél gyors kamrafrekvenciájú PF miatt alakul ki HFrEF (tachycardiomyopathia), mivel a sinusritmus helyreállítását követően javul a balkamra-funkció (185, 226–228). A tachycardiomyopathia diagnózisának felállítása kihívást jelenthet, és adott esetben szükség lehet a sinusritmus helyreállítására (229). Egyidejűleg fennálló HFrEF-ben és PF-ben elvégzett katéterablációval megfelelően helyreállítható a bal kamra működése és azzal együtt a beteg életminősége (185, 226–228), ehhez azonban további adatokra van szükség. A 4. ábra szemlélteti a pitvarfibrilláló szívelégtelen betegek kezelésének menetét.
7.1.2 Pitvarfibrilláció és megőrzött ejekciós frakcióval járó szívelégtelenség
Nehéz felállítani a megőrzött ejekciós frakcióval járó szívelégtelenség (HFpEF) diagnózisát PF-betegeknél, mivel nehéz egymástól elkülöníteni a szívelégtelenség és a PF tüneteit. A kardioverzió, és a klinikai kép újraértékelése segíthet a differenciáldiagnózisban, ezek azonban csak tüneti kezelésre alkalmasak, mivel HFpEF-ben prognosztikai szempontból kedvező specifikus terápia jelenleg nem ismert. Az echokardiográfia segítheti a HFpEF felismerését szimptómás PF esetén azáltal, hogy igazolja a háttérben fennálló strukturális szívbetegséget (pl. a balkamra-hipertrófiát [LVH]) és/vagy alkalmas a diasztolés diszfunkció mérésére. A szöveti Dopplerrel kimutatható korai diasztolés áramlási sebesség (e’ paraméter) csökkenése a bal kamra relaxációs zavarát jelzi, míg az E/e’ hányados jól korrelál az invazív módszerrel mérhető bal kamrai töltőnyomással (230–234). A natriuretikus peptidek szintjének mérése része a HFpEF diagnosztikus kivizsgálásának (222) annak ellenére, hogy a natriuretikus peptidek szintje PF-ben emelkedett, az optimális diagnosztikai küszöbérték („cut-off” érték) pedig egyelőre nem ismert (235). Az egyidejűleg HFpEF-ben és PF-ben szenvedő betegek ellátása során a folyadékháztartás egyensúlyának fenntartására és a társuló állapotok (pl. magas vérnyomás, miokardiális iszkémia) kezelésére kell törekedni.
7.1.3 Pitvarfibrilláció és közepesen csökkent ejekciós frakcióval járó szívelégtelenség
A közepesen csökkent ejekciós frakcióval járó szívelégtelenség (HFmrEF) egy nemrégiben létrehozott új entitás. Azok a betegek tartoznak ebbe a csoportba, akiknél észlelhetőek a szívelégtelenség jelei és tünetei, a LVEF 40-49% közötti, a natriuretikus peptidek szintje emelkedett, és vagy bal pitvari megnagyobbodással együtt járó balkamra-hipertrófia vagy diasztolés diszfunkció igazolható (222). PF-betegeknél még nehezebb a diagnózis felállítása, mivel PF-ben eleve emelkedett a natriuretikus peptidek szintje és gyakran észlelhető bal pitvari megnagyobbodás szívelégtelenség fennállásának hiányában is. A bal kamrai ejekciós frakció mértéke szintén változó, PF-ben pedig nehezen megítélhető a PF-indukálta szisztolés balkamra-diszfunkció a szívciklusok változó hossza miatt. Az egyidejűleg HFmrEF-ben és PF-ben szenvedő betegekre szabott speciális kezelési stratégia kialakításához még további vizsgálatok szükségesek.
7.1.4 A pitvarfibrilláció megelőzése szívelégtelenségben
Nagyszabású randomizált vizsgálatok eredményeinek retrospektív elemzéséből az derült ki, hogy az ACE-gátlóval vagy ARB-vel kezelt betegek körében alacsonyabb az újonnan felismert PF incidenciája, mint a placebóval kezelteknél (236–238). A HFpEF-betegek között már kevésbé egyértelmű az ACE-gátló vagy ARB-kezelés mellett megfigyelhető incidencia-csökkenés (239), szívelégtelenségben nem szenvedőknél pedig egyáltalán nem figyelhető meg (240–242). Úgy tűnik, a neprilizin-gátlás nem járul hozzá a PF incidenciájának további csökkenéséhez (224). A béta-blokkoló terápia mellett 33%-kal csökkent az incidentális PF korrigált esélyhányadosa az előzőleg ACE-gátlóval vagy ARB-vel kezelt HFrEF-betegeknél. Ez a tény is azt bizonyítja, hogy mennyire fontos a béta-blokkoló terápia alkalmazása a sinusritmusban lévő HFrEF-betegeknél (23). Az eplerenon – ami egy mineralokortikoid-receptor-antagonista – az ACE-gátlók/ARB-k és a béta-blokkolók mellé adva szintén csökkentette az újonnan felismert PF kialakulásának kockázatát a New York Heart Association (NYHA) II. stádiumú, LVEF ≤35% betegeknél (243).
7.2 Magas vérnyomás
A magas vérnyomás stroke-kockázati tényezőnek számít PF-ben. A kontrollálatlan magas vérnyomás fokozza a stroke és a vérzéses események kialakulásának a kockázatát, valamint a PF visszatéréséért is felelős lehet. Ezért a megfelelő vérnyomás-kontrollnak a PF-betegek kezelésének szerves részét kell képeznie (247). A renin–angiotenzin–aldoszteron-rendszer gátlásával megakadályozható a szerkezeti remodelling és a PF visszatérése (236, 244). A dán egészségügyi adatbázisból nyert adatokkal nemrégiben elvégzett elemzés arra kereste a választ, hogy a különböző antihipertenzív szerek hogyan befolyásolják hosszú távon a PF előfordulását. A vizsgálatból az derült ki, hogy az ACE-gátlók és az ARB-k kedvező hatással rendelkeznek (245). A másodlagos elemzések azt mutatták, hogy szívelégtelenségben vagy balkamra-hipertrófiában szenvedő betegeknél az ACE-gátlók vagy az ARB-k mellett alacsonyabb az újonnan felismert PF incidenciája (238, 246). Balkamra-diszfunkció vagy szívelégtelenség nélkül fennálló, igazolt PF-ben a rekurrens PF megelőzésére nem találták hatékonyabbnak az ARB-ket a placebónál (240, 241). Kardioverzió után, az antiaritmiás terápia mellé bevezetett ACE-gátló- vagy ARB-kezelés csökkentheti a PF visszatérését az önmagában alkalmazott antiaritmiás terápiához képest (248, 249). Ezeket a vizsgálatokat felölelő metaanalízis azt feltételezte, hogy alacsonyabb a rekurrens PF kockázata (236–238, 250), de egy kontrollált vizsgálatnak sem sikerült igazolni a kezelés eredményességét (240, 251).
7.3 Szívbillenytű-betegség
A szívbillentyűbetegséghez függetlenül társul incidentális PF (252). A PF-betegek mintegy 30%-ának van valamilyen billentyűbetegsége, amelyre gyakran csak echokardiográfiával derül fény (201, 253–255). A PF rontja a súlyos fokú billentyűbetegségben szenvedők prognózisát (256), az aorta- vagy a mitralis billentyűbetegség miatt műtéten vagy a transzkatéteres intervención átesett betegekét is (257–262). A billentyűbetegséghez fokozott tromboembólia-kockázat társulhat, amely PF-betegeknél valószínűleg fokozza a stroke-kockázatot is (263). A szívelégtelenségnél leírtakhoz hasonlóan a billenytűbetegségek és a PF egymást befolyásoló és fenntartó tényezői lehetnek a volumen- és nyomástúlterhelés, a tachycardiomyopathia és a neurohormonális tényezőkön keresztül jöhet létre (264–270). Súlyos billentyűelégtelenség esetén a PF a progresszió jelének tekinthető, a billentyűplasztika vagy a billentyűcsere szükségességét mutatja (271).

A PF-nek hagyományosan két formáját különböztetik meg: a „valvuláris” és a „non-valvuláris” pitvarfibrillációt (272). Habár kissé eltérő definíciók vannak használatban, a valvuláris PF leginkább azoknál a betegeknél jelentkezik, akik valamilyen reumás eredetű billenytűbetegségben (elsősorban mitralis stenosisban) szenvednek vagy műbillentyűvel élnek. Valójában, amíg a mitralis stenosisos betegeknél a tromboembólia szempontjából többletkockázatnak számít a PF (263, 273, 274), nincsenek arra vonatkozóan egyértelmű evidenciák, hogy más billentyűbetegségekben (pl. mitralis regurgitáció, aortabillentyű betegségei) is figyelembe kellene venni az a PF-et az antikoagulálás megválasztásakor vagy a tényleges stroke-kockázat számításakor (275). Ezért úgy döntöttünk, hogy a régi „non-valvuláris” PF-megnevezés helyett bevezetjük a specifikus kiváltó ok megjelölését.
7.4 Diabetes mellitus
A diabétesz és a PF gyakran áll fenn egy időben, mivel ezek több közös kockázati tényezővel is társulnak (277–283). A diabétesz kockázati tényezőnek számít a stroke és a PF egyéb szövődményeinek kialakulása szempontjából (284). PF-betegeknél a régóta fennálló diabétesz magasabb tromboembólia kockázattal jár, míg az OAC kapcsán fellépő vérzés szempontjából nem jelent magasabb kockázatot (285). Sajnálatos módon diabéteszeseknél az intenzív glikémiás-kontroll nem befolyásolja az újonnan felismert PF kialakulásának gyakoriságát (284), a metformin terápia mellett azonban alacsonyabb PF-kockázatot figyeltek meg, sőt még a stroke-kockázat is alacsonyabbnak tűnik hosszú távon (13). A diabéteszes retinopathia – amely a fennálló betegség súlyosságára utal – nem növeli az okuláris vérzés kockázatát antikoagulált betegeknél (287).

7.5 Elhízás és fogyás
7.5.1 Az elhízás mint kockázati tényező
Az elhízás fokozza a PF kockázatát (8. táblázat) (288–291), amely progresszívan emelkedik a BMI növekedésével (288, 2910–291). Az elhízottaknál súlyosabb bal kamrai diasztolés diszfunkciót, megnövekedett szimpatikus aktivitást, fokozott gyulladásos és zsíros infiltrációt találtak a pitvarokban (293–295). PF-betegeknél az elhízás kockázati tényezőnek számít az iszkémiás stroke, a tromboembólia és a halálozás szempontjából is (292).
7.5.2 Fogyás az elhízott pitvarfibrilláló betegeknél
Az intenzív fogyás (10-15 kg súlyvesztés) az egyéb kardiovaszkuláris kockázati tényezők kezelésével egyidejűleg a PF rekurrenciájának és a tüneteknek a csökkenését eredményezte, szemben azzal a megközelítéssel, amikor az elhízott PF-betegeket csak általános tanácsokkal látták el (203, 204, 296). A kardiorespiratorikus állapot javításával tovább csökkenhető a PF-epizódok száma az elhízott betegeknél (297). Habár ezeknek a vizsgálatoknak az eredményei még további megerősítésre várnak, rámutatnak a fogyás pozitív hatására elhízott PF-betegeknél.
7.5.3 Katéterabláció elhízott betegeknél
Az elhízás növelheti a PF rekurrenciájának a gyakoriságát katéterablációt követően (298–301), ebből a szempontból az obstruktív alvási apnoe egy fontos hajlamosító tényezőnek számít. A PF ablációja az elhízott betegeknél gyakran magasabb sugárdózissal és magasabb szövődményrátával jár (302, 303). Érdekes, hogy a PF katéterablációját követő tüneti javulás hasonló mértékű az elhízott és a normál testsúlyú betegeknél (298). Tekintettel arra, hogy a fogyással csökkenthető a PF-epizódok száma (ld. 6.5.2. fejezet), elhízott betegeknek a katéterabláció lehetőségének felajánlása mellett javasolni kell a testsúlycsökkentésre irányuló életmódváltást is.
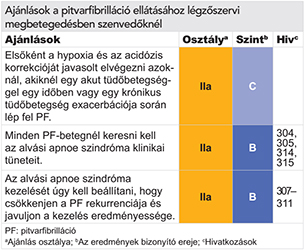
7.6 Krónikus obstruktív tüdőbetegség, alvási apnoe és egyéb légzőszervi megbetegedések
Az obstruktív alvási apnoe-hoz is társulhat PF (304, 305). Obstruktív alvási apnoe fennállása esetén számos patofiziológiai mechanizmus hozzájárulhat a PF kialakulásához: ilyenek az autonóm diszfunkció, a hypoxia, a hypercapnia és a gyulladás (96, 304–307). Obstruktív alvási apnoe-ban megnő az intrathoracalis nyomás, amely önmagában és a vagus tónus növelésével egyaránt képes lerövidíteni a pitvari akciós potenciál hosszát és PF-et indukálni. A kockázati tényezők eliminálása és a folyamatos pozítív nyomású lélegeztetés képes csökkenteni a PF rekurrenciáját (308–312). Indokolt lehet az obstruktív alvási apnoe szűrése a kockázati tényezőkkel rendelkező PF-betegeknél. Az obstruktív alvási apnoe terápiáját úgy kell beállítani, hogy az javítsa a PF-kezelés hatékonyságát az adott betegnél. A főként centrális eredetű alvási apnoéban szenvedő HFrEF-betegeknél (akiknél 25%-ban PF is fennáll) (313) nem alkalmazható servo-kontrollált nyomástámogatott lélegeztetés.
A krónikus obstruktív tüdőbetegségben szenvedőknél gyakran lépnek fel pitvari tachycardiák, amelyeket EKG alapján el kell tudni különíteni a PF-től. A bronchospazmus oldására használt szerek – különösen a theophyllinek és a béta-agonisták – PF-et provokálhatnak és nehezítik a kamrai válasz kontrollálását. A nem szelektív béta-blokkolók, a sotalol, a propafenon, az adenozin csak kellő óvatossággal adhatóak jelentős mértékű bronchospazmus esetén, míg a krónikus obstruktív tüdőbetegeknél biztonsággal alkalmazhatók. A szelektív béta-1-receptor-blokkolók (pl. bisoprolol, metoprolol, nebivolol), a diltiazem és a varapamil általában jól tolerálhatók és hatékonyak (ld. 9. fejezet).
7.7 Krónikus vesebetegség
A CKD-betegek 15-25%-ánál van jelen PF (316). A CKD-t relatíve szigorúan definiálják a legtöbb PF-fel kapcsolatos vizsgálatban. Habár a 60 ml/perces becsült kreatinin-clearance (CrCl) érték CKD-re utal, számos PF-betegekkel végzett vizsgálatban a NOAC beállításához a Cockroft-Gault formula alapján számított CrCl <50 ml/perces értéket vették alapul. PF-betegeknél a CrCl értéke idővel csökkenhet (317). A CKD-betegek orális antikoagulálásával a 8.2.4. fejezet foglalkozik.

8. A pitvarfibrilláló betegek integrált ellátása
A legtöbb beteg a gyógyszerészeken, a közösségi egészségügyi dolgozókon vagy a háziorvosokon keresztül kerül az egészségügyi ellátórendszerbe. Mivel a PF gyakran tünetmentes formában zajlik („néma PF”), ezeknek az egészségügyi szakembereknek fontos szerepük van a PF észlelésében és megfelelő ellátásában. Az egészségügyi ellátás igénybevételekor már az első vizsgálat alkalmával fel kell ismerni a PF-et, amelyre a legtöbb egészségügyi létesítményben lehetőség van (ahol elérhető egy EKG-készülék).
Az újonnan észlelt PF-fel jelentkező betegeknél már az első vizsgálat alkalmával javasolt tájékozódni a következő 5 kérdéskör tekintetében (5. ábra). Ezek a következők:
- Hemodinamikai instabilitás, vagy súlyos, a beteget korlátozó tünetek megléte.
- Kiváltó okok (pl. thyreotoxicosis, szepszis, vagy posztoperatív PF), hajlamosító kardiovaszkuláris állapotok fennállása.
- A stroke-kockázat mértéke és az antikoagulálás szükségessége.
- A szívfrekvencia és a frekvenciakontroll szükségessége.
- A tünetek mérlegelése és ritmuskontroll-terápia indítása.
A PF kezelésének integrált és strukturált megközelítése – az orvoslás többi területéhez hasonlóan (322–324) – lehetővé teszi az egységes, irányelvekre épülő ellátás biztosítását minden beteg számára (325) (6. ábra), ezzel együtt a várható kimenetelek javulását (42, 326, 327). Ez a megközelítés összhangban áll a WHO által kidolgozott krónikus ellátási modellben (Innovative Care for Chronic Conditions Framework) javasoltakkal (328). Az első vizsgálatot követően a beteget egy szakellátó intézménybe kell irányítani, vagy legalább egy kardiológus szakorvoshoz, hogy a beteg kardiovaszkuláris állapotát teljes körűen felmérjék (329). Sürgős vagy azonnali beutalásra is szükség lehet (9. táblázat). A pitvarfibrillációval újonnan diagnosztizált beteg integrált ellátása segíthet kiküszöbölni a jelenlegi ellátás hiányosságait, mint az antikoagulálás nem teljes körű alkalmazását, ezen kívül frekvencia- és ritmuskontroll-terápiában részesülhet a beteg, valamint következetesen végezhető a kardiovaszkuláris kockázatcsökkentés. A PF-betegek integrált ellátásának megvalósításához szükség van a háziorvos, a kardiológus, a szívsebész, a PF ellátásában jártas szakorvos, a stroke ellátásában jártas szakorvos, az ellátásban résztvevő egyéb egészségügyi dolgozók és a beteg együttműködésére, életmódváltásra, a kardiovaszkuláris alapbetegség kezelésére és a PF speciális kezelésére (7. ábra).


8.1 A pitvarfibrilláció integrált ellátását támogató evidenciák
A PF ellátására már számos strukturált megközelítést kidolgoztak. Vannak evidenciák, amelyek alátámasztják ezeknek a helyességét, azonban további vizsgálatok szükségesek annak megítélésére, hogy melyik a legoptimálisabb integrált ellátási módszer. Egy randomizált, kontrollált vizsgálatban az integrált megközelítés előtérbe helyezte a PF evidenciákon alapuló ellátását és egyharmadával csökkentette a kardiovaszkuláris hospitalizációt és a kardiovaszkuláris halálozást magába foglaló összetett végpontot az átlagosan 22 hónapos utánkövetési idő alatt (14,3% vs. 20,8%, HR: 0,65, 95%-os CI: 0,45–0,93, p=0,017) a megszokott ellátási módszerhez viszonyítva egy nagy, harmadlagos ellátási szintű központban (330). Ebben a vizsgálatban költséghatékonynak tűnt az integrált ellátási mód alkalmazása (331). Ezzel szemben egy ausztrál randomizált, kontrollált vizsgálatban – amelyben az integrált ellátás csak a PF ellátásának az első időszakára korlátozódott – mindössze kevés előnyét tapasztalták ennek az ellátási formának a nem tervezett kórházi felvételek és a halálozás szempontjából. Ez is az intergrált ellátás tartós alkalmazásának fontosságát hangsúlyozza (332). A PF integrált ellátását vizsgáló két megfigyeléses tanulmány kevesebbnek találta a hospitalizációs arányt (333, 334), míg egy másik vizsgálatból az derült ki, hogy kevesebb a stroke előfordulása (333), megint egy másik nem randomizált vizsgálat pedig csökkenő tendenciát észlelt a halálozás összetett végpontját, a kardiovaszkuláris okból bekövetkező hospitalizációt és a PF miatt szükségessé vált sürgősségi ellátás igénybevételének gyakoriságát tekintve (335). További vizsgálatok szükségesek a témában, a különböző egészségügyi ellátórendszerekben pedig valószínűleg eltérő integrált ellátási modellek kialakítására van szükség.


8.2 A pitvarfibrilláció integrált ellátásának elemei
8.2.1 A beteg bevonása az ellátásba
A beteg központi szerepet tölt be az ellátás folyamatában. Mivel a PF-kezeléséhez a beteg közreműködése az életmódváltás tekintetében, illetve terápiáshűsége a tartós, és sokszor nem kézzelfogható haszonnal járó terápia kapcsán elengedhetetlen. Meg kell értetni a beteggel, hogy mi az ő saját felelőssége a terápiában. Az orvosok és az egészségügyi szakemberek felelőssége, hogy a PF-betegek evidenciákon alapuló ellátásban részesüljenek, a terápia-adherencia viszont végsősoron a tájékozott és önrendelkezési jogát gyakorló, autonóm beteg felelőssége. Ezt jelenti a „közös felelősségvállalás” (336). A betegnek, és gyakran az élettársának vagy hozzátartozójának a felvilágosítása és oktatása tehát nélkülözhetetlen abból a szempontból, hogy a beteg önellátóvá válljon és aktívan részt tudjon venni a közös döntéshozatalban (326, 328), megértse a betegség természetét és a felajánlott kezelés lényegét (337).
8.2.2 Multidiszciplináris teammunka pitvarfibrillációban
A feladatok átruházása a szakorvosokról az általános orvosokra, valamint az orvosokról az ellátásban résztvevő egészségügyi szakemberekre az integrált ellátási modell alapkoncepciójának része. Egy multidiszciplináris pitvarfibrillációval foglalkozó teamen belül hatékonyan ötvöződnének az interperszonális és kommunikációs készségek, az oktatás és a PF ellátása területén megszerzett szakértelem, csakúgy, mint a szükséges technológiai háttér ismerete. Ez a megközelítés arra mutat rá, hogy mennyire fontos lenne a jelenlegi gyakorlat átalakítása oly módon, hogy a nem szakemberek és az egészségügyi szakdolgozók jelentős szerepet vállaljanak a betegoktatásban és az ellátás megszervezésében, míg a szakemberek az ellátás szakmai részét végezzék. A kulturális és a regionális különbségek meghatározzák az egyes PF-teamek összetételét.

8.2.3 A nem specialisták szerepe
Sok szakirányú végzettséggel nem rendelkező egészségügyi szakember (pl. az alapellátásban dolgozó orvosoknak) széles körű tapasztalattal rendelkezik a stroke megelőzésében és a PF-betegek elsődleges ellátásában. Másoknak viszont képzéseken kell résztvenniük, hogy elsajátítsák ezt a tudást. A PF további ellátásához (pl. társuló kardiovaszkuláris állapotok felismerése, antiaritmiás kezelés, intervenciós kezelés) azonban gyakran már szakemberek bevonására van szükség. Az integrált ellátási elv alapján egy nem szakorvos feladata a kezelés elindítása és a beteg azonnali szakorvoshoz juttatása, ahol ez kivitelezhető, hogy a PF-beteg a legoptimálisabb ellátásban részesülhessen.
8.2.4 A pitvarfibrilláció ellátását segítő technológiák alkalmazása
A technológiai eszközök, mint például a döntéstámogató rendszer használata lehetővé teszi az evidenciákon alapuló ellátás szélesebb körben elterjedt alkalmazását és elősegítik a kimenetelek javítását a szakmai döntések meghozatalának elősegítésével (338). Az elektronikai eszközök gondoskodnak az egységes kommunikációról a PF-teamen belül. Annak érdekében, hogy ezeknek a technológiai eszközöknek a használata még szélesebb körben elterjedhessen, a munkacsoport a PF-betegek és az ellátásukban résztvevő egészségügyi szakemberek rendelkezésére bocsát digitális döntéstámogató eszközöket ingyenesen letölthető okostelefon applikációk formájában.
8.3 A pitvarfibrilláció részletes kivizsgálásának elemei
A PF gyakran fordul elő egyéb – sok esetben diagnosztizálatlan – kardiovaszkuláris kórállapotokkal együtt. Éppen ezért minden beteg számára előnyökkel jár a kardiovaszkuláris szempontból történő alapos kivizsgálás (339).
8.3.1 A kivizsgálás menete pitvarfibrillációban
A teljes kórtörténetet rögzíteni kell és minden beteg állapotát fel kell mérni klinikai szempontból. Meg kell vizsgálni, hogy fennállnak-e társbetegségek, meg kell határozni a PF típusát, mérlegelni kell a stroke-kockázatot és a PF tüneteit, valamint keresni kell az aritmiához társuló egyéb szövődményeket, mint a tromboembolizációt és a balkamra-diszfunkciót. 12-elvezetéses EKG-felvétel készítése javasolt a feltételezett PF diagnózisának igazolásához, a frekvencia meghatározásához, a vezetési zavarok, az iszkémia és a strukturális szívbetegség tüneteinek észleléséhez.
Az első vérvételből meg kell határozni a pajzsmirigyfunkciót, a vesefunkciót, a szérum elektrolitok szintjét és a teljes vérképet. Minden betegnél javasolt transthoracalis echokardiográfiás vizsgálatot végezni, amely alapjául szolgál a terápiás döntések meghozatalának. A transthoracalis echokardiográfia segítségével azonosíthatók a strukturális elváltozások (pl. billenytűbetegségek), meghatározható a bal kamra mérete és működése (szisztolés és diasztolés paraméterei), a pitvarok mérete, valamint a jobb szívfél működése (339, 340). Habár a biomarkerek, mint a natriuretikus peptidek szintje emelkedett PF-ben, nincs elegendő adat ahhoz, hogy a vérből kimutatható paramétereket a PF önálló markereinek lehessen tekinteni (341–343).
8.3.2 Pitvarfibrillációban elvégzendő kiegészítő vizsgálatok
PF-betegeknél az ambulánsan végzett EKG-vizsgálattal megállapítható, hogy megfelelő-e a frekvenciakontroll, a tünetek előfordulása összekapcsolható-e a PF rekurrenciájával, valamint paroxizmális PF-ben meghatározható vele az aritmia kiindulási helye. A transoesophagealis echokardiográfia hasznos módszer a billentyűbetegségek (TOE) részletes vizsgálatára, valamint a korai kardioverziót és a katéterablációt megelőzően az intrakardiális – főként a bal pitvari fülcsében elhelyezkedő – thrombus kizárására (344). A miokardiális iszkémia tüneteit vagy jeleit mutató betegeknél egyéni döntés alapján koronária-angiográfiát vagy terheléses vizsgálatot kell végezni. Agyi iszkémia vagy stroke jeleit mutató PF-betegeknél komputertomográfiás (CT) vagy mágneses rezonancia (MR) vizsgálatot kell végezni az agyról a stroke igazolására, amely segíti a terápiás döntések meghozatalát az akut ellátás és a hosszú távú antikoagulálás vonatkozásában. A gadolínium kontrasztanyag késői típusú halmozását vizsgáló MRI-felvétel a bal pitvarról (345–347), a T1 súlyozott kardiális MR-felvételek (347), valamint az intrakardiális echo (348) segíthetik a terápiás döntések meghozatalát, ezeknél a vizsgálómódszereknél azonban szükség van multicentrikus vizsgálatok keretében végzett külső validálásra.


8.4 Strukturált utánkövetés
A legtöbb PF-beteg rendszeres utánkövetésre szorul, a folyamatos és optimális kezelés biztosítása érdekében. Az utánkövetés történhet az alapellátás keretei között, de végezheti szakirányú végzettséggel rendelkező ápoló, kardiológus szakorvos vagy a PF ellátásában jártas szakember (325, 330). Az ellátást és az utánkövetést szakembernek kell kordinálnia. Az utánkövetés során meg kell bizonyosodni arról, hogy a beteg tartja magát a kezelési tervhez, fenn kell tartani a beteg elköteleződését a terápia iránt és szükség esetén változtatni kell a terápián.
8.5 Terápiás célok meghatározása pitvarfibrillációban
A PF-ellátásban vannak olyan kezelési módszerek, amelyek prognosztikai jelentőséggel bírnak (pl. antikoagulálás, a kardiovaszkuláris állapotok kezelése), és vannak olyanok, amelyek elsősorban a tüneteket enyhítik (pl. frekvenciakontroll, ritmuskontroll) (10. táblázat). A prognosztikai jelentőségű kezelési módszerek hasznát részletesen el kell magyarázni a betegnek, mivel ezeknek a hatását közvetlenül nem érzik. A ritmuskontroll-terápia akkor sikeres, ha megszűnteti a panaszokat még a PF visszatérése esetén is. A terápia megkezdésekor a várható terápiás előny részletes ismertetésével megelőzhető, hogy a beteg megalapozatlan elvárásokat állítson fel, továbbá javítható a beteg életminősége.
9. Stroke-prevenció pitvarfibrillációban
Az orális antikoagulálással jelentős részben megelőzhető az iszkémiás stroke PF-ben, és meghosszabbítható a beteg élettartama (38, 39, 42, 194, 201, 329, 350–352). Az OAC-terápia superiornak bizonyult a kezelésmentességhez vagy az aszpirinkezeléshez képest a különféle stroke-kockázati profillal rendelkező betegeknél (353, 354). A kezelés nettó klinikai haszna a nagyon alacsony stroke-kockázattal rendelkező betegek kivételével mindenkinél egyforma, vagyis a PF-betegek többségét orális antikoagulálásban kell részesíteni (8. ábra). Annak ellenére, hogy ez bizonyított tény, sok esetben még mindig nem teljeskörűen alkalamazzák vagy túl korán fejezik be az antikoaguláns kezelést. Az OAC-terápia felfüggesztésének vagy abbahagyásának leggyakoribb okai a súlyos, illetve a kellemetlenséget okozó vérzéses események kialakulása, az antikoagulálás alatt felmerülő magas vérzési kockázat, valamint a K-vitamin-antagonista kezelés monitorozásához és dózisának beállításához szükséges erőfeszítés hiánya (352, 355–359). Az OAC nélkül fennálló jelentős stroke-kockázat gyakran felülmúlja az OAC-terápiával járó vérzési kockázatot, még az időseknél, a kognitív diszfunkcióban szenvedőknél, illetve a gyakran eleső vagy megromlott egészségügyi állapotú betegeknél is (360, 361). Az aszpirin szedésével járó vérzési kockázat mértéke nem különbözik a K-vitamin-antagonisták (362) vagy a NOAC-ok (354, 363) mellett észlelt vérzési kockázat mértékétől. A különbség közöttük, hogy a K-vitamin-antagonisták és a NOAC-ok képesek hatékonyan megelőzni a stroke kialakulását PF-ben, az aszpirin viszont nem (38, 354, 362, 363).


9.1 A stroke-kockázat és a vérzéskockázat felmérése
9.1.1 A stroke-kockázat és a szisztémás embolizáció kockázatának felmérésére alkalmas pontrendszerek
Pitvarfibrilláló betegeknél a klinikumban alkalmazható, egyszerű kockázatbecslő rendszereket kis kohorsz vizsgálatokban fejlesztették ki az 1990-es évek végén, majd a későbbiek folyamán többször módosították és nagyobb betegpopuláción is validálták (364–368). A CHA2DS2-VASc pontrendszer (11. táblázat) bevezetése leegyszerűsítette a döntést az OAC-terápia indításáról PF-betegeknél. Széles körben alkalmazzák (370), amióta 2010-ben első alkalommal bekerült az ESC Útmutatóba (369). A stroke-kockázat felmérését PF-betegeknél a CHA2DS2-VASc pontrendszer alkalmazásával javasoljuk elvégezni (368). Általánosságban elmondható, hogy a klinikai stroke-kockázati tényezőkkel nem rendelkező betegeket nem kell antitrombotikus kezelésben részesíteni, míg a stroke-kockázattal rendelkező betegek (pl. ha a CHA2DS2-VASc pontszám férfiaknál 1 vagy több, nőknél 2 vagy több) nagy valószínűséggel profitálnak az OAC-kezelésből. Egyéb, kevésbé bizonyított kockázati tényezők stroke szempontjából a K-vitamin-antagonistákkal kezelt betegeknél a nem stabil INR-érték (nemzetközi normalizált ráta) és az alacsony TTR-érték (terápiás tartományban töltött idő), a korábban előforduló vérzés vagy anémia, a túlzott alkoholfogyasztás és a rossz terápiahűséget jelző egyéb tényezők, a krónikus vesebetegség, az emelkedett magas szenzitivitású troponin (hsTnT)-szint, továbbá az emelkedett NT-proBNP (B-típusú átriális natriuretikus peptid)-szint.
9.1.2 Az 1 vagy magasabb CHA2DS2-VASc pontszámot elérő férfiak és a 2 vagy magasabb CHA2DS2-VASc pontszámot elérő nők antikoaguláns kezelése
A PF-betegek orális antikoagulálásával foglalkozó kontrollált vizsgálatokban (38, 39, 42, 194, 201, 329, 351, 352) jónéhány magas stroke-kockázattal rendelkező beteg vett részt, ennélfogva erős evidenciák támasztják alá, hogy a 2 vagy magasabb CHA2DS2-VASc pontszámot elérő férfiak és a 3 vagy magasabb CHA2DS2-VASc pontszámot elérő nők egyértelmű hasznát látják az OAC-kezelésnek. Szerencsére egyre több evidencia áll rendelkezésre az 1 klinikai kockázati tényezővel rendelkező betegek stroke-kockázatáról (pl. férfiaknál 1 vagy magasabb, nőknél 2 vagy magasabb CHA2DS2-VASc pontszám), jóllehet ezek többnyire az OAC-cal nem kezelt betegeknél észlelt stroke előfordulási arányán alapulnak. Sokuknák úgy tűnik, hogy az antikoaguláns kezelés klinikai haszonnal jár (371–375). A stroke és a tromboembólia előfordulási aránya jelentősen különbözik az 1 vagy a 2 CHA2DS2-VASc pontszámot elérő betegek között, mivel különbözőek a kimeneteleik, eltérő a két betegpopuláció és eltérő a véralvadási státuszuk is (1. web-táblázat) (371, 376, 377. 1041). Éppen azért, hogy tájékoztatást tudjunk adni erről az Útmutatóban, végeztünk egy elemzést a stroke-kockázat felmérésére a további 1 stroke-kockázati tényezővel rendelkező nők és férfiak körében (1. web-táblázat, utolsó sor). Férfiaknál 1 vagy magasabb, nőknél pedig 2 vagy magasabb CHA2DS2-VASc pontszám észlelésekor mérlegelendő az OAC-terápia folytatása, mivel így hozható egyensúlyba a stroke-kockázat várható csökkenése, a vérzéses kockázat mértéke és a beteg preferenciája. Fontos, hogy az életkor (65 év vagy magasabb) egy relatíve magas és folyamatosan növekvő stroke-kockázatot jelent, amely más kockázati tényezők hatását is fokozza (pl. szívelégtelenség, nem). Ezért hát a női nemtől eltekintve, az 1 CHA2DS2-VASc stroke-kockázati tényezővel rendelkező betegeknél egyénileg kell mérlegelni az antikoaguláns terápia kockázatát a beteg kívánságának figyelembevételével. A női nem önmagában, egyéb kockázati tényezők hiányában nem jelent nagyobb kockázatot a stroke kialakulása szempontjából (1. web-táblázat) (378, 379). Bizonyos PF-betegeknél a kardiális troponin-szint (magas szenzitivitású troponin T vagy I) és az NT-proBNP-szint mérése prognosztikai szempontból további információkkal szolgálhat (380–382). A biomarkerek mérésén alapuló pontbecslés nagy segítséget nyújthat a jövőben a betegek pontosabb stratifikálásában (pl. a valóban alacsony kockázatú betegek azonosításában) (75, 382).
9.1.3 A vérzéskockázat felmérése
Többféle pontrendszer létezik, amelyek főként a K-vitamin-antagonistákkal kezelt betegek vérzési kockázatának felmérésére alkalmasak. Ilyen a HAS-BLED pontrendszer (magas vérnyomás, rossz vese- vagy májfunkció [1-1 pont], stroke, anamnézisben vérzés vagy arra hajlamosító tényező, ingadozó INR-érték, idős kor [>65 év], egyidejűleg drog- és alkoholfogyasztás [1-1 pont]), az ORBIT (Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) pontrendszer és a nemrégiben kifejlesztett ABC (életkor, biomarkerek szintje, kórtörténet) pontrendszer, amelyben már szerepel bizonyos biomarkerek mérése is (383–385). A stroke és vérzéses szövődmények kockázati tényezői részben közösek (ld. 11., és 12. táblázat). Például az előrehaladott életkor az egyik legjelentősebb előrejelzője az iszkémiás stroke-nak és a vérzésnek egyaránt PF-betegeknél (386, 387). Magas vérzéskockázat esetén általában nem szabad felfüggeszteni az OAC-terápiát. Ilyen esetben azonosítani és – amennyiben lehetséges – kezelni kell a vérzéskockázatot növelő tényezőket (ld. 8.5 fejezet). A 12. táblázatban a terápiásan befolyásolható, a vérzéskockázatot növelő tényezőket foglaltuk össze.


9.2 Stroke-prevenció
9.2.1 K-vitamin-antagonisták
PF-betegeknél legelőször a warfarint és a többi K-vitamin-antagonistát alkalmazták antikoagulálásra. A K-vitamin-antagonista kezelés kétharmadával csökkenti a stroke-kockázatot és egynegyedével a halálozást a kontrollhoz (az aszpirinhez vagy a terápiamentességhez) képest (38). A K-vitamin-antagonistákat számos betegnél sikerrel alkalmazzák világszerte (394–396), ez látszik a NOAC-okról szóló vizsgálatokban a warfarinnal kezelt betegeknél (9.2.2. fejezet). A K-vitamin-antagonisták alkalmazhatóságát korlátozza a szűk terápiás tartományuk, illetve gyakori monitorozást és dóziskorrekciót igényelnek. Azonban ha a megfelelő ideig a terápiás tartományban alkalmazzák őket, hatékonyan képesek megelőzni a stroke kialakulását PF-betegeknél. Bizonyos klinikai paraméterek segítségével azonosítani lehet azokat a betegeket, akiknél a K-vitamin-antagonista kezelés mellett megfelelő lesz a terápiás tartományban eltöltött idő (TTR) (397). Ezeket a paramétereket tartalmazza a SAMe-TT2R2 pontrendszer. Azoknak a K-vitamin-antagonistával kezelt betegeknek, akik kedvezőbb eredményt érnek el ebben a pontrendszerben, átlagosan magasabb a TTR-értékük, mint azoknak, akik rosszabbul teljesítenek (398, 399). A reumás eredetű mitralis-billentyű betegségben, és/vagy mechanikus műbillentyűvel élő pitvarfibrilláló betegeknél jelenleg egyedül a K-vitamin-antagonisták biztonságossága igazolt (400).

9.2.2 Nem K-vitamin-antagonista orális antikoagulánsok
A NOAC-ok (a direkt trombin-inhibitor dabigatran és a X-es faktor inhibitor apixaban, edoxaban, rivaroxaban) megfelelő alternatívái a K-vitamin-antagonistáknak stroke-prevenció szempontjából PF-betegeknél (13. táblázat). A klinikai gyakorlatban egyre gyakrabban alkalmazzák őket (401). A NOAC-ok hatása kiszámítható (a hatáskezdet és a hatásvég), ezért nincs szükség a véralvadás rendszeres monitorozásra. A NOAC-ok gondosan megválasztott dózisaival elvégezték a fázis III. vizsgálatokat, ezen belül egyértelműen megszabták a dóziscsökkentés klinikumban is alkalmazandó szabályait (13. táblázat).
9.2.2.1 Apixaban
Az ARISTOTLE (Apixaban for Reduction in Stroke and Other Thrombo-embolic Events in Atrial Fibrillation) vizsgálatban (319) a napi kétszer 5 mg apixaban 21%-kal csökkentette a stroke vagy a szisztémás embolizáció kockázatát a warfarinhoz képest, emellett a major vérzések kockázatát 31%-kal, a bármely okból bekövetkező mortalitást pedig 11%-kal csökkentette (minden eredmény statisztikailag szignifikáns volt). Az apixaban mellett alacsonyabb volt a vérzéses stroke és az intracranialis vérzések gyakorisága, az iszkémiás stroke-é azonban nem. A kétféle kezelési csoportban hasonlóan alakult a gasztrointesztinális vérzések gyakorisága (402). A NOAC-ok közül egyedül az apixabant hasonlították össze az aszpirinnel PF-betegeknél. Az apixaban szignifikánsan, 55%-kal csökkentette a stroke vagy a szisztémás embolizáció gyakoriságát az aszpirinhez képest, ellenben a major vérzések és az intracranialis vérzések gyakoriságát tekintve nem, vagy csak nagyon kicsi különbséget találtak a kétféle kezelés között (354, 403).
9.2.2.2 Dabigatran
A RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) vizsgálatban (318, 404) a napi kétszer 150 mg dabigatran 35%-kal csökkentette a stroke és a szisztémás embolizáció kockázatát a warfarinhoz képest, a major vérzések előfordulását tekintve viszont nem észleltek szignifikáns különbséget a kétféle kezelés között. A napi kétszer 110 mg dabigatrant „non-inferiornak” találták a warfarinhoz képest a stroke és a szisztémás embolizáció megelőzésében, míg a major vérzéses események előfordulását 20%-kal csökkentette. A dabigatran mindkét említett dózisban szignifikánsan csökkentette a vérzéses stroke és az intracranialis vérzés gyakoriságát. A napi kétszer 150 mg dabigatran szignifikánsan, 24%-kal csökkentette az iszkémiás stroke kialakulását és 12%-kal a vaszkuláris eredetű halálozást, azonban 50%-kal megnövelte a gastrointestinalis vérzések előfordulását. A számok alapján egy nem szignifikáns emelkedés látszott a miokardiális infarktus előfordulásában mindkét dózis mellett (318, 404), ezt azonban már nem észlelték a forgalomba hozatali engedély megadását követően elvégzett nagyszabású vizsgálatban (396). Ezekből a megfigyelésekből származó adatok szintén a dabigatran előnyösebb voltát bizonyították a K-vitamin-antagonistákhoz képest, amelyet korábban már a RELY-vizsgálatban is igazoltak, főként a magasabb dabigatran dózissal (napi kétszer 150 mg) kezelt betegeknél (396).
9.2.2.3 Edoxaban
Az ENGAGE AF-TIMI 48 (Effective Anticoagulation with Factor Xa Next Generation in Atrial Fibrillation–Thrombolysis in Myocardial Infarction 48) vizsgálatban (321) a napi 60 mg és a napi 30 mg (bizonyos esetekben csökkentett dózisban alkalmazott) (ld. 13. táblázat) edoxabant hasonlították össze a megfelelően beállított warfarin-dózissal (405). A napi 60 mg edoxaban non-inferiornak bizonyult a warfarinhoz képest (13. táblázat). A kezelés közben végzett elemzés szerint a napi 60 mg edoxaban szignifikánsan, 21%-kal csökkentette a stroke vagy a szisztémás embolizáció, valamint 20%-kal a major vérzéses események előfordulását a warfarinhoz képest. A napi 30 mg edoxaban szintén non-inferiornak bizonyult a warfarinhoz képest a stroke vagy a szisztémás embolizáció megelőzésében, és szignifikánsan, 53%-kal csökkentette a major vérzéses események előfordulását. A warfarinhoz képest a napi 60 mg és a napi 30 mg edoxaban mellett alacsonyabb kardiovaszkuláris halálozást észleltek. PF-betegeknél csak az edoxaban nagyobb dózisa adható stroke-prevenció céljára.
9.2.2.4 Rivaroxaban
A ROCKET-AF (Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation)-vizsgálatban (320) a betegeket random besorolás alapján napi 20 mg rivaroxabannal vagy K-vitamin-antagonistával kezelték. A Cockroft–Gault-formula alapján számított 30-49 ml/perces CrCl esetén napi 15 mg-ra csökkentették a rixaroxaban dózisát (13. táblázat). A rivaroxaban non-inferiornak bizonyult a warfarinhoz képest a stroke és a szisztémás embolizáció prevenciójában az „intention-to-treat” elemzés alapján, míg a vizsgálat közben végzett „per-protocol” elemzés statisztikailag superiornak találta a rivaroxabant, amely 21%-kal csökkentetta a stroke és a szisztémás embolizáció gyakoriságát a warfarinhoz képest. A rivaroxaban nem csökkentette sem a halálozás, sem az iszkémiás stroke, sem pedig a major vérzéses események kockázatát a K-vitamin-antagonistákkal összhasonlítva. A forgalomba hozatali engedély megadását követően, a kockázatkezelési folyamat részeként elvégzett vizsgálatokban hasonlónak találták a két csoport között az egyes események előfordulását.(406, 407).
9.2.3 Nem K-vitamin-antagonista vagy K-vitamin-antagonista orális antikoagulánsok
A K-vitamin-antagonisták és a NOAC-ok is képesek hatékonyan megelőzni a stroke kialakulását PF-ben. A NOAC-okat a warfarinal összehasonlító, klinikai szempontból legfontosabbnak ítélt vizsgálatokból a nagyobb dózisokkal kezelt betegcsoportok eredményeit ölelte fel az a metaanalízis (39), amelyben 42 411 NOAC-kal kezelt és 29 272 warfarinnal kezelt beteg adatait elemezték. A NOAC-ok ezekben a dózisokban szignifikánsan, 19%-kal csökkentették a stroke és a szisztémás embolizáció előfordulását a warfarinhoz képest (RR: 0,81, 95%-os CI: 0,73–0,91, p<0,0001), amely nagyrészt a vérzéses stroke gyakoriságának csökkenéséből adódott (RR: 0,49, 95%-os CI: 0,38–0,64; p<0,0001). A NOAC-kal kezelt betegeknél a halálozás 10%-kal (RR: 0,90, 95%-os CI: 0,85–0,95, p=0,0003), az intracranialis vérzés előfordulása pedig a felére (RR: 0,48, 95%-os CI: 0,39–0,59, p<0,0001) csökkent, ezzel szemben sokkal gyakrabban fordult elő gasztrointesztinális vérzés (RR: 1,25, 95%-os CI: 1,01–1,55, p=0,04) (39). A NOAC-ok mellett az összes vizsgált csoportban konzisztensen csökkent a stroke gyakorisága, míg a vérzések gyakoriságának relatív csökkenése nagyobb mértékű volt azokban a központokban, ahol nem volt megfelelő az INR-kontroll (p=0,022). Megjegyzendő azonban, hogy az intracranialis vérzéseknek a warfarinhoz képest a NOAC-ok mellett jóval alacsonyabbnak észlelt gyakorisága nem függ össze az INR-kontroll minőségével (408, 409).

9.2.4 Pitvarfibrilláló krónikus vesebetegek orális antikoagulálása
Nagyméretű adatállományok elemzése arra mutatott rá, hogy a CKD stroke-kal és vérzéssel is társul (410, 411). A mérsékelt vagy mérsékelt-súlyos fokú CKD-ban szenvedő (GFR ≥15/min/1,73 m2) PF-betegeknél biztonsággal indítható antikoaguláns terápia. A SPAF III (Stroke Prevention in Atrial Fibrillation) randomizált vizsgálatba bevont 1936 betegből 805 3-as stádiumú CKD-s beteg volt (becsült GFR <59/min/1,73 m2), náluk kedvezően alakultak a kimenetelek a warfarinkezelés mellett (INR 2–3) (412). Ezt bizonyítja egy svéd adatbázisból származó adatokkal végzett nagyméretű elemzés is, amelyben a warfarinnal kezelt CKD-s PF-betegeknél alacsonyabb stroke-kockázatot észleltek (korrigált HR: 0,76, 95%-os CI: 0,72–0,80) (413), azonban a vérzés kockázatot is kissé magasabbnak találták, főként a terápia bevezetése idején (414).
A NOAC-okkal foglalkozó fontosabb tanulmányok eredményeit felölelő metaanalízis tanulsága szerint az enyhe vagy mérsékelt fokú CKD-ban szenvedő betegek közül a NOAC-kal kezelteknél kevesebb esetben fordult elő stroke, szisztémás embolizáció vagy major vérzéses esemény, mint a warfarinnal kezelt betegeknél (415). Az OAC-okkal kezelt PF-betegeknek rendszeresen ellenőrizni kell a vesefunkcióját, hogy szükség esetén korrigálni lehessen a NOAC-ok dózisát (14. táblázat) és pontosítani a kockázatbecslés eredményét (416).
9.2.5 Pitvarfibrilláló dializált betegek orális antikoagulálása
Körülbelül 8-ból 1 dializált beteg PF-ben szenved, a PF incidenciája 2,7/100 betegév (417). Dializált betegeknél magasabb a PF mortalitása (417). A hemodializált betegek orális antikoagulálásával kapcsolatban (418) nem végeztek randomizált vizsgálatokat, és a súlyos fokú CKD-s (CrCl: 25–30 ml/perc) betegek NOAC-kezelésével kapcsolatban sincsenek kontrollált vizsgálatokból származó eredmények (318–321). A warfarin használata mellett semleges, vagy magasabb stroke-kockázatot figyeltek meg dializált betegeknél az adatbázis-elemzések kapcsán (419–421). Ezt támasztotta alá egy populációalapú kanadai elemzés eredménye is (korrigált HR stroke-ra nézve: 1,14, 95%-os CI: 0,78–1,67, korrigált HR a vérzésre nézve: 44, 95%-os CI: 1,13–1,85) (422). Ezzel szemben a Dániában gyűjtött adatok tanúlsága szerint az OAC-kezelés jótékony hatású művesekezelésben részesülő betegeknél (423). Szükség lenne dializált PF-betegek bevonásával, az antikoagulánsok hatását (K-vitamin-antagonisták és NOAC-ok) elemző kontrollált vizsgálatokra (424).


9.2.6 Pitvarfibrilláció transzplantációra váró betegeknél
A vesetranszplantációt követően OAC-cal kezelt betegek bevonásával nem készültek randomizált vizsgálatok. A NOAC-terápiát a transzplantált vese becsült GFR-értéke alapján kell beállítani. Mérlegelni kell az orális antikoagulánsok és az immunszupresszív szerek lehetséges farmakokinetikai gyógyszerkölcsönhatásait.
9.2.7 Trombocitaaggregáció-gátló kezelés, mint alternatíva az orális antikoagulánsok helyett
Az önmagában alkalmazott vérlemezkegátló kezelés hatékonyságáról a stroke prevenciójában kevés evidencia áll rendelkezésre (38, 428–430). A K-vitamin-antagonisták hatékonyabbak a stroke, a szisztémás embolizáció, a miokardiális infarktus, valamint a vaszkuláris eredetű halálozás prevenciójában, mint az aszpirinnel és a clopidogrellel végzett szimpla vagy kettős trombocitaaggregáció-gátló kezelés (TAGG) (az aszpirin és a clopidogrel mellett az éves kockázat 5,6% vs. a K-vitamin-antagonisták mellett 3,9%) (431). Még kedvezőbb hatást értek el azoknál a K-vitamin-antagonistával kezelt betegeknél, akik jelentős időt töltöttek a terápiás tartományon belül (432). A trombocitaaggregáció-gátló kezelés – főként a kettős TAGG – növeli a vérzés kockázatát (2,0% vs. 1,3% az egyszeres TAGG-gal szemben, p<0,001) (433), így a vérzéses események gyakorisága hasonló az OAC-ok mellett tapasztalthoz (354, 362, 431, 434). Éppen ezért a trombocitaaggregáció-gátlók adása nem javasolt stroke-prevenció céljára PF-betegeknél.
9.3 Bal pitvari fülcsezárás vagy fülcseeltávolítás
9.3.1 Fülcsezáró eszközök
Főként megfigyeléses tanulmányokban és regiszterekben szerepel az intervenciós bal pitvari fülcsezárás (446–449) és a kevés tapasztalattal végzett percutan bal pitvari fülcsekirekesztés. Egyetlen eszköz (Watchman-katéter) használatát vetették eddig össze randomizált vizsgálat keretében a K-vitamin-antagonistákkal folytatott kezelés eredményességével (a PROTECT AF [Watchman Left Atrial Appendage System for Embolic Protection in Patients With AF trial], ld. 2. web-táblázat, és a PREVAIL [Prospective Randomized Evaluation of the Watchman LAA Closure Device In Patients with AF Versus Long Term Warfarin Therapy trial] vizsgálat (449–451). Ezek alapján a stroke-prevenció tekintetében a bal pitvari fülcsezárás noninferiornak bizonyult a K-vitamin-antagonistákkal szemben a mérsékelt stroke-kockázattal rendelkező PF-betegeknél, a vérzéses események valószínűségét pedig alacsonyabbnak találták az utánkövetésben résztvevő betegeknél (452, 453). Két klinikai vizsgálatot és a hozzájuk kapcsolódó regiszterek adatait felölelő metaanalízis is megerősítette ezeket az eredményeket (453). A bal pitvari fülcsezárással azoknál a betegeknél is csökkenthető a stroke-kockázat, akiknél az orális antikoagulálás ellenjavallt (454, 455). A biztosítási cégek adatbázisaiból és szisztémás összefoglaló közlemények adataiból készült elemzések – bizonyos mértékű közlési hiba lehetőségét is számba véve (446, 456) – arról tanúskodnak, hogy az eszköz bevezetésekor gyakori és súlyos szövődmények léphetnek fel (446, 456–458). Egy nagyméretű, nemrégiben elkészült európai regiszter adatai alapján az eszköz bevezetésének sikeraránya magas (98%), 30 nap után a beavatkozáshoz társuló szövődmények aránya pedig 4%, ami elfogadható mértékűnek számít (459). Úgy tűnik, hogy a legtöbb olyan betegnél, akiket korábban nem találtak alkalmasnak az OAC-terápiára, jelenleg relatíve jól működik az orális antikoagulálás (396, 407, 460). Mihamarabb megfelelő statisztikai erejű kontrollált vizsgálatokra lenne szükség ahhoz, hogy megismerhessük ezeknek az eszközöknek a legoptimálisabb felhasználási módját: ilyen a fülcsezárók használata az OAC-kal nem kezelhető betegeknél vagy azoknál, akik OAC-kezelés mellett kapnak stroke-ot, továbbá szükség lenne a fülcsezárók és a NOAC-ok összahasonlítására egy randomizált vizsgálat keretében, valamint a bal pitvari fülcsezárást követően a trombocitaaggregáció-gátló kezelés minimálisan szükséges mértékének a meghatározására.
9.3.2 Sebészi fülcsezárás vagy fülcseeltávolítás
Szívsebészeti beavatkozással egy ülésben kivitelezhető sebészi fülcsezárást vagy fülcseeltávolítást már évtizedek óta végeznek, számos technikája ismert. A bal pitvari fülcsezárás alkalmazhatóságát és biztonságosságát több összetett megfigyeléses vizsgálat bizonyítja, kontrollált vizsgálatból azonban csak kevés áll rendelkezésre (461–464). A bal pitvari fülcsében fennmaradt reziduális áramlás vagy a fülcse inkomplett eltávolítása növelheti a stroke-kockázatot (465). A legtöbb vizsgálatban a bal pitvari fülcsezárást vagy fülcseeltávolítást a nyitott szívműtéttel egy ülésben, újabban a PF sebészi ablációjával egy időben (463), vagy önálló torakoszkópiás eljárásként végezték. Egy 2015-ben közzétett randomizált vizsgálat, amely a PF miatti sebészeti beavatkozás és a bal pitvari fülcsezárás egy időben történő elvégzését értékelte, nem talált egyértelmű evidenciát arra, hogy a PF miatt sebészeti beavatkozáson átesett betegek alcsoportjában a fülcse eltávolítása hasznos lett volna a stroke megelőzése szempontjából (466). Jelenleg folyamatban van egy nagyméretű randomizált vizsgálat (467).
9.4 Szekunder stroke-prevenció
PF-betegeknél stroke szempontjából a leggyakoribb kockázati tényezőnek az előrehaladott életkor és a korábbi cardioemboliás stroke vagy TIA számít (382) – ez a tény is a PF-betegek orális antikoagulálásának a fontosságára mutat rá. A rekurrens stroke kockázata az első stroke vagy TIA kialakulása utáni korai időszakban a legnagyobb (469, 470).
9.4.1 Az akut iszkémiás stroke kezelése
A rekombináns szöveti plazminogén aktivátorral (rtPA) végzett szisztémás trombolízis hatékony és elfogadott módja az akut iszkémiás stroke kezelésének a tünetek jelentkezését követő 4,5 órán belül (471). Az orális antikoaguláns terápiában részesülő betegeknél ellenjavallt a szisztémás trombolízis (472, 473). Rekombináns szöveti plazminogén aktivátor azoknak a K-vitamin-antagonistával kezelt betegeknek adható, akiknél az INR-értéke 1,7 alatti (474), vagy azoknak a dabigatrannal kezelt betegeknek, akiknél az aktivált parciális tromboplasztin idő normáltartományban van és a legutóbbi gyógyszerbevétel 48 órával korábban történt (szakértői konszenzus alapján) (472). Meg kell vizsgálni, hogy a NOAC-ok specifikus antidótumának (475) beadását követően végezhető-e szisztémás thrombolysis. Az arteria carotisban vagy az arteria cerebri mediában distalisan elhelyezkedő thrombus esetén 6 órás időablakon belül végezhető thrombectomia antikoagulált betegnél (476).

9.4.2 Antikoagulálás tranziens iszkémiás attak vagy iszkémiás stroke után
Kevés adat áll rendelkezésre az orális antikoagulálás (heparin, alacsony molekulatömegű heparin, heparinoid, K-vitamin-antagonista, NOAC) optimális módjáról a stroke utáni első napokban. Úgy tűnik, hogy az akut stroke lezajlásától számított 7-14 napon belül alkalmazott parenterális antikoagulánsok nem szignifikáns mértékben csökkentik a rekurrens iszkémiás stroke kialakulását (esélyhányados [OR]: 0,68, 95%-os CI: 0,44–1,06), szignifikáns mértékben növelik a tüneteket okozó intracranialis vérzés (OR: 2,89, 95%-os CI: 1,19–7,01) előfordulását, a halálozás és a rokkantság gyakoriságát viszont nem befolyásolják az utolsó kontroll alkalmával végzett vizsgálat eredményei alapján (477). Valószínűnek tűnik, hogy egy nagy kiterjedésű stroke lezajlását követő első napokban a parenterális antikoaguláláshoz társuló vérzéskockázat mértéke maghaladja a stroke-prevencióból származó előny mértékét, míg a TIA-s vagy kisebb stroke-on átesett betegeknél előnyös lehet az antikoagulálás (azonnali) korai megkezdése vagy folytatása. Ezért azt javasoljuk, hogy PF-betegeknél az iszkémiás stroke lezajlását követően 1-12 napon belül – a stroke súlyosságától függően – el kell kezdeni az antikoagulálást (9. ábra) (478). Javasolt megismételni az agyi képalkotó vizsgálatot, amely segít meghatározni az antikoagulálás bevezetésének optimális időpontját a nagy kiterjedésű iszkémiás stroke vérzéses transzformációja szempontjából veszélyeztetett betegeknél. A K-vitamin-antagonistákkal (363, 479–481) vagy NOAC-okkal (482) végzett antikoagulálás hosszú távon előnyökkel jár a stroke-túlélő PF-betegeknél. A NOAC-ok mellett valamivel jobbak a vizsgált kimenetelek, ami leginkább abból adódik, hogy a NOAC-ok mellett kevesebb az intracranialis vérzés és a vérzéses stroke előfordulása (OR: 0,44, 95%-os CI: 0,32–0,62) (482). Az edoxabanról eddig még nem jelentek meg pontos adatok (321). Ha egy beteg antikoaguláns terápia közben kap stroke-ot, mérlegelni kell a terápiaváltást.
9.4.3 Antikoagulálás intracranialis vérzés után
Egyetlen prospektív vizsgálat sem tanulmányozta az orális antikoagulálás indításának hasznát és kockázatát intracranialis vérzést követően (483), a korábban intracranialis vérzésben szenvedő betegeket pedig kizárták a K-vitamin-antagonistákat és a NOAC-okat összehasonlító randomizált vizsgálatokból. Evidenciákkal alátámasztható, hogy PF-betegeknél 4-8 hét elteltével újból elindítható az antikoaguláns kezelés, különösen abban az esetben, amikor a vérzés okát vagy az arra hajlamosító tényezőt (pl. kontrollálatlan hipertenzió, ld. 12. táblázat) ellátták. Antikoagulálás mellett a rekurrens (iszkémiás) stroke és a mortalitás aránya alacsonyabb lesz (460, 484). Az antikoagulálás újbóli bevezetésére az alacsony vérzési kockázattal járó szereket kell előnyben részesíteni (39). A 10. ábrán az intracranialis vérzés után az orális antikoagulálás megkezdésének vagy folytatásának mérlegeléséről szóló konszenzusos véleményen alapuló folyamatleírás látható. Javasoljuk, hogy a döntést kölönböző szakterületeken jártas szakemberekből álló csapat hozza meg, amelynek tagjai között stroke szakemberek/neurológusok, kardiológusok, neuroradiológusok és idegsebészek is vannak.

9.5 Antikoaguláns kezelés mellett a vérzés kockázatát csökkentő stratégiák
Egy 47 vizsgálatot felölelő metaanalízisben a K-vitamin- antagonisták mellett előforduló major vérzések összes incidenciája 2,1 (0,9–3,4)/100 betegév volt a kontrollált vizsgálatok adatai alapján és 2,0 (0,2–7,6)/100 betegév a megfigyeléses vizsgálatok adatai szerint (488). Antikoagulálás mellett a vérzéses események előfordulásának gyakorisága elsősorban a kezelhető kockázati tényezők hatásának csökkentésével érhető el (12. táblázat).
9.5.1 Kontrollálatlan hipertenzió
A kontrollálatlan hipertenzió az orális antikoagulálás mellett fokozza a vérzés kockázatát (53). Ezért különösen fontos a szisztolés vérnyomás normálértéken tartása antikoagulálásban részesülő PF-betegeknél. Az ismert hipertóniás betegeket a legfrissebb ajánlások szerint kell kezelni (489).
9.5.2 Korábbi vérzéses esemény
Az összes orális antikoagulálásban részesülő betegnél fel kell mérni, hogy fordult-e elő korábban vérzéses esemény vagy fennáll-e anémia. A vérzések jelentős része gasztrointesztinális eredetű vérzés. A warfarinnal összehasonlítva a napi kétszer 150 mg dabigatran (396, 490), a napi 20 mg rivaroxaban (491) és a napi 60 mg edoxaban mellett magasabb volt a vérzés kockázata (321). A gasztrointesztinális vérzés kockázata a warfarinéhoz hasonló volt a napi kétszer 110 mg dabigatran (490) és a napi kétszer 5 mg apixaban mellett (319). Friss megfigyelések alapján elvégzett elemzések nem mutatták ugyanezeket az eredményeket, így feltételezhetően kisebb volt a hatás mértéke (396, 492, 493). Azoknál a betegeknél, akiknél megtalálták és ellátták a vérzésforrást, folytatni lehet az OAC-terápiát. Ugyanez igaz a korábban intracranialis vérzésen átesett betegekre, amennyiben a vérzés szempontjából kockázati tényezőnek számító állapotokat ellátták (pl. kontrollálatlan magas vérnyomás) (460, 484).
9.5.3 Labilis INR-érték és a nem K-vitamin-antagonista orális antikoagulánsok adagolása
K-vitamin-antagonista kezelés mellett a TTR-ben töltött idő fontos prediktív tényezőnek számít a major vérzések szempontjából (432, 441, 494). Ezért javasolt az INR-értéket 2,0–3,0 közé beállítani a K-vitamin-antagonistával kezelt betegeknél, hogy magas legyen a TTR-érték (≥70%) (494). Amennyiben nem lehetséges a betegnél magas TTR-értéket elérni, megfontolandó a NOAC-ra történő terápiaváltás (444). A NOAC dózisának beállításakor követni kell a klinikai vizsgálatokban meghatározott dóziscsökkentési kritériumokat, amelyek figyelembe veszik a beteg vesefunkcióját, korát és testsúlyát. A cél elérése érdekében elengedhetetlen a betegek oktatása és motiválása, amely leghatékonyabban a PF integrált ellátási módjának alkalmazásán keresztül valósítható meg.

9.5.4 Alkoholfogyasztás
A túlzott mértékű alkoholfogyasztás kockázati tényezőnek számít vérzés szempontjából az antikoagulálásban részesülő betegeknél (384). Ebben szerepet játszik a beteg rossz terápiahűsége, a csökkent májfunkció, a varix-vérzések és a súlyos trauma kockázata. A nagymértékű alkoholfüggőséget és a mértéktelen alkoholfogyasztást kezelni kell az OAC-terápiára alkalmas betegeknél.
9.5.5 Elesés és demencia
Az elesések és a demencia együtt járnak a magasabb halálozási kockázattal PF-betegeknél (495), nincs azonban bizonyíték arra, hogy ezek az állapotok számottevően növelnék az intracranialis vérzés kockázatát (495, 496). Éppen ezért csak azok a betegek nem részesülnek antikoagulálásban, akiknél nagyon súlyos következményekkel járó, befolyásolhatatlan elesésekre lehet számítani (pl. epilepszia vagy előrehaladott stádiumú multiszisztémás atrófia hanyattesésekkel), vagy bizonyos demenciákban, amikor a gondozó nem tudja biztosítani a beteg-compliance-t és a terápiaadherenciát.
9.5.6 Genetikai vizsgálat
Az étel- és a gyógyszer-interakciók mellett számos genetikai variáció befolyásolja a K-vitamin-antagonisták metabolizációját (497). Kontrollált klinikai vizsgálatok értékelik a genetikai ismeretek szisztematikus alkalmazását a K-vitamin-antagonisták optimális dózisának beállításakor (498–500). A genetikai vizsgálat nem befolyásolja a warfarin mellett észlelt TTR-t vagy a vérzéses kockázatot, így jelenleg nem javasolt a klinikai alkalmazása (501).
9.5.7 Az orális antikoagulálás-mentes időszakok áthidalása
A legtöbb kardiovaszkuláris intervenció (pl. percutan koronária-intervenció vagy pacemaker-implantáció) biztonsággal elvégezhető folyamatos OAC-terápia mellett. Amennyiben szükség van az OAC felfüggesztésére, az áthidaló terápia nem tűnik hatékonynak, kivéve a mechanikai műbillentyűvel rendelkező betegeknél. Egy 1884 PF-beteg bevonásával készült randomizált vizsgálatban az artériás tromboembólia kimenetele szempontjából az antikoagulálás felfüggesztése non-inferiornak bizonyult az áthidaló heparin-terápiához képest (az incidenciája rendre 0,4% és 0,3% volt), ugyanakkor a major vérzés kockázata alacsonyabb volt (1,3% és 3,2% rendre) (502). Az antikoagulálást csak a szükséges legrövidebb időtartamra szabad felfüggeszteni, hogy megelőzzük a stroke kialakulását.
9.6 A vérzéses események ellátása antikoagulált pitvarfibrilláló betegeknél
9.6.1 Enyhe, közepes és súlyos fokú vérzés ellátása
Az antikoaguláns terápiában részesülő, aktívan vérző PF-betegek általános kivizsgálásának része a vérzés forrásának, kialakulásának, súlyosságának, az OAC vagy más alvadásgátló szer utolsó bevételi időpontjának, illetve vérzést befolyásoló egyéb kockázati tényezőknek (CKD, alkoholfogyasztás, egyidejűleg szedett egyéb gyógyszereknek) a felderítése. A vérből ellenőrizni kell a hemoglobinszintet, a hematokritot, a vérlemezkeszámot, a vesefunkciót, valamint a K-vitamin-antagonistával kezelt betegeknél a protrombin-időt, az aktivált parciális tromboplasztin időt és az INR-értéket. A véralvadási vizsgálatok nem informatívak a NOAC-kal kezelt betegeknél, kivéve dabigatran-kezelés esetén az aktivált parciális tromboplasztin idő. Léteznek speciális alvadási vizsgálatok, mint a hígított thrombin-idő (HEMOCLOT) dabigatran-kezelés esetén, valamint a X-es faktor kalibrált kvantitatív meghatározása X-es faktor-gátlók alkalmazása esetén (503). Ezek a szűrővizsgálatok azonban nem mindig elérhetőek, és gyakran szükségtelenek a vérzés ellátásához (504).

Orális antikoagulálásban részesülő betegeknél egy egyszerű séma használatát javasoljuk a vérzéses események ellátásához (11. ábra). A minor vérzéseket szupportívan, mechanikus kompresszióval vagy kisebb sebészeti beavatkozással kell kezelni. A K-vitamin-antagonistával kezelt betegeknél elhalasztható a soron következő gyógyszeradag bevétele. A NOAC-ok féléletideje a plazmában rövid, 12 óra, a hemostasis javulása pedig 12-24 óra alatt várható egy halasztott vagy kihagyott gyógyszerbevétel után. A mérsékelt fokú vérzés ellátásához már transzfúzióra és folyadékpótlásra lehet szükség. A vérzésforrás kezelésére irányuló speciális diagnosztikus és terápiás beavatkozásokat (pl. gasztroszkópia) azonnal el kell végezni. Amennyiben a NOAC bevétele nemrégiben történt (2-4 órán belül), aktív szén adásával és/vagy gyomormosással csökkenthető az expozíció mértéke. A dabigatran eltávolítható a vérből dialízissel, a többi NOAC-nál ez a módszer kevésbé hatékony.
Az antitrombotikus hatás azonnali felfüggesztésére van szükség súlyos fokú vagy életet veszélyeztető vérzés esetén. Életet veszélyeztető vérzés ellátásához az adott intézményben egyezményesen megalkotott algoritmust dokumentált formában bármikor elérhetővé kell tenni, hogy szükség esetén az ellátást azonnal meg lehessen kezdeni. K-vitamin-antagonistával kezelt betegeknél a friss fagyasztott plazma adása gyorsabban helyreállítja a véralvadást, mint a K-vitamin, a protrombin komplex-koncentrátum (PCC) adásával pedig még jobban felgyorsítható a véralvadás folyamata (505). A regiszterekből származó adatok elemzése azt mutatja, hogy a K-vitamin-antagonistával kezelt betegeknél egy intracraniális vérzés esetén ≥1,3 INR-érték mellett plazma és PCC együttes adása mellett a legkisebb a fatális kimenetel aránya (506). Egy 188 beteg részvételével készült multicentrikus randomizált vizsgálatban a 4 faktorkomponensű PCC-vel sokkal gyorsabban tudtak változtatni az INR-értéken és hatékony hemosztázist elérni, mint a plazmával a sürgős műtétre vagy invazív beavatkozásra szoruló betegeknél (507). A PCC adása NOAC mellett fellépő súlyos vérzés ellátásakor is mérlegelendő, ha specifikus antidótum nem áll rendelkezésre.
A NOAC-oknak számos antidótuma áll fejlesztés alatt. Az idarucizumab – amelyet 2015-ben törzskönyvezett az Amerikai Élelmiszer- és Gyógyszerügynökség –, egy a klinikumban hozzáférhető humanizált antitest-fragment, amely képes megkötni a dabigatrant és antagonizálni annak hatását anélkül, hogy túlkorrigálná azt vagy thrombin-képződést indukálna (475). Az andexanet-alfa egy módosított rekombináns humán Xa-faktor hiányzó emzimatikus aktivitással, amely egészséges embereken a beadástól számítva perceken belül elkezdi antagonizálni a Xa-faktor-gátlók antikoaguláns hatását egészen addig, amíg az infúziót kapja a beteg. Átmenetileg növeli az alvadási rendszer aktivitását mutató markerek szintjét, amelynek klinikai relevanciája azonban nem ismert (508). Egy másik fejlesztés alatt álló antidótum a ciraparantag (PER977), amelyet úgy terveztek, hogy a direkt trombin-inhibitorok és a Xa-faktor-gátlók hatását is képes legyen antagonizálni, csakúgy, mint az indirekt inhibitor enoxaparinét (509). További vizsgálatok szükségesek ahhoz, hogy pontosabban felmérhessük ezeknek a specifikus antidótumoknak a klinikai hasznát.
9.6.2 A magas vérzési kockázattal rendelkező vagy vérző pitvarfibrilláló betegek orális antikoagulálása
Míg az aktív vérzés ellátásának ideje alatt az antikoaguláns terápiát fel kell függeszteni, egy vérzéses epizód után hosszú távon ritkán áll fenn az orális antikoagulálásnak abszolút ellenjavallata. Észszerűnek tűnik váltani az egyik alvadásgátló szerről a másikra, ha a terápia abbahagyásának oka a kellemetlenséget okozó vérzések előfordulása. A major vérzések számos kiváltó oka kezelhető és/vagy megszűntethető, mint például a kontrollálatlan hipertenzió, a gasztrointesztinális fekélyek vagy az intracranialis aneurizmák. Egy vérzéses esemény után gyakran az antikoagulálás folytatása a klinikailag helyes döntés (460, 510). A fajsúlyos döntéseket, mint az orális antikoagulálás abbahagyása vagy folytatása, egy multidiszciplináris teamnek kell meghoznia egy újabb stroke vagy vérzéses esemény kockázatának, valamint a különböző stroke-prevenciót szolgáló kezelések vérzéskockázatának mérlegelése alapján. Egyes betegeknél alternatív megoldás lehet a bal pitvari fülcsezárás vagy fülcseeltávolítás.

9.7 Orális antikoagulánsból és trombocitaaggregáció-gátlóból álló kombinált terápia
Friss vizsgálatok (513) és regiszterek (514–516) adatai szerint a PF-betegek közel 15%-ánál szerepel miokardiális infarktus a korábbi anamnézisben. A betegek 5-15%-ának lesz szüksége élete során valamikor stentbeültetésre. Ezért gondosan mérlegelni kell az antitrombotikus terápia bevezetését a vérzéskockázat, a stroke-kockázat és az akut koronáia szindróma (ACS) kialakulásának kockázatát szem előtt tartva (516). Egy OAC és egy trombocitaaggregáció-gátló együttes felírása – főként ha hármas terápiáról van szó – növeli a major vérzés kialakulásának az abszolút kockázatát (445, 517, 518). Nemrégiben ACS-en átesett 30 866 beteg adataiból készült friss metaanalízis a NOAC-ok hatását vizsgálta szimpla (4135 beteg) vagy kettős (26 731 beteg) trombocitaaggregáció-gátló terápia mellett (519). Nem PF-betegeknél a terápia kiegészítése NOAC-kal 79-134%-kal növelte a vérzés kockázatát, míg az iszkémiás események ismétlődését csak csekély mértékben csökkentette. Pitvarfibrilláló, stabil koszorúér-betegeknél – akiknél a megelőző 12 hónapban nem zajlott ACS és/vagy nem történt koronária-intervenció – egyedül az OAC adása javasolt monoterápiában, és nem a TAGG-gal kombinálva. ACS miatt kezelt betegeknél vagy koronária-stent beültetése után rövid távon indokoltnak tűnik a hármas kombináció (OAC, clopidogrel és aszpirin) adása (12. ábra).


9.7.1 Antitrombotikus terápia akut koronária szindróma és percutan koronária-intervenció után orális antikoagulálást igénylő betegeknél
A percutan koronária-intervención átesett PF-betegeknél nem ismert sem az optimális véralvadásgátló kombináció, sem az optimális terápiás idő, de a tartós vérzéskockázat alapján a rövid terápiás idő tűnik megfelelőnek. A szakértői konszenzus (520) – amelyet ez a szakértői munkacsoport is felülvizsgált és újragondolt – a következő alapelvek követését javasolja: a stroke-kockázattal rendelkező, a műbillentyűvel élő, illetve a nemrégiben vagy ismételten mélyvénás trombózison vagy pulmonalis embólián átesett PF-betegeknél az OAC-terápiát folytatni kell a stentbeültetés ideje alatt és után is. Ilyen esetben általában rövid ideig tartó hármas kombinált terápia (OAC, clopidogrel és aszpirin) adása javasolt, amelyet bizonyos ideig a kettős terápia vált fel (OAC+egy TAGG) (13. ábra). NOAC-okkal kapcsolatban a konszenzusajánlás azt mondja ki, hogy PF-ben a stroke-prevenció szempontjából hatékony legalacsonyabb dózisban kell alkalmazni őket. A fázis III vizsgálatokban igazolt dózisoknál (13. táblázat) alacsonyabb dózisok használata jelenleg nem javasolt, ezért az ilyen jellegű dóziscsökkentéssel meg kell várni a folyamatban lévő vizsgálatok eredményeit. Az aszpirin, clopidogrel, és az alacsony dózisú rivaroxaban (napi kétszer 2,5 mg) adása nem javasolt PF-betegeknél stroke-prevencióra (521). Mivel a prasugrelről és a ticagrelorról nem áll rendelkezésre elég adat, illetve a clopidogrellel összevetve mellettük nagyobb a major vérzések kockázata, javasolt ezeket mellőzni a hármas kombinációs terápiából, kivéve, ha kifejezetten ezeknek a szereknek az alkalmazására van szükség (pl. stent-trombózis aszpirin+clopidogrel mellett) (522, 523). A folyamatban lévő vizsgálatoktól várható, hogy újabb ismeretekkel szolgálnak az efféle kombinációs terápiákról a jövőben.
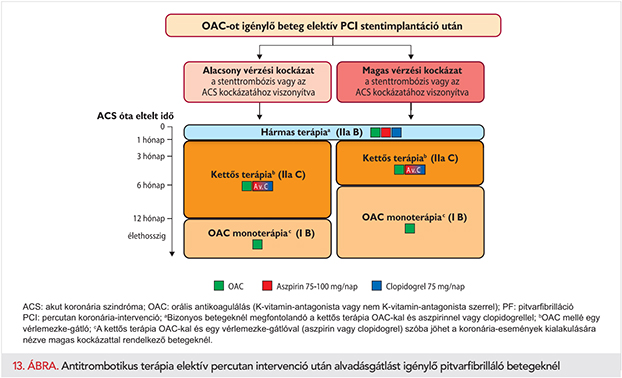
A WOEST (What is the Optimal antiplatElet and anticoagulant therapy in patients with oral anticoagulation and coronary StenTing) vizsgálatban az aszpirin elhagyásának hatását vizsgálták a clopidogrel és az OAC szedésének folytatása mellett. A randomizált vizsgálatban 573 percutan koronária-intervención átesett beteget (70%-uk pitvarfibrillált) kezeltek kettős terápiával (OAC+napi 75 mg clopidogrel), vagy hármas terápiával (OAC+clopidogrel+aszpirin) (524). Az első évben kevesebb vérzéses esemény fordult elő a kettős terápiával kezelt csoportban, főként a minor vérzéses események számának csökkenése miatt. A két csoportnál nem különbözött a miokardiális infarktus, a stroke, a cél-ér revaszkularizáció és a stent-trombózis előfordulási gyakorisága (jóllehet, alacsony volt az események száma), a bármely okból bekövetkező halálozás viszont az első évben alacsonyabb volt a kettős terápiával kezelt betegeknél (2,5% vs. a hármas terápia mellett 6,4%). Habár a vizsgálat túlságosan kisméretű volt ahhoz, hogy értékelni lehessen az iszkémiás végpontokat, az OAC+clopidogrel kettős terápia várhatóan egyre gyakrabban váltja fel a jövőben a hármas terápiát a pitvarfibrilláló, ACS-en és/vagy koronária intervención átesett betegeknél (525).
10. Frekvenciakontroll-terápia pitvarfibrillációban
A PF ellátásának fontos eleme a frekvenciakontroll, amely sokszor elegendő a PF okozta tünetek mérséklésére. A stroke-prevencióval és a ritmuskontroll-terápiával ellentétben a frekvenciakontroll-terápia optimális típusát és intenzitását tekintve nagyon kévés egyértelmű evidencia áll rendelkezésre, ráadásul ezek nagyrésze rövidtávú cross-over és megfigyeléses vizsgálatokból származik (41, 526–528). Gyógyszeres frekvenciakontroll akutan és hosszú távon is végezhető béta-blokkolókkal, digoxinnal, kalciumcsatorna-gátló diltiazemmel és verapamillal, vagy kombinált terápiával (15. táblázat). Számos antiaritmiás szer rendelkezik frekvenciacsökkentő hatással (amiodaron, dronedaron, sotalol és bizonyos mértékben a propafenon), ezeket a szereket azonban csak a ritmuskontroll-terápiára szoruló betegeknél alkalmazzuk (ld. 11. fejezet).
10.1 Akut frekvenciakontroll
Akutan kialakult, újonnan felismert PF-ben gyakran van szükség frekvenciakontrollra. Minden esetben keresni kell a szapora szívritmus háttérében álló okokat, mint infekció, endokrin betegség, anémia vagy tüdőembólia. A kamrafrekvencia akut kontrolljára a béta-blokkolók és a diltiazem vagy a verapamil részesítendő előnyben a digoxinnal szemben, mivel ezeket gyors hatáskezdet jellemzi és fokozott szimpatikus tónus esetén is hatékonyak (528–532). Az alkalmazott szer típusa (15. táblázat) és a célfrekvencia függ a beteg jellemzőitől, a tünetektől, az LVEF mértékétől, és a hemodinamikától. A terápia indításakor a fokozatosság elvének kell érvényesülnie. Gyógyszer-kombinációk alkalmazására is szükség lehet (14. ábra). A HFrEF-betegeknél béta-blokkolót, digitáliszt (digoxint vagy digitoxint), vagy ezek kombinációját kell alkalmazni (218, 533), mivel 40%-os LVEF alatt a diltiazemnek és a verapamilnak negatív inotrop hatása lehet (222, 534, 535). Kritikus állapotú betegeknél és a bal kamra szisztolés funkciójának súlyos mértékű csökkenése esetén, amikor a túlságosan gyors kamrai frekvencia hemodinamikai instabilitást idéz elő, intravénásan amiodaront lehet adni a betegnek (536–538). Hemodinamikailag instabil betegeknél szóba jöhet az azonnali kardioverzió (ld. 11.2 fejezet).
10.2 Hosszú távú gyógyszeres frekvenciakontroll
10.2.1 Béta-blokkolók
Gyakran a béta-blokkoló monoterápia az elsőként választandó gyógyszeres frekvenciakontroll céljára (539), akut esetben hatékonyabban csökkenti a szívfrekvenciát, mint a digoxin. A béta-blokkolóknak a sinusritmusban lévő HFrEF-betegeknél észlelt prognosztikai előnye, érdekes módon, PF-ben elvész. Egy randomizált kontrollált vizsgálatokat felölelő önálló, betegszintű metaanalízisben a béta-blokkolók nem csökkentették a placebónál nagyobb mértékben a bármely okból bekövetkező mortalitást a kiinduláskor pitvarfibrilláló betegeknél (HR: 0,97, 95%-os CI: 0,83-1,14, p=0,73), míg a sinusritmusban lévő betegeknél egyértelműen előnyösnek bizonyultak (HR: 0,73, 95%-os CI: 0,67-0,80, p<0,001) (23). A 3066 pitvarfibrilláló HFrEF-betegnél az elemzés konzisztens eredményt hozott minden alcsoportban és minden klinikai végpont tekintetében, a 10 randomizált kontrollált vizsgálat között pedig nem állt fenn heterogenitás (I2=0%). Annak ellenére, hogy a pitvarfibrilláló HFrEF-betegeknél nem találták prognosztikai szemponból előnyösebbnek a béta-blokkolókat, a munkacsoport minden PF-betegnél hasznos első vonalbeli frekvenciacsökkentő szerként tekint rájuk, mivel tüneti és funcionális szempontból egyaránt hatékonyak, az eddigi eredmények alapján nincs káros hatásuk, illetve minden életkorban, sinusritmusban és PF-ben egyaránt jól tolerálhatók (23, 540).
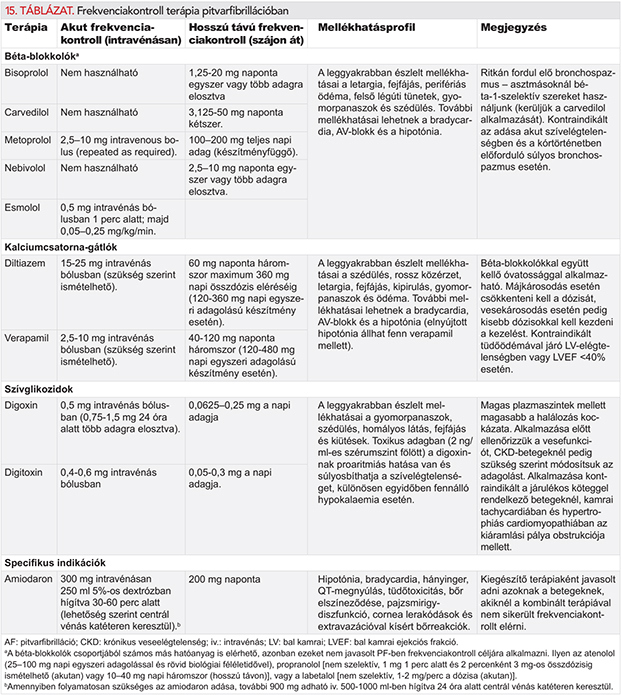

10.2.2 Nem-dihidropiridin típusú kalciumcsatorna-gátlók
A verapamil és a diltiazem elfogadható mértékben képes csökkenteni a kamrafrekvenciát PF-betegeknél (541). HFrEF-betegeknél kerülni kell a használatukat a negatív inotrop hatásuk miatt (222, 534, 535). A verapamil és a diltiazem képes javítani a PF-fel járó tüneteket (526), a béta-blokkolókkal összehasonlítva, amelyek csökkentették a betegek terhelhetőségét és növelték a B-típusú natriuretikus peptid szintjét egy alacsony kockázatú, megtartott bal kamrai EF-fel rendelkező betegcsoporton végzett kisméretű tanulmányban 8542).
10.2.3 Digitálisz
A szívglikozidok, mint a digoxin és a digitoxin már két évszázada vannak használatban, bár az utóbbi 15 évben egyre csökken az alkalmazásuk (543). A randomizált Digitalis Investigation Group (DIG) vizsgálatban a digoxin a placebóhoz képest egyáltalán nem befolyásolta a halálozást sinusritmusban lévő HFrEF-betegeknél (RR: 0,99, 95%-os CI: 0,91–1,07), viszont csökkentette a kórházi felvételek arányát (RR: 0,72, 95%-os CI: 0,66–0,79) (544, 545). Nincsenek „head-to-head” összehasonlító RCT-k a digoxinnal kapcsolatban PF-betegeknél (546). Megfigyeléses vizsgálatok szerint a digoxin használata többlethalálozással társul PF-betegeknél (547–349), ezt az összefüggést azonban valószínűleg a betegek beválasztásából és besorolásából eredő hibák eredményezték, nem pedig a digoxin káros hatása (550–553), különösképpen, hogy a digoxint általában a súlyosabb betegek szedik (225). Egy 47 pitvarfibrilláló HFrEF-beteget felölelő mechanisztikus crossover- vizsgálatban nem találtak különbséget a carvedilol és a digoxin között a szívfrekvenciát, a vérnyomást, a járástávolságot vagy az LVEF-et befolyásoló hatásuk tekintetében, a béta-blokkolók azonban növelték a B-típusú natriuretikus peptid szintjét, a carvedilol+digoxin kombináció javította, míg a digoxin elhagyása rontotta az LVEF-et (554). Csak kisméretű, rövidtávú vizsgálatok végeztek összehasonlítást a digoxin és más frekvenciakontrolláló szerek között, amelyekben nem, vagy csak kismértékű különbséget találtak az egyes szerek között a terhelhetőségre, az életminőségre vagy az LVEF-re kifejtett hatásuk tekintetében (526, 554–558). A digoxin alacsonyabb dózisaihoz (napi egyszer ≤250 mg) mellé – amikor a szérum digoxinszint 0,5-0,9 ng/ml tartományba esik –, jobb prognózis társul (225).

10.2.4 Amiodaron
Az amiodaron legvégső esetben hasznos szer lehet a kamrafrekvencia csökkentésére. Mivel az amiodaronnak számos extracardialis mellékhatása van, csak tartalék szerként alkalmazzuk azoknál a betegeknél, akiknek a szívritmusát kombinált terápiával (pl. béta-blokkoló vagy verapamil/diltiazem digoxinnal kombinálva) sem lehet csökkenteni.
Összességében egyformán alkalmazzuk a különböző frekvenciacsökkentő szereket PF-ben. A béta-blokkolók, a diltiazem/verapamil, a digoxin és a kombinált terápia alkalmazását egyénileg kell mérlegelni a beteg sajátosságai és preferenciái szerint. Minden terápiának lehetnek mellékhatásai, éppen ezért a kezelést alacsony dózisban kell elkezdeni és fokozatosan lehet növelni az adagolást a tüntetek megszűnéséig. A gyakorlatban a 110/perc alatti frekvencia eléréséhez gyakran kombinált kezelésre van szükség (15. ábra). A különböző frekvenciacsökkentő stratégiák eredményességét a tünetek, az életminőség és a többi köztes végpont szempontjából még vizsgálják (559).
10.3 Frekvencia-célértékek pitvarfibrillációban
Nincs meghatározva az optimális célfrekvencia PF-ben. A RACE (Rate Control Efficacy in Permanent Atrial Fibrillation) II randomizált vizsgálatban 614 permanens pitvarfibrillációban szenvedő beteget kezeltek két csoportban. Az egyik csoportban a célfrekvencia nyugalomban <80/perc, mérsékelt fokú aktivitás közben <110/perc volt, a másik csoportban pedig egy megengedőbb <110/perc célértéket jelöltek ki. A két csoport között nem találtak különbséget a klinikai eseményekből (14,9% a szigorú frekvenciacsökkentésre törekvő csoportban és 12,9% a megengedőbb célértékre törekvő csoportban) (560), a NYHA-stádium besorolásból és a hospitalizációból álló összetett végpont tekintetében (560, 561). Hasonló eredményeket mutatott az AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management) és a RACE-vizsgálatokból (1091 résztvevő) származó adatok poolozott elemzése, noha a szívfrekvencia vonatkozásában kisebb különbségeket észleltek és nem végeztek randomizációt sem (562). Érdemes megjegyezni, hogy sok „megfelelően kontrolláltnak” (a nyugalmi szívfrekvencia 60-100/perc) tekintett beteg erős tünetektől szenved és további terápiára szorul (194). Mindazonáltal, kezdetben a megengedőbb frekvenciakontroll tekinthető elfogadható megközelítésnek – függetlenül a szívelégtelenség állapotától –, hacsak a tünetek nem teszik szükségessé a szigorúbb frekvenciakontrollt.
10.4 Atrioventrikuláris csomó abláció és pacemaker-beültetés
Amikor gyógyszeresen már nem uralható a szívfrekvencia és a tünetek, az atrioventricularis-csomó/His-köteg ablációjával és VVI-pacemaker beültetésével csökkenthető a kamrafrekvencia. Ez egy relatíve egyszerű eljárás, amelynek alacsony a szövődményrátája és a hosszú távú halálozási kockázata (563, 564), különösen abban az esetben, ha az AV-csomó ablációját megelőzően pár héten belül beültetnek egy pacemakert, az abláció után pedig a kezdő frekcenciát 50-70/perc tartományba állítják be (565, 566). Az eljárás nem rontja a balkamra-funkciót (567), sőt egyes betegeknél még javíthatja is az LVEF-t (568–570). Egyes biventricularis pacemakerrel rendelkező HFrEF-betegeknél (kardiális reszinkronizációs terápia) megszűnhet a PF (571), bár a kardiális reszinkronizációs terápia „ritmuskontroll” hatásának kicsi a valószínűsége és ez a hatás további egyértelmű megerősítésre vár (572). Az AV-csomó ablációval a beteget egész hátralévő életére pacemakerfüggővé tesszük, ezért az AV-csomó ablációt és pacemakerbeültetést csak azoknál a betegeknél szabad elvégezni, akiknek a tünetei már nem uralhatók frekvenciacsökkentő szerekkel, vagy észszerű ritmuskontroll-terápiával (lsd. pitvarfibrillációval foglalkozó Szív Munkacsoport, 12. fejezet). A pacemaker-terápia kiválasztása (jobb kamrai vagy biventricularis pacing implantálható defibrillátorral vagy anélkül) a beteg egyéni sajátosságainak a függvénye, beleértve az LVEF-értékét is (573, 574).
11. Ritmuskontroll-terápia pitvarfibrillációban
A sinusritmus helyreállítása és fenntartása a PF ellátásának integráns része. Az antiaritmiás szerek használata mellett közel kétszer olyan gyakori a sinusritmus előfordulása (580–384). A katéterabláció és a kombinált terápia gyakran akkor is alkalmazható, amikor az antiaritmiás szerek már nem hatékonyak (226, 585–587). Bár a klinikusok közül sokan meg vannak róla győződve, hogy a sinusritmus fenntartása javíthatja a PF-betegek életkilátásait (588), azok a vizsgálatok, amelyek az együttesen alkalmazott frekvenciakontroll- és ritmuskontroll-terápia hatását vetették össze az önmagában – megfelelő antikoaguláns védelemben – alkalmazott frekvenciakontroll-terápiáéval, semleges eredménnyel zárultak (41, 578, 579, 582, 589–593). Jelenleg is azt vizsgálják (az EAST – AFNET 4 [Early treatment of Atrial fibrillation for Stroke prevention Trial] (40) vizsgálat és a CABANA [Catheter Ablation vs. Anti-aritmic Drug Therapy for Atrial Fibrillation Trial] (594) vizsgálat), hogy a modern ritmuskontroll-terápia – amelynek része a katéterabláció, a kombinált terápia és a korai ellátás – képes-e csökkenteni a major kardiovaszkuláris események előfordulását. Ritmuskontroll-terápiát jelenleg csak a megfelelő frekvenciakontroll ellenére szimptómás PF-betegeknél javasolt alkalmazni a tünetek enyhítése céljából.

11.1 A sinusritmus akut helyreállítása
11.1.1 A sinusritmus helyreállításához használt antiaritmiás szerek („gyógyszeres kardioverzió”)
Az antiaritmiás szerek képesek visszaállítani a sinusritmust PF-betegeknél (gyógyszeres kardioverzió). Ezt igazolta több kisebb kontrollált vizsgálat, metaanalízisek (41, 584, 595, 596) és néhány nagyobb kontrollált vizsgálat (597–605) is. A dofetilid olyan szer, amely az Európán kívüli országokban elérhető, és képes visszaállítani a sinusritmust az újonnan felismert PF-ben (606). Gyógyszeres kardioverzióval közel 50%-ban sikerül visszaállítani a sinusritmust az újonnan felismert PF-ben (16. táblázat) (607–609). Rövidtávon az elektromos kardioverzióval gyorsabban és hatékonyabban lehet eredményt elérni, mint a gyógyszeres kardioverzióval, emellett a hospitalizációs idő is rövidebb mellette (609–613). A gyógyszeres kardioverzióhoz viszont nincs szükség a beteg szedálására és nem kell a betegnek éhgyomorra maradnia (16. ábra). A flecainid és a propafenon hatékony szerei a gyógyszeres kardioverziónak (595, 602–605, 614, 615), azonban ezek csak akkor alkalmazhatóak, ha nem áll fenn strukturális szívbetegség. Az ibutilid – ahol elérhető – ezeknek az alternatívája lehet, mellékhatásként azonban torsades de pointes-t okozhat (615). A vernakalant (602–605) enyhe fokú szívelégtelenségben szenvedő (NYHA I. és II. stádium) betegeknek adható, beleértve az iszkémiás szívbetegeket is, amennyiben nem hipotenziósak és nincs súlyos fokú aortastenosisuk (616–618). Az amiodaron a szívelégteleneknek és az iszkémiás szívbetegeknek is adható (bár a súlyos fokú szívelégtelenségben szenvedőket kizárták a legtöbb PF-betegek kardioverzióját vizsgáló tanulmányból) (596). Az intravénásan alkalmazott amiodaron is lassítja a szívfrekvenciát 10-12 ütés/perccel 8-12 óra elteltével (596). Az amiodaron és a flecainid is hatékonyabb a sinusritmus helyreállításában, mint a sotalol (600, 601, 619).
11.1.2 „Pill in the pocket”: a beteg által végzett kardioverzió
Azok a betegek, akiknél csak ritkán jelentkeznek tünetekkel járó paroxizmális PF-epizódok, akár az otthonukban, önállóan is bevehetnek szájon át egyetlen bólust a flecainidből (200-300 mg) vagy a propafenonból (450-600 mg), hogy helyreállítsák a sinusritmust („pill in the pocket” terápia). Ezeknél a betegeknél előzetesen kórházi körülmények között meg kell győződni a terápia biztonságosságáról (620). A fentebb említett módszernek a hatékonysága csak minimálisan marad alul a kórházban elvégzett kardioverzióéhoz képest (620), azonban praktikus, ezen felül pedig megfelelő védelmet és bizonságérzetet nyújt az erre alkalmas betegeknek.

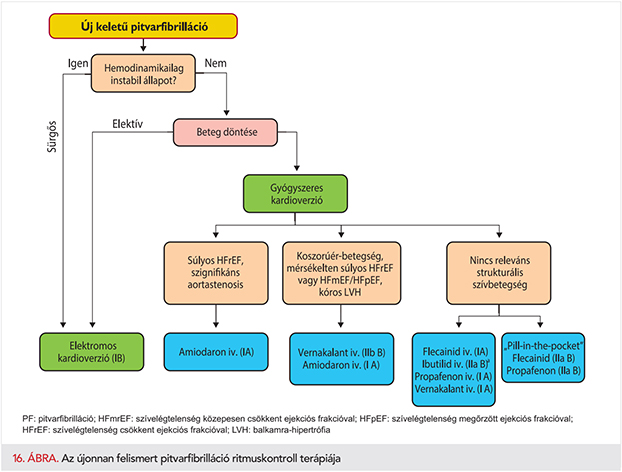
11.1.3 Elektromos kardioverzió
Az elektromos szinkron kardioverzió (DCC: direct current electrical cardioversion) gyors és hatékony módszere a PF sinusritmusba történő konvertálásának. Ez az eljárás választadó a súlyos hemodinamikai állapotú betegek újonnan felismert PF-jének a kardioverziójához is (16. ábra) (626–628). Az elektromos kardioverzió biztonsággal végezhető a megelőzően intravénás midazolammal és/vagy propofollal szedált betegeknél. A beavatkozás ideje alatt fontos a vérnyomás- és a vér oxigén-szaturációjának a folyamatos monitorozása (629). Egyes esetekben égési sérülést okozhat a bőrön. Intravénásan adható atropinnak, izoproterenolnak, vagy ideiglenes transzkután pacemakernek elérhetőnek kell lennie a kardioverziót követően fellépő bradycardia ellátásához. A kétfázisú defibrillátorok hatékonyabbak, mint a monofázisosak, ezért szabvány szerint ezeket alkalmazzuk (626, 628). Az elektródák antero-posterior irányú elhelyezésekor nagyobb energia adható le a bal pitvarra, mint az antero-laterális pozicionáláskor, így hatékonyabban végezhető a sinusritmus helyreállítása (626, 627, 630).
Az amiodaronnal (néhány héten keresztül) (631, 632), a sotalollal (631), az ibutiliddel (633), vagy a vernakalanttal (634) végzett előkezelés javíthatja az elektromos kardioverzió hatékonyságát. Hasonló hatás várható a flecainidtől (584) és a propafenontól is (635). A béta-blokkolók (636), a verapamil, a diltiazem (637–639) és a digoxin (640, 641) nem megbízhatóak a PF megszűntetésében és nem segítik elő az elektromos kardioverzió sikerességét. Ha antiaritmiás terápiával tervezzük fenntartani a sinusritmust a kardioverziót követően, érdemes már előtte 1-3 héttel korábban (az amiodaron esetében néhány héttel korábban) elkezdeni az antiaritmiás szer adását, hogy elősegítsük a gyógyszeres konverziót és addigra a hatékony terápiás szintet érjük el (584, 601).
11.1.4 Kardioverzióra váró betegek antikoagulálása
A kardioverzió stroke-kockázatot rejt magában az antikoaguláns-kezelésben nem részesülő betegeknél (642), amely az antikoagulálással jelentős mértékben csökkenthető (643).
Minden kardioverzióra váró betegnél azonnal el kell kezdeni valamilyen véralvadásgátló adását (644–646). A több mint 48 órája fennálló PF esetén legalább 3 héttel a kardioverziót megelőzően el kell kezdeni az OAC-terápiát és még további 4 héten keresztül folytatni kell (amennyiben hosszabb távú antikoagulálásra nem szorul a beteg). A stroke-kockázattal rendelkező betegeknél életük végéig fenn kell tartan az OAC-terápiát. Ezt az eljárást ugyan még nem értékelték kontrollált vizsgálatokban, de biztonságosnak tűnt egy finnországi nagyméretű megfigyeléses adathalmaz elemzése alapján (647). Ha korai kardioverzió szükséges, az esetek nagy részében TOE-val kizárható a bal pitvari thrombus jelenléte, így lehetővé válik a kardioverzió azonnali elvégzése (648, 649). Kardioverzióra váró betegeknél az újonnan indított NOAC-terápia biztonságosságát és hatékonyságát még folyamatban lévő vizsgálatok fogják értékelni.
11.2 Hosszú távú gyógyszeres kezelés antiaritmiás szerekkel
Az antiaritmiás szerekkel végzett gyógyszeres kezelés célja a PF-okozta tünetek enyhítése (41). A hosszú távú gyógyszeres terápia mérlegelésekor figyelembe kell venni a tünetek által okozott terhet, a lehetséges gyógyszermellékhatásokat és a beteg preferenciáit. A hosszú távú antiaritmiás gyógyszeres kezelést tekintve jelenleg is a 2010-es ESC PF Útmutatóban (369) lefektetett alapelvek az érvényesek:
- A kezelés célja a PF-okozta tünetek enyhítése.
- Az antiaritmiás szerek kevésbé hatékonyak a sinusritmus fenntartásában.
- A klinikailag hatékony antiaritmiás terápia csökkentheti, de nem szünteti meg a rekurrens PF kialakulásának a valószínűségét.
- Ha az egyik antiaritmiás szer „nem működik”, egy másikkal klinikai szempontból még jó eredmény érhető el.
- Gyakoriak a gyógyszer-indukálta proaritmiák és az extrakardiális gyógyszermellékhatások.
- Az antiaritmiás szerek kiválasztásánál elsősorban a biztonságosság szempontjait kell figyelembe venni a hatékonysági szempontokkal szemben.
A kezelésben nem részesülő betegekhez viszonyítva, az antiaritmiás terápiában részesülőknél közel kétszer olyan gyakori a sinusritmus (580). Az antiaritmiás terápia nincs hatással a mortalitásra és a kardiovaszkuláris szövődmények kialakulására, a ritmuskontroll-terápia viszont még kis mértékben növelheti is a hospitalizáció kockázatát (gyakran a PF miatt) (41, 578, 579, 582, 589–593). A mellékhatások minimálisra csökkentése végett (201, 580) csak rövid ideig alkalmazzuk az antiaritmiás szereket. Példaképp, a hosszú távú kezeléshez képest, a PF kardioverziója után 4 héten keresztül flecainiddel végzett rövid távú (4 hét) kezelést jól tolerálták a betegek és az esetek többségében (80%-ban) a kezelés megakadályozta a PF rekurrenciáját (584). A rövidtávú antiaritmiás kezelés alkalmas a PF korai rekurrenciájának a kivédésére katéterabláció után (650), ezen felül indokolt lehet azoknál a betegeknél, akiknél fokozott az antiaritmiás gyógyszermellékhatások kockázata, illetve azoknál, akik a PF rekurrenciája szempontjából alacsony-kockázatúnak számítanak.
Az antiaritmiás kezelés és a katéterabláció mellett (ld. 11.3 fejezet) a társult kardiovaszkuláris állapotok kezelésére irányuló beavatkozások csökkenthetik a PF tüneteit és elősegíthetik a sinusritmus fenntartását (203, 204, 296, 312). Ezek közé sorolandó a testsúlycsökkentés, a vérnyomáskontroll, a szívelégtelenség kezelése, a kardiorespiratorikus állóképesség növelése és az egyéb teendők is (7. fejezet).
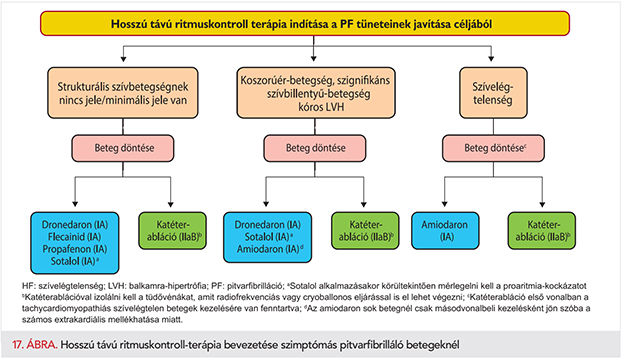
11.2.1 Antiaritmiás szerek kiválasztása a hosszú távú gyógyszeres kezeléshez: elsődleges a biztonságosság!
Általában az antiaritmiás terápia biztonságossága határozza meg, hogy amelyik szert választjuk elsőként (17. ábra). A következő, legfontosabb antiaritmiás szerek alkalmazhatók a PF megelőzése céljából.
11.2.1.1 Amiodaron
Az amiodaron egy hatékony ioncsatorna-gátlószer, amely többféle ioncsatornán hatva csökkenti a kamrafrekvenciát, és a szívelégtelen betegeknek is biztonsággal adható (582, 651). Előfordulhat mellékhatásként torsades de pointes típusú proaritmia, illetve a QT-intervallumokat és a TU-hullámokat monitorozni kell a terápia ideje alatt (17. táblázat) (652). Az amiodaronnak gyakoriak az extrakardiális mellékhatásai, különösen hosszú távon (653, 654), ezért csak másodvonalbeli szerként alkalmazandó azoknál a betegeknél, akiknél más antiaritmiás szer adása is szóba jöhet. Az amiodaron kevésbé tűnik alkalmasnak rövidtávú epizodikus terápiának (hacsak nem katéterablációt követően) (655), valószínűleg a hossszú biológiai felezési ideje miatt.
11.2.1.2 Dronedaron
A dronedaron alkalmas a sinusritmus fenntartására, csökkenti a kamrafrekvenciát, megelőzi a kardiovaszkuláris okból (főként PF miatt) történő hospitalizációt és a kardiovaszkuláris halálozást azoknál a paroxizmális vagy perzisztens PF-ben, illetve pitvari flutterben szenvedő betegeknél, akiknek legalább egy releváns kardiovaszkuláris társbetegségük volt (583, 588, 656). A dronedaron viszont növeli a mortalitását a nemrégiben dekompenzálódott szívelégtelenségben szenvedő (pitvarfibrilláló vagy nem pitvarfibrilláló) betegeknek (657), valamint azoknak a permanens PF-ben szenvedő betegeknek, akiknél nem történik meg a sinusritmus helyreállítása (658). A dronedaron mérsékelten megemeli a szérum kreatininszintet, amely a csökkent kreatinin-kiválasztást tükrözi, nem pedig a vesefunkció romlását (659).
11.2.1.3 Flecainid és propafenon
A flecainid és a propafenon hatékonyak a rekurrens PF megelőzésében (581, 584, 6201). Az életet veszélyeztető kamrai aritmiák elkerülése végett csak azoknál a betegeknél alkalmazhatóak, akiknek nincsen jelentős mértékű iszkémiás szívbetegségük vagy szívelégtelenségük (660). A flecainid és a propafenon a PF-t 1:1-es vezetésű magas kamrafrekvenciával járó pitvari flutterré alakítja át, amelyet béta-blokkoló, verapamil vagy diltiazem előzetes adásával meg lehet előzni.
11.2.1.4 Kinidin és disopiramid
A kinidin és a disopiramid alkalmazása mellett magasabbnak találták a báramely okból bekövetkező mortalitást (OR: 2,39, 95%-os CI: 1,03–5,59, egy nem kívánt esemény bekövetkeztéhez minimálisan szükséges betegszám: 109, 95%-os CI: 34–4985) az 1 éves utánkövetés végén (661), valószínűleg a kamrai aritmiák kialakulásának (torsades de pointes) köszönhetően (580, 661). Annak ellenére, hogy ez a proaritmiás hatásuk nagyobb dózisok mellett észlelhető gyakrabban, ritkábban használjuk őket PF-ben ritmuskontroll céljából. A disopiramid hasznos lehet a fokozott vagus aktivitás miatt kialakuló PF-ben (pl. sportolók PF-je és/vagy az alvás alatt kialakuló PF) (76), ezenkívül bebizonyították azt is, hogy csökkenti a bal kamra kiáramlási grádiensét és javítja a hypertrophiás cardiomyopathiában szenvedő betegek tüneteit (662–664)

11.2.1.5 Sotalol
A sotalol mellett nagy a kockázata a torsades de pointes kialakulásának (1% a Prevention of Atrial Fibrillation After Cardioversion [PAFAC] vizsgálatban) (118). Miokardiális infarktus után balkamra-diszfunkcióban szenvedő betegek közül a sotalol d-enantiomerjével kezelt betegeknek magasabb volt a halálozási kockázata, mint a placebóval kezelt betegeknek (665), feltehetően kamrai aritmiák kialakulása miatt (OR: 2,47, 95%-os CI: 1,2–5,05, egy nem kívánt esemény bekövetkeztéhez minimálisan szükséges betegszám: 166, 95%-os CI: 61–1159) (580, 665). Másfelől viszont a d,l-sotalolt két kontrollált vizsgálatban is biztonsági figyelmeztetések nélkül alkalmazták PF-betegeknél (581, 601).
11.2.1.6 Dofetilid
A dofetilid egy másik káliumcsatorna-blokkoló, amelyet főként Európán kívüli országokban alkalmaznak. A dofetilid képes helyreállítani és fenntartani a sinusritmust a szívelégtelenségben szenvedő betegeknél (666), és esetlegesen más antiaritmiás szerekre refakter betegeknél (667).
Összességében elmondható, hogy a kinidin, a disopiramid, a dofetilid és a sotalol alkalmazását érdemes speciális helyzetekre tartogatni. Ezenkívül a QT-megnyúlást okozó antiaritmiás szerek kombinálása kerülendő a PF ritmuskontroll kezelése során (17. táblázat).
11.2.2 A 12 elvezetéses EKG segítségével azonosíthatók a proaritmia-kockázatnak kitett betegek
A proaritmia kockázattal rendelkező betegek azonosításával csökkenthető az antiaritmiás szerek proaritmogén kockázata (668). A fentebb említett klinikai jellemzők mellett az antiaritmiás terápia indításakor a PR-távolság, a QT-távolság és a QRS szélességének a követésével kiszűrhetőek a hosszú távú kezelés alatt magas gyógyszerindukálta proaritmogén kockázattal rendelkező betegek (669–671). Ezen felül, az „abnormális TU-hullámok” megjelenése fenyegető torsades de pointes kialakulására utal (652). Az antiaritmiás szereket vizsgáló legfrissebb tanulmányokban a periodikusan végzett EKG-elemzéssel sikeresen észlelni tudták a proaritmia jeleit (118, 584, 672). Az EKG-vizsgálatokat szisztematikusan végezték az 1-3. napokon a flecainiddel, a propafenonnal vagy a sotalollal kezelt betegeknél, hogy kiszűrjék a proaritmiára hajlamos betegeket (118, 584, 601). Ezen gyakorlat alapján javasoljuk, hogy minden betegnél készüljön EKG az antiaritmiás terápia bevezetése előtt. A terápia bevezető szakaszában indokolt lehet ütemezetten végezni az EKG-vizsgálatokat (17. táblázat).


11.2.3 Új antiaritmiás gyógyszerek
Számos, az ultrarapid káliumáramot gátló vegyület (IKur) és az atípusos ioncsatornák egyéb inhibitorai állnak klinikai fejlesztés alatt (673–675). Ezek a klinikum számára még nem elérhetők. A ranolazin antianginás vegyület, amely a kálium- és a nátriumáramot gátolja és fokozza a glükóz metabolizmusát a szabad zsírsavmetabolizmus kárára, ezáltal hatékonyabbá teszi az oxigén felhasználását (676, 677). A ranolazin biztonságosnak bizonyult a MERLIN (Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary Syndrome) vizsgálatban a nem ST-elevációs miokardiális infarktusban és instabil anginában szenvedő betegeknél (678). A randomizált besorolást követő első 7 napban folyamatosan készült EKG-regisztrátumok post-hoc elemzésében a ranolazinnal kezelt betegeknél tendenciát figyeltek meg a PF-epizódok ritkább előfordulására a placebóval kezelt betegekhez képest (75 [2,4%] vs. 55 [1,7%] beteg, p=0,08] (679). A HARMONY (A Study to Evaluate the Effect of Ranolazine and Dronedarone When Given Alone and in Combination in Patients With Paroxysmal Atrial Fibrillation)-vizsgálatban a ranolazin és a dronedaron kombinációja a legmagasabb vizsgált dózisokban (ranolazin 750 mg napi kétszer, dronedaron 225 mg napi kétszer) kis mértékben csökkentette a PF-epizódok számát a paroxizmális PF-ben szenvedő, kétüregi pacemakerrel rendelkező 134 vizsgált betegnél (680). Kisvolumenű, nyílt vizsgálatok azt mutatták, hogy a ranolazin fokozhatja az amiodaron antiaritmiás hatását, amelyet a kardioverziónál aknázunk ki (681–683). Ezzel szemben, kontrollált vizsgálatok ellentmondásosnak találták a ranolazinnak és a ranolazin-dronedaron kombinációnak a pitvari magasfrekvenciájú epizódok (AHRE) megelőzésében kifejtett hatását pacemakeres betegeknél (684). Jelen pillanatban nincs elég bizonyíték ahhoz, hogy a ranolazin, mint antiaritmiás szer használatát javasolni lehessen akár önmagában, akár más antiaritmiás szerekkel kombináltan. Meg kell jegyezni, hogy a „funny”-ioncsatornát gátló ivabradin, amelyet anginában és szívelégtelenségben használnak, növeli a PF kockázatát (685).

11.2.4 Nem antiaritmiás szerek antiaritmiás hatásai
Úgy tűnik, hogy az ACE-gátlók és az ARB-k képesek megelőzni az újonnan felismert PF kialakulását balkamra-diszfunkció, illetve hipertenzióhoz társuló balkamra-hipertrófia esetén (219, 236, 237, 239, 246, 250, 686). A neprilizin-gátlással kapcsolatban még további kutatásokra van szükség, azonban úgy tűnik, hogy nem fokozza az előbbiek hatását (224). Egy dán kohorsz vizsgálatban azt feltételezték, hogy a szövődménymentes hipertónia kezdeti kezelésében az ACE-gátlók vagy az ARB-k más vérnyomáscsökkentőkhöz képest csökkentik az incidentális PF esetleges kialakulását (245). Az ARB-terápia nem csökkenti a PF-epizódok számát strukturális szívbetegségben nem szenvedő pitvarfibrilláló betegeknél (241). Vagyis nem valószínű, hogy az ACE-gátlóknak és az ARB-knek releváns direkt antiaritmiás hatása lenne. Célszerű azonban megfontolni az ACE-gátlók vagy az ARB-k adását az antiaritmiás terápia mellé kardioverzió után a PF-rekurrencia csökkentése céljából (248, 249, 687). A béta-blokkolók placebóhoz képest csökkentik az újonnan felismert PF kialakulását HFrEF-ben és sinusritmusban lévő betegeknél (23). A béta-blokkolókról azt is leírták, hogy csökkentik a szimptómás PF rekurrenciáját (580, 636, 688), ami leginkább a frekvenciakontroll kedvező hatásának köszönhető, így a PF gyakrabban jelentkezik tünetmentes formában. Számos alacsony betegszámú RCT eredménye azt mutatta, hogy a perioperatív statinterápia csökkenti a posztoperatív PF kockázatát (689, 690), ezzel szemben egy megfelelő elemszámmal rendelkező, placebokontrollált vizsgálatban a perioperatív rosuvastatin terápiának semmilyen hatását nem találták a posztoperatív PF-re nézve (691). A statinkezelés más esetekben sem előzi meg a PF kialakulását (692, 693). Ehhez hasonlóan, a többszörösen telítetlen zsírsavak sem mutattak meggyőző eredményeket (241, 694–698). Az aldoszteron-antagonisták szerepe a PF kezelésében kevéssé kutatott. Habár az eplerenon primer prevenciós alkalmazásával kapcsolatban az előzetes vizsgálati eredmények biztatóak (243), jelen pillanatban nincsenek olyan meggyőző evidenciák, amelyek alapján javasolni lehetne az aldoszteron-antagonisták alkalmazását a PF másodlagos prevenciójára (699–701).
11.3 Katéterabláció
Mióta először leírták, hogy a tüdővénákban létrejövő fokális aktivitású területek paroxizmális PF-et képesek kiváltani (108), a PF katéterablációval történő kezelése kísérleti eljárásból hétköznapi kezelési móddá vált, amelyet a rekurrens PF megelőzésére használunk (587, 715). Ez elsődlegesen a pulmonalis vénák izolációjával érhető el, amelyet valószínűleg maradéktalanul kell elvégezni a teljes siker érdekében (716) a bal pitvar hátsó falának ablációjával együtt. A PF ablációja – ha megfelelően képzett szakemberekből álló teamek végzik nagy gyakorlattal rendelkező centrumokban – hatékonyabb a sinusritmus fenntartásában, mint az antiaritmiás szerekkel végzett gyógyszeres terápia, a szövődményrátája pedig – annak ellenére, hogy nem elhanyagolható – a gyógyszeres terápiájéval megegyező mértékű (585, 717).
11.3.1 Indikációi
A PF katéterablációja hatékony megoldás a sinusritmus helyreállítására és fenntartására a szimptómás paroxizmális, perzisztens és valószínűleg a tartós perzisztens PF esetén. Általában másodvonalbeli kezelésként jön szóba, amikor a beteg az antiaritmiás szereket nem tolerálja vagy azokkal nem sikerült eredményt elérni. Az ilyen betegeknél a katéterabláció hatékonyabb az antiaritmiás gyógyszeres terápiánál (185, 586, 713, 717–720). Randomizált vizsgálatok azt mutatták, hogy paroxizmális PF-ben első vonalbeli kezelésként a katéterabláció csak mérsékelten javította a ritmuskontrollt az antiaritmiás gyógyszeres terápia hatásával összevetve (585, 721–723). Mindkét kezelési módszer szövődményrátája hasonló volt, amennyiben a katéterablációt szakmai szempontból kiemelt centrumban végezték. Ez is alátámasztja, hogy a katéterabláció elvégezhető első vonalbeli kezelésként paroxizmális PF-ben, amennyiben a beteg intervenciós terápiához ragaszkodik. Perzisztens vagy tartós perzisztens PF-ben kevesebb adat áll rendelkezésre az eljárás hatékonyságáról és biztonságosságáról, de a meglévő adatok mind azt igazolják, hogy a katéterablációt követően alacsonyabb a PF rekurrenciája, mint a kardioverzió mellett vagy önállóan alkalmazott antiaritmiás gyógyszeres terápia után (2. web-ábra) (185, 717, 723–726, 1039). Minden RCT jobbnak találta a katéterablációt az antiaritmiás szereknél a sinusritmus fenntartásában azoknál a betegeknél, akik a gyógyszeres antiaritmiás kezelés ellenére erősen szimptómás rekurrens PF-epizódokat élnek meg (586, 713, 727, 728). Jelenleg katéterabláció nem végezhető sem a kardiovaszkuláris kimenetelek megelőzése (vagy az antikoagulásás abbahagyása), sem a hospitalizáció csökkentése céljából (40, 594).
11.3.2 Technikák és technológiai eszközök
A teljes pitvari tüdővéna izolálás (PVI) a katéterabláció legrészletesebben dokumentált célpontja (716, 729–731), amely során a tüdővénákban körkörös léziókat hoznak létre pontról pontra történő radiofrekvenciás vagy cryoballonos ablációval. Mindkettőhöz hasonló klinikai eredmények társulnak (732–734). A pulmonalis vénák teljes izolálásának a ritmuskontroll szempontjából jobb az eredménye, mint a részleges izolálásnak (716). A PVI-t először paroxizmális PF-ben szenvedő betegeknél vizsgálták meg, ám noninferiornak tűnik a perzisztens PF-ben végzett kiterjedtebb ablációhoz képest is (729, 735). Perzisztens PF-ben szenvedő betegeknél kiterjedtebb ablációkat végeztek, jelenleg azonban nincs elég adat ahhoz, hogy ezeknek a hasznát meg lehessen ítélni (117, 718, 719, 735–737). A kiterjedtebb ablációs eljárások (a PVI-on túl) hosszabb ideig tartanak és nagyobb ionizáló sugárterheléssel járnak, amely a beteg számára potenciális kockázatot jelent. PVI után igen ritka a bal pitvari macro-reentry tachycardia előfordulása (~5%). A pitvari macro-reentry tachycardia szintén ritkán fordul elő cryoballonos ablációt követően (734), de akár a betegek 25%-ánál is jelentkezhet bal pitvari szubsztrát-modifikációs ablációt követően az inkomplett hegvonalnak köszönhetően. Éppen ezért perzisztens PF-ben az első beavatkozás során nem tűnik indokoltnak a komplex frakcionált elektrogrammok ablációja, a rotorok ablációja, illetve a lineáris léziók vagy egyéb kiegészítő ablációk rutinszerű elvégzése (735, 738, 739). Azoknál a betegeknél viszont, akiknél rekurrens PF jelentkezik az első ablációt követően (719, 740, 741), megfontolandó a teljes PVI mellett a kiegészítő abláció végzése (716). Dokumentált jobb pitvari isthmus-dependens flutter miatt PF-ablációra váró betegeknél javasolt elvégezni a jobb pitvari isthmus ablációját. Az adenozin-próbát – amellyel kideríthető, hogy mely betegeknél van szükség kiegészítő abláció elvégzésére –, számos közlemény vizsgálta, ennek ellenére még mindig vannak ellentmondások vele kapcsolatban (739, 742–744). Az ún. rotorok ablációja, amelyet a felületi potenciál-térképezés vagy endocardialis mapping segítségével végeznek, egyelőre még vizsgálat alatt áll, rutinszerű alkalmazása a klinikumban nem javasolt.
11.3.3 Hatékonyság és szövődmények
11.3.3.1 A pitvarfibrilláció katéterablációjának eredményei
A pitvarfibrilláció miatt végzett katéterablációt követően egyes betegeknél nehéz megjósolni annak a hatását a ritmusra (173, 227, 713, 728). A betegek nagyrészénél több beavatkozásra is szükség van a tüneti kontroll eléréséhez (713, 726, 728). Fiatal betegeknél, rövid ideje fennálló PF, valamint gyakori rövid PF-epizódok jelentkezése esetén – amennyiben nem áll fenn strukturális szívbetegség –, általában jobb a ritmuskontroll, és kevesebb szövődménnyel jár a beavatkozás (745). A katéterabláció hatékonyabb a sinusritmus fenntartásában, mint az antiaritmiás gyógyszeres terápia (2. web-ábra) (746, 1039). Sinusritmus erősen szimptómás rekurrens PF-epizódok nélkül a paroxizmális PF-ben szenvedő betegek akár 70%-ánál, míg a perzisztens PF-ben szenvedők közel 50%-ánál figyelhető meg (713, 728, 735). Nem ritka a nagyon kései PF-rekurrencia, akár több évnyi sinusritmusban töltött idő után, amely a betegség progressziójára utal és a PF-terápia folytatását teszi szükségessé (728). Számos tényezőt azonosítottak a PF miatt végzett katéterabláció után jelentkező rekurrencia kockázati tényezőjeként, ezeknek a prediktív értéke azonban kicsi. A katéterabláció elvégzéséről szóló döntést a beteggel együtt kell meghozni (747) (ld. 8. fejezet) a várható haszon és a lehetséges kockázatok, valamint az egyéb alternatív lehetőségek (pl. antiaritmiás gyógyszeres kezelés vagy a meglévő tünetek elfogadása ritmuskontroll-terápia nélkül) részletes ismertetését követően (175).
11.3.3.2 A pitvarfibrilláció katéterablációjának szövődményei
A gyakorlatban egyértelműen fontos a szövődmények rendszeres észlelése, amellyel javítható a PF miatt végzendő ablációs eljárások minősége (175). Az EURObservational Research Programme (EORP) keretében 1391 olyan beteget vizsgálatak meg, akik az első ablációs beavatkozáson estek át olyan kórházban, ahol évente legalább 50 ablációs beavatkozást végeznek, és azt találták, hogy esetükben a kórházi tartózkodás medián ideje 3 nap volt (interquartilis tartomány: 2-4 nap). A PF katéterablációját követően a betegek 5-7%-a szenved súlyos szövődményektől, és 2-3%-uknál jelentkezik életet veszélyeztető, de általában kezelhető szövődmény (727, 748–750). A beavatkozás alatt halálozásról is beszámoltak már, ez azonban ritka (<0,2%) (751). A súlyos szövődmények közül legjelentősebb a stroke/TIA (<1%), a szívtamponád (1-2%), a pulmonalis véna stenosis és a súlyos nyelőcsősérülés, amely atrio-oesophagealis fisztula kialakulásához vezet hetekkel az abláció után (18. táblázat). A „néma stroke” (vagyis az agyi MRI-n észlelhető fehérállományi lézió) a radiofrekvenciás vagy cryoballonos ablációval kezelt betegek körülbelül 10%-ánál figyelhető meg (752). Ennek a megfigyelésnek a klinikai relevanciája még nem tisztázott (749). Az ablációt követően fellépő szövődmények közé sorolható a stroke (legmagasabb a kockázata ez első egy hétben) (753), a késői perikardiális tamponád (napokkal a beavatkozás után jelentkezik) (751), valamint az oesophagealis fisztulák (7-30 nappal az abláció után). Az atrio-oesophagealis fisztulák időben történő felismerése a rá jellemző tüneti triász alapján (egyértelmű forrás nélkül fennálló infekció, retrosternalis fájdalom és stroke/TIA) életmentő lehet (748).
11.3.4 Antikoagulálás: abláció előtt, alatt és után
A K-vitamin-antagonista kezelést folytatni kell az abláció ideje alatt is (az INR-értéknek 2-3 között kell lennie) (760). A warfarin alternatívájaként NOAC-okkal is végezhető az antikoagulálás (478, 761–765). Nem keletkeztek biztonsági figyelmeztetések azoknál a megfigyeléses kohorszoknál, amelyeket a nagy tapasztalattal rendelkező centrumokban végzett katéterabláció alatt mindvégig folymatos NOAC-kezelésben részesítettek (761, 763, 766, 767). Számos megfigyelésből származó adat mellett (761, 769, 770) nemrégiben közzétették az első kontrollált vizsgálat eredményét (768), amely közel 200 PF miatt abláción áteső betegeknél hasonlította össze a folyamatos NOAC- és a folyamatos K-vitamin-antagonista kezelés hatását. A folyamatban lévő vizsgálatok a K-vitamin-antagonistákkal és a NOAC-okkal megszakítás nélkül végzett kezelést értékelik egymással összehasonlítva a PF miatt abláción áteső betegeknél (pl. az AXAFA–AFNET 5 [Anticoagulation using the direct factor Xa inhibitor apixaban during Atrial Fibrillation catheter Ablation: Comparison to vitamin K antagonist therapy, NCT02227550] vizsgálat és a RE-CIRCUIT [(Randomized Evaluation of dabigatran etexilate Compared to warfarin in pulmonaRy vein ablation: assessment of different periproCedUral anticoagulation sTrategies, NCT02348723] vizsgálat). Az abláció ideje alatt heparin adása javasolt a >300 ms-os aktivált alvadási idő fenntartásához. Az alvadásgátló-kezelést az ablációt követően legalább 8 héten keresztül fenn kell tartani minden betegnél. A tromboembóliás események valódi incidenciáját a katéterabláció után eddig még nem vizsgálták rendszerezett formában, a várható stroke-kockázat mértékét pedig más PF-betegekből álló, de ablációval nem kezelt kohorszokból vették át. Habár a megfigyeléses vizsgálatok egy relatíve alacsony stroke-kockázatot feltételeznek a PF miatti katéterablációt követő első években (737, 771–776), a rekurrens PF hosszú távú kockázatát, valamint az antikoaguláns kezelés biztonságossági profilját is figyelembe kell venni. Kontrollált vizsgálati eredmények hiányában, katéterabláció után az orális antikoagulálás általános szabályai a mérvadóak a várható ritmuskimeneteltől függetlenül.
11.3.5 A pitvarfibrilláció ablációs kezelése szívelégtelenségben
Az amiodaron kezeléssel összevetve a katéterabláció szignifikáns mértékben csökkenti a rekurrens PF előfordulását HFrEF-betegeknél (777). Bizonyos PF-ben és HFrEF-ben szenvedő betegeknél helyreállhat a bal kamra szisztolés funkciója katéterabláció után (ez nagy valószínűséggel tachycardiomyopathiára utal). Számos kisebb tanulmány szerint javul a HFrEF-betegek balkamra-funkciója katéterablációt követően (185, 226–228, 778, 779) valamint csökken a hospitalizáció aránya (720, 777) főként a miokardiális infarktusban nem szenvedő betegeknél (780). Az eredmények megerősítéséhez további nagyméretű vizsgálatokra van szükség. Nélkülözhetetlen a katéterabláció elvégzése ezeknél a betegeknél. HFrEF-betegeknél körültekintően kell felállítani a katéterabláció indikációját és magát az eljárást nagy tapasztalattal rendelkező centrumokban kell elvégezni.
11.3.6 Katéterabláción átesett betegek utánkövetése
A katéterabláción átesett betegek utánkövetésében résztvevő orvosoknak és maguknak a betegeknek is ismerniük kell a késői komplikációk jeleit és tüneteit, hogy azonnali ellátásra kerülhessenek (18. táblázat). A betegnek tisztában kell lennie azzal, hogy a katéterabláció után gyakori a szimptómás és az aszimptómás PF-epizódok előfordulása (119, 781, 782). A ritmuskontroll-terápia elsődleges céljával egybehangzó az a javaslat, miszerint az aszimptómás epizódok általában nem igényelnek további ritmuskontroll-terápiát a gyakorlatban. A betegeket a katéterablációt követő 12 hónapban legalább egy alkalommal látnia kell egy elektrofiziológus szakembernek. A szimptómás PF-epizódok visszatérése esetén más rimuskontroll-terápiás lehetőségeket is mérlegelni kell, amelyeket a Szív Munkacsoportnak jóvá kell hagynia (17., 19. ábra).
11.4 A pitvarfibrilláció sebészeti kezelése
11.4.1 Kiegészítő sebészeti beavatkozások pitvarfibrillációban
A Cox-maze műtétet, mint „vágás-varrás” típusú sebészi technikát 30 évvel ezelőtt végezték először. Az eljárás lényege a bal pitvar hátsó részének izolálása, összekapcsolása a mitralis annulus posterior szegmensével, cavotricuspidalis kapcsolat létesítése és a bal pitvari fülcse eltávolítása (18. ábra) (783). Vagyis a Cox-maze műtéttel egy elektromos labirintust (maze) hoznak létre, amelynek a metszésvonalain keresztül a sinoatrialis csomóból eredő impulzusok utat találnak maguknak az atrioventricularis csomóhoz, miközben a fibrillációs potenciálok nem tudnak elvezetődni. A Cox-maze eljárást és az egyéb – gyakran egyszerűbb – PF sebészeti technikákat főként más típusú, nyitott szívműtétet igénylő beavatkozás mellett végzik (461, 466, 784–798). Ehhez az Útmutatóhoz készült szisztémás irodalmi áttekintésből az derült ki, hogy a PF egyidejű sebészi megoldása növelte a PF-mentes, a pitvari flutter-mentes és a pitvari tachycardia-mentes időszak hosszát ahhoz képest, amikor sebészi beavatkozás nem történt (RR: 1,94, 95%-os CI: 1,51-2,49, a betegszám 7 RCT-ből n=554) (3. web-ábra) (1040). A Cox-maze műtéten átesett betegeknél gyakrabban vált szükségessé pacemaker beültetése (RR: 1,69, 95%-os CI: 1,12-2,54, n=1631 from 17 RCTs), az egyéb kimenetelek és szövődmények tekintetében azonban nem észleltek különbséget. A Mellkassebészeti Társaság adatbázisából – amely 67 389 nyitott szívműtéten átesett PF-beteg adatait tartalmazza –, elvégzett elemzés megerősíti ezeket az eredényeket: a mortalitást és a jelentősebb megbetegedéseket nem befolyásolta a PF egyidejű sebészi kezelése (korrigált esélyhányados [OR]: 1,00, 95%-os CI: 0,83–1,20), pacemaker-implantáció azonban sokkal gyakrabban történt (korrigált OR: 1,26, 95%-os CI: 1,07–1,49) (799). A következő tényezők fennállása esetén várható a PF-rekurrenciája műtétet követően: bal pitvari dilatáció, előrehaladott életkor, több mint 10 éve fennálló PF, valamint nem paroxizmális PF (800–804). A PF típusát figyelembe véve paroxizmális PF-ben hatékonynak tűnik a sebészi PVI (805), perzisztens és tartósan perzisztens PF fennállása esetén pedig hatékonyabb eredményt nyújtanak a biatrial bemetszések (797, 803, 806). A nyitott szívműtétre váró, a PF tüneteitől szenvedő betegek ellátásának javasolt menetét a 19. ábra mutatja, a pitvarfibrillációval foglalkozó Szív Munkacsoport pedig segíti a betegek felvilágosítását és támogatja őket a döntéshozatalban.
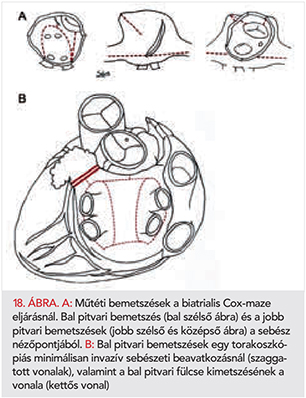
11.4.2 Ritmuskontrollt célzó önálló sebészeti beavatkozás
A Cox-maze eljárást újabban felváltják a már elérhető egyszerűbb, könnyebben reprodukálható és kivitelezhető technikák (pl. bipoláris radiofrekvenciás vagy cryothermiás eljárások), amelyek egy kis mellkasi thoracotomiás nyíláson keresztül is elvégezhetők (786, 807, 808). A bipoláris radiofrekvenciával végezhető torakoszkópiás PVI segít megelőzni a paroxizmális PF rekurrenciáját (69-91%-ban biztosít aritmiamentességet az első évben, ld. 18.B ábra, a metszésvonalak elhelyezkedése) (468, 809, 810) és hatékonynak tűnik a katéterablációra refrakter betegeknél (811). A kórházi tartózkodás átlagideje torakoszkópiás abláció esetén 3,6-6,0 nap között mozog (468, 812, 813). A FAST (Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment) vizsgálat (468), valamint egy másik kisebb vizsgálat (814) szerint a torakoszkópiás PF-műtét hatékonyabb lehet a katéterablációnál a sinusritmus fenntartásában (468, 814), a szövődményrátája viszont magasabb (19. táblázat) (815). Az eredményesség növelése érdekében kiterjesztett bemetszéseket lehet ejteni (468, 816–818) ide értve a PVI közötti vonalakat („box- izoláció”) és a mitralis annulushoz vezető vonalakat (812–822). Az eredményesebb transmuralis bemetszésekhez (716) endo-epicardialis ablációs stratégiák alkalmazását javasolták nemrégiben (812, 823–825). Habár a szimultán végzett hibrid ablációs technikáról szóló előzetes eredmények ígéretesek, a beavatkozás ideje és a vérzéses szövődmények gyakorisága magasabbnak tűnik (812, 823).


11.5 A ritmuskontroll-terápia lehetőségei ablációs sikertelenség esetén
Nincs elég evidencia egyértelmű ajánlások megfogalmazásához a katéterablációt követően rekurrens PF-ben szenvedő betegek ellátására vonatkozóan. Az ablációt követően (8 héten belül) fellépő korai PF-rekurrencia vagy pitvari tachycardia kezelésére kardioverzió alkalmazható. A PF miatt végzett ablációs kezelésen átesett betegekről szóló számos közleményben antiaritmiás kezelésre refrakter betegek is szerepelnek. Ezért indokolt lehet ablációs kezelést is végezni a gyógyszeres antiaritmiás terápia mellett szimptómás rekurrens epizódoktól szenvedő betegeknél. Másik lehetőségként újabb antiaritmiás szer kipróbálása jöhet szóba. Azoknál a betegeknél, akiknél korábban az egyik vagy másik terápia önmagában nem volt elegendő, megfontolandó egy antiaritmiás gyógyszer és az abláció kombinált alkalmazása („hibrid terápia”, ld. 12. fejezet), mivel ezeknek a szereknek a hatása különböző és esetlegesen szinergisztikus lehet az ablációéval. Szóba jöhet frekvenciakontroll-terápia ritmuskontroll nélkül, sebészi abláció vagy ismételt katéterabláció (20. ábra). A kezdeti terápiás sikertelenséget követően további ritmuskontroll-terápiára szoruló betegeknél a további terápiás lehetőségek ismertetése szempontjából meghatározó a beteg preferenciája és az egyes eljárások lokális hozzáférhetősége.
11.6 A pitvarfibrillációs Szív Munkacsoport
Tekintettel az egyes terápiás lehetőségek összetett voltára, azoknál a betegeknél, akik a korábbi ritmuskontroll-terápiára nem reagáltak, de esetükben kívánatos vagy elengedhetetlen a további terápia, – a Munkacsoport álláspontja szerint – javasolt kikérni egy pitvarfibrillációval foglalkozó Szív Munkacsoport véleményét a PF sebészi megoldásáról, illetve a PF miatt végzett kiterjesztett ablációról szóló döntések meghozatalához. Ugyanez vonatkozik a frekvenciakontroll startégia visszaállítására is a súlyos PF-tünetektől (EHRA III vagy IV) szenvedő betegek esetében. A pitvarfibrillációval foglalkozó Szív Munkacsoportnak egy antiaritmiás kezelésben jártas kardiológus szakemberből, egy intervenciós elektrofiziológusból és egy olyan szívsebészből kell állnia, akinek gyakorlata van a PF intervenciós vagy katéterablációs megoldására alkalmas betegek, technikák és technológiák kiválasztásában (20. ábra). Ilyen teamek létrehozására – valamint a folyamatos ellátást biztosító orvosok, a pitvarfibrilláció ellátásában jártas kardiológusok, intervenciós elektrofiziológusok és szívsebészek állandó együttműködését lehetővé tevő kollaboratív infrastruktúrára – van szükség, amelyek optimális tanácsokkal képesek javítani a ritmus-kimenetelt a fejlettebb és összetettebb ritmuskontrollt célzó intervencióra szoruló betegeknél.


12. Ritmuskontrollt célzó hibrid terápia
A PF-nek számos kiváltó tényezője létezik, amelyeket az antiaritmiás szerek és a katéterabláció csak részben képesek megszűntetni (96). Éppen ezért lehet létjogosultsága a hibrid típusú ritmuskontroll-terápiának, noha mindössze néhány kontrollált vizsgálatból származó evidencia támasztja alá a hasznát.

12.1 Antiaritmiás szerek és katéterabláció kombinált alkalmazása
Az antiaritmiás terápia hossza általában 8-12 hét az ablációt követően, hogy csökkentse a PF korai rekurrenciáját a katéterabláció után. Ezt támasztja alá egy friss kontrollált vizsgálat eredménye is, amelyben az amiodaron a placebóhoz képest a felére csökkentette a PF korai rekurrenciáját (650). Prospektív vizsgálatok ugyan nem készültek, de a rendelkezésre álló (gyenge) evidenciákat felölelő metaanalízis szerint a katéterabláció után antiaritmiás terápiában részesülő betegeknél hatékonyabb a rekurrens PF megelőzése (713). A katéterabláció után sok beteg részesül antiaritmiás terápiában (legtöbbször amiodaronnal vagy flecainiddel) (587), ami kézenfekvő választás az abláció után rekurrens PF-ben szenvedő betegeknél. Észszerű javaslat, hogy a katéterablációt követően további ritmuskontroll-terápiára szoruló betegeknél mérlegeljük az gyógyszeres antiaritmiás kezelést, ennek megerősítésére azonban további kontrollált vizsgálatokra lenne szükség. A cavotricuspidalis isthmus ablációja gyógyszeres antiaritmiás terápiával kombinálva a bal pitvar ablációja nélkül is javíthatja a ritmuskontrollt azoknál a betegeknél, akiknél a flekainid, a propafenon vagy az amiodaron mellett „gyógyszer indukálta pitvari flutter” lépett fel (834–836), hosszú távon viszont a PF rekurrenciáját kell mérlegelni (837, 838).
12.2 Antiaritmiás szerek és pacemaker- kezelés kombinált alkalmazása
Egyes sick sinus szindrómás betegeknél, akiknél a gyors kamrai vezetéssel járó paroxizmális PF-epizódok miatt szükség van frekvenciakontroll-terápiára, a pacemaker-beültetés nem csupán optimalizálja a frekvenciakontrollt, de a ritmuskontrollt is segítheti (711, 712). Sőt, ha az gyógyszeres antiaritmiás kezelés sinuscsomó-diszfunkciót és bradycardiát okoz, a pacemaker mellett lehetővé válik az antiaritmiás gyógyszer dózisának a feltitrálása. Ezeket a kezelési stratégiákat még sosem elemezték prospektív vizsgálatok, a vizsgált betegpopuláció pedig több szempontból is válogatott volt (839, 840). PF-indukálta bradycardiában szenvedő betegeknél a katéterablációval elkerülhető az antiaritmiás kezelés vagy a pacemaker-beültetés (829, 830).
13. Speciális esetek
13.1 Elesett és idős betegek
Sok betegnél időskorban jelentkezik a pitvarfibrilláció (pl. 75 vagy 80 év fölött). Nincsen olyan tanulmány, amely arról számolna be, hogy a kardiovaszkuláris kockázatcsökkentés kevésbé hatékony az időskorú pitvarfibrilláló betegeknél, mint a fiatalabbaknál. Sőt, az életkor az egyik legerősebb prognosztikai tényező az iszkémiás stroke szempontjából PF-ben (382). A BAFTA (Birmingham Atrial Fibrillation Treatment of the Aged Study) vizsgálatból (362), a NOAC-kokkal végzett vizsgálatokból (39), és az időskorú amerikaiak adataival végzett elemzésekből (Medicare) (396) származó megbízható adatok az antikoagulánsok használata mellett szólnak idős betegeknél. Az idős pitvarfibrilláló betegeknél magasabb a stroke kockázata, ezért ők nagyobb eséllyel profitálnak az OAC-kezelésből, mint a fiatalabb életkorú betegek (841). Ennek ellenére az OAC-terápia még mindig kihasználatlan az időseknél (220, 842). Habár a PF többi kezelési módjának kisebb a tudományos megalapozottsága, a rendelkezésre álló adatok támogatják az alkalmazható ritmuskontroll és a frekvenciakontroll eljárások elvégzését, a pacemaker-beültetést és a katéterablációt az életkorra tekintet nélkül. Idősebb korban egy adott betegnél számos társbetegség is fennállhat, mint a demencia, a fokozott elesési hajlam, a CKD, az anémia, a hipertenzió, a diabétesz és a kognitívfunkció-romlás. Ezek az állapotok nagyobb mértékben ronthatják az életminőséget, mint a PF-fel járó tünetek. Az időseknél gyakrabban észlelhető a vesefunkció és a májfunkció romlása, illetve a polipragmázia miatt a gyógyszerinterakciók és a mellékhatások jelentkezése. Az integrált PF-ellátással, valamint a gyógyszerdózisok óvatos korrekciójával csökkenthetőek a PF-terápia szövődményei ezeknél a betegeknél (843).

13.2 Örökletes cardiomyopathiák, ioncsatorna-rendellenességek és járulékos kötegek
Számos örökletes szívbetegséghez társul korai kezdetű PF (20. táblázat). A fennálló állapot kezelése szerves része a PF-ellátásnak ezeknél a fiatal betegeknél (ld. ESC Útmutató a hirtelen szívhalál (844) és a hypertrophiás cardiomyopathia (845) ellátásához).
13.2.1 Wolff–Parkinson–White-szindróma
A preexcitációval együtt járó PF esetén fennáll a gyors kamrai aktiváció kockázata a járulékos kötegen keresztül, amely gyors kamrafrekvenciát eredményez, kamrafibrillációhoz és hirtelen szívhalálhoz vezethet. Az anterográd vezetésű járulékos köteggel rendelkező pitvarfibrilláló betegeknél javasolt elvégezni a járulékos köteg katéterablációját (869, 870). Ez egy biztonságos és hatékony eljárás, amely profilaktikus beavatkozásnak is tekinthető (871, 872). Amennyiben egy ilyen anterográd vezetésű járulékos köteggel rendelkező pitvarfibrilláló beteg túlél egy hirtelen szívhalált, sürgősséggel javasolt elvégezni nála a járulékos köteg katéterablációját (869). Wolff–Parkinson–White (WPW)-szindrómában a hirtelen szívhalál kockázatát jelzi spontán vagy indukált PF alatt a preexcitáció miatt az RR-távolságok rövidsége (<250 ms), a kórtörténetben szereplő szimptomás tachycardia, több járulékos köteg és Ebstein-anomália megléte. Az intravénás procainamiddal, propafenonnal vagy ajmalinnal akutan lassítható a kamrafrekvencia (873, 874), a digoxin, a verapamil és a diltiazem adása viszont kontraindikált (875). Az intravénás amiodaron csak fokozott óvatossággal alkalmazható, mivel egyes esetbemutatások tanúsága szerint az infúzióban adott amiodaron akcelerált kamrai ritmust és kamrafibrillációt okozhat preexcitációval járó pitvarfibrillációban (876).
13.2.2 Hypertrophiás cardiomyopathia
A hypertrophiás cardiomyopathiában szenvedő betegeknél a PF a leggyakoribb aritmia típus, a betegek közel egynegyedét érinti (877). Megfigyelésekből származó adatok azt mutatják, hogy ezeknél a betegeknél magas a stroke-kockázat, ezért szükség van OAC-terápiára (878). Habár a K-vitamin-antagonistákkal több a tapasztalat, nincsenek arra vonatkozó adatok, hogy a NOAC-okat ne lehetne használni ezeknél a betegeknél (845). Kevés tanulmányban vizsgálták a frekvenciakontroll és a ritmuskontroll gyógyszerek alkalmazását hipertrófiás cardiomyopathiában. A béta-blokkolók és a diltiazem vagy a verapamil használata indokolt lehet frekvenciakontroll céljából ezeknél a betegeknél. Amennyiben nem áll fenn a bal kamrai kiáramlási pálya szűkülete, digoxin adható a betegnek önmagában vagy béta-blokkolóval kombinálva (845). Az amiodaron biztonságos antiaritmiás szernek tűnik hypertrophiás cardiomyopathiában szenvedő PF-betegeknél (879), a szakemberek véleménye szerint a disopiramid pedig azoknál lehet hasznos, akiknél fennáll a kiáramlási pálya szűkülete. A PF ablációjával hatékonyan megakadályozható a szimptómás PF rekurrenciája (880–884). A PF sebészi kezelése is szóba jöhet azoknál a hypertrophiás cardiomyopathiás betegeknél, akiknél valamilyen szívműtétet terveznek (pl. bal kamra kiáramlási pálya szűkülete miatt, vagy mitralis billenytűplasztika céljából), ám ezzel kapcsolatban kevés a tapasztalat.
13.2.3 Ioncsatorna-rendellenességek és aritmogen jobb kamrai cardiomyopathia
Számos ioncsatorna-rendellenességben és öröklött cardiomyopathia formában jelentkezik PF. A PF prevalenciája 5-20% közötti a hosszú QT-szindrómában vagy Brugada-szindrómában szenvedő betegeknél, a rövid QT-szindrómás betegeknél (20. táblázat) ez az arány akár 70% is lehet (853, 856–858). A betegség fenotípusának – és a PF-nek is – a penetranciája változó lehet (61, 852, 885, 886). Ezekben a betegségekben a PF hátterében egyaránt állhat a pitvari akciós potenciál idejének megrövidülése és megnyúlása is. A pitvarfibrilláló öröklött cardiomyopathiás betegeknél indokolt lehet olyan antiaritmiás szereknek az alkalmazása (pl. nátriumcsatorna-gátlók LQT3-ban (852) vagy a kinidin Brugada-szindrómában) (887), amelyek helyreállítják a feltételezett ioncsatornadefektust. Sokkal fontosabb, hogy egyébként egészséges fiataloknál az újonnan felismert PF-ben alapos kivizsgálást (kórtörténet, családi anamnézis, EKG-fenotípus, echokardiográfia és/vagy valamilyen kardiális képalkotó vizsgálatot) kell indítani az örökletes állapotok felderítése céljából.

A monogénesen öröklődő génhibák a PF-betegek mindössze 3-5%-ánál vannak jelen, még a fiatalabb populációban is (846, 848, 888–890). Azonkívül, nincs egyértelmű összefüggés az azonosított mutációk és a specifikus kimenetelek vagy a szükséges terápiás teendők között. Éppen ezért a pitvarfibrilláló betegekeknél általánosságban nem javasolt genetikai vizsgálatot végezni (77). A genetikai vizsgálat elvégzésének indikációi öröklött aritmogén betegségekben egy másik Útmutatóban olvashatók (844, 891).

13.3 A sportolás és a pitvarfibrilláció
A fizikai aktivitás javítja az egyén kardiovaszkuláris egészségi állapotát, amely alacsonyabb PF-kockázatban nyilvánul meg (898). Ebből következik, hogy a fizikai aktivitás lényeges eleme a PF-prevenciónak. Az intenzív sportolás, különösen az állóképességet növelő sportok (>1500 óra állóképességi sportolás) (899) a későbbi életszakaszban növelik a PF kialakulásának a kockázatát (900–902). Ebben valószínűleg közrejátszik az autonóm idegrendszer megváltozott működése, az edzés alatti volumenterhelés, a pitvari hipertrófia és dilatáció is (903, 904). A fizikai aktivitás és az incidentális PF között egy U-alakú összefüggés figyelhető meg (214, 898, 902, 905, 906). Az edzéselhagyás („detraining”) csökkentheti a PF előfordulását modellekben (904), valamint csökkenti a ventricularis aritmiák kialakulását atlétáknál (907). Atlétáknál nem ismert, hogy az edzéselhagyás mennyire befolyásolja a PF kialakulását. Az atlétáknál fellépő PF kezelésénél az általános ellátás szempontjai követendők, azonban van néhány sajátosság, amelyeket figyelembe kell venni. Az antikoagulálás szükségességét a beteg klinikai kockázati tényezői határozzák meg. Az OAC-kal kezelt betegeknek kerülniük kell a közvetlen fizikai kontaktussal, illetve a fokozott sérülésveszéllyel járó sportokat. A béta-blokkolókat gyakran nem tolerálják, bizonyos esetekben tilos is az adásuk, a digoxin, a verapamil és a diltiazem pedig gyakran nem csökkenti elég hatékonyan a szívfrekvenciát terhelésre kialakul PF-ben. A PF miatt végzett katéterablációnak valószínűleg hasonlóak a kimenetelei atlétáknál, mint nem sportolóknál (908, 909), ezt azonban még további vizsgálatoknak kell megerősíteniük. A „pill in the pocket” terápiát is alkalmazták náluk (620). A flecainid vagy a propafenon tabletta lenyelését követően tartózkodni kell a sportolástól, amíg fennáll a PF, és az antiaritmiás gyógyszer kétszeres féléletidejének megfelelő idő el nem telik. A nátriumcsatorna-blokkolóval kezelt atlétáknál megfontolandó a flutter áramkörének profilaktikus ablációja (910).
13.4 Terhesség
Terhes nőknél ritkán, általában valamilyen korábban már fennálló szívbetegség talaján alakul ki pitvarfibrilláció. PF-ben gyakrabban fordulnak elő mind az anyát, mind a magzatot veszélyeztető komplikációk (911, 912). A kongenitális szívbetegség hatékonyabb kezelése mellett várhatóan nagyobb lesz a PF terhesség alatti incidenciája (913). A pitvarfibrilláló nők terhessége magas kockázatúnak számít, ezért az ő gondozásukban szükség van a kardiológus, a szülész-nőgyógyász és a neonatológus szakemberek együttműködésére.
13.4.1 Frekvenciakontroll
Mivel pontos adatok nem érhetőek el, az Amerikai Gyógyszerügynökség a béta-blokkolókat, a verapamilt, a diltiazemet és a digoxint terhesség szempontjából „C” biztonsági kategóriába sorolta (a várható haszon felülmúlja a gyógyszerszedés kockázatát), az atenolol viszont „D” biztonsági kategóriába került besorolásra (evidenciák támasztják alá, hogy kockázatos az alkalmazása). Ezeket a gyógyszereket a lehető legkisebb dózisban és a szükséges legrövidebb ideig kell alkalmazni. Egyik szernek sem ismert teratogén hatása, azonban könnyen átjutnak a placentán (914). A béta-blokkolókat gyakran alkalmazzák kardiovaszkuláris betegségben szenvedő terhes nőknél (pl. a gesztációs hipertónia és a preeclampsia kezelésére), azonban intrauterin növekedési retardációt okozhatnak (915), ezért a 20. gesztációs hét után javasolt a magzat növekedésének a vizsgálata. A digoxint biztonságosnak tartják az anyai és a magzati aritmiák kezelésére (916). A verapamilról és a diltiazemről nincs elég adat, hogy ezt meglehessen ítélni, így frekvenciakontroll céljából a béta-blokkolók és/vagy a digoxin alkalmazása javasolt (917). Az összes frekvenciakontroll céljából használható szer kiválasztódik az anyatejbe, jóllehet a béta-blokkolók, a digoxin és a verapamil szintje annyira alacsony, hogy nem tekintjük ártalmasnak. Mivel a diltiazem nagy mennyiségben jelenik meg az anyatejben, csak másodvonalbeli szerként választandó (918).
13.4.2 Ritmuskontroll
Ritmuskontroll-terápiával kapcsolatban várandós pitvarfibrilláló betegeknél csak esettanulmányok készültek. Az amiodaron súlyos magzati károsodást okozhat, ezért csak életmentő szituációban alkalmazható (919). A flecainid és a sotalol jelentősebb mellékhatások nélkül alkalmazhatók a magzati aritmiák conversiójára (920), így valószínűleg biztonságosan kezelhető velük az anya tünetekkel járó PF-je is. Az elektromos kardioverzióval hatékonyan helyreállítható a sinusritmus, abban az esetben, amikor a tachyaritmia hemodinamikai instabilitást okoz. Az elektromos kardioverzió mellett ritkák az anyát és a magzatot érintő kedvezőtlen kimenetelek (921), azonban a magzati distresszt okozó hatása miatt csak abban az esetben végezhető, ha lehetőség van a magzat monitorozására és szükség esetén sürgősségi császármetszés elvégzésére. Mint a terhesség folyamán fellépő minden sürgősségi ellátást igénylő esetben, a terhes nőnek 100%-os oxigént kell adni, vénát kell biztosítani már az ellátás korai szakában, és a bal oldalára kell fektetni az anyát, hogy megfelelő legyen a vénás visszaáramlás (922).
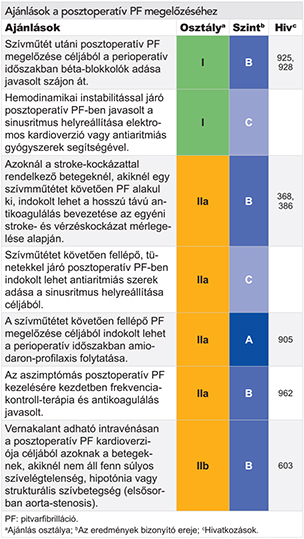
13.4.3 Antikoagulálás
A K-vitamin-antagonisták alkalmazását kerülni kell az első trimeszterben a teratogén hatásuk miatt, a szülést megelőző 2-4 hétben pedig a magzati vérzéses szövődmények elkerülése végett. Helyette biztonsággal alkalmazhatók az alacsony molekulasúlyú heparin készítmények, mivel azok nem jutnak át a placentán (923). A harmadik trimeszterben javasolt rendszeresen laboratóriumban ellenőrizni a véralvadást (pl. 10-14 naponta). Szükség esetén korrigálni kell a dózist, mivel bizonyos nőknél nagy dózisban lehet szükség K-vitamin-antagonista vagy heparin adásra a megfelelő hemosztázis fenntartásához. Azokat a mechanikai műbillentyűvel élő pitvarfibrilláló terhes nőket, akik a szakorvosi teammel történő konzultációt követően a K-vitamin-antagonisták szedésének felfüggesztése mellett döntenek a fogamzást megelőző 6-12 hétben, folyamatos, dóziskorrekcióval végzett frakcionálatlan heparin vagy dóziskorrekcióval végzett szubkután alacsony molekulasúlyú heparin kezelésben kell részesíteni. Mivel csak kevés adat van a NOAC-ok teratogenitásáról, ezért ezeknek az alkalmazása a terhesség ideje alatt kerülendő.
13.5 Posztoperatív pitvarfibrilláció
Szívműtét után gyakran lép fel PF (a betegek 15-45%-ánál) (924–926) és gyakran társul mellé huzamosabb kórházi tartózkodás, illetve magasabb szövődmény- és mortalitási ráta (927). Más nagyobb műtét után sem ritka, hogy PF lép fel, főként az idősebb betegeknél. A posztoperatív PF kezelésének szempontjai főként a szívműtéten átesett betegekkel végzett tanulmányok eredményein alapulnak, a más típusú műtéten átesett betegek kezelésével kapcsolatosan jóval kevesebb evidencia áll rendelkezésre.
13.5.1 A posztoperatív pitvarfibrilláció megelőzése
Egy publikált tanulmányokat felölelő szisztémás irodalmi áttekintésből az derült ki, hogy a béta-blokkolók – jóllehet nagyfokú heterogenitás és mérsékelt torzulási kockázat mellett –, csökkentik a posztoperatív PF és a supraventricularis tachycardiák előfordulását. A leggyakrabban vizsgált szer a proplanolol volt: a propanolollal kezelt betegcsoportban 16,3%, míg a kontrollcsoportban 31,7% volt a PF előfordulása (925). Ezen vizsgálatok többségében a béta-blokkolókat posztoperatívan alkalmazták egy friss metaanalízis által ismertetett módon (928). Számos metaanalízisből az derült ki, hogy az amiodaron a béta-blokkolókhoz képest csökkenti a posztoperatívan fellépő PF incidenciáját, valamint a kórházi tartózkodás idejét (925, 929–931).
Az első metaanalízisek eredményeinek ellentmond (689, 932, 933) egy prospektív kontrollált vizsgálat eredménye, amely szerint a műtét előtt alkalmazott statinkezelés nem előzi meg a posztoperatívan jelentkező PF-et (934). Kisméretű hipotézist generáló vizsgálatokban más terápiás lehetőségeket is kipróbáltak, azonban egyértelműen pozitív hatásról egyik esetben sem számoltak be. Végeztek kezeléseket magéziummal (925, 935, 936), n-3 többszörösen telítetlen zsírsavakkal (937–945), colchicinnel (946), kortikoszteroidokkal (947, 948), valamint megvizsgálták a posterior pericardectomia hatását is (949). A posztoperatív biatrialis overdrive pacing nem terjedt el széles körben annak ellenére, hogy feltehetően profilaktikus hatású (925, 950).

13.5.2 Antikoagulálás
A posztoperatív PF mellett magasabb a stroke korai előfordulásának a kockázata, a morbiditás és a 30 napos mortalitás (927, 951, 952). A posztoperatív PF-epizódoktól szenvedő betegeknél hosszú távon kétszeresére nő a kardiovaszkuláris mortalitás és jelentősen nő a későbbi PF, valamint az iszkémiás stroke kialakulásának a kockázata azokhoz a betegekhez képest, akik sinusritmusban maradnak a műtét után (952–958). A hazabocsátás idején orális antikoagulálásban részesült betegeknél alacsonyabb volt a posztoperatív PF hosszú távú mortalitása (959), kontrollált vizsgálatokat azonban nem végeztek ezzel kapcsolatban. Jó minőségű adatokból meg lehetne állapítani, hogy a hosszú távú antikoagulálással megelőzhető-e a stroke kialakulása a magas stroke-kockázattal rendelekező, posztoperatív PF-ben szenvedő betegeknél (368, 386), illetve hogy a rövid (pl. <48 óra) posztoperatív PF-epizódok ugyanolyan mértékű kockázatot hordoznak-e, mint a tartósak (960). Posztoperatív PF esetén az orális antikoagulálás indikálásánál és indításánál figyelembe kell venni a posztoperatív vérzési kockázatot.
13.5.3 Ritmuskontroll-terápia posztoperatív pitvarfibrillációban
A hemodinamikailag instabil állapotú betegeknél kardioverzió és antiaritmiás gyógyszerek alkalmazása jöhet szóba. Az amiodaron és a vernakalant hatékonyan váltották át a posztoperatív PF-t sinusritmusba (603, 950, 961). Egy nemrégiben közzétett, közepes méretű, randomizált vizsgálatban posztoperatív PF-ben szenvedő betegeknek adtak amiodaront (ritmuskontroll-terápiaként) vagy frekvenciakontroll-terápiát. A kórházi felvételek számát tekintve a 60 napos utánkövetési idő alatt nem volt különbség a két csoport között (962). Ez megfelel annak az elvárásnak, miszerint a ritmuskontroll-terápia célja a PF-okozta tünetek enyhítése posztoperatív PF-ben. Az aszimptómás betegeknél, illetve azoknál, akik együtt tudnak élni a tünetekkel, indokolt lehet a frekvenciakontroll vagy az antikoaguláns védelemben végzett halasztott kardioverzió.
13.6 Pitvari aritmiák kongenitális szívbetegségben szenvedő felnőtteknél
A kongenitális szívhibák miatt végzett korrekciós műtétek után jóval később gyakran – a kongenitális szívhibával élő felnőttek (GUCH-betegek) 15-40%-ánál – fordulnak elő pitvari aritmiák (PF, pitvari flutter, pitvari tachycardiák). Gyakran szívelégtelenség, syncope, tromboembóliás események és hirtelen szívhalál is társul mellé (963–967). A tünetek hátterében összetett patofiziológiai folyamatok állnak: hipertrófia, fibrosis, hypoxia, krónikus hemodinamikai túlterhelés, műtéti hegek és varratok megléte. Mindemellett, a kongenitális szívbetegséghez társulva az ingerületvezetési rendszer primer anomáliái pitvari és kamrai reentry tachycardiát, ingerületvezetési blokkot, vagy sinuscsomó-diszfunkciót okozhatnak (963). Macro-reentry pitvari tachycardia vagy atípusos pitvari flutter jelentkezhet szinte báramelyik olyan szívműtét után, amelyek során atriotomiát végeznek vagy varratokat helyeznek be a pitvar falába.
13.6.1 A pitvari aritmiák ellátásának általános szempontjai kongenitális szívbetegségben szenvedő felnőtteknél
Kongenitális szívhibával élő pitvarfibrilláló felnőtteknél a hosszú távú antikoagulálás mérlegelésénél figyelembe kell venni az ismert stroke-kockázati tényezőket. Azoknál a pitvari aritmiában szenvedő GUCH-betegeknél is indokolt antikoagulálás bevezetése, akiknél intrakardiális korrekciós műtét történt, cianózis áll fenn, Fontan-műtéten estek át vagy szisztémás jobb kamrával rendelkeznek (968). Ezeknél a betegeknél béta-blokkolót, verapamilt, diltiazemet és digitáliszt lehet alkalmazni. Ügyelni kell rá, hogy ne okozzunk bradycardiát és hipotenziót. A Fontan-műtéten átesett betegeknél jelentkező aritmiák közel fele kivédhető nátriumcsatorna-gátló szerek adásával (969). Az amiodaron még hatékonyabb, azonban hosszú távú alkalmazása mellett gyakoriak az extrakardiális mellékhatások ennél a relatíve fiatal betegpopulációnál. A PF miatt kardiovertált GUCH-betegeknél gyakori az intrakardiális thrombusképződés, de nemcsak náluk, hanem a pitvari tachycardiában vagy pitvari flutterben szenvedő betegeknél is (970). Éppen ezért a tervezett kardioverziót megelőzően mind a TOE, mind pedig a több hétig tartó antikoagulálás mérlegelendő (964). A pitvari aritmiákban szenvedő szimptómás GUCH-betegeknél jó választási lehetőség lehet a radiofrekvenciás abláció, kiváltképp pitvari flutter és más macro-reentry tachycardiák esetén. A beavatkozásokat megfelelő tapasztalattal rendelkező centrumokban kell elvégezni PF-ellátásában jártas szakemberekből álló teameknek.
13.6.2 Pitvari tachyaritmiák és pitvari szeptumdefektusok
A nem operált pitvari szeptumdefektusok 14-22%-ában – főként az idősebb betegeknél (971) – fordul elő pitvari flutter vagy PF, amely szívelégtelenség kialakulásához vezethet (972). A korai korrekciós műtét csökkentheti, de meg nem szűnteti a PF kialakulásának kockázatát (973). A biatrialis volumentúlterhelés (974), a pulmonalis hipertenzió és valószínűleg a pitvari varratok aritmogén hatása mind hozzájárulhat ezeknek az aritmiáknak a kialakulásához (976). Az antikoagulálás szükségességéről a meglévő stroke-kockázati tényezők figyelembevételével kell dönteni. Azoknál a PF-betegeknél, akiknek az anamnézisében szerepel korábbi paroxizmális vagy perzisztens PF, megfontolandó a PF sebészi megoldása a defektus műtéti zárásával egy ülésben, vagy a katéterabláció a pitvari szeptumdefektus intervenciós zárásával egyidőben. A késői keletű aritmiák katéterablációja hatékony megoldásnak bizonyult egy kisebb méretű betegcsoportnál a pitvari szeptumdefektus műtéti zárása után (977).

13.6.3 Pitvari aritmiák Fontan-műtét után
A Fontan-keringéssel élő betegek akár 40%-ánál is jelentkezhetnek pitvari aritmiák pitvari flutter, primer pitvari tachycardia, PF, akcelerált junkcionális ritmus vagy junkcionális tachycardia (978) sinuscsomó-diszfunkcióval társulva vagy önállóan (979). Hosszú távon nagyobb az esélye a pitvari aritmiák kialakulásának azoknál a betegeknél, akiknél atriopulmonalis anastomosis áll fenn (valószínűleg a nagyobb pitvari volumen- és nyomásterhelés miatt), illetve azoknál, akiknél korai posztoperatív pitvari aritmiák jelentkeznek (980). A pitvari aritmia első jele lehet az atriopulmonalis anastomosis elzáródásának, egy olyan szövődménynek, amelyet fel kell ismerni. A pitvari aritmiában szenvedő Fontan-betegeknél gyakori a jobb pitvari thrombusképződés, amely orális antikoagulálás bevezetését teszi szükségessé (981). A vena cava inferior és a pulmonalis rendszer anastomosisának (teljes cavopulmonalis anastomosisnak) műtéti kialakításával egy ülésben végzett aritmiaműtét egyes betegeknél javíthatja a szívelégtelenség tüneteit és csökkentheti az aritmiák rekurrenciáját (969, 982), ismételt műtétet követően az első pár éven belül csökken a klinikai tünetekkel járó pitvari aritmiák rekurrenciája (983–985). Egyes Fontan-betegeknél sikeresen végeztek katéterablációt a pitvari aritmia miatt (986).

13.6.4 Pitvari aritmiák a Fallot-tetralógia korrekciós műtéte után
A Fallot-tetralógia korrekciós műtéte után a betegek közel egyharmadánál jelentkeznek pitvari aritmiák, mint az intraatrialis reentry tachycardia, a fokális pitvari tachycardia vagy a PF (987). A cavotricuspidalis isthmus területét és a jobb pitvari műtéti hegek területét involváló áramkörök felelősek lehetnek a pitvari aritmiák kialakulásáért.
13.7 A pitvari flutter ellátása
Pitvari flutter esetén a kezelési célok hasonlóak a PF-ben megjelöltekhez (922). A rendelkezésre álló evidenciák alapján a pitvari flutterben szenvedő betegek stroke-kockázata nem tér el jelentősen a PF-ben szenvedőkétől (827). Továbbá sok betegnél a pitvari flutter PF-be vált át (993–995). Éppen ezért a pitvari flutterben szenvedő betegeket ugyanúgy antikoagulálni kell, mint a PF-betegeket. Frekvenciakontroll céljára ugyanazokat a szereket lehet alkalmazni flutterben, mint PF-ben, a kivitelezése azonban gyakran nehezebb. A flecainid, a propafenon, a dofetilid és az intravénás ibutilid hasznos szerek a pitvari flutter kardioverziójára. Egy frekvenciakontrollra alkalmas szerrel kombinálva kell őket adni, hogy elkerüljük a lassú flutter hullámok 1:1 arányú átvezetődését a kamrákra. Az ibutilid hatékonyabb a pitvari flutter konvenrziójára, mint a PF-ére, míg a vernakalant kevésbé hatékony a típusos flutter konverziójára (996, 997). A pitvari flutter elektromos kardioverziója kisebb energiával (50–100 J) végezhető, mint a PF-é (998, 999). A pitvari overdrive pacing pacemaker elektródán, valamint endokardiális vagy transoesophagealis katéteren keresztül sinusritmusba válthatja át a pitvari fluttert (1000, 1001). Az antikoagulálást és a TOE-t a kardioverzió vagy az overdrive pacing előtti és utáni időszakban a PF-nél leírtakhoz hasonlóan ajánlott végezni. Az isthmus-dependens jobb pitvari flutter (akár a gyakori antihorális, akár a kevésbé gyakori horális) miatt végzett cavotricuspidalis isthmus abláció 90-95%-os sikeraránnyal képes helyreállítani és fenntartani a sinusritmust (1002). Egyes betegeknél csökkentheti a PF rekurrenciáját is (1003, 1004) és segíthet megelőzni a hospitalizációt (1004, 1005). Az isthmus-abláció ugyanolyan biztonságos, viszont hatékonyabb, mint a gyógyszeres antiaritmiás terápia, ezért rekurrens pitvari flutter esetén ez az ajánlott eljárás (585–587, 713). A bal pitvari macro-reentry tachycardia katéterablációja sokkal összetettebb, alacsonyabb a siker aránya és magasabb a rekurrenciája (1006, 1007).
14. A betegek bevonása a terápiába, a betegedukáció és az önellátás
14.1 Betegközpontú ellátás
Az önrendelkezési jogát gyakorló, tájékozott beteg alkalmasabb a hosszú távú terápiára. A krónikus betegségek – mint a PF – hosszú távú kezelése szempontjából sokkal szerencsésebb, ha a beteg tájékozott és tisztában van a saját felelősségével az ellátás sikerét illetően (328). A közös döntéshozatallal (747) és a betegközpontú ellátásszervezéssel biztosítható a betegek terápiahűsége, felelősségvállalása, respektálhatóak az egyéni igények, szükségletek és értékek (ld. 7.2 fejezet) (326, 1008, 1009). Az aktív szereppel felruházott betegeknek jobbak az egészségi mutatóik és az ellátással kapcsolatos tapasztalataik, ezen felül az elköteleződés önmagában egy intermedier kimenetelnek számít (1010).
14.2 Integrált betegedukáció
A betegedukáció nélkülözhetetlen a tájékozott és motivált beteg, valamint a betegközpontú gondozás kialakításához. A betegek azonban gyakran alulinformáltak a PF-fel kapcsolatban, még azok is, akik szóbeli és írásbeli tájékoztatást is kaptak a betegségükről (32, 1011, 1012). Ez is azt jelzi, hogy szükség van a szervezett betegedukáció fejlesztésére. Számos betegtájékoztató eszköz létezik, amelyek kiemelten foglalkoznak az orális antikoagulálással (1013–1016). Ez a munkacsoport kifejlesztett a PF-betegek számára egy mobiltelefonos applikációt, amely a betegek tájékoztatását és a betegedukációt szolgálja. A betegek PF-fel kapcsolatos észleléseinek és magatartásának a megértése javíthatja a PF-ellátás színvonalát és az ahhoz kapcsolódó mutatókat (1017). Ennek része a személyreszabott betegedukáció, amely nagy figyelmet szentel a betegségnek, a tünetek felismerésének, a terápiának, a PF befolyásolható kockázati tényezőinek és az önellátás körébe tartozó tevékenységeknek (1018, 1019).
14.3 Az önellátás és a közös döntéshozatal
Az önellátás körébe elsődlegesen az állapot kezeléséhez szükséges teendők tartoznak, mint a terápiahűség egy terápiás rezsimhez, vagy a változásra képes hozzáállás (pl. a dohányzás abbahagyása vagy a fogyás) (1020). Ehhez a betegnek meg kell értenie az egyes terápiás lehetőségeket és célokat (350). Egy multidiszciplináris teamen belül az egészségügyi szakemberek tudják irányítani ezt az interaktív folyamatot, amelyben a kommunikációnak, a bizalomnak és a kölcsönös tiszteletnek nagy szerepe van a beteg elköteleződésében (1021). A közös döntéshozatal rutin része kell legyen a döntéshozatali folyamatnak (747), amelyet – ahol ez lehetséges –, a döntéstámogató eszközök segítenek (1022). Ma már olyan gondozási modellek állnak rendelkezésre, amelyeknek szerves részét képezi a betegedukáció, a beteg elköteleződése, valamint a közös döntéshozatal (1023), és amelyek különösen nagy jelentőséggel bírnak a PF ellátásának folyamatában.
15. Hiányzó evidenciák
A PF-ellátás bizonyos aspektusainak helyességét számos, megfelelő statisztikai erővel rendelkező randomizált kontrollált vizsgálatból származó, kiváló evidencia támasztja alá (pl. orális antikoagulálás). A PF-ellátásának vannak olyan területei, mint a ritmuskontroll-terápia, az integrált PF-ellátás és az életmódváltás, amelyekkel kapcsolatban jelenleg is folyamatosan születnek a szükséges új evidenciák, míg más területeken, mint például a frekvenciakontroll, hiányoznak a későbbiek során megfogalmazandó ajánlásokhoz szükséges evidenciák. Az alábbiakban összegyűjtöttük azokat a területeket, amelyek még további kutatásra várnak.
15.1 Az egészségi állapotot befolyásoló
legfontosabb tényezők, amelyek pitvarfibrillációhoz vezethetnek
Különböző embereknél különböző okok miatt alakul ki PF. A PF főbb kiváltó okainak (pl. elektrofiziológiai mechanizmusok) azonosításához további vizsgálatokra van szükség (176, 1024), amelyek során figyelembe kell venni a jelentősebb társbetegségeket is, és jellemezni a különböző, patofiziológiai szempontból eltérő PF típusokban a terápiára adott választ.
15.2 Minden pitvarfibrillációt kezelni kell?
A technológiai fejlődés lehetővé tette, hogy egy beteg által aktivált EKG-rögzítő eszköz segítségével, okostelefonok, vagy más technológiai fejlesztések segítségével ki tudjuk szűrni a szabálytalan pulzushullámokat. Ezek az eszközön nagyon hasznosak lehetnek a néma PF felfedezésében (157). Megfelelő statisztikai erejű vizsgálatokra van szükség az előbb említett technológiák diagnosztikai pontosságának felmérésére és diagnosztikai hasznának megítélésére a különböző betegpopulációkban, a pitvari aritmiák stoke-kockázattal járó legrövidebb időtartamának és mintázatának felmérésére, valamint az EKG segítségével történő szűrés kimenetelekre gyakorolt hatékonyságának a megítéléséhez.
15.3 Az antikoagulálás szükségessége pitvari magasfrekvenciájú epizódok (AHRE) mellett
Az orális antikoagulálás eredményességével kapcsolatos összes adat EKG segítségével diagnosztizált PF-betegektől származik. A technológiai fejlődés lehetővé tette az AHRE-k azonnali detektálását az implantálható eszközzel és pitvari elvezetéssel rendelkező betegeknél. Ezeknél a betegeknél fokozott a stroke-kockázat, nem ismert azonban, hogy az orális antikoagulálásból származik-e előnyük. Folyamatban vannak olyan kontrollált vizsgálatok, amelyek az AHRE-val diagnosztizált betegek orális antikoagulálását értékelik és evidenciákkal fognak szolgálni az alvadásgátló terápia ezen betegek számára legelőnyösebb módjáról.
15.4 A stroke-kockázat alakulása egyes betegcsoportoknál
Többféle PF-betegalcsoportot (pl. az egy stroke-kockázati tényezővel rendelekező betegek, nem kaukázusi rasszhoz tartozó betegek stb.) kellene megvizsgálni ahhoz, hogy alaposabban meg lehessen ismerni az egyes csoportok PF-kockázatát, stroke-kockázatát és más PF-szövődményre vonatkozó kockázatát. A zavaró tényezők (pl. a kardiovaszkuláris társbetegségek eltérő kezelése) magyarázhatják a PF incidenciájával, prevalenciájával és szövődményeivel kapcsolatban közölt adatok variabilitását. Ugyanez igaz PF-ben a nemek hatására (47).
15.5 Antikoagulálás súlyos fokú krónikus veseelégtelenségben
Eddig még nem vizsgálták a NOAC-ok alkalmazását 30 ml/perc alatti kreatinin-clearance értékek mellett, illetve nagyon kevés evidencia igazolja az orális antikoagulánsok eredményességét hemodializált vagy más vesepótló kezelésben részesülő betegeknél. Az optimális terápia kialakításához szükség lenne olyan vizsgálatokra, amelyek súlyos fokú CKD-ban szenvedő betegeknél tanulmányozzák az orális antikoagulálás hatását, ahol magas stroke- és vérzéskockázattal kell számolni.
15.6 Bal pitvari fülcsezárás stroke-prevencióként
A bal pitvari fülcsezárásra használható intervenciós záróeszközök alkalmazásának leggyakoribb indikációja a gyakorlatban a magas vérzéskockázat, vagy ritkábban az orális antikoagulálás kontraindikációjának fennállása (459). Sajnos ezekben a betegpopulációkban eddig még nem végeztek vizsgálatokat intervenciós záróeszközökkel. Sőt, eddig még nem végeztek összehasonlítást a fülcsezáró eszközök használata és a vérzéskockázatnak kitett betegek NOAC-kal történő antikoagulálása, vagy a torakoszkópiás fülcseklippelés között sem. Egyértelműen szükség lenne olyan jól megtervezett és megfelelő statisztikai erővel bíró vizsgálatokra, amelyek meghatároznák a fülcsezáró eszközök és a NOAC-ok klinikai szerepét az antikoagulálás tekintetében relatív vagy abszolút kontraindikációval rendelkező betegeknél és/vagy azoknál a betegeknél, akik az antikoaguláns terápia mellett szenvednek el iszkémiás stroke-ot.
15.7 Antikoagulálás pitvarfibrilláló betegeknél vérzéses eseményt vagy stroke-ot követően
A PF miatt antikoagulált betegek legalább 2%-ánál fordul elő évente egy súlyos vérzéses esemény. A megfigyeléses vizsgálatokból az derült ki, hogy még egy intracerebrális vérzéses epizód után is újra lehet indítani az OAC-terápiát (460, 484). Sürgősen szükség lenne olyan kontrollált vizsgálatokra, amelyek a különféle alvadásgátló és stroke-prevenciós módszereket értékelnék és evidenciákkal szolgálnának azoknak a vérzéses eseményt elszenvedett betegeknek a legoptimálisabb kezelési módjáról, akiknél általában felfüggesztésre kerülne az OAC-ok adása. Néhány vizsgálat (pl. APACHE-AF [Apixaban versus Antiplatelet drugs or no antithrombotic drugs after anticoagulation-associated intraCerebral HaEmorrhage in patients with Atrial Fibrillation]) (1025) már folyamatban van, de még további, megfelelő statisztikai erejű vizsgálatokra lenne szükség. Ehhez hasonlóan, a stroke vagy az intracranialis vérzés után (újra)indított OAC-terápia stroke-prevenciós hatásának és a vele járó vérzéskockáznak a megítéléséhez prospektív adatokra lenne szükség.
15.8 Antikoagulálás és a halasztott kardioverzió optimális időpontjának meghatározása
A retrospektív adatok alapján összeállított korábbi irányelvek „gold standardként” a 48 órás biztonságos időablakot jelölték meg, amelyen belül még védelem nélkül biztonsággal elvégezhető a kardioverzió az újonnan felismert PF-ben. Az újabb evidenciák azonban már azt mutatják, hogy a 24 órán belül, vagy még a 12 órán belül kialakult újonnan felismert PF esetén is biztonságosabb alvagásgátlást alkalmazni a kardioverzió előtt (642, 647, 1026–1028). További kutatások szükségesek a biztonságos időablak pontosabb meghatározásához ilyen esetben.
15.9 A stroke és a tranziens iszkémiás attak közös oka pitvarfibrilláló betegeknél
Prospektív randomizált, kontrollált vizsgálatok szerint a tüneteket okozó, szignifikáns mértékű carotis interna szűkülettel élő betegeknél a carotis endarterectomia jobbnak bizonyult a stentbeültetésnél (1029). Az endarterectomia minimálisra csökkenti az orális antikoagulánsból és trombocitaaggregáció-gátlóból álló kombinált terápia szükségességét (1030), ezáltal csökkenthető a PF-betegek vérzési kockázata. Csak kevés ilyen vizsgálatban vettek részt PF-betegek. Egy nagy megfigyeléses vizsgálatban a kórházi halálozásból, a beavatkozás utáni stroke-ból és a kardiális szövődményekből összetevődő arányszám magasabb volt a carotis stentbeültetésen átesett PF-betegeknél (457/7668 beteg; 6,0%), mint az endarterectomián átesetteknél (4438/51320 beteg; 8,6%; p<0,0001) (1031). Annak ellenére, hogy korrigáltak a kiindulási kockázattal, ezekből az adatokból megmondható, hogy melyik vizsgálatot, melyik betegtípusnál végzik. A carotis-betegségben szenvedő PF-betegek optimális kezelési stratégiájának meghatározásához további randomizált megerősítő vizsgálatokra van szükség.
15.10 Antikoagulálás biológiai műbillentyű mellett (valamint transzkatéteres aorta-műbillentyű-implantációt követően) és valvuláris szívbetegség speciális formáiban
A biológiai műbillentyű-beültétés után – beleértve a katéteres beavatkozást is –, az első pár hónapban nem ismert az optimális antitrombotikus terápia. A kezelés alapját a K-vitamin-antagonisták jelentik a korai posztoperatív időszakban, de valószínűleg a NOAC-ok is hasonló védelmet nyújtanak. Sok centrumban a nem pitvarfibrilláló betegeknél csak trombocitaaggregáció-gátlókat alkalmaznak. A ROCKET-AF-vizsgálat alcsoportelemzése (1032) és a Loire Valley AF project (1033) eredményei alapján mérsékelt fokú aorta-stenosisban a NOAC-ok ugyanolyan hatékonyak, mint a K-vitamin-antagonisták. További vizsgálatok eredményei segíthetnének megerősíteni ezeket a megfigyeléseket (1034). Eddig még nem vizsgálták, bár szükséges lenne a NOAC-ok biztonságosságának és hatékonyságának a megítélése reumás eredetű mitralis billentyűbetegségben.
15.11 Antikoagulálás „sikeres” katéterabláció után
A PF hosszú távú rekurrencia-arányára tekintettel ez a Munkacsoport azt javasolja, hogy PF-betegeknél a „sikeres” katéterablációt követően is folytassuk az orális antikoagulálást. Mindazonáltal, megfigyeléses adatokból az derül ki, hogy a PF katéterablációján átesett betegeknél kisebb a stroke-kockázat, mint a többi PF-betegnél. Általánosabban a folyamatban lévő EAST – AFNET 4-vizsgálatból fog kiderülni, hogy a ritmuskontroll-terápia képes-e csökkenteni a stroke-kockázatot az antikoagulálásban részesülő PF-betegeknél. Emellett meg lenne a helye egy olyan kontrollált vizsgálatnak, amely időközönként mérlegeli az orális antikoagulálás befejezését a „sikeres” katéterablációt követően.
15.12 A frekvenciakontrollt célzó gyógyszerek összehasonlítása
Habár a PF-betegek gyakran részesülnek frekvenciakontroll-terápiában, hiányoznak az egyes frekvenciakontroll-terápiákat egymással összehasonlító megbízható adatok. Az ilyen vizsgálatok többsége kisméretű, nem kontrollált és rövid utánkövetési időszakot ölel fel. Már folyamatban van néhány vizsgálat (pl. RATE-AF [Rate Control Therapy Evaluation in Permanent Atrial Fibrillation]) (559), amely az egyes frekvenciakontroll szerek lehetséges előnyeit kutatja. Olyan jellegzetességeket vagy biomarkereket keresnek, amelyek segíthetnek személyre szabni a frekvenciakontroll alkalmazását, és betegcsoportokra vonatkozóan meghatározni a specifikus szerek mellékhatásprofilját.
15.13 Katéterabláció perzisztens és tartósan perzisztens pitvarfibrillációban
Számos új keletű randomizált vizsgálat támogatja a katéteres vagy a sebészi abláció elvégzését perzisztens vagy tartósan perzisztens PF-betegeknél (1042), mégis szükség lenne további, megfelelő elemszámú randomizált vizsgálatokból származó evidenciákra.
15.14 Az ismételt katéterabláció optimális technikája
A PF miatt végzett katéterabláció legfontosabb célpontjának a PVI tűnik. Habár a kiegészítő ablációs technikáknak már egész tárházát ismertették, kérdéses, hogy van-e többlethasznuk az első alkalommal végzett katéterablációnál, illetve perzisztens PF-ben (735, 1042). Sok betegnél több katéterabláció elvégzésére is szükség van, amelyek gyakran a helyileg megjelölt, vagy az operátor által meghatározott protokollok szerint zajlanak, egyértelmű evidenciák nem támasztják alá az ablációs célpont vagy az intervenció típusának megválasztását. Egyértelműen szükség van olyan vizsgálatokra, amelyek segítenek kiválasztani az intervenció legoptimálisabb módját azoknál a betegeknél, akiknél szükség van egy második ablációs beavatkozásra is.
15.15 A sinusritmus fenntartására irányuló kombinált terápia
A kezdetben sikeres katéterabláció utánkövetési időszaka alatt – még a nagy tapasztalattal rendelkező centrumokban végzett ablációk után is –, sok beteg észleli szimptómás PF-epizódok visszatérését. Ezeket a betegeket gyakran antiaritmiás terápiában részesítik. Meglepően kevés adat áll rendelkezésre a katéterablációt követően alkalmazható különböző ritmuskontrollt célzó beavatkozásokról rekurrens PF-ben szenvedő betegeknél. Észszerű és kivitelezhető is lenne az ilyen vizsgálatok elvégzése.
15.16 Lehet prognosztikai szempontból előnye a ritmuskontroll-terápiának pitvarfibrilláló betegeknél?
A ritmuskontroll-terápia fejlődése (katéterabláció, új antiaritmiás szerek), valamint a hosszú távú megfigyeléses elemzések arra utalnak, hogy a ritmuskontroll-terápia prognosztikai szempontból előnyös lehet az antikoagulált PF-betegnél. Folyamatban lévő vizsgálatok, mint a CABANA és az EAST – AFNET 4 elsőként fognak választ adni erre a fontos kérdésre, de a sebészi ablációs technikákkal kapcsolatosan is szükség lenne további adatokra.
15.17 Torakoszkópiás beavatkozás „stand-alone” pitvarfibrillációban
A minimálisan invazív technikával végzett epikardiális ablációt már egy évtizeddel ezelőtt is alkalmazták a „stand-alone” PF kezelésére (1035). A beavatkozást azóta kizárólag torakoszkópiás technikával végzik (1036), a maze-bemetszéseket pedig a teljes bal pitvarra kiterjesztették (822). Sürgető szükség lenne a standardizált eljárást vizsgáló randomizált tanulmányokra, amelyek egyértelműen meghatároznák a torakoszkópiás módszerrel végzett PF-abláció előnyeit és kockázatait, valamint segítenék a Szív Munkacsoport döntéseit.
15.18 A bal pitvari fülcse sebészi eltávolítása
A bal pitvari fülcse eltávolítását évtizedek óta végzik a szívsebészek, azonban jelenleg nincsen olyan prospektív, randomizált vizsgálat, amelyek az iszkémiás stroke gyakoriságát értékelné a bal pitvari fülcse eltávolítása mellett vagy annak hiányában. A LAAOS (Left Atrial Appendage Occlusion Study) III randomizált vizsgálatba jelenleg is folyik a szívműtétre váró PF-betegek toborzása, hogy egy részüknél együlésben elvégezzék fülcsezárást is (467). A korai pozitív megfigyeléses adatok után további adatok szükségesek a torakoszkópiás fülcseeltávolítás biztonságosságának és hatékonyságának az igazolásához (1037).
15.19 A pitvarfibrilláció kiegészítő sebészeti megoldása
Szükség van olyan megfelelő elemszámmal rendelkező vizsgálatokra, amelyekben szisztematikus utánkövetést, egységes metszésvonalakat és enegiaforrásokat alkalmazva értékelik a párhuzamosan végzett PF miatti műtét előnyeit és kockázatait szimptómás PF-betegeknél. Hamarosan közlésre kerül egy hosszú távú utánkövetéses RCT a nem egységes metszésvonalakról (1038). Az ilyen vizsgálati eredmények segíteni fognak a Szív Munkacsoportnak a gyógyszeres beavatkozásoktól a sebészi intervenciókig terjedő teljes repertoárból kiválasztani az egyénileg legoptimálisabb PF-terápiát.
16. Az Útmutató szerint követendő és kerülendő eljárások


17. Rövid összefoglaló javaslatok a pitvarfibrilláló betegek ellátásához

18. Interneten elérhető kiegészítés
Három kiegészítő ábra és két kiegészítő táblázat érhető el a 2016-os ESC PF Útmutatóhoz készült webes felületen keresztül, amely hozzáférhető a European Heart Journal honlapján online formában, valamint az ESC honlapján (www.escardio.org/guidelines).
19. Függelék
A gyakorlatra vonatkozó irányelvekért felelős ESC Bizottság (CPG) tagjai: Jose Luis Zamorano (elnök) (Spanyolország), Victor Aboyans (Franciaország), Stephan Achenbach (Németország), Stefan Agewall (Norvégia), Lina Badimon (Spanyolország), Gonzalo Barón-Esquivias (Spanyolország), Helmut Baumgartner (Németország), Jeroen J. Bax (Hollandia), Héctor Bueno (Spanyolország), Scipione Carerj (Olaszország), Veronica Dean (Franciaország), Çetin Erol (Törökország), Donna Fitzsimons (Egyesült Királyság), Oliver Gaemperli (Svájc), Paulus Kirchhof (Egyesült Királyság/Németország), Philippe Kolh (Belgium), Patrizio Lancellotti (Belgium), Gregory Y. H. Lip (Egyesült Királyság), Petros Nihoyannopoulos (Egyesült Királyság), Massimo F. Piepoli (Olaszország), Piotr Ponikowski (Lengyelország), Marco Roffi (Svájc), Adam Torbicki (Lengyelország), António Vaz Carneiro (Portugália), Stephan Windecker (Svájc).
Az ESC Nemzeti Kardiológiai Társaságai aktívan résztvettek az ESC és az EACTS együttműködésében elkészült 2016. évi Útmutató a pitvarfibrilláció ellátásához címmel összeállított irányelvek szakmai felülvizsgálatában:
Örményország: Örmény Kardiológusok Társasága, Hamlet G. Hayrapetyan; Ausztria: Osztrák Kardiológusok Társasága, Franz Xaver Roithinger; Azerbajdzsán: Azerbajdzsáni Kardiológusok Társasága, Farid Aliyev; Fehéroroszország: Fehéroroszországi Kardiológusok Tudományos Társasága, Alexandr Chasnoits; Belgium: Belga Kardiológusok Társasága, Georges H. Mairesse; Bosznia-Hercegovina: Bosznia-Hercegovinai Kardiológusok Társasága, Daniela Loncar Matičević; Bulgária: Bolgár Kardiológusok Társasága, Tchavdar Shalganov; Horvátország: Horvát Kardiológusok Társasága, Boško Skorić; Ciprus: Ciprusi Kardiológusok Társasága, Loizos Antoniades; Csehország: Cseh Kardiológusok Társasága, Milos Taborsky; Dánia: Dán Kardiológusok Társasága, Steen Pehrson; Egyiptom: Egyiptomi Kardiológusok Társasága, Said Khaled; Észtország: Észt Kardiológusok Társasága, Priit Kampus; Finnország: Finn Kardiológusok Társasága, Antti Hedman; Macedónia Volt Jugoszláv Köztársaság: Macedón Kardiológusok Társasága, Lidija Poposka; Franciaország: Francia Kardiológusok Társasága, Jean-Yves Le Heuzey; Grúzia: Grúz Kardiológusok Társasága, Kakhaber Estadashvili; Németország: Német Kardiológusok Társasága, Dietmar Bänsch; Magyarország: Magyar Kardiológusok Társasága, Csanádi Zoltán; Írország: Ír Kardiológusok Társasága, David Keane; Izrael: Izraeli Kardiológus Társaság, Roy Beinart; Olaszország: Olasz Kardiológusok Szövetsége, Francesco Romeo; Kazahsztán: Kazahsztáni Kardiológusok Társasága, Kulzida Koshumbayeva; Koszovó: Koszovói Kardiológusok Társasága, Gani Bajraktari; Kirgizisztán: Kirgíz Kardiológusok Társasága, Aibek Mirrakhimov, Lettország: Lett Kardiológusok Társasága, Oskars Kalejs; Libanon: Libanoni Kardiológusok Társasága, Samer Nasr; Litvánia: Litván Kardiológusok Társasága, Germanas Marinskis; Luxemburg: Luxemburgi Kardiológusok Társasága, Carlo Dimmer; Málta: Máltai Kardiológus Társaság, Mark Sammut; Moldova: Moldovai Kardiológusok Társasága, Aurel Grosu; Marokkó: Marokkói Kardiológusok Társasága, Salima Abdelali; Hollandia: E. W. Hemels; Norvégia: Norvég Kardiológusok Társasága, Ole-Gunnar Anfinsen; Lengyelország: Lengyel Kardiológus Társaság, Beata Średniawa; Portugália: Portugál Kardiológusok Társasága, Pedro Adragao; Románia: Román Kardiológusok Társasága, Gheorghe-Andrei Dan; Oroszországi Föderáció: Orosz Kardiológusok Társasága, Evgeny N. Mikhaylov; San Marino: San Marinói Kardiológusok Társasága, Marco Zavatta; Szerbia: Szerb Kardiológiai Társaság, Tatjana Potpara; Szlovákia: Szlovák Kardiológusok Társasága, Peter Hlivak Szlovénia: Szlovén Kardiológusok Társasága, Igor Zupan; Spanyolország: Spanyol Kardiológusok Társasága, Angel Arenal; Svédország: Svéd Kardiológusok Társasága, Frieder Braunschweig; Svájc: Svájci Kardiológusok Társasága, Dipen Shah; Tunézia: Tunéziai Kardiológusok és Kardiovaszkuláris Sebészek Társasága, Ag Sana Ouali; Törökország: Török Kardiológusok Társasága, Mesut Demir; Ukrajna: Ukrán Kardiológus Társaság, Oleg Sychov; Egyesült Királyság: Britt Kardiovaszkuláris Társaság, Ed Duncan.
Irodalom
1. Chugh SS, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation 2014; 129: 837–847.
2. Colilla S, et al. Estimates of current and future incidence and prevalence of atrial fibrillation in the U.S. adult population. Am J Cardiol 2013; 112: 1142–1147.
3. Heeringa J, van der Kuip DA, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27: 949–953.
4. Lloyd-Jones DM, et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004; 110: 1042–1046.
5. Go AS, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285: 2370–2375.
6. Krijthe BP, et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J 2013; 34: 2746–2751.
7. Zoni-Berisso M, et al. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014; 6: 213–220.
8. Bjorck S, et al. Atrial fibrillation, stroke risk, and warfarin therapy revisited: a population-based study. Stroke 2013; 44: 3103–3108.
9. Haim M, et al. Prospective national study of the prevalence, incidence, management and outcome of a large contemporary cohort of patients with incident non-valvular atrial fibrillation. J Am Heart Assoc 2015; 4: e001486.
10. McManus DD, et al. An update on the prognosis of patients with atrial fibrillation. Circulation 2012; 126: e143–146.
11. Ball J, et al. Atrial fibrillation: profile and burden of an evolving epidemic in the 21st century. Int J Cardiol 2013; 167: 1807–1824.
12. Kannel WB, et al. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates. Am J Cardiol 1998; 82: 2N–9N.
13. Nguyen TN, et al. Review of epidemiology and management of atrial fibrillation in developing countries. Int J Cardiol 2013; 167: 2412–2420.
14. Oldgren J, et al. RE-LY Atrial Fibrillation Registry Investigators. Variations in cause and management of atrial fibrillation in a prospective registry of 15,400 emergency department patients in 46 countries: the RE-LY Atrial Fibrillation Registry. Circulation 2014; 129: 1568–1576.
15. Chiang CE, et al. Distribution and risk profile of paroxysmal, persistent, and permanent atrial fibrillation in routine clinical practice: insight from the real life global survey evaluating patients with atrial fibrillation international registry. Circ Arrhythm Electrophysiol 2012; 5: 632–639.
16. Wang TJ, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003; 107: 2920–2925.
17. Kishore A, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke 2014; 45: 520–526.
18. Sanna T, et al. CRYSTAL AF Investigators. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370: 2478–2486.
19. Schnabel RB, et al. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study. Lancet 2015; 386: 154–162.
20. Benjamin EJ, et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998; 98: 946–952.
21. Stewart S, et al. A population-based study of the longterm risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/ Paisley study. Am J Med 2002; 113: 359–364.
22. Andersson T, et al. All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term casecontrol study. Eur Heart J 2013; 34: 1061–1067.
23. Kotecha D, et al. Beta-Blockers in Heart Failure Collaborative Group. Efficacy of beta blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet 2014; 384: 2235–2243.
24. Wolf PA, et al. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22: 983–988.
25. Krahn AD, et al. The natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med 1995; 98: 476–484.
26. Henriksson KM, et al. Comparison of cardiovascular risk factors and survival in patients with ischemic or hemorrhagic stroke. Int J Stroke 2012; 7: 276–281.
27. Grond M, et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke 2013; 44: 3357–3364.
28. Ott A, et al. Atrial fibrillation and dementia in a population-based study. The Rotterdam Study. Stroke 1997; 28: 316–321.
29. Knecht S, et al. Atrial fibrillation in stroke-free patients is associated with memory impairment and hippocampal atrophy. Eur Heart J 2008; 29: 2125–2132.
30. Ball J, et al. Mild cognitive impairment in high-risk patients with chronic atrial fibrillation: a forgotten component of clinical management? Heart 2013; 99: 542–547.
31. Marzona I, et al. Increased risk of cognitive and functional decline in patients with atrial fibrillation: results of the ONTARGET and TRANSCEND studies. CMAJ 2012; 184: E329–336.
32. Thrall G, et al. Quality of life in patients with atrial fibrillation: a systematic review. Am J Med 2006; 119: 448.e1–19.
33. von Eisenhart Rothe A, et al. Depressed mood amplifies heart-related symptoms in persistent and paroxysmal atrial fibrillation patients: a longitudinal analysis—data from the German Competence Network on Atrial Fibrillation. Europace 2015; 17: 1354–1362.
34. Steinberg BA, et al. Drivers of hospitalization for patients with atrial fibrillation: Results from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF). Am Heart J 2014; 167: 735–742.e2.
35. Kirchhof P, et al. Management of patients wtih atrial fibrillation by primary care physicians in Germany: 1-year results of the ATRIUM registry. Clin Cardiol 2014; 37: 277–284.
36. Stewart S, et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the UK. Heart 2004; 90: 286–292.
37. Kim MH, et al. Estimation of total incremental health care costs in patients with atrial fibrillation in the United States. Circ Cardiovasc Qual Outcomes 2011; 4: 313–320.
38. Hart RG, et al. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146: 857–867.
39. Ruff CT, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014; 383: 955–962.
40. Kirchhof P, et al. Improving outcomes in patients with atrial fibrillation: rationale and design of the Early treatment of Atrial fibrillation for Stroke prevention Trial. Am Heart J 2013; 166: 442–448.
41. Al-Khatib SM, et al. Rate- and rhythm-control therapies in patients with atrial fibrillation: a systematic review. Ann Intern Med 2014; 160: 760–773.
42. Lip GY, et al. Prognosis and treatment of atrial fibrillation patients by European cardiologists: one year follow-up of the EURObservational Research Programme-Atrial Fibrillation General Registry Pilot Phase (EORP-AF Pilot registry). Eur Heart J 2014; 35: 3365–3376.
43. Marijon E, et al. RE-LY Investigators. Causes of death and influencing factors in patients with atrial fibrillation: a competing-risk analysis from the randomized evaluation of long-term anticoagulant therapy study. Circulation 2013; 128: 2192–2201.
44. Senoo K, et al. Residual risk of stroke and death in anticoagulated patients according to the type of atrial fibrillation: AMADEUS Trial. Stroke 2015; 46: 2523–2528.
45. Soliman EZ, et al. Atrial fibrillation and the risk of myocardial infarction. JAMA Intern Med 2014; 174: 107–114.
46. Emdin CA, et al. Atrial fibrillation as risk factor for cardiovascular disease and death in women compared with men: systematic review and meta-analysis of cohort studies. BMJ 2016; 532: h7013.
47. Ko D, et al. Atrial fibrillation in women: epidemiology, pathophysiology, presentation, and prognosis. Nat Rev Cardiol 2016; 13: 321–332.
48. Andersson T, et al. Gender-related differences in risk of cardiovascular morbidity and all-cause mortality in patients hospitalized with incident atrial fibrillation without concomitant diseases: A nationwide cohort study of 9519 patients. Int J Cardiol 2014; 177: 91–99.
49. Fang MC, et al. Gender differences in the risk of ischemic stroke and peripheral embolism in atrial fibrillation: the AnTicoagulation and Risk factors In Atrial fibrillation (ATRIA) study. Circulation 2005; 112: 1687–1691.
50. Pancholy SB, et al. Marchlinski FE. Meta-analysis of gender differences in residual stroke risk and major bleeding in patients with nonvalvular atrial fibrillation treated with oral anticoagulants. Am J Cardiol 2014; 113: 485–490.
51. Potpara TS, et al. Gender-related differences in presentation, treatment and long-term outcome in patients with first-diagnosed atrial fibrillation and structurally normal heart: the Belgrade atrial fibrillation study. Int J Cardiol 2012; 161: 39–44.
52. Ball J, et al. Women versus men with chronic atrial fibrillation: insights from the Standard versus Atrial Fibrillation spEcific managemenT studY (SAFETY). PLoS One 2013; 8: e65795.
53. Hughes M, et al. Risk factors for anticoagulation-related bleeding complications in patients with atrial fibrillation: a systematic review. QJM 2007; 100: 599–607.
54. Roten L, et al. Gender differences in patients referred for atrial fibrillation management to a tertiary center. Pacing Clin Electrophysiol 2009; 32: 622–626.
55. Forleo GB, et al. Gender-related differences in catheter ablation of atrial fibrillation. Europace 2007; 9: 613–620.
56. Henry L, et al. Are there gender differences in outcomes after the Cox-Maze procedure for atrial fibrillation? Innovations (Phila) 2013; 8: 190–198.
57. Michelena HI, et al. Gender in atrial fibrillation: Ten years later. Gend Med 2010; 7: 206–217.
58. Fox CS, et al. Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring. JAMA 2004; 291: 2851–2855.
59. Oyen N, et al. Familial aggregation of lone atrial fibrillation in young persons. J Am Coll Cardiol 2012; 60: 917–921.
60. Ellinor PT, et al. Meta-analysis identifies six new susceptibility loci for atrial fibrillation. Nat Genet 2012; 44: 670–675.
61. Olesen MS, et al. Atrial fibrillation: the role of common and rare genetic variants. Eur J Hum Genet 2014; 22: 297–306.
62. Sinner MF, et al. Integrating genetic, transcriptional, and functional analyses to identify 5 novel genes for atrial fibrillation. Circulation 2014; 130: 1225–1235.
63. Gudbjartsson DF, et al. Variants conferring risk of atrial fibrillation on chromosome 4q25. Nature 2007; 448: 353–357.
64. Lubitz SA, et al. Novel genetic markers associate with atrial fibrillation risk in Europeans and Japanese. J Am Coll Cardiol 2014; 63: 1200–1210.
65. Lemmens R, et al. The association of the 4q25 susceptibility variant for atrial fibrillation with stroke is limited to stroke of cardioembolic etiology. Stroke 2010; 41: 1850–1857.
66. Tada H, et al. Twelve-single nucleotide polymorphism genetic risk score identifies individuals at increased risk for future atrial fibrillation and stroke. Stroke 2014; 45: 2856–2862.
67. Wang J, et al. Pitx2 prevents susceptibility to atrial arrhythmias by inhibiting left-sided pacemaker specification. Proc Natl Acad Sci U S A 2010; 107: 9753–9758.
68. Franco D, et al. Modulation of conductive elements by Pitx2 and their impact on atrial arrhythmogenesis. Cardiovasc Res 2011; 91: 223–231.
69. Kirchhof P, et al. PITX2c is expressed in the adult left atrium, and reducing Pitx2c expression promotes atrial fibrillation inducibility and complex changes in gene expression. Circ Cardiovasc Genet 2011; 4: 123–133.
70. Wang J, et al. Pitx2-microRNA pathway that delimits sinoatrial node development and inhibits predisposition to atrial fibrillation. Proc Natl Acad Sci U S A 2014; 111: 9181–9186.
71. Husser D, et al. Chromosome 4q25 variants and atrial fibrillation recurrence after catheter ablation. J Am Coll Cardiol 2010; 55: 747–753.
72. Parvez B, et al. Common genetic polymorphism at 4q25 locus predicts atrial fibrillation recurrence after successful cardioversion. Heart Rhythm 2013; 10: 849–855.
73. Benjamin Shoemaker M, et al. Common atrial fibrillation risk alleles at 4q25 predict recurrence after catheter-based atrial fibrillation ablation. Heart Rhythm 2013; 10: 394–400.
74. Parvez B, et al. Symptomatic response to antiarrhythmic drug therapy is modulated by a common single nucleotide polymorphism in atrial fibrillation. J Am Coll Cardiol 2012; 60: 539–545.
75. Kirchhof P, et al. The continuum of personalized cardiovascular medicine: a position paper of the European Society of Cardiology. Eur Heart J 2014; 35: 3250–3257.
76. Kirchhof P, et al. Personalized management of atrial fibrillation: Proceedings from the fourth Atrial Fibrillation competence NETwork/European Heart Rhythm Association consensus conference. Europace 2013; 15: 1540–1556.
77. Ackerman MJ, Priori SG, Willems S, Berul C, Brugada R, Calkins H, Camm AJ, Ellinor PT, Gollob M, Hamilton R, Hershberger RE, Judge DP, Le Marec H, McKenna WJ, Schulze-Bahr E, Semsarian C, Towbin JA, Watkins H, Wilde A, Wolpert C, Zipes DP, Heart Rhythm Society, European Heart Rhythm Association. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopat hies and cardiomyopathies: this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Europace 2011; 13: 1077–1109.
78. Anne W, et al. Matrix metallo proteinases and atrial remodeling in patients with mitral valve disease and atrial fibrillation. Cardiovasc Res 2005; 67: 655–666.
79. Chimenti C, et al. Histological substrate of human atrial fibrillation. Biomed Pharmacother 2010; 64: 177–183.
80. Nguyen BL, et al. Histopathological substrate for chronic atrial fibrillation in humans. Heart Rhythm 2009; 6: 454–460.
81. Frustaci A, et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation 1997; 96: 1180–1184.
82. Venteclef N, et al. Human epicardial adipose tissue induces fibrosis of the atrial myocardium through the secretion of adipofibrokines. Eur Heart J 2013; 36: 795–805a.
83. Rocken C, et al. Atrial amyloidosis: an arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106: 2091–2097.
84. Schotten U, et al. Cellular mechanisms of depressed atrial contractility in patients with chronic atrial fibrillation. Circulation 2001; 103: 691–698.
85. Allessie MA, et al. Electropathological substrate of long-standing persistent atrial fibrillation in patients with structural heart disease: longitudinal dissociation. Circ Arrhythm Electrophysiol 2010; 3: 606–615.
86. Spach MS, et al. Initiating reentry: the role of nonuniform anisotropy in small circuits. J Cardiovasc Electrophysiol 1994; 5: 182–209.
87. Shinagawa K, et al. Dynamic nature of atrial fibrillation substrate during development and reversal of heart failure in dogs. Circulation 2002; 105: 2672–2678.
88. Lim HS, et al. Effect of atrial fibrillation on atrial thrombogenesis in humans: impact of rate and rhythm. J Am Coll Cardiol 2013; 61: 852–860.
89. Hijazi Z, et al. Biomarkers in atrial fibrillation: a clinical review. Eur Heart J 2013; 34: 1475–1480.
90. Xu J, et al. Atrial extracellular matrix remodeling and the maintenance of atrial fibrillation. Circulation 2004; 109: 363–368.
91. Gramley F, et al. Decreased plasminogen activator inhibitor and tissue metalloproteinase inhibitor expression may promote increased metalloproteinase activity with increasing duration of human atrial fibrillation. J Cardiovasc Electrophysiol 2007; 18: 1076–1082.
92. Hatem SN, et al. Epicardial adipose tissue and atrial fibrillation. Cardiovasc Res 2014; 102: 205–213.
93. Leone O, et al. Amyloid deposition as a cause of atrial remodelling in persistent valvular atrial fibrillation. Eur Heart J 2004; 25: 1237–1241.
94. Dobrev D, et al. The G protein-gated potassium current I(K, ACh) is constitutively active in patients with chronic atrial fibrillation. Circulation 2005; 112: 3697–3706.
95. Van Wagoner DR, et al. Atrial L-type Ca2+ currents and human atrial fibrillation. Circ Res 1999; 85: 428–436.
96. Schotten U, et al. Pathophysiological mechanisms of atrial fibrillation: a translational appraisal. Physiol Rev 2011; 91: 265–325.
97. Voigt N, et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation 2014; 129: 145–156.
98. Voigt N, et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation 2012; 125: 2059–2070.
99. Polontchouk L, et al. Effects of chronic atrial fibrillation on gap junction distribution in human and rat atria. J Am Coll Cardiol 2001; 38: 883–891.
100. Aime-Sempe C, et al. Myocardial cell death in fibrillating and dilated human right atria. J Am Coll Cardiol 1999; 34: 1577–1586.
101. Spach MS, et al. Cell size and communication: role in structural and electrical development and remodeling of the heart. Heart Rhythm 2004; 1: 500–515.
102. Skalidis EI, et al. Isolated atrial microvascular dysfunction in patients with lone recurrent atrial fibrillation. J Am Coll Cardiol 2008; 51: 2053–2057.
103. Barretto AC, et al. Atrial fibrillation in endomyocardial fibrosis is a marker of worse prognosis. Int J Cardiol 1998; 67: 19–25.
104. Levy S. Factors predisposing to the development of atrial fibrillation. Pacing Clin Electrophysiol 1997; 20: 2670–2674.
105. Chen PS, et al. Role of the autonomic nervous system in atrial fibrillation: pathophysiology and therapy. Circ Res 2014; 114: 1500–1515.
106. Christ T, et al. Arrhythmias, elicited by catecholamines and serotonin, vanish in human chronic atrial fibrillation. Proc Natl Acad Sci U S A 2014; 111: 11193–11198.
107. Greiser M, et al. Tachycardia-induced silencing of subcellular Ca2+ signaling in atrial myocytes. J Clin Invest 2014; 124: 4759–4772.
108. Haissaguerre M, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659–666.
109. Patterson E, et al. Spontaneous pulmonary vein firing in man: relationship to tachycardia-pause early afterdepolarizations and triggered arrhythmia in canine pulmonary veins in vitro. J Cardiovasc Electrophysiol 2007; 18: 1067–1075.
110. Atienza F, et al. Activation of inward rectifier potassium channels accelerates atrial fibrillation in humans: evidence for a reentrant mechanism. Circulation 2006; 114: 2434–2442.
111. Mandapati R, et al. Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000; 101: 194–199.
112. Sahadevan J, et al. Epicardial mapping of chronic atrial fibrillation in patients: preliminary observations. Circulation 2004; 110: 3293–3299.
113. Sanders P, et al. Frequency mapping of the pulmonary veins in paroxysmal versus permanent atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17: 965–972.
114. Moe GK, et al. Atrial fibrillation as a self-sustaining arrhythmia independent of focal discharge. Am Heart J 1959; 58: 59–70.
115. Cox JL, et al. The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101: 406–426.
116. Narayan SM, et al. Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. J Am Coll Cardiol 2012; 60: 628–636.
117. Haissaguerre M, et al. Driver domains in persistent atrial fibrillation. Circulation 2014; 130: 530–538.
118. Fetsch T, et al. Prevention of atrial fibrillation after cardioversion: results of the PAFAC trial. Eur Heart J 2004; 25: 1385–1394.
119. Hindricks G, et al. Perception of atrial fibrillation before and after radiofrequency catheter ablation: relevance of asymptomatic arrhythmia recurrence. Circulation 2005; 112: 307–313.
120. Kirchhof P, et al. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference ‘research perspectives in AF’. Eur Heart J 2009; 30: 2969–2977c.
121. Xiong Q, et al. Asymptomatic versus symptomatic atrial fibrillation: A systematic review of age/gender differences and cardiovascular outcomes. Int J Cardiol 2015; 191: 172–177.
122. Savelieva I, et al. Clinical relevance of silent atrial fibrillation: prevalence, prognosis, quality of life, and management. J Interv Card Electrophysiol 2000; 4: 369–382.
123. Friberg L, et al. Stroke in paroxysmal atrial fibrillation: report from the Stockholm Cohort of Atrial Fibrillation. Eur Heart J 2010; 31: 967–975.
124. Vanassche T, et al. Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin treated patients in ACTIVE-A and AVERROES. Eur Heart J 2015; 36: 281–287a.
125. Steinberg BA, et al. Higher risk of death and stroke in patients with persistent vs. paroxysmal atrial fibrillation: results from the ROCKET-AF Trial. Eur Heart J 2015; 36: 288–296.
126. Fitzmaurice DA, et al. Screening versus routine practice in detection of atrial fibrillation in patients aged 65 or over: cluster randomised controlled trial. BMJ 2007; 335: 383.
127. Rizos T, et al. Continuous stroke unit electrocardiographic monitoring versus 24-hour Holter electrocardiography for detection of paroxysmal atrial fibrillation after stroke. Stroke 2012; 43: 2689–2694.
128. Gladstone DJ, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370: 2467–2477.
129. Friberg L, et al. Population screening of 75- and 76-year-old men and women for silent atrial fibrillation (STROKESTOP). Europace 2013; 15: 135–140.
130. Davis RC, et al. Prevalence of atrial fibrillation in the general population and in high-risk groups: the ECHOES study. Europace 2012; 14: 1553–1559.
131. Hobbs FD, et al. A randomised controlled trial and cost-effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study. Health Technol Assess 2005; 9: iii–iv, ix–x, 1–74.
132. Aronsson M, et al. Cost-effectiveness of mass screening for untreated atrial fibrillation using intermittent ECG recording. Europace 2015; 17: 1023–1029.
133. Levin LA, et al. A cost-effectiveness analysis of screening for silent atrial fibrillation after ischaemic stroke. Europace 2015; 17: 207–214.
134. Lowres N, et al. Screening to identify unknown atrial fibrillation. A systematic review. Thromb Haemost 2013; 110: 213–222.
135. Engdahl J, et al. Stepwise screening of atrial fibrillation in a 75-year-old population: implications for stroke prevention. Circulation 2013; 127: 930–937.
136. Kaleschke G, et al. Prospective, multicentre validation of a simple, patientoperated electrocardiographic system for the detection of arrhythmias and electrocardiographic changes. Europace 2009; 11: 1362–1368.
137. Tieleman RG, et al. Validation and clinical use of a novel diagnostic device for screening of atrial fibrillation. Europace 2014; 16: 1291–1295.
138. Barrett PM, et al. Comparison of 24-hour Holter monitoring with 14-day novel adhesive patch electrocardiographic monitoring. Am J Med 2014; 127: 95.e11–97.
139. Lowres N, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014; 111: 1167–1176.
140. Quinn FR, et al. Screening for undiagnosed atrial fibrillation in the community. Curr Opin Cardiol 2014; 29: 28–35.
141. Healey JS, et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012; 366: 120–129.
142. Hindricks G, et al. Performance of a new leadless implantable cardiac monitor in detecting and quantifying atrial fibrillation – results of the XPECT trial. Circ Arrhythm Electrophysiol 2010; 3: 141–147.
143. Brambatti M, et al. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation 2014; 129: 2094–2099.
144. Boriani G, et al. Device-detected atrial fibrillation and risk for stroke: an analysis of .10,000 patients from the SOS AF project (Stroke preventiOn Strategies based on Atrial Fibrillation information from implanted devices). Eur Heart J 2014; 35: 508–516.
145. Santini M, et al. Devicedetected atrial tachyarrhythmias predict adverse outcome in real-world patients with implantable biventricular defibrillators. J Am Coll Cardiol 2011; 57: 167–172.
146. Daoud EG, et al. Temporal relationship of atrial tachyarrhythmias, cerebrovascular events, and systemic emboli based on stored device data: a subgroup analysis of TRENDS. Heart Rhythm 2011; 8: 1416–1423.
147. Glotzer TV, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol 2009; 2: 474–480.
148. Lamas G. How much atrial fibrillation is too much atrial fibrillation? N Engl J Med 2012; 366: 178–180.
149. Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options—a report from the 3rd Atrial Fibrillation Competence NETwork/ European Heart Rhythm Association consensus conference. Europace 2012; 14: 8–27.
150. Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: Emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost 2011; 106: 1012–1019.
151. Sposato LA, et al. Diagnosis of atrial fibrillation after stroke and transient ischemic attack: a systematic review and meta-analysis. Lancet Neurol 2015; 14: 377–387.
152. Thijs VN, et al. Predictors for atrial fibrillation detection after cryptogenic stroke: Results from CRYSTAL AF. Neurology 2016; 86: 261–269.
153. Adams HP Jr, et al. Marsh EE III. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993; 24: 35–41.
154. Hart RG, et al. Cryptogenic Stroke/ESUS International Working Group. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol 2014; 13: 429–438.
155. Mant J, et al. Accuracy of diagnosing atrial fibrillation on electrocardiogram by primary care practitioners and interpretative diagnostic software: analysis of data from screening for atrial fibrillation in the elderly (SAFE) trial. BMJ 2007; 335: 380.
156. Israel CW, et al. Long-term risk of recurrent atrial fibrillation as documented by an implantable monitoring device: implications for optimal patient care. J Am Coll Cardiol 2004; 43: 47–52.
157. Svennberg E, et al. Mass Screening for Untreated Atrial Fibrillation: The STROKESTOP Study. Circulation 2015; 131: 2176–2184.
158. Bun SS, et al. Atrial flutter: more than just one of a kind. Eur Heart J 2015; 36: 2356–2363.
159. Granada J, et al. Incidence and predictors of atrial flutter in the general population. J Am Coll Cardiol 2000; 36: 2242–2246.
160. Halligan SC, et al. The natural history of lone atrial flutter. Ann Intern Med 2004; 140: 265–268.
161. Jahangir A, et al. Long-term progression and outcomes with aging in patients with lone atrial fibrillation: a 30-year follow-up study. Circulation 2007; 115: 3050–3056.
162. Gillis AM, et al. Temporal patterns of paroxysmal atrial fibrillation following DDDR pacemaker implantation. Am J Cardiol 2000; 85: 1445–1450.
163. Charitos EI, et al. Clinical classifications of atrial fibrillation poorly reflect its temporal persistence: insights from 1,195 patients continuously monitored with implantable devices. J Am Coll Cardiol 2014; 63: 2840–2848.
164. Banerjee A, et al. Pattern of atrial fibrillation and risk of outcomes: the Loire Valley Atrial Fibrillation Project. Int J Cardiol 2013; 167: 2682–2687.
165. Lee G, et al. Catheter ablation of atrial arrhythmias: state of the art. Lancet 2012; 380: 1509–1519.
166. Wyse DG, et al. Lone atrial fibrillation: does it exist? J Am Coll Cardiol 2014; 63: 1715–1723.
167. Andrade J, et al. The clinical profile and pathophysiology of atrial fibrillation: relationships among clinical features, epidemiology, and mechanisms. Circ Res 2014; 114: 1453–1468.
168. Chao TF, et al. Atrial substrate properties and outcome of catheter ablation in patients with paroxysmal atrial fibrillation associated with diabetes mellitus or impaired fasting glucose. Am J Cardiol 2010; 106: 1615–1620.
169. Albertsen IE, et al. The impact of smoking on thromboembolism and mortality in patients with incident atrial fibrillation: insights from the Danish Diet, Cancer, and Health study. Chest 2014; 145: 559–566.
170. Overvad TF, et al. Alcohol intake and prognosis of atrial fibrillation. Heart 2013; 99: 1093–1099.
171. Daccarett M, et al. Association of left atrial fibrosis detected by delayed-enhancement magnetic resonance imaging and the risk of stroke in patients with atrial fibrillation. J Am Coll Cardiol 2011; 57: 831–838.
172. Neilan TG, et al. The incidence, pattern, and prognostic value of left ventricular myocardial scar by late gadolinium enhancement in patients with atrial fibrillation. J Am Coll Cardiol 2013; 62: 2205–2214.
173. Marrouche NF, et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study. JAMA 2014; 311: 498–506.
174. Bonizzi P, et al. Systematic comparison of non-invasive measures for the assessment of atrial fibrillation complexity: a step forward towards standardization of atrial fibrillation electrogram analysis. Europace 2014; 17: 318–325.
175. Kirchhof P, et al. A roadmap to improve the quality of atrial fibrillation management: proceedings from the fifth Atrial Fibrillation Network/European Heart Rhythm Association consensus conference. Europace 2016; 18: 37–50.
176. Fabritz L, et al. Expert consensus document: Defining the major health modifiers causing atrial fibrillation: a roadmap to underpin personalized prevention and treatment. Nat Rev Cardiol 2016; 13: 230–237.
177. Dorian P, et al. The impairment of health-related quality of life in patients with intermittent atrial fibrillation: implications for the assessment of investigational therapy. J Am Coll Cardiol 2000; 36: 1303–1309.
178. Sears SF, et al. Understanding atrial symptom reports: objective versus subjective predictors. Pacing Clin Electrophysiol 2005; 28: 801–807.
179. Peinado R, et al. Variation in quality of life with type of atrial fibrillation. Rev Esp Cardiol 2010; 63: 1402–1409.
180. Steg PG, et al. Symptoms, functional status and quality of life in patients with controlled and uncontrolled atrial fibrillation: data from the RealiseAF cross-sectional international registry. Heart 2012; 98: 195–201.
181. Gronefeld GC, et al. Pharmacological Intervention in Atrial Fibrillation (PIAF) Study investigators. Impact of rate versus rhythm control on quality of life in patients with persistent atrial fibrillation. Results from a prospective randomized study. Eur Heart J 2003; 24: 1430–1436.
182. Pepine CJ. Effects of pharmacologic therapy on health-related quality of life in elderly patients with atrial fibrillation: a systematic review of randomized and nonrandomized trials. Clin Med Insights Cardiol 2013; 7: 1–20.
183. Hagens VE, et al. Effect of rate or rhythm control on quality of life in persistent atrial fibrillation. Results from the Rate Control Versus Electrical Cardioversion (RACE) Study. J Am Coll Cardiol 2004; 43: 241–247.
184. Weerasooriya R, et al. The Australian intervention randomized control of rate in atrial fibrillation trial (AIRCRAFT). J Am Coll Cardiol 2003; 41: 1697–1702.
185. Jones DG, et al. A randomized trial to assess catheter ablation versus rate control in the management of persistent atrial fibrillation in heart failure. J Am Coll Cardiol 2013; 61: 1894–1903.
186. Rienstra M, et al. Symptoms and functional status of patients with atrial fibrillation: state of the art and future research opportunities. Circulation 2012; 125: 2933–2943.
187. Arribas F, et al. Validation of the AF-QoL, a disease-specific quality of life questionnaire for patients with atrial fibrillation. Europace 2010; 12: 364–370.
188. Spertus J, et al. Development and validation of the Atrial Fibrillation Effect on QualiTy-of-Life (AFEQT) Questionnaire in patients with atrial fibrillation. Circ Arrhythm Electrophysiol 2011; 4: 15–25.
189. Dorian P, et al. Interpreting changes in quality of life in atrial fibrillation: How much change is meaningful? Am Heart J 2013; 166: 381–387.e8.
190. Ware JE Jr, et al. Overview of the SF-36 Health Survey and the International Quality of Life Assessment (IQOLA) Project. J Clin Epidemiol 1998; 51: 903–912.
191. Herdman M, et al. Development and preliminary testing of the new five-level version of EQ-5D (EQ-5D-5L). Qual Life Res 2011; 20: 1727–1736.
192. Kirchhof P, et al. Outcome parameters for trials in atrial fibrillation: executive summary. Eur Heart J 2007; 28: 2803–2817.
193. Dorian P, et al. A novel, simple scale for assessing the symptom severity of atrial fibrillation at the bedside: the CCS-SAF scale. Can J Cardiol 2006; 22: 383–386.
194. Kirchhof P, et al. Management of atrial fibrillation in seven European countries after the publication of the 2010 ESC Guidelines on atrial fibrillation: primary results of the PREvention oF thromboemolic events—European Registry in Atrial Fibrillation (PREFER in AF). Europace 2014; 16: 6–14.
195. Lip GY, et al. Improved outcomes with European Society of Cardiology guideline-adherent antithrombotic treatment in high-risk patients with atrial fibrillation: a report from the EORP-AF General Pilot Registry. Europace 2015; 17: 1777–1786.
196. Freeman JV, et al. Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF) Investigators and Patients. Association Between Atrial Fibrillation Symptoms, Quality of Life, and Patient Outcomes: Results From the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF). Circ Cardiovasc Qual Outcomes 2015; 8: 393–402.
197. Boriani G, et al. Asymptomatic atrial fibrillation: clinical correlates, management, and outcomes in the EORP-AF Pilot General Registry. Am J Med 2015; 128: 509–518 e2.
198. Szymanski FM, et al. Occurrence of poor sleep quality in atrial fibrillation patients according to the EHRA score. Acta Cardiol 2014; 69: 291–296.
199. Wynn GJ, et al. The European Heart Rhythm Association symptom classification for atrial fibrillation: validation and improvement through a simple modification. Europace 2014; 16: 965–972.
200. Meinertz T, et al. Management of atrial fibrillation by primary care physicians in Germany: baseline results of the ATRIUM registry. Clin Res Cardiol 2011; 100: 897–905.
201. Nabauer M, et al. The Registry of the German Competence NETwork on Atrial Fibrillation: Patient characteristics and initial management. Europace 2009; 11: 423–434.
202. von Eisenhart Rothe AF, et al. Depression in paroxysmal and persistent atrial fibrillation patients: a cross-sectional comparison of patients enroled in two large clinical trials. Europace 2014; 16: 812–819.
203. Pathak RK, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol 2014; 64: 2222–2231.
204. Abed HS, et al. Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patients with atrial fibrillation: a randomized clinical trial. JAMA 2013; 310: 2050–2060.
205. Psaty BM, et al. Incidence of and risk factors for atrial fibrillation in older adults. Circulation 1997; 96: 2455–2461.
206. Selmer C, et al. The spectrum of thyroid disease and risk of new onset atrial fibrillation: a large population cohort study. BMJ 2012; 345: e7895.
207. Kim EJ, et al. Relation of hypothyroidism and incident atrial fibrillation (from the Framingham Heart Study). Am Heart J 2014; 167: 123–126.
208. Vermond RA, et al. Incidence of atrial fibrillation and relationship ith cardiovascular events, heart failure, and mortality: A communitybased study from the netherlands. J Am Coll Cardiol 2015; 66: 1000–1007.
209. Buch P, et al. Reduced lung function and risk of atrial fibrillation in the Copenhagen City Heart Study. Eur Respir J 2003; 21: 1012–1016.
210. Gami AS, et al. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation. J Am Coll Cardiol 2007; 49: 565–571.
211. Baber U, et al. Association of chronic kidney disease with atrial fibrillation among adults in the United States: REasons for Geographic and Racial Differences in Stroke (REGARDS) Study. Circ Arrhythm Electrophysiol 2011; 4: 26–32.
212. Chamberlain AM, et al. Smoking and incidence of atrial fibrillation: results from the Atherosclerosis Risk in Communities (ARIC) study. Heart Rhythm 2011; 8: 1160–1166.
213. Larsson SC, et al. Alcohol consumption and risk of atrial fibrillation: a prospective study and dose-response meta-analysis. J Am Coll Cardiol 2014; 64: 281–289.
214. Aizer A, et al. Relation of vigorous exercise to risk of atrial fibrillation. Am J Cardiol 2009; 103: 1572–1577.
215. Guha K, et al. Heart failure epidemiology: European perspective. Curr Cardiol Rev 2013; 9: 123–127.
216. Braunschweig F, et al. What are the costs of heart failure? Europace 2011; 13: ii13–17.
217. Wodchis WP, et al. A review of the cost of atrial fibrillation. Value Health 2012; 15: 240–248.
218. Kotecha D, et al. Atrial fibrillation in heart failure: what should we do? Eur Heart J 2015; 36: 3250–3257.
219. Olsson LG, et al. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction: results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol 2006; 47: 1997–2004.
220. Kotecha D, et al. Atrial fibrillation and heart failure due to reduced versus preserved ejection fraction: A systematic review and meta-analysis of death and adverse outcomes. Int J Cardiol 2016; 203: 660–666.
221. Mamas MA, et al. A meta-analysis of the prognostic significance of atrial fibrillation in chronic heart failure. Eur J Heart Fail 2009; 11: 676–683.
222. Ponikowski P, et al. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J; doi: https://doi.org/10.1093/eurheartj/ehw128. Published online ahead of print 20 May 2016.
223. Lip GY, et al. European Heart Rhythm Association/Heart Failure Association joint consensus document on arrhythmias in heart failure, endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace 2016; 18: 12–36.
224. McMurray JJ, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
225. Ziff OJ, et al. Safety and efficacy of digoxin: systematic review and meta-analysis of observational and controlled trial data. BMJ 2015; 351: h4451.
226. Anselmino M, et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: a systematic review and meta-analysis. Circ Arrhythm Electrophysiol 2014; 7: 1011–1018.
227. Ganesan AN, et al. Catheter ablation of atrial fibrillation in patients with concomitant left ventricular impairment: a systematic review of efficacy and effect on ejection fraction. Heart Lung Circ 2015; 24: 270–280.
228. Khan MN, et al. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med 2008; 359: 1778–1785.
229. Gupta S, et al. Tachycardia mediated cardiomyopathy: pathophysiology, mechanisms, clinical features and management. Int J Cardiol 2014; 172: 40–46.
230. Kusunose K, et al. Clinical utility of single-beat E/e’ obtained by simultaneous recording of flow and tissue Doppler velocities in atrial fibrillation with preserved systolic function. JACC Cardiovasc Imaging 2009; 2: 1147–1156.
231. Li C, Zhang J, et al. Will simultaneous measurement of E/e’ index facilitate the non-invasive assessment of left ventricular filling pressure in patients with non-valvular atrial fibrillation? Eur J Echocardiogr 2010; 11: 296–301.
232. Senechal M, et al. A simple Doppler echocardiography method to evaluate pulmonary capillary wedge pressure in patients with atrial fibrillation. Echocardiography 2008; 25: 57–63.
233. Sohn DW, et al. Mitral annulus velocity in the evaluation of left ventricular diastolic function in atrial fibrillation. J Am Soc Echocardiogr 1999; 12: 927–931.
234. Wada Y, et al. Simultaneous Doppler tracing of transmitral inflow and mitral annular velocity as an estimate of elevated left ventricular filling pressure in patients with atrial fibrillation. Circ J 2012; 76: 675–681.
235. Kelly JP, et al. Patient selection in heart failure with preserved ejection fraction clinical trials. J Am Coll Cardiol 2015; 65: 1668–1682.
236. Schneider MP, et al. Prevention of atrial fibrillation by Renin-Angiotensin system inhibition a meta-analysis. J Am Coll Cardiol 2010; 55: 2299–2307.
237. Healey JS, et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832–1839.
238. Jibrini MB, et al. Prevention of atrial fibrillation by way of abrogation of the renin-angiotensin system: a systematic review and meta-analysis. Am J Ther 2008; 15: 36–43.
239. Ducharme A, et al. Prevention of atrial fibrillation in patients with symptomatic chronic heart failure by candesartan in the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) program. Am Heart J 2006; 152: 86–92.
240. GISSI-AF Investigators, Disertori M, et al. Valsartan for prevention of recurrent atrial fibrillation. N Engl J Med 2009; 360: 1606–1617.
241. Goette A, et al. Angiotensin II-antagonist in paroxysmal atrial fibrillation (ANTIPAF) trial. Circ Arrhythm Electrophysiol 2012; 5: 43–51.
242. Active I Investigators, Yusuf S, et al. Irbesartan in patients with atrial fibrillation. N Engl J Med 2011; 364: 928–938.
243. Swedberg K, et al. Eplerenone and atrial fibrillation in mild systolic heart failure: results from the EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization And SurvIval Study in Heart Failure) study. J Am Coll Cardiol 2012; 59: 1598–1603.
244. Goette A, et al. Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000; 35: 1669–1677.
245. Marott SC, et al. Antihypertensive treatment and risk of atrial fibrillation: a nationwide study. Eur Heart J 2014; 35: 1205–1214.
246. Wachtell K, et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005; 45: 712–719.
247. Manolis AJ, et al. Hypertension and atrial fibrillation: diagnostic approach, prevention and treatment. Position paper of the Working Group ‘Hypertension Arrhythmias and Thrombosis’ of the European Society of Hypertension. J Hypertens 2012; 30: 239–252.
248. Madrid AH, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002; 106: 331–336.
249. Ueng K-C, et al. Use of enalapril to facilitate sinus rhythm maintenance after external cardioversion of long-standing persistent atrial fibrillation. Results of a prospective and controlled study. Eur Heart J 2003; 24: 2090–2098.
250. Anand K, et al. Meta-analysis: inhibition of renin-angiotensin system prevents new-onset atrial fibrillation. Am Heart J 2006; 152: 217–222.
251. Tveit A, et al. Effect of candesartan and various inflammatory markers on maintenance of sinus rhythm after electrical cardioversion for atrial fibrillation. Am J Cardiol 2007; 99: 1544–1548.
252. Furberg CD, et al. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74: 236–241.
253. Vahanian A, et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC), European Association for Cardio- Thoracic Surgery (EACTS). Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33: 2451–2496.
254. Nishimura RA, et al. 2014 AHA/ ACC guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63: 2438–2488.
255. Nieuwlaat R, et al. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005; 26: 2422–2434.
256. Moretti M, et al. Prognostic significance of atrial fibrillation and severity of symptoms of heart failure in patients with low gradient aortic stenosis and preserved left ventricular ejection fraction. Am J Cardiol 2014; 114: 1722–1728.
257. Ngaage DL, et al. Influence of preoperative atrial fibrillation on late results of mitral repair: is concomitant ablation justified? Ann Thorac Surg 2007; 84: 434–442; discussion 442–433.
258. Ngaage DL, et al. Prognostic implications of preoperative atrial fibrillation in patients undergoing aortic valve replacement: is there an argument for concomitant arrhythmia surgery? Ann Thorac Surg 2006; 82: 1392–1399.
259. Eguchi K, et al. Pre-operative atrial fibrillation as the key determinant of outcome of mitral valve repair for degenerative mitral regurgitation. Eur Heart J 2005; 26: 1866–1872.
260. Lim E, et al. Influence of atrial fibrillation on outcome following mitral valve repair. Circulation 2001; 104: I59–63.
261. Maan A, et al. Impact of atrial fibrillation on outcomes in patients who underwent transcatheter aortic valve replacement. Am J Cardiol 2015; 115: 220–226.
262. Barbash IM, et al. Predictors and clinical implications of atrial fibrillation in patients with severe aortic stenosis undergoing transcatheter aortic valve implantation. Catheter Cardiovasc Interv 2015; 85: 468–477.
263. Halperin JL, et al. Atrial fibrillation and stroke: new ideas, persisting dilemmas. Stroke 1988; 19: 937–941.
264. Messika-Zeitoun D, et al. Left atrial remodeling in mitral regurgitation—methodologic approach, physiological determinants, and outcome implications: a prospective quantitative Doppler-echocardiographic and electron beam-computed tomographic study. Eur Heart J 2007; 28: 1773–1781.
265. Calvo N, et al. Impact of atrial fibrillation-induced tachycardiomyopathy in patients undergoing pulmonary vein isolation. Int J Cardiol 2013; 168: 4093–4097.
266. Edner M, et al. Prospective study of left ventricular function after radiofrequency ablation of atrioventricular junction in patients with atrial fibrillation. Br Heart J 1995; 74: 261–267.
267. Gertz ZM, et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation: reversal with arrhythmia control. J Am Coll Cardiol 2011; 58: 1474–1481.
268. Kihara T, et al. Mitral regurgitation associated with mitral annular dilation in patients with lone atrial fibrillation: an echocardiographic study. Echocardiography 2009; 26: 885–889.
269. Zhou X, et al. Impact of atrial fibrillation on tricuspid and mitral annular dilatation and valvular regurgitation. Circ J 2002; 66: 913–916.
270. Ring L, et al. Mechanisms of atrial mitral regurgitation: insights using 3D transoesophageal echo. Eur Heart J Cardiovasc Imaging 2014; 15: 500–508.
271. Vahanian A, et al. ESC Committee for Practice Guidelines (CPG), Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC), European Association for Cardio-Thoracic Surgery (EACTS). Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur J Cardiothorac Surg 2012; 42: S1–44.
272. Molteni M, et al. The definition of valvular and non-valvular atrial fibrillation: results of a physicians’ survey. Europace 2014; 16: 1720–1725.
273. Blackshear JL, et al. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg 1996; 61: 755–759.
274. Szekely P. Systemic Embolism and Anticoagulant Prophylaxis in Rheumatic Heart Disease. Br Med J 1964; 1: 1209–1212.
275. De Caterina R, et al. What is ‘valvular’ atrial fibrillation? A reappraisal. Eur Heart J 2014; 35: 3328–3335.
276. Goldstone AB, et al. Early surgical intervention or watchful waiting for the management of asymptomatic mitral regurgitation: a systematic review and meta-analysis. Ann Cardiothorac Surg 2015; 4: 220–229.
277. Schoen T, et al. Type 2 diabetes mellitus and risk of incident atrial fibrillation in women. J Am Coll Cardiol 2012; 60: 1421–1428.
278. Du X, et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009; 30: 1128–1135.
279. Rizzo MR, et al. Autonomic dysfunction is associated with brief episodes of atrial fibrillation in type 2 diabetes. J Diabetes Complications 2015; 29: 88–92.
280. Olson TM, et al. Human K(ATP) channelopathies: diseases of metabolic homeostasis. Pflugers Arch 2010; 460: 295–306.
281. Chung MK, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001; 104: 2886–2891.
282. Donath MY, et al. Type 2 diabetes as an inflammatory disease. Nat Rev Immunol 2011; 11: 98–107.
283. Ziolo MT, et al. Defining the role of oxidative stress in atrial fibrillation and diabetes. J Cardiovasc Electrophysiol 2015; 26: 223–225.
284. Fatemi O, et al. Impact of intensive glycemic control on the incidence of atrial fibrillation and associated cardiovascular outcomes in patients with type 2 diabetes mellitus (from the Action to Control Cardiovascular Risk in Diabetes Study). Am J Cardiol 2014; 114: 1217–1222.
285. Overvad TF, et al. Duration of Diabetes Mellitus and Risk of Thromboembolism and Bleeding in Atrial Fibrillation: Nationwide Cohort Study. Stroke 2015; 46: 2168–2174.
286. Chang S-H, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort and in vitro studies. Cardiovasc Diabetol 2014; 13: 123.
287. Lip GY, et al. The impact of associated diabetic retinopathy on stroke and severe bleeding risk in diabetic patients with atrial fibrillation: the Loire valley atrial fibrillation project. Chest 2015; 147: 1103–1110.
288. Huxley RR, et al. Physical activity, obesity, weight change, and risk of atrial fibrillation: the Atherosclerosis Risk in Communities study. Circ Arrhythm Electrophysiol 2014; 7: 620–625.
289. Murphy NF, et al. Long-term cardiovascular consequences of obesity: 20-year follow-up of more than 15 000 middle-aged men and women (the Renfrew-Paisley study). Eur Heart J 2006; 27: 96–106.
290. Wanahita N, et al. Atrial fibrillation and obesity-results of a meta-analysis. Am Heart J 2008; 155: 310–315.
291. Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004; 292: 2471–2477.
292. Overvad TF, et al. Body mass index and adverse events in patients with incident atrial fibrillation. Am J Med 2013; 126: 640.e649–617.
293. Karason K, et al. Heart rate variability in obesity and the effect of weight loss. Am J Cardiol 1999; 83: 1242–1247.
294. Russo C, et al. Effect of obesity and overweight on left ventricular diastolic function: a community-based study in an elderly cohort. J Am Coll Cardiol 2011; 57: 1368–1374.
295. Visser M, et al. Elevated C-reactive protein levels in overweight and obese adults. JAMA 1999; 282: 2131–2135.
296. Pathak RK, et al. Sanders P. Long- Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort: A Long-Term Follow-Up Study (LEGACY). J Am Coll Cardiol 2015; 65: 2159–2169.
297. Pathak RK, et al. Impact of CARDIOrespiratory FITness on Arrhythmia Recurrence in Obese Individuals With Atrial Fibrillation: The CARDIO-FIT Study. J Am Coll Cardiol 2015; 66: 985–996.
298. Cha YM, et al. Catheter ablation for atrial fibrillation in patients with obesity. Circulation 2008; 117: 2583–2590.
299. Jongnarangsin K, et al. Body mass index, obstructive sleep apnea, and outcomes of catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2008; 19: 668–672.
300. Guijian L, et al. Impact of body mass index on atrial fibrillation recurrence: a meta-analysis of observational studies. Pacing Clin Electrophysiol 2013; 36: 748–756.
301. Zhuang J, et al. Influence of body mass index on recurrence and quality of life in atrial fibrillation patients after catheter ablation: a meta-analysis and systematic review. Clin Cardiol 2013; 36: 269–275.
302. Ector J, et al. Obesity is a major determinant of radiation dose in patients undergoing pulmonary vein isolation for atrial fibrillation. J Am Coll Cardiol 2007; 50: 234–242.
303. Shoemaker MB, et al. Relation of morbid obesity and female gender to risk of procedural complications in patients undergoing atrial fibrillation ablation. Am J Cardiol 2013; 111: 368–373.
304. Vizzardi E, et al. Obstructive sleep apnoea-hypopnoea and arrhythmias: new updates. J Cardiovasc Med (Hagerstown) 2014, doi https://doi.org/10.2459/JCM.0000000000000043.
305. Digby GC, et al. Sleep apnea and atrial fibrillation; 2012 update. Curr Cardiol Rev 2012; 8: 265–272.
306. Lin YK, et al. Hypoxia and reoxygenation modulate the arrhythmogenic activity of the pulmonary vein and atrium. Clin Sci (Lond) 2012; 122: 121–132.
307. Linz D. Atrial fibrillation in obstructive sleep apnea: atrial arrhythmogenic substrate of a different sort. Am J Cardiol 2012; 110: 1071.
308. Patel D, et al. Safety and efficacy of pulmonary vein antral isolation in patients with obstructive sleep apnea: the impact of continuous positive airway pressure. Circ Arrhythm Electrophysiol 2010; 3: 445–451.
309. Fein AS, et al. Treatment of obstructive sleep apnea reduces the risk of atrial fibrillation recurrence after catheter ablation. J Am Coll Cardiol 2013; 62: 300–305.
310. Naruse Y, et al. Concomitant obstructive sleep apnea increases the recurrence of atrial fibrillation following radiofrequency catheter ablation of atrial fibrillation: clinical impact of continuous positive airway pressure therapy. Heart Rhythm 2013; 10: 331–337.
311. Neilan TG, et al. Effect of sleep apnea and continuous positive airway pressure on cardiac structure and recurrence of atrial fibrillation. J Am Heart Assoc 2013; 2: e000421.
312. Li L, et al. Efficacy of catheter ablation of atrial fibrillation in patients with obstructive sleep apnoea with and without continuous positive airway pressure treatment: a meta-analysis of observational studies. Europace 2014; 16: 1309–1314.
313. Cowie MR, et al. Adaptive Servo- Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med 2015; 373: 1095–1105.
314. Bitter T, et al. Predictors of recurrence in patients undergoing cryoballoon ablation for treatment of atrial fibrillation: the independent role of sleep-disordered breathing. J Cardiovasc Electrophysiol 2012; 23: 18–25.
315. Ng CY, et al. Meta-analysis of obstructive sleep apnea as predictor of atrial fibrillation recurrence after catheter ablation. Am J Cardiol 2011; 108: 47–51.
316. Hart RG, et al. Stroke prevention in atrial fibrillation patients with chronic kidney disease. Can J Cardiol 2013; 29: S71–78.
317. Roldan V, et al. Renal impairment in a „real-life” cohort of anticoagulated patients with atrial fibrillation (implications for thromboembolism and bleeding). Am J Cardiol 2013; 111: 1159–1164.
318. Connolly SJ, et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151.
319. Granger CB, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981–992.
320. Patel MR, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883–891.
321. Giugliano RP, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 2093–2104.
322. Page K, et al. A systematic approach to chronic heart failure care: a consensus statement. Med J Aust 2014; 201: 146–150.
323. Stock S, et al. Chronic care model strategies in the United States and Germany deliver patient-centered, highquality diabetes care. Health Aff (Millwood) 2014; 33: 1540–1548.
324. Lundstrom H, et al. The effectiveness of structured personal care of type 2 diabetes on recurrent outcomes: a 19 year follow-up of the study Diabetes Care in General Practice (DCGP). Diabetologia 2014; 57: 1119–1123.
325. Berti D, et al. A proposal for interdisciplinary, nurse-coordinated atrial fibrillation expert programmes as a way to structure daily practice. Eur Heart J 2013; 34: 2725–2730.
326. Wagner EH, et al. Organizing care for patients with chronic illness. Milbank Q 1996; 74: 511–544.
327. Nieuwlaat R, et al. Guideline-adherent antithrombotic treatment is associated with improved outcomes compared with undertreatment in high-risk patients with atrial fibrillation. The Euro Heart Survey on Atrial Fibrillation. Am Heart J 2007; 153: 1006–1012.
328. Nuno R, et al. Integrated care for chronic conditions: the contribution of the ICCC Framework. Health Policy 2012; 105: 55–64.
329. Kirchhof P, et al. Impact of the type of centre on management of AF patients: surprising evidence for differences in antithrombotic therapy decisions. Thromb Haemost 2011; 105: 1010–1023.
330. Hendriks JM, et al. Nurse-led care vs. usual care for patients with atrial fibrillation: results of a randomized trial of integrated chronic care vs. routine clinical care in ambulatory patients with atrial fibrillation. Eur Heart J 2012; 33: 2692–2699.
331. Hendriks J, et al. Cost-effectiveness of a specialized atrial fibrillation clinic vs. usual care in patients with atrial fibrillation. Europace 2013; 15: 1128–1135.
332. Stewart S, et al. Standard versus atrial fibrillation-specific management strategy (SAFETY) to reduce recurrent admission and prolong survival: pragmatic, multicentre, randomised controlled trial. Lancet 2015; 385: 775–784.
333. Tran HN, et al. A multidisciplinary atrial fibrillation clinic. Curr Cardiol Rev 2013; 9: 55–62.
334. Conti A, et al. Clinical management of atrial fibrillation: early interventions, observation, and structured follow-up reduce hospitalizations. Am J Emerg Med 2012; 30: 1962–1969.
335. Carter L, et al. An Integrated Management Approach to Atrial Fibrillation. J Am Heart Assoc 2016; 5: e002950.
336. Peterson ED, et al. ACC/AHA/AACVPR/AAFP/ANA Concepts for Clinician-Patient Shared Accountability in Performance Measures: A Report of the American College of Cardiology/American Heart Association Task Force on Performance Measures. Circulation 2014; 130: 1984–1994.
337. Lane DA, et al. Cardiac tachyarrhythmias and patient values and preferences for their management: the European Heart Rhythm Association (EHRA) consensus document endorsed by the Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2015; 17: 1747–1769.
338. Hendriks JM, et al. An integrated chronic care program for patients with atrial fibrillation: study protocol and methodology for an ongoing prospective randomised controlled trial. Int J Nurs Stud 2010; 47: 1310–1316.
339. Donal E, et al. EACVI/EHRA Expert Consensus Document on the role of multi-modality imaging for the evaluation of patients with atrial fibrillation. Eur Heart J Cardiovasc Imaging 2016; 17: 355–383.
340. Lang RM, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the american society of echocardiography and the European association of cardiovascular imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 233–271.
341. Filion KB, et al. High-sensitivity cardiac troponin T and the risk of incident atrial fibrillation: The Atherosclerosis Risk in Communities (ARIC) study. Am Heart J 2015; 169: 31–38.
342. Aviles RJ, et al. Inflammation as a risk factor for atrial fibrillation. Circulation 2003; 108: 3006–3010.
343. Patton KK, et al. N-terminal pro-B-type natriuretic peptide is a major predictor of the development of atrial fibrillation: the Cardiovascular Health Study. Circulation 2009; 120: 1768–1774.
344. Bartel T, et al. Transoesophageal echocardiography for immediate and safe cardioversion in patients with atrial fibrillation. Eur Heart J 2001; 22: 2041–2044.
345. Mahnkopf C, et al. [Relevance of magnetic resonance imaging for catheter ablation of atrial fibrillation]. Herzschrittmacherther Elektrophysiol 2014; 25: 252–257.
346. Haemers P, et al. The use of cardiac magnetic resonance imaging in the diagnostic workup and treatment of atrial fibrillation. Cardiol Res Pract 2012; 2012: 658937.
347. Ling LH, et al. Diffuse ventricular fibrosis in atrial fibrillation: noninvasive evaluation and relationships with aging and systolic dysfunction. J Am Coll Cardiol 2012; 60: 2402–2408.
348. Lewalter T, et al. An update and current expert opinions on percutaneous left atrial appendage occlusion for stroke prevention in atrial fibrillation. Europace 2013; 15: 652–656.
349. Kirchhof P, et al. Outcome parameters for trials in atrial fibrillation: executive summary: Recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork (AFNET) and the European Heart Rhythm Association (EHRA). Eur Heart J 2007; 28: 2803–2817.
350. Alonso-Coello P, et al. Values and preferences in oral anticoagulation in patients with atrial fibrillation, physicians’ and patients’ perspectives: protocol for a two-phase study. BMC Health Serv Res 2008; 8: 221.
351. Lip GY, et al. Contemporary management of atrial fibrillation: what can clinical registries tell us about stroke prevention and current therapeutic approaches? J Am Heart Assoc 2014; 3: e001179.
352. Gorst-Rasmussen A, et al. Dabigatran adherence in atrial fibrillation patients during the first year after diagnosis: a nationwide cohort study. J Thromb Haemost 2015; 13: 495–504.
353. Hart RG, et al. Adjusted-dose warfarin versus aspirin for preventing stroke in patients with atrial fibrillation. Ann Intern Med 2007; 147: 590–592.
354. Connolly SJ, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364: 806–817.
355. Frankel DS, et al. HRS/NSA 2014 Survey of Atrial Fibrillation and Stroke: Gaps in Knowledge and Perspective, Opportunities for Improvement. Heart Rhythm 2015; 12: e105–113.
356. Le Heuzey JY, et al. Differences among western European countries in anticoagulation management of atrial fibrillation. Data from the PREFER IN AF registry. Thromb Haemost 2014; 111: 833–841.
357. O’Brien EC, et al. Physician practices regarding contraindications to oral anticoagulation in atrial fibrillation: findings from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF) registry. Am Heart J 2014; 167: 601–609.e1.
358. Fang MC, et al. Warfarin discontinuation after starting warfarin for atrial fibrillation. Circ Cardiovasc Qual Outcomes 2010; 3: 624–631.
359. Zalesak M, et al. Higher persistence in newly diagnosed nonvalvular atrial fibrillation patients treated with dabigatran versus warfarin. Circ Cardiovasc Qual Outcomes 2013; 6: 567–574.
360. Donze J, et al. Risk of falls and major bleeds in patients on oral anticoagulation therapy. Am J Med 2012; 125: 773–778.
361. Man-Son-Hing M, et al. Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls. Arch Intern Med 1999; 159: 677–685.
362. Mant J, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007; 370: 493–503.
363. Diener HC, et al. Apixaban versus aspirin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a predefined subgroup analysis from AVERROES, a randomised trial. Lancet Neurol 2012; 11: 225–231.
364. The SPAF III Writing Committee for the Stroke Prevention in Atrial Fibrillation Investigators. Patients with nonvalvular atrial fibrillation at low risk of stroke during treatment with aspirin: Stroke Prevention in Atrial Fibrillation III Study. JAMA 1998; 279: 1273–1277.
365. Gage BF, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285: 2864–2870.
366. van Walraven C, et al. A clinical prediction rule to identify patients with atrial fibrillation and a low risk for stroke while taking aspirin. Arch Intern Med 2003; 163: 936–943.
367. Wang TJ, et al. A risk score for predicting stroke or death in individuals with new-onset atrial fibrillation in the community: the Framingham Heart Study. JAMA 2003; 290: 1049–1056.
368. Lip GY, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest 2010; 137: 263–272.
369. Camm AJ, et al. ESC Committee for Practice Guidelines, European Heart Rhythm Association, European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Europace 2010; 12: 1360–1420.
370. Kirchhof P, et al. Atrial fibrillation guidelines across the Atlantic: a comparison of the current recommendations of the European Society of Cardiology/European Heart Rhythm Association/European Association of Cardiothoracic Surgeons, the American College of Cardiology Foundation/American Heart Association/Heart Rhythm Society, and the Canadian Cardiovascular Society. Eur Heart J 2013; 34: 1471–1474.
371. Olesen JB, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011; 342: d124.
372. Chao TF, et al. Should atrial fibrillation patients with 1 additional risk factor of the CHA2DS2-VASc score (beyond sex) receive oral anticoagulation? J Am Coll Cardiol 2015; 65: 635–642.
373. Lip GY, et al. Oral anticoagulation, aspirin, or no therapy in patients with nonvalvular AF with 0 or 1 stroke risk factor based on the CHA2DS2-VASc score. J Am Coll Cardiol 2015; 65: 1385–1394.
374. Fauchier L, et al. Oral Anticoagulation and the Risk of Stroke or Death in Patients With Atrial Fibrillation and One Additional Stroke Risk Factor: The Loire Valley Atrial Fibrillation Project. Chest 2016; 149: 960–968.
375. Joundi RA, et al. Ischemic Stroke Risk in Patients With Atrial Fibrillation and CHA2DS2-VASc Score of 1: Systematic Review and Meta-Analysis. Stroke 2016; 47: 1364–1367.
376. Friberg L, et al. Benefit of anticoagulation unlikely in patients with atrial fibrillation and a CHA2DS2-VASc score of 1. J Am Coll Cardiol 2015; 65: 225–232.
377. Lip GY, et al. Non-valvular atrial fibrillation patients with none or one additional risk factor of the CHA2DS2-VASc score. A comprehensive net clinical benefit
analysis for warfarin, aspirin, or no therapy. Thromb Haemost 2015; 114: 826–834.
378. Mikkelsen AP, et al. Female sex as a risk factor for stroke in atrial fibrillation: a nationwide cohort study. J Thromb Haemost 2012; 10: 1745–1751.
379. Wagstaff AJ, et al. Is female sex a risk factor for stroke and thromboembolism in patients with atrial fibrillation? A systematic review and meta-analysis. QJM 2014; 107: 955–967.
380. Hijazi Z, et al. Cardiac biomarkers are associated with an increased risk of stroke and death in patients with atrial fibrillation: a Randomized Evaluation of Long-term Anticoagulation Therapy (RE-LY) substudy. Circulation 2012; 125: 1605–1616.
381. Hijazi Z, et al. N-terminal pro-B-type natriuretic peptide for risk assessment in patients with atrial fibrillation: insights from the ARISTOTLE Trial (Apixaban for the Prevention of Stroke in Subjects With Atrial Fibrillation). J Am Coll Cardiol 2013; 61: 2274–2284.
382. Hijazi Z, et al. The ABC (age, biomarkers, clinical history) stroke risk score: a biomarker-based risk score for predicting stroke in atrial fibrillation. Eur Heart J 2016; 37: 1582–1590.
383. Gage BF, et al. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J 2006; 151: 713–719.
384. Pisters R, et al. A novel userfriendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093–1100.
385. Fang MC, et al. A new risk scheme to predict warfarin-associated hemorrhage: The ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) Study. J Am Coll Cardiol 2011; 58: 395–401.
386. Friberg L, et al. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J 2012; 33: 1500–1510.
387. Hijazi Z, et al. The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study. Lancet 2016; 387: 2302–2311.
388. O’Brien EC, et al. The ORBIT bleeding score: a simple bedside score to assess bleeding risk in atrial fibrillation. Eur Heart J 2015; 36: 3258–3264.
389. Loewen P, et al. Risk of bleeding with oral anticoagulants: an updated systematic review and performance analysis of clinical prediction rules. Ann Hematol 2011; 90: 1191–1200.
390. Olesen JB, et al. Bleeding risk in ‘real world’ patients with atrial fibrillation: comparison of two established bleeding prediction schemes in a nationwide cohort. J Thromb Haemost 2011; 9: 1460–1467.
391. Van Staa TP, et al. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice. J Thromb Haemost 2011; 9: 39–48.
392. Roldan V, et al. The HAS-BLED score has better prediction accuracy for major bleeding than CHADS2 or CHA2DS2-VASc scores in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2013; 62: 2199–2204.
393. Wallentin L, et al. Growth differentiation factor 15, a marker of oxidative stress and inflammation, for risk assessment in patients with atrial fibrillation: insights from the Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE) trial. Circulation 2014; 130: 1847–1858.
394. Raunso J, et al. Increased short-term risk of thrombo-embolism or death after interruption of warfarin treatment in patients with atrial fibrillation. Eur Heart J 2012; 33: 1886–1892.
395. Sjogren V, et al. Safety and efficacy of well managed warfarin. A report from the Swedish quality register Auricula. Thromb Haemost 2015; 113: 1370–1377.
396. Graham DJ, et al. Cardiovascular, bleeding, and mortality risks in elderly medicare patients treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation 2015; 131: 157–164.
397. Apostolakis S, et al. Factors affecting quality of anticoagulation control among patients with atrial fibrillation on warfarin: the SAMe-TT(2)R(2) score. Chest 2013; 144: 1555–1563.
398. Lip GY, et al. Relationship of the SAMe-TT(2)R(2) score to poor-quality anticoagulation, stroke, clinically relevant bleeding, and mortality in patients with atrial fibrillation. Chest 2014; 146: 719–726.
399. Gallego P, et al. SAMe-TT2R2 score, time in therapeutic range, and outcomes in anticoagulated patients with atrial fibrillation. Am J Med 2014; 127: 1083–1088.
400. Eikelboom JW, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med 2013; 369: 1206–1214.
401. Olesen JB, et al. Non-vitamin K antagonist oral anticoagulation agents in anticoagulant naive atrial fibrillation patients: Danish nationwide descriptive data 2011–2013. Europace 2015; 17: 187–193.
402. Hylek EM, et al. Major bleeding in patients with atrial fibrillation receiving apixaban or warfarin: The ARISTOTLE Trial (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation): Predictors, Characteristics, and Clinical Outcomes. J Am Coll Cardiol 2014; 63: 2141–2147.
403. Flaker GC, et al. Bleeding during treatment with aspirin versus apixaban in patients with atrial fibrillation unsuitable for warfarin: the apixaban versus acetylsalicylic acid to prevent stroke in atrial fibrillation patients who have failed or are unsuitable for vitamin K antagonist treatment (AVERROES) trial. Stroke 2012; 43: 3291–3297.
404. Connolly SJ, et al. Randomized Evaluation of Long-Term Anticoagulation Therapy Investigators. Newly identified events in the RE-LY trial. N Engl J Med 2010; 363: 1875–1876.
405. Ruff CT, et al. Association between edoxaban dose, concentration, anti-Factor Xa activity, and outcomes: an analysis of data from the randomised, double-blind ENGAGE AF-TIMI 48 trial. Lancet 2015; 385: 2288–2295.
406. Beyer-Westendorf J, et al. Rates, management, and outcome of rivaroxaban bleeding in daily care: results from the Dresden NOAC registry. Blood 2014; 124: 955–962.
407. Camm AJ, et al. XANTUS: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation. Eur Heart J 2016; 37: 1145–1153.
408. Wallentin L, et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet 2010; 376: 975–983.
409. Piccini JP, et al. Relationship between time in therapeutic range and comparative treatment effect of rivaroxaban and warfarin: results from the ROCKET AF trial. J Am Heart Assoc 2014; 3: e000521.
410. Olesen JB, et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012; 367: 625–635.
411. Albertsen IE, et al. Risk of stroke or systemic embolism in atrial fibrillation patients treated with warfarin: A systematic review and meta-analysis. Stroke 2013; 44: 1329–1336.
412. Hart RG, et al. Warfarin in atrial fibrillation patients with moderate chronic kidney disease. Clin J Am Soc Nephrol 2011; 6: 2599–2604.
413. Friberg L, et al. Balancing stroke and bleeding risks in patients with atrial fibrillation and renal failure: the Swedish Atrial Fibrillation Cohort study. Eur Heart J 2014: 36: 297–306.
414. Jun M, et al. The association between kidney function and major bleeding in older adults with atrial fibrillation starting warfarin treatment: population based observational study. BMJ 2015; 350: h246.
415. Del-Carpio Munoz F, et al. Meta-Analysis of Renal Function on the Safety and Efficacy of Novel Oral Anticoagulants for Atrial Fibrillation. Am J Cardiol 2016; 117: 69–75.
416. Heidbuchel H, et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17: 1467–1507.
417. Zimmerman D, et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012; 27: 3816–3822.
418. Marinigh R, et al. Severe renal impairment and stroke prevention in atrial fibrillation: implications for thrombo-prophylaxis and bleeding risk. J Am Coll Cardiol 2011; 57: 1339–1348.
419. Wizemann V, et al. Atrial fibrillation in hemodialysis patients: clinical features and associations with anticoagulant therapy. Kidney Int 2010; 77: 1098–1106.
420. Chan KE, et al. Warfarin use associates with increased risk for stroke in hemodialysis patients with atrial fibrillation. J Am Soc Nephrol 2009; 20: 2223–2233.
421. Winkelmayer WC, et al. Effectiveness and safety of warfarin initiation in older hemodialysis patients with incident atrial fibrillation. Clin J Am Soc Nephrol 2011; 6: 2662–2668.
422. Shah M, et al. Warfarin use and the risk for stroke and bleeding in patients with atrial fibrillation undergoing dialysis. Circulation 2014; 129: 1196–1203.
423. Bonde AN, et al. Net clinical benefit of antithrombotic therapy in patients with atrial fibrillation and chronic kidney disease: a nationwide observational cohort study. J Am Coll Cardiol 2014; 64: 2471–2482.
424. Chan KE, et al. Dabigatran and rivaroxaban use in atrial fibrillation patients on hemodialysis. Circulation 2015; 131: 972–979.
425. Hijazi Z, et al. Efficacy and safety of dabigatran compared with warfarin in relation to baseline renal function in patients with atrial fibrillation: a RE-LY (Randomized Evaluation of Long-term Anticoagulation Therapy) trial analysis. Circulation 2014; 129: 961–970.
426. Fox KA, et al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin in patients with non-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011; 32: 2387–2394.
427. Hohnloser SH, et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: insights from the ARISTOTLE trial. Eur Heart J 2012; 33: 2821–2830.
428. Stroke Prevention in Atrial Fibrillation Investigators. Stroke Prevention in Atrial Fibrillation Study. Final results. Circulation 1991; 84: 527–539.
429. Olesen JB, et al. Risks of thromboembolism and bleeding with thromboprophylaxis in patients with atrial fibrillation: A net clinical benefit analysis using a ‘real world’ nationwide cohort study. Thromb Haemost 2011; 106: 739–749.
430. Sjalander S, et al. Atrial fibrillation patients do not benefit from acetylsalicylic acid. Europace 2014; 16: 631–638.
431. ACTIVE Writing Group of the ACTIVE Investigators, Connolly S, et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367: 1903–1912.
432. Connolly SJ, et al. Benefit of oral anticoagulant over antiplatelet therapy in atrial fibrillation depends on the quality of international normalized ratio control achieved by centers and countries as measured by time in therapeutic range. Circulation 2008; 118: 2029–2037.
433. Connolly SJ, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med 2009; 360: 2066–2078.
434. vanWalraven C, et al. Effect of age on stroke prevention therapy in patients with atrial fibrillation: the atrial fibrillation investigators. Stroke 2009; 40: 1410–1416.
435. Olesen KH. The natural history of 271 patients with mitral stenosis under medical treatment. Br Heart J 1962; 24: 349–357.
436. Perez-Gomez F, et al. Comparative effects of antiplatelet, anticoagulant, or combined therapy in patients with valvular and nonvalvular atrial fibrillation: a randomized multicenter study. J Am Coll Cardiol 2004; 44: 1557–1566.
437. Rowe JC, et al. The course of mitral stenosis without surgery: ten- and twenty-year perspectives. Ann Intern Med 1960; 52: 741–749.
438. Wilson JK, et al. The natural history of mitral stenosis. Can Med Assoc J 1954; 71: 323–331.
439. Cannegieter SC, et al. Warfarin and aspirin afterheart-valve replacement. N Engl J Med 1994; 330: 507–508; author reply 508-509.
440. Chiang CW, et al. Predictors of systemic embolism in patients with mitral stenosis. A prospective study. Ann Intern Med 1998; 128: 885–889.
441. Wan Y, et al. Anticoagulation control and prediction of adverse events in patients with atrial fibrillation: a systematic review. Circ Cardiovasc Qual Outcomes 2008; 1: 84–91.
442. Morgan CL, et al. Warfarin treatment in patients with atrial fibrillation: observing outcomes associated with varying levels of INR control. Thromb Res 2009; 124: 37–41.
443. Gallagher AM, et al. Risks of stroke and mortality associated with suboptimal anticoagulation in atrial fibrillation patients. Thromb Haemost 2011; 106: 968–977.
444. De Caterina R, et al. Vitamin K antagonists in heart disease: current status and perspectives (Section III). Position paper of the ESC Working Group on Thrombosis—Task Force on Anticoagulants in Heart Disease. Thromb Haemost 2013; 110: 1087–1107.
445. Dans AL, et al. Concomitant use of antiplatelet therapy with dabigatran or warfarin in the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) trial. Circulation 2013; 127: 634–640.
446. Bajaj NS, et al. Percutaneous left atrial appendage occlusion for stroke prophylaxis in nonvalvular atrial fibrillation: a systematic review and analysis of observational studies. JACC Cardiovasc Interv 2014; 7: 296–304.
447. Lewalter T, et al. Ischaemic stroke prevention in patients with atrial fibrillation and high bleeding risk: opportunities and challenges for percutaneous left atrial appendage occlusion. Europace 2014; 16: 626–630.
448. Meier B, et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion. Europace 2014; 16: 1397–1416.
449. Holmes DR Jr, et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol 2014; 64: 1–12.
450. Holmes DR, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised noninferiority trial. Lancet 2009; 374: 534–542.
451. Reddy VY, et al. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-Year Follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) Trial. Circulation 2013; 127: 720–729.
452. Reddy VY, et al. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. JAMA 2014; 312: 1988–1998.
453. Holmes DR Jr,, et al. Left Atrial Appendage Closure as an Alternative toWarfarin for Stroke Prevention in Atrial Fibrillation: A Patient-Level Meta-Analysis. J Am Coll Cardiol 2015; 65: 2614–2623.
454. Reddy VY, et al. Left atrial appendage closure with the Watchman device in patients with a contraindication for oral anticoagulation: the ASAP study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). J Am Coll Cardiol 2013; 61: 2551–2556.
455. Santoro G, et al. Percutaneous left atrial appendage occlusion in patients with non-valvular atrial fibrillation: implantation and up to four years follow-up of the AMPLATZER Cardiac Plug. EuroIntervention 2016; 11: 1188–1194.
456. Badheka AO, et al. Utilization and adverse outcomes of percutaneous left atrial appendage closure for stroke prevention in atrial fibrillation in the United States: influence of hospital volume. Circ Arrhythm Electrophysiol 2015; 8: 42–48.
457. Pison L, et al. Left atrial appendage closure-indications, techniques, and outcomes: results of the European Heart Rhythm Association Survey. Europace 2015; 17: 642–646.
458. Price MJ, et al. Early safety and efficacy of percutaneous left atrial appendage suture ligation: results from the U.S. transcatheter LAA ligation consortium. J Am Coll Cardiol 2014; 64: 565–572.
459. Boersma LV, et al. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. Eur Heart J; doi: https://doi.org/10.1093/eurheartj/ehv730. Published online ahead of print27 January 2016.
460. Kuramatsu JB, et al. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulationrelated intracerebral hemorrhage. JAMA 2015; 313: 824–836.
461. Budera P, et al. Comparison of cardiac surgery with left atrial surgical ablation vs. cardiac surgery without atrial ablation in patients with coronary and/or valvular heart disease plus atrial fibrillation: final results of the PRAGUE-12 randomized multicentre study. Eur Heart J 2012; 33: 2644–2652.
462. Healey JS, et al. Left Atrial Appendage Occlusion Study (LAAOS): results of a randomized controlled pilot study of left atrial appendage occlusion during coronary bypass surgery in patients at risk for stroke. Am Heart J 2005; 150: 288–293.
463. Tsai YC, et al. Surgical left atrial appendage occlusion during cardiac surgery for patients with atrial fibrillation: a meta-analysis. Eur J Cardiothorac Surg 2015; 47: 847–854.
464. Whitlock RP, et al. Left Atrial Appendage Occlusion Study II (LAAOS II). Can J Cardiol 2013; 29: 1443–1447.
465. Aryana A, et al. Association between incomplete surgical ligation of left atrial appendage and stroke and systemic embolization. Heart Rhythm 2015; 12: 1431–1437.
466. Gillinov AM, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med 2015; 372: 1399–1409.
467. Whitlock R, et al. Rationale and design of the Left Atrial Appendage Occlusion Study (LAAOS) III. Ann Cardiothorac Surg 2014; 3: 45–54.
468. Boersma LV, et al. Atrial fibrillation catheter ablation versus surgical ablation treatment (FAST): a 2-center randomized clinical trial. Circulation 2012; 125: 23–30.
469. Grau AJ, et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001; 32: 2559–2566.
470. Giles MF, et al. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis. Lancet Neurol 2007; 6: 1063–1072.
471. Emberson J, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individualpatient data from randomised trials. Lancet 2014; 384: 1929–1935.
472. Diener HC, et al. Anti-thrombotic therapy in patients with atrial fibrillation and intracranial hemorrhage. Expert Rev Neurother 2014; 14: 1019–1028.
473. Hankey GJ, et al. Management of acute stroke in patients taking novel oral anticoagulants. Int J Stroke 2014; 9: 627–632.
474. Xian Y, et al. Risks of intracranial hemorrhage among patients with acute ischemic stroke receiving warfarin and treated with intravenous tissue plasminogen activator. JAMA 2012; 307: 2600–2608.
475. Pollack CV Jr, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511–520.
476. Badhiwala JH, et al. Endovascular Thrombectomy for Acute Ischemic Stroke: A Meta-analysis. JAMA 2015; 314: 1832–1843.
477. Paciaroni M, et al. Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke: a meta-analysis of randomized controlled trials. Stroke 2007; 38: 423–430.
478. Heidbuchel H, et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013; 15: 625–651.
479. Diener HC, et al. Dabigatran compared with warfarin in patients with atrial fibrillation and previous transient ischaemic attack or stroke: a subgroup analysis of the RE-LY trial. Lancet Neurol 2010; 9: 1157–1163.
480. Hankey GJ, et al. Rivaroxaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of ROCKET AF. Lancet Neurol 2012; 11: 315–322.
481. Easton JD, et al. Apixaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of the ARISTOTLE trial. Lancet Neurol 2012; 11: 503–511.
482. Ntaios G, et al. Nonvitamin-K-antagonist oral anticoagulants in patients with atrial fibrillation and previous stroke or transient ischemic attack: a systematic review and meta-analysis of randomized controlled trials. Stroke 2012; 43: 3298–3304.
483. Paciaroni M, et al. Should oral anticoagulants is restarted after warfarin-associated cerebral haemorrhage in patients with atrial fibrillation? Thromb Haemost 2014; 111: 14–18.
484. Nielsen PB, et al. Restarting Anticoagulant Treatment After Intracranial Hemorrhage in Patients With Atrial Fibrillation and the Impact on Recurrent Stroke, Mortality, and Bleeding: A Nationwide Cohort Study. Circulation 2015; 132: 517–525.
485. Weber R, et al. Antiplatelet therapy in cerebrovascular disorders. Handb Exp Pharmacol 2012: 519–546.
486. Flaker GC, et al. Risks and benefits of combining aspirin with anticoagulant therapy in patients with atrial fibrillation: an exploratory analysis of stroke prevention using an oral thrombin inhibitor in atrial fibrillation (SPORTIF) trials. Am Heart J 2006; 152: 967–973.
487. Yung D, et al. Investigators of the Registry of the Canadian Stroke Network. Reinitiation of anticoagulation after warfarin-associated intracranial hemorrhage and mortality risk: the Best Practice for Reinitiating Anticoagulation Therapy After Intracranial Bleeding (BRAIN) study. Can J Cardiol 2012; 28: 33–39.
488. Roskell NS, et al. Major bleeding in patients with atrial fibrillation receiving vitamin K antagonists: a systematic review of randomized and observational studies. Europace 2013; 15: 787–797.
489. Mancia G, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34: 2159–2219.
490. Eikelboom JW, et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation 2011; 123: 2363–2372.
491. Goodman SG, et al. Factors associated with major bleeding events: insights from the ROCKETAF trial (rivaroxaban once-daily oral direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and embolism trial in atrial fibrillation). J Am Coll Cardiol 2014; 63: 891–900.
492. Chang HY, et al. Risk of gastrointestinal bleeding associated with oral anticoagulants: population based retrospective cohort study. BMJ 2015; 350: h1585.
493. Abraham NS, et al. Comparative risk of gastrointestinal bleeding with dabigatran, rivaroxaban, and warfarin: population based cohort study. BMJ 2015; 350: h1857.
494. Björck F, et al. Outcomes in a arfarin-Treated Population With Atrial Fibrillation. JAMA Cardiology 2016; 1: 172–180.
495. Jacobs LG, et al. Anticoagulation for stroke prevention in elderly patients with atrial fibrillation, including those with falls and/or early-stage dementia: a single-center, retrospective, observational study. Am J Geriatr Pharmacother 2009; 7: 159–166.
496. Banerjee A, et al. Prior history of falls and risk of outcomes in atrial fibrillation: the Loire Valley Atrial Fibrillation Project. Am J Med 2014; 127: 972–978.
497. Palareti G, et al. Bleeding with anticoagulation therapy – who is at risk, and how best to identify such patients. Thromb Haemost 2009; 102: 268–278.
498. van Schie RM, et al. Genotype-guided dosing of coumarin derivatives: the European pharmacogenetics of anticoagulant therapy (EU-PACT) trial design. Pharmacogenomics 2009; 10: 1687–1695.
499. International Warfarin Pharmacogenetics Consortium, Klein TE, et al. Estimation of the warfarin dose with clinical and pharmacogenetic data. N Engl J Med 2009; 360: 753–764.
500. Schwarz UI, et al. Genetic determinants of response to warfarin during initial anticoagulation. N Engl J Med 2008; 358: 999–1008.
501. Tang T, et al. Genotype-Guided Dosing of Coumarin Anticoagulants: A Meta-analysis of Randomized Controlled Trials. J Cardiovasc Pharmacol Ther 2015; 20: 387–394.
502. Douketis JD, et al. BRIDGE Investigators. Perioperative Bridging Anticoagulation in Patients with Atrial Fibrillation. N Engl J Med 2015; 373: 823–833.
503. Cuker A, et al. Laboratory measurement of the anticoagulant activity of the non-vitamin K oral anticoagulants. J Am Coll Cardiol 2014; 64: 1128–1139.
504. Niessner A, et al. Reversal strategies for non-vitamin K antagonist oral anticoagulants: a critical appraisal of available evidence and recommendations for clinical management-a joint position paper of the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy and European Society of Cardiology Working Group on Thrombosis. Eur Heart J; doi: https://doi.org/10.1093/eurheartj/ehv676. Published online ahead of print 24 December 2015.
505. Hanley JP. Warfarin reversal. J Clin Pathol 2004; 57: 1132–1139.
506. Parry-Jones AR, et al. Reversal strategies for vitamin K antagonists in acute intracerebral hemorrhage. Ann Neurol 2015; 78: 54–62.
507. Goldstein JN, et al. Four-factor prothrombin complex concentrate versus plasma for rapid vitamin K antagonist reversal in patients needing urgent surgical or invasive interventions: a phase 3b, open-label, non-inferiority, randomised trial. Lancet 2015; 385: 2077–2087.
508. Siegal DM, et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med 2015; 373: 2413–2424.
509. Crowther M, et al. Antidotes for novel oral anticoagulants: current status and future potential. Arterioscler Thromb Vasc Biol 2015; 35: 1736–1745.
510. Staerk L, et al. Stroke and recurrent haemorrhage associated with antithrombotic treatment after gastrointestinal bleeding in patients with atrial fibrillation: nationwide cohort study. BMJ 2015; 351: h5876.
511. Felmeden DC, et al. Antithrombotic therapy in hypertension: a Cochrane Systematic review. J Hum Hypertens 2005; 19: 185–196.
512. Sharma M, et al. Efficacy and Harms of Direct Oral Anticoagulants in the Elderly for Stroke Prevention in Atrial Fibrillation and Secondary Prevention of Venous Thromboembolism: Systematic Review and Meta-Analysis. Circulation 2015; 132: 194–204.
513. Ruiz-Nodar JM, et al. Anticoagulant and antiplatelet therapy use in 426 patients with atrial fibrillation undergoing percutaneous coronary intervention and stent implantation implications for bleeding risk and prognosis. J Am Coll Cardiol 2008; 51: 818–825.
514. Hansen ML, et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med 2010; 170: 1433–1441.
515. Lamberts M, et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012; 126: 1185–1193.
516. Windecker S, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for ardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2014; 35: 2541–2619.
517. Vandvik PO, et al. American College of Chest Physicians. Primary and secondary prevention of cardiovascular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 012; 141: e637S–668S.
518. Rubboli A, et al. The optimal management of patients on oral anticoagulation undergoing coronary artery stenting. The 10th Anniversary Overview. Thromb Haemost 2014; 112: 1080–1087.
519. Oldgren J, et al. New ral anticoagulants in addition to single or dual antiplatelet therapy after an acute oronary syndrome: a systematic review and meta-analysis. Eur Heart J 2013; 34: 1670–1680.
520. Lip GY, et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary or valve interventions: a joint consensus document of the European Society of Cardiology Working Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS) and Asia-Pacific Heart Rhythm Society (APHRS). Eur Heart J 2014; 35: 3155–3179.
521. Mega JL, et al. Rivaroxaban versus placebo in patients with acute coronary syndromes (ATLAS ACS-TIMI 46): a randomised, double-blind, phase II trial. Lancet 2009; 374: 29–38.
522. Sarafoff N, et al. Triple therapy with aspirin, prasugrel, and vitamin K antagonists in patients with drug-eluting stent implantation and an indication for oral anticoagulation. J Am Coll Cardiol 2013; 61: 2060–2066.
523. Jackson LR II, et al. Outcomes of Patients With Acute Myocardial Infarction Undergoing Percutaneous Coronary Intervention Receiving an Oral Anticoagulant and Dual Antiplatelet Therapy: A Comparison of Clopidogrel Versus Prasugrel From the TRANSLATE-ACS Study. JACC Cardiovasc Interv 2015; 8: 1880–1889.
524. Dewilde WJM, et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013; 381: 1107–1115.
525. Braun OÖ, et al. Concomitant use of warfarin and ticagrelor as an alternative to triple antithrombotic therapy after an acute coronary syndrome. Thromb Res 2015; 135: 26–30.
526. Nikolaidou T, et al. Chronic atrial fibrillation: a systematic review of medical heart rate control management. Postgrad Med J 2009; 85: 303–312.
527. Tamariz LJ, Bass EB. Pharmacological rate control of atrial fibrillation. Cardiol Clin 2004; 22: 35–45.
528. Segal JB, et al. The evidence regarding the drugs used for ventricular rate control. In. J Fam Practice 2000; 49: 47–59.
529. Schreck DM, et al. Emergency management of atrial fibrillation and flutter: intravenous diltiazem versus intravenous digoxin. Ann Emerg Med 1997; 29: 135–140.
530. Siu CW, et al. Intravenous diltiazem is superior to intravenous amiodarone or digoxin for achieving ventricular rate control in patients with acute uncomplicated atrial fibrillation. Crit Care Med 2009; 37: 2174–2179; quiz 2180.
531. Tisdale JE, et al. A randomized, double-blind comparison of intravenous diltiazem and digoxin for atrial fibrillation after coronary artery bypass surgery. Am Heart J 1998; 135: 739–747.
532. Scheuermeyer FX, et al. Safety and efficiency of calcium channel blockers versus betablockers for rate control in patients with atrial fibrillation and no acute underlying medical illness. Acad Emerg Med 2013; 20: 222–230.
533. Darby AE, Dimarco JP. Management of atrial fibrillation in patients with structural heart disease. Circulation 2012; 125: 945–957.
534. Elkayam U. Calcium channel blockers in heart failure. Cardiology 1998; 89: 38–46.
535. Goldstein RE, et al. Diltiazem increases late-onset congestive heart failure in postinfarction patients with early reduction in ejection fraction. The Adverse Experience Committee; and the Multicenter Diltiazem Postinfarction Research Group. Circulation 1991; 83: 52–60.
536. Clemo HF, et al. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol 1998; 81: 594–598.
537. Delle Karth G, et al. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med 001; 29: 1149–1153.
538. Hou ZY, et al. Acute treatment of recent-onset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone. A randomized, digoxin-controlled study. Eur Heart J 1995; 16: 521–528.
539. National Institute for Health and Care Excellence (NICE) guidelines. Atrial fibrillation: management. http://www.nice.org.uk/guidance/cg180/ (5 May 2016).
540. Kotecha D, et al. Beta-Blockers in Heart Failure Collaborative Group. Effect of age and sex on efficacy and tolerability of b blockers in patients with heart failure with reduced ejection fraction: individual patient data meta-analysis. BMJ 2016; 353: i1855.
541. Ulimoen SR, et al. Comparison of four single-drug regimens on ventricular rate and arrhythmia-related symptoms in patients with permanent atrial fibrillation. Am J Cardiol 2013; 111: 225–230.
542. Ulimoen SR, et al. Calcium channel blockers improve exercise capacity and reduce N-terminal Pro-B-type natriuretic peptide levels compared with beta-blockers in patients with permanent atrial fibrillation. Eur Heart J 2014; 35: 517–524.
543. Goldberger ZD, et al. Digitalis use in contemporary clinical practice: refitting the foxglove. JAMA Intern Med 2014; 174: 151–154.
544. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525–533.
545. Ahmed A, et al. Gheorghiade M. Effects of digoxin on morbidity and mortality in diastolic heart failure: the ancillary digitalis investigation group trial. Circulation 2006; 114: 397–403.
546. Ziff OJ, et al. Digoxin: The good and the bad. Trends in Cardiovascular Medicine; doi: https://doi.org/10.1016/j.tcm.2016.03.011. Published online ahead of print 30 March 2016.
547. Turakhia MP, et al. Increased mortality associated with digoxin in contemporary patients with atrial fibrillation: findings from the TREAT-AF study. J Am Coll Cardiol 2014; 64: 660–668.
548. Hallberg P, et al. Digoxin and mortality in atrial fibrillation: a prospective cohort study. Eur J Clin Pharmacol 2007; 63: 959–971.
549. Whitbeck MG, et al. Increased mortality among patients taking digoxin—analysis from the AFFIRM study. Eur Heart J 2013; 34: 1481–1488.
550. Gheorghiade M, et al. Lack of evidence of increased mortality among patients with atrial fibrillation taking digoxin: findings from post hoc propensity-matched analysis of the AFFIRM trial. Eur Heart J 2013; 34: 1489–1497.
551. Flory JH, et al. Observational cohort study of the safety of digoxin use in women with heart failure. BMJ Open 2012; 2: e000888.
552. Andrey JL, et al. Mortality and morbidity of heart failure treated with digoxin. A propensity-matched study. Int J Clin Pract 2011; 65: 1250–1258.
553. Allen LA, et al. Digoxin Use and Subsequent Outcomes Among Patients in a Contemporary Atrial Fibrillation Cohort. J Am Coll Cardiol 2015; 65: 2691–2698.
554. Khand AU, et al. Carvedilol alone or in combination with digoxin for the management of atrial fibrillation in patients with heart failure? J Am Coll Cardiol 2003; 42: 1944–1951.
555. Farshi R, et al. Ventricular rate control in chronic atrial fibrillation during daily activity and programmed exercise: a crossover open-label study of five drug regimens. J Am Coll Cardiol 1999; 33: 304–310.
556. Koh KK, et al. Efficacy and safety of digoxin alone and in combination with low-dose diltiazem or betaxolol to control ventricular rate in chronic atrial fibrillation. Am J Cardiol 1995; 75: 88–90.
557. Lewis RV, et al. Effects of atenolol, verapamil, and xamoterol on heart rate and exercise tolerance in digitalised patients with chronic atrial fibrillation. J Cardiovasc Pharmacol 1989; 13: 1–6.
558. Tsuneda T, et al. Rate control and quality of life in patients with permanent atrial fibrillation: the Quality of Life and Atrial Fibrillation (QOLAF) Study. Circ J 2006; 70: 965–970.
559. ClinicalTrials.gov. Rate Control Therapy Evaluation in Permanent Atrial Fibrillation (RATE-AF). https://clinicaltrials.gov/ct2/show/NCT02391337 (5 May 2016).
560. Van Gelder IC, et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362: 1363–1373.
561. Groenveld HF, et al. The effect of rate control on quality of life in patients with permanent atrial fibrillation: data from the RACE II (Rate Control Efficacy in Permanent Atrial Fibrillation II) study. J Am Coll Cardiol 2011; 58: 1795–1803.
562. Van Gelder IC, et al. Does intensity of rate-control influence outcome in atrial fibrillation? An analysis of pooled data from the RACE and AFFIRM studies. Europace 2006; 8: 935–942.
563. Queiroga A, et al. Ablate and pace revisited: long term survival and predictors of permanent atrial fibrillation. Heart 2003; 89: 1035–1038.
564. Lim KT, et al. Ablate and pace strategy for atrial fibrillation: long-term outcome of AIRCRAFT trial. Europace 2007; 9: 498–505.
565. Geelen P, et al. Ventricular fibrillation and sudden death after radiofrequency catheter ablation of the atrioventricular junction. Pacing Clin Electrophysiol 1997; 20: 343–348.
566. Wang RX, et al. Effect of pacing method on risk of sudden death after atrioventricular node ablation and pacemaker implantation in patients with atrial fibrillation. Heart Rhythm 2013; 10: 696–701.
567. Chatterjee NA, et al. Atrioventricular nodal ablation in atrial fibrillation: a meta-analysis and systematic review. Circ Arrhythm Electrophysiol 2012; 5: 68–76.
568. Bradley DJ, et al. Overview of management of atrial fibrillation in symptomatic elderly patients: pharmacologic therapy versus AV node ablation. Clin Pharmacol Ther 2007; 81: 284–287.
569. Wood MA, et al. Clinical outcomes after ablation and pacing therapy for atrial fibrillation: a meta-analysis. Circulation 2000; 101: 1138–1144.
570. Ozcan C, et al. Long-term survival after ablation of the atrioventricular node and implantation of a permanent pacemaker in patients with atrial fibrillation. N Engl J Med 2001; 344: 1043–1051.
571. Hess PL, et al. Is cardiac resynchronization therapy an antiarrhythmic therapy for atrial fibrillation? A systematic review and meta-analysis. Curr Cardiol Rep 2013; 15: 330.
572. Hoppe UC, et al. Effect of cardiac resynchronization on the incidence of atrial fibrillation in patients with severe heart failure. Circulation 2006; 114: 18–25.
573. Brignole M, et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34: 2281–2329.
574. Chatterjee NA, et al. Atrioventricular nodal ablation in atrial fibrillation: a meta-analysis of biventricular vs. right ventricular pacing mode. Eur J Heart Fail 2012; 14: 661–667.
575. Lewis RV, et al. Relationships between heart rate, exercise tolerance and cardiac output in atrial fibrillation: the effects of treatment with digoxin, verapamil and diltiazem. Eur Heart J 1988; 9: 777–781.
576. Mulder BA, et al. Digoxin in patients with permanent atrial fibrillation: data from the RACE II study. Heart Rhythm 2014; 11: 1543–1550.
577. Koh KK, et al. Comparative study of efficacy and safety of low-dose diltiazem or betaxolol in combination with digoxin to control ventricular rate in chronic atrial fibrillation: randomized crossover study. Int J Cardiol 1995; 52: 167–174.
578. Chatterjee S, et al. Pharmacologic rate versus rhythm-control strategies in atrial fibrillation: an updated comprehensive review and meta-analysis. PACE 2013; 36: 122–133.
579. de Denus S, et al. Rate vs rhythm control in patients with atrial fibrillation: a meta-analysis. Arch Intern Med 2005; 165: 258–262.
580. Lafuente-Lafuente C, et al. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev 2012; 5: CD005049.
581. Roy D, et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342: 913–920.
582. Roy D, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008; 358: 2667–2677.
583. Singh BN, et al. Dronedarone for maintenance of sinus rhythm in atrial fibrillation or flutter. N Engl J Med 2007; 357: 987–999.
584. Kirchhof P, et al. Short-term versus long-term antiarrhythmic drug treatment after cardioversion of atrial fibrillation (Flec-SL): a prospective, randomised, open-label, blinded endpoint assessment trial. Lancet 2012; 380: 238–246.
585. Cosedis Nielsen J, et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation. N Engl J Med 2012; 367: 1587–1595.
586. Wilber DJ, et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA 2010; 303: 333–340.
587. Arbelo E, et al. The atrial fibrillation ablation pilot study: a European Survey on Methodology and results of catheter ablation for atrial fibrillation conducted by the European Heart Rhythm Association. Eur Heart J 2014; 35: 1466–1478.
588. Hohnloser SH, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668–678.
589. Wyse DG, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825–1833.
590. Van Gelder IC, et al. Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347: 1834–1840.
591. Opolski G, et al. Investigators of the Polish How to Treat Chronic Atrial Fibrillation Study. Rate control vs rhythm control in patients with nonvalvular persistent atrial fibrillation: the results of the Polish How to Treat Chronic Atrial Fibrillation (HOT CAFE) Study. Chest 2004; 126: 476–486.
592. Kong MH, et al. Is rhythmcontrol superior to rate-control in patients with atrial fibrillation and diastolic heart failure? Ann Noninvasive Electrocardiol 2010; 15: 209–217.
593. Kotecha D, et al. Rate and rhythm control have comparable effects on mortality and stroke in atrial fibrillation but better data are needed. Evid Based Med 2014; 19: 222–223.
594. ClinicalTrials.gov. Catheter Ablation vs Anti-arrhythmic Drug Therapy for Atrial Fibrillation Trial (CABANA). https://clinicaltrials.gov/ct2/show/NCT00911508 (5 May 2016).
595. Khan IA. Oral loading single dose flecainide for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol 2003; 87: 121–128.
596. Chevalier P, et al. Amiodarone versus placebo and class Ic drugs for cardioversion of recent-onset atrial fibrillation: a meta-analysis. J Am Coll Cardiol 2003; 41: 255–262.
597. Letelier LM, et al. Effectiveness of amiodarone for conversion of atrial fibrillation to sinus rhythm: a meta-analysis. Arch Intern Med 2003; 163: 777–785.
598. Khan IA, et al. Amiodarone for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol 2003; 89: 239–248.
599. Thomas SP, et al. Rapid loading of sotalol or amiodarone for management of recent onset symptomatic atrial fibrillation: a randomized, digoxin-controlled trial. Am Heart J 2004; 147: E3.
600. Vijayalakshmi K, et al. A randomized trial of prophylactic antiarrhythmic agents (amiodarone and sotalol) in patients with atrial fibrillation for whom direct current cardioversion is planned. Am Heart J 2006; 151: 863.e1–6.
601. Singh BN, et al. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005; 352: 1861–1872.
602. Roy D, et al. Vernakalant hydrochloride for rapid conversion of atrial fibrillation: a phase 3, randomized, placebo controlled trial. Circulation 2008; 117: 1518–1525.
603. Kowey PR, et al. Vernakalant hydrochloride for the rapid conversion of atrial fibrillation after cardiac surgery: a randomized, double-blind, placebo-controlled trial. Circ Arrhythm Electrophysiol 2009; 2: 652–659.
604. Camm AJ, et al. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodarone in recent-onset atrial fibrillation. J Am Coll Cardiol 2011; 57: 313–321.
605. Bash LD, et al. Systematic reviewand meta-analysis of the efficacy of cardioversion by vernakalant and comparators in patients with atrial fibrillation. Cardiovasc Drugs Ther 2012; 26: 167–179.
606. Falk RH, et al. Intravenous dofetilide, a class III antiarrhythmic agent, for the termination of sustained atrial fibrillation or flutter. Intravenous Dofetilide Investigators. J Am Coll Cardiol 1997; 29: 385–390.
607. Dankner R, et al. Treatment of stable atrial fibrillation in the emergency department: a population-based comparison of electrical direct-current versus pharmacological cardioversion or conservative management. Cardiology 2009; 112: 270–278.
608. Chen WS, et al. Comparison of pharmacological and electrical cardioversion in permanent atrial fibrillation after prosthetic cardiac valve replacement: a prospective randomized trial. J Int Med Res 2013; 41: 1067–1073.
609. Gitt AK, et al. Types and outcomes of cardioversion in patients admitted to hospital for atrial fibrillation: results of the German RHYTHM-AF Study. Clin Res Cardiol 2013; 102: 713–723.
610. Cristoni L, et al. Cardioversion of acute atrial fibrillation in the short observation unit: comparison of a protocol focused on electrical cardioversion with simple antiarrhythmic treatment. Emerg Med J 2011; 28: 932–937.
611. Bellone A, et al. Cardioversion of acute atrial fibrillation in the emergency department: a prospective randomised trial. Emerg Med J 2012; 29: 188–191.
612. Crijns HJ, et al. Contemporary real life cardioversion of atrial fibrillation: Results from the multinational RHYTHM-AF study. Int J Cardiol 2014; 172: 588–594.
613. Lip GY, et al. Overtreatment and undertreatment with anticoagulation in relation to cardioversion of atrial fibrillation (the RHYTHM-AF study). Am J Cardiol 2014; 113: 480–484.
614. Reisinger J, et al. Flecainide versus ibutilide for immediate cardioversion of atrial fibrillation of recent onset. Eur Heart J 2004; 25: 1318–1324.
615. Stambler BS, et al. Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation. Ibutilide Repeat Dose Study Investigators. Circulation 1996; 94: 1613–1621.
616. Torp-Pedersen C, et al. Vernakalant: conversion of atrial fibrillation in patients with ischemic heart disease. Int J Cardiol 2013; 166: 147–151.
617. Savelieva I, et al. Pharmacological cardioversion of atrial fibrillation with vernakalant: evidence in support of the ESC Guidelines. Europace 2014; 16: 162–173.
618. Simon A, et al. Vernakalant is superior to ibutilide for achieving sinus rhythm in patients with recent-onset atrial fibrillation: a randomized controlled trial at the emergency department. Europace; doi: https://doi.org/10.1093/europace/euw052. Published online ahead of print 22 March 2016.
619. Reisinger J, et al. Prospective comparison of flecainide versus sotalol for immediate cardioversion of atrial fibrillation. Am J Cardiol 1998; 81: 1450–1454.
620. Alboni P, et al. Outpatient treatment of recent-onset atrial fibrillation with the „pill-in-the-pocket” approach. N Engl J Med 2004; 351: 2384–2391.
621. Saborido CM, et al. Systematic review and cost-effectiveness evaluation of ‘pill-in-the-pocket’ strategy for paroxysmal atrial fibrillation compared to episodic in-hospital treatment or continuous antiarrhythmic drug therapy. Health Technol Assess 2010; 14: iii–iv, 1–75.
622. Khan IA. Single oral loading dose of propafenone for pharmacological cardioversion of recent-onset atrial fibrillation. J Am Coll Cardiol 2001; 37: 542–547.
623. Stroobandt R, et al. Propafenone for conversion and prophylaxis of atrial fibrillation. Propafenone Atrial Fibrillation Trial Investigators. Am J Cardiol 1997; 79: 418–423.
624. Hughes C, et al. Oral propafenone for rapid conversion of recent onset atrial fibrillation – A review. Can J Cardiol 1997; 13: 839–842.
625. Zhang N, et al. Comparison of intravenous ibutilide vs. propafenone for rapid termination of recent onset atrial fibrillation. Int J Clin Pract 2005; 59: 1395–1400.
626. Mittal S, et al. Transthoracic cardioversion of atrial fibrillation: comparison of rectilinear biphasic versus damped sine wave monophasic shocks. Circulation 2000; 101: 1282–1287.
627. Kirchhof P, et al. Anterior-posterior versus anteriorlateral electrode positions for external cardioversion of atrial fibrillation: a randomised trial. Lancet 2002; 360: 1275–1279.
628. Kirchhof P, et al. A trial of self-adhesive patch electrodes and hand-held paddle electrodes for external cardioversion of atrial fibrillation (MOBIPAPA). Eur Heart J 2005; 26: 1292–1297.
629. Furniss SS, et al. Safe sedation in modern cardiological practice. Heart 2015; 101: 1526–1530.
630. Alp N, et al. Randomised comparison of antero-lateral versus antero-posterior paddle positions for DC cardioversion of persistent atrial fibrillation. Int J Cardiol 2000; 75: 211–216.
631. Singh SN, et al. Systematic electrocardioversion for atrial fibrillation and role of antiarrhythmic drugs: a substudy of the SAFE-T trial. Heart Rhythm 2009; 6: 152–155.
632. Channer KS, et al. A randomized placebo-controlled trial of pre-treatment and short- or long-term maintenance therapy with amiodarone supporting DC cardioversion for persistent atrial fibrillation. Eur Heart J 2004; 25: 144–150.
633. Oral H, et al. Facilitating transthoracic cardioversion of atrial fibrillation with ibutilide pretreatment. N Engl J Med 1999; 340: 1849–1854.
634. Mussigbrodt A, et al. Vernakalant facilitated electrical cardioversion: comparison of intravenous vernakalant and amiodarone for drug-enhanced electrical cardioversion of atrial fibrillation after failed electrical cardioversion. Europace 2016; 18: 51–56.
635. Bianconi L, et al. Effects of oral propafenone administration before electrical cardioversion of chronic atrial fibrillation: a placebo-controlled study. J Am Coll Cardiol 1996; 28: 700–706.
636. Nergardh AK, et al. Maintenance of sinus rhythm with metoprolol CR initiated before cardioversion and repeated cardioversion of atrial fibrillation: a randomized double-blind placebo-controlled study. Eur Heart J 2007; 28: 1351–1357.
637. Hemels ME, et al. Verapamil versus digoxin and acute versus routine serial cardioversion for the improvement of rhythm control for persistent atrial fibrillation. J Am Coll Cardiol 2006; 48: 1001–1009.
638. Villani GQ, et al. Effects of diltiazem pretreatment on direct-current cardioversion in patients with persistent atrial fibrillation: a single-blind, randomized, controlled study. Am Heart J 2000; 140: e12.
639. De Simone A, et al. Pretreatment with verapamil in patients with persistent or chronic atrial fibrillation who underwent electrical cardioversion. J Am Coll Cardiol 1999; 34: 810–814.
640. The Digitalis in Acute Atrial Fibrillation (DAAF) Trial Group. Intravenous digoxin in acute atrial fibrillation. Results of a randomized, placebo-controlled multicentre trial in 239 patients. Eur Heart J 1997; 18: 649–654.
641. Atarashi H, et al. Double-blind placebo-controlled trial of aprindine and digoxin for the prevention of symptomatic atrial fibrillation. Circ J 2002; 66: 553–556.
642. Airaksinen KE, et al. Thromboembolic complications after cardioversion of acute atrial fibrillation: the FinCV (Finnish CardioVersion) study. J Am Coll Cardiol 2013; 62: 1187–1192.
643. Hansen ML, et al. Thromboembolic risk in 16 274 atrial fibrillation patients undergoing direct current cardioversion with and without oral anticoagulant therapy. Europace 2015; 17: 18–23.
644. Schadlich PK, et al. Economic evaluation of enoxaparin for anticoagulation in early cardioversion of persisting nonvalvular atrial fibrillation: a statutory health insurance perspective from Germany. Am J Cardiovasc Drugs 2007; 7: 199–217.
645. Schmidt-Lucke C, et al. Quality of anticoagulation with unfractionated heparin plus phenprocoumon for the prevention of thromboembolic complications in cardioversion for non-valvular atrial fibrillation. Sub-analysis from the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Thromb Res 2007; 119: 27–34.
646. Stellbrink C, et al. Safety and efficacy of enoxaparin compared with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation 2004; 109: 997–1003.
647. Nuotio I, et al. Time to cardioversion for acute atrial fibrillation and thromboembolic complications. JAMA 2014; 312: 647–649.
648. Klein AL, et al. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med 2001; 344: 1411–1420.
649. Cappato R, et al. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation. Eur Heart J 2014; 35: 3346–3355.
650. Darkner S, et al. Recurrence of arrhythmia following short-term oral AMIOdarone after CATheter ablation for atrial fibrillation: a double-blind, randomized, placebo-controlled study (AMIO-CAT trial). Eur Heart J 2014; 35: 3356–3364.
651. Singh SN, et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med 1995; 333: 77–82.
652. Kirchhof P, et al. Giant T-U waves precede torsades de pointes in long QT syndrome: a systematic electrocardiographic analysis in patients with acquired and congenital QT prolongation. J Am Coll Cardiol 2009; 54: 143–149.
653. Goldschlager N, et al. A practical guide for clinicians who treat patients with amiodarone: 2007. Heart Rhythm 2007; 4: 1250–1259.
654. Wolkove N, et al. Amiodarone pulmonary toxicity. Can Respir J 2009; 16: 43–48.
655. Ahmed S, et al. Continuous vs episodic prophylactic treatment with amiodarone for the prevention of atrial fibrillation: a randomized trial. JAMA 2008; 300: 1784–1792.
656. Davy JM, et al. Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for the cOntrol of ventricular rate during atrial fibrillation (ERATO) study. Am Heart J 2008; 156: 527.e1–9.
657. Kober L, et al. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008; 358: 2678–2687.
658. Connolly SJ, et al. Dronedarone in high risk permanent atrial fibrillation. N Engl J Med 2011; 365: 2268–2276.
659. Tschuppert Y, et al. Effect of dronedarone on renal function in healthy subjects. Br J Clin Pharmacol 2007; 64: 785–791.
660. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321: 406–412.
661. Freemantle N, et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace 2011; 13: 329–345.
662. Sherrid MV, et al. Multicenter study of the efficacy and safety of disopyramide in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2005; 45: 1251–1258.
663. Sirak TE, et al. Oral disopyramide for the acute treatment of severe outflow obstruction in hypertrophic cardiomyopathy in the ICU setting. Chest 2008; 133: 1243–1246.
664. Sherrid MV, et al. Treatment of obstructive hypertrophic cardiomyopathy symptoms and gradient resistant to first-line therapy with beta-blockade or verapamil. Circ Heart Fail 2013; 6: 694–702.
665. Waldo AL, et al. Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival With Oral d-Sotalol. Lancet 1996; 348: 7–12.
666. Pedersen OD, et al. Efficacy of dofetilide in the treatment of atrial fibrillation-flutter in patients with reduced left ventricular function: a Danish investigations of arrhythmia and mortality on dofetilide (diamond) substudy. Circulation 2001; 104: 292–296.
667. Shamiss Y, et al. Dofetilide is safe and effective in preventing atrial fibrillation recurrences in patients accepted for catheter ablation. Europace 2009; 11: 1448–1455.
668. Haverkamp W, et al. The potential for QT prolongation and pro-arrhythmia by non-anti-arrhythmic drugs: clinical and regulatory implications. Report on a Policy Conference of the European Society of Cardiology. Cardiovasc Res 2000; 47: 219–233.
669. Käab S, et al. Sotalol testing unmasks altered repolarization in patients with suspected acquired long-QT-syndrome-a casecontrol pilot study using iv. sotalol. Eur Heart J 2003; 24: 649–657.
670. Fabritz L, et al. Predictable and less predictable unwanted cardiac drugs effects: individual pre-disposition and transient precipitating factors. Basic Clin Pharmacol Toxicol 2010; 106: 263–268.
671. Choy AM, et al. Exaggerated QT prolongation after cardioversion of atrial fibrillation. J Am Coll Cardiol 1999; 34: 396–401.
672. Patten M, et al. Suppression of paroxysmal atrial tachyarrhythmias – results of the SOPAT trial. Eur Heart J 2004; 25: 1395–1404.
673. Burashnikov A, et al. Atrialselective prolongation of refractory period with AVE0118 is due principally to inhibition of sodium channel activity. J Cardiovasc Pharmacol 2012; 59: 539–546.
674. Ford J, et al. Human electrophysiological and pharmacological properties of XEN-D0101: a novel atrial-selective Kv1.5/IKur inhibitor. J Cardiovasc Pharmacol 2013; 61: 408–415.
675. Loose S, et al. Effects of IKur blocker MK-0448 on human right atrial action potentials from patients in sinus rhythm and in permanent atrial fibrillation. Front Pharmacol 2014; 5: 26.
676. Schram G, et al. Ranolazine: ion-channel-blocking actions and in vivo electrophysiological effects. Br J Pharmacol 2004; 142: 1300–1308.
677. McCormack JG, et al. Ranolazine stimulates glucose oxidation in normoxic, ischemic and reperfused ischemic rat hearts. Circulation 1996; 93: 135–142.
678. Scirica BM, et al. Effect of ranolazine, an antianginal agent with novel electrophysiological properties, on the incidence of arrhythmias in patients with non ST-segment elevation acute coronary syndrome: results from the Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary Syndrome Thrombolysis in Myocardial Infarction 36 (MERLIN-TIMI 36) randomized controlled trial. Circulation 2007; 116: 1647–1652.
679. Scirica BM, Belardinelli L, Chaitman BR, Waks JW, Volo S, Karwatowska-Prokopczuk E, Murphy SA, Cheng ML, Braunwald E, Morrow DA. Effect of ranolazine on atrial fibrillation in patients with non-ST elevation acute coronary syndromes: observations from the MERLIN-TIMI 36 trial. Europace 2015; 17: 32–37.
680. Reiffel JA, et al. The HARMONY Trial: Combined Ranolazine and Dronedarone in the Management of Paroxysmal Atrial Fibrillation: Mechanistic and Therapeutic Synergism. Circ Arrhythm Electrophysiol 2015; 8: 1048–1056.
681. Fragakis N, Koskinas KC, Katritsis DG, Pagourelias ED, Zografos T, Geleris P. Comparison of effectiveness of ranolazine plus amiodarone versus amiodarone alone for conversion of recent-onset atrial fibrillation. Am J Cardiol 2012; 110: 673–677.
682. Simopoulos V, et al. Ranolazine enhances the antiarrhythmic activity of amiodarone by accelerating conversion of new-onset atrial fibrillation after cardiac surgery. Angiology 2014; 65: 294–297.
683. Koskinas KC, et al. Ranolazine enhances the efficacy of amiodarone for conversion of recent-onset atrial fibrillation. Europace 2014; 16: 973–979.
684. De Ferrari GM, et al. Ranolazine in the treatment of atrial fibrillation: Results of the dose-ranging RAFFAELLO (Ranolazine in Atrial Fibrillation Following An ELectricaL CardiOversion) study. Heart Rhythm 2015; 12: 872–878.
685. Martin RI, et al. Atrial fibrillation associated with ivabradine treatment: meta-analysis of randomised controlled trials. Heart 2014; 100: 1506–1510.
686. Okin PM, et al. Regression of electrocardiographic left ventricular hypertrophy and decreased incidence of new onset atrial fibrillation in patients with hypertension. JAMA 2006; 296: 1242–1248.
687. Savelieva I, et al. Upstream therapies for management of atrial fibrillation: review of clinical evidence and implications for European Society of Cardiology guidelines. Part II: secondary prevention. Europace 2011; 13: 610–625.
688. Kuhlkamp V, et al. Use of metoprolol CR/XL to maintain sinus rhythm after conversion from persistent atrial fibrillation: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 2000; 36: 139–146.
689. Liakopoulos OJ, et al. Preoperative statin therapy for patients undergoing cardiac surgery. Cochrane Database Syst Rev 2012; 4: Cd008493.
690. Kuhn EW, et al. Preoperative statin therapy in cardiac surgery: a meta-analysis of 90,000 patients. Eur J Cardiothorac Surg 2014; 45: 17–26; discussion 26.
691. Zheng Z, et al. Perioperative Rosuvastatin in Cardiac Surgery. N Engl J Med 2016; 374: 1744–1753.
692. Rahimi K, Emberson J, McGale P, Majoni W, Merhi A, Asselbergs FW, Krane V, Macfarlane PW, PROSPER Executive. Effect of statins on atrial fibrillation: collaborative meta-analysis of published and unpublished evidence from randomised controlled trials. BMJ 2011; 342: d1250.
693. Pinho-Gomes AC, et al. Targeting inflammation and oxidative stress in atrial fibrillation: role of 3-hydroxy-3-methylglutaryl-coenzyme a reductase inhibition with statins. Antioxid Redox Signal 2014; 20: 1268–1285.
694. Bianconi L, et al. n-3 polyunsaturated fatty acids for the prevention of arrhythmia recurrence after electrical cardioversion of chronic persistent atrial fibrillation: a randomized, double-blind, multicentre study. Europace 2011; 13: 174–181.
695. Kowey PR, et al. Efficacy and safety of prescription omega-3 fatty acids for the prevention of recurrent symptomatic atrial fibrillation: a randomized controlled trial. JAMA 2010; 304: 2363–2372.
696. Mozaffarian D, et al. Fish oil and postoperative atrial fibrillation: the Omega-3 Fatty Acids for Prevention of Post-operative Atrial Fibrillation (OPERA) randomized trial. JAMA 2012; 308: 2001–2011.
697. Yamashita T, et al. Randomized trial of angiotensin II-receptor blocker vs. dihydropiridine calcium channel blocker in the treatment of paroxysmal atrial fibrillation with hypertension (J-RHYTHM II study). Europace 2011; 13: 473–479.
698. Macchia A, et al. Omega-3 fatty acids for the prevention of recurrent symptomatic atrial fibrillation: results of the FORWARD (Randomized Trial to Assess Efficacy of PUFA for the Maintenance of Sinus Rhythm in Persistent Atrial Fibrillation) trial. J Am Coll Cardiol 2013; 61: 463–468.
699. Dabrowski R, et al. Effect of combined spironolactone-b-blocker+enalapril treatment on occurrence of symptomatic atrial fibrillation episodes in patients with a history of paroxysmal atrial fibrillation (SPIR-AF study). Am J Cardiol 2010; 106: 1609–1614.
700. Ito Y, et al. Effect of eplerenone on maintenance of sinus rhythm after catheter ablation in patients with long-standing persistent atrial fibrillation. Am J Cardiol 2013; 111: 1012–1018.
701. Swedberg K, et al. EMPHASIS-Hf Study Investigators. Eplerenone and atrial fibrillation in mild systolic heart failure: results from the EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization And SurvIval Study in Heart Failure) study. J Am Coll Cardiol 2012; 59: 1598–1603.
702. Coll-Vinent B, et al. Sedation for cardioversion in the emergency department: analysis of effectiveness in four protocols. Ann Emerg Med 2003; 42: 767–772.
703. del Arco C, et al. Analysis of current management of atrial fibrillation in the acute setting: GEFAUR-1 study. Ann Emerg Med 2005; 46: 424–430.
704. Scheuermeyer FX, et al. Emergency department management and 1-year outcomes of patients with atrial flutter. Ann Emerg Med 2011; 57: 564–571.e2.
705. Goldner BG, et al. Electrical cardioversion of atrial fibrillation or flutter with conscious sedation in the age of cost containment. Am Heart J 1998; 136: 961–964.
706. Martinez-Marcos FJ, et al. Comparison of intravenous flecainide, propafenone, and amiodarone for conversion of acute atrial fibrillation to sinus rhythm. Am J Cardiol 2000; 86: 950–953.
707. Buccelletti F, et al. Efficacy and safety of vernakalant in recent-onset atrial fibrillation after the European medicines agency approval: systematic review and meta-analysis. J Clin Pharmacol 2012; 52: 1872–1878.
708. Cappato R, et al. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation. Eur Heart J 2014; 35: 3346–3355.
709. Nagarakanti R, et al. Dabigatran versus warfarin in patients with atrial fibrillation: an analysis of patients undergoing cardioversion. Circulation 2011; 123: 131–136.
710. Steinberg JS, et al. Analysis of causespecific mortality in the Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study. Circulation 2004; 109: 1973–1980.
711. Andersen HR, et al. Long-term follow-up of patients from a randomised trial of atrial versus ventricular pacing for sick-sinus syndrome. Lancet 1997; 350: 1210–1216.
712. Connolly SJ, et al. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologic Pacing Investigators. N Engl J Med 2000; 342: 1385–1391.
713. Calkins H, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009; 2: 349–361.
714. Schmieder RE, et al. Reduced incidence of new-onset atrial fibrillation with angiotensin II receptor blockade: the VALUE trial. J Hypertens 2008; 26: 403–411.
715. Calkins H, et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012; 14: 528–606.
716. Kuck KH, et al. Impact of Complete Versus Incomplete Circumferential Lines Around the Pulmonary Veins During Catheter Ablation of Paroxysmal Atrial Fibrillation: Results From the Gap-Atrial Fibrillation-German Atrial Fibrillation Competence Network 1 Trial. Circ Arrhythm Electrophysiol 2016; 9: e003337.
717. Mont L, et al. Catheter ablation vs. antiarrhythmic drug treatment of persistent atrial fibrillation: a multicentre, randomized, controlled trial (SARA study). Eur Heart J 2014; 35: 501–507.
718. Schreiber D, et al. Five-year follow-up after catheter ablation of persistent atrial fibrillation using the stepwise approach and prognostic factors for success. Circ Arrhythm Electrophysiol 2015; 8: 308–317.
719. Scherr D, et al. Five-year outcome of catheter ablation of persistent atrial fibrillation using termination of atrial fibrillation as a procedural endpoint. Circ Arrhythm Electrophysiol 2015; 8: 18–24.
720. Al Halabi S, et al. Catheter Ablation for Atrial Fibrillation in Heart Failure Patients: A Meta-Analysis of Randomized Controlled Trials. JACC Clin Electrophysiol 2015; 1: 200–209.
721. Hakalahti A, et al. Radiofrequency ablation vs. antiarrhythmic drug therapy as first line treatment of symptomatic atrial fibrillation: systematic review and meta-analysis. Europace 2015; 17: 370–378.
722. Morillo CA, et al. RAAFT-2 Investigators. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA 2014; 311: 692–700.
723. Wazni OM, et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005; 293: 2634–2640.
724. Oral H, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354: 934–941.
725. Stabile G, et al. Catheter ablation treatment in patients with drug-refractory atrial fibrillation: a prospective, multi-centre, randomized, controlled study (Catheter Ablation For The Cure Of Atrial Fibrillation Study). Eur Heart J 2006; 27: 216–221.
726. Forleo GB, et al. Catheter ablation of atrial fibrillation in patients with diabetes mellitus type 2: results from a randomized study comparing pulmonary vein isolation versus antiarrhythmic drug therapy. J Cardiovasc Electrophysiol 2009; 20: 22–28.
727. Cappato R, et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3: 32–38.
728. Ganesan AN, et al. Long-term outcomes of catheter ablation of atrial fibrillation: a systematic review and meta-analysis. J Am Heart Assoc 2013; 2: e004549.
729. McLellan AJ, et al. A minimal or maximal ablation strategy to achieve pulmonary vein isolation for paroxysmal atrial fibrillation: a prospective multi-centre randomized controlled trial (the Minimax study). Eur Heart J 2015; 36: 1812–1821.
730. Verma A, et al. Substrate and Trigger Ablation for Reduction of Atrial Fibrillation Trial-Part II (STAR AF II): design and rationale. Am Heart J 2012; 164: 1–6.e6.
731. Nery PB, et al. Relationship Between Pulmonary Vein Reconnection and Atrial Fibrillation Recurrence. JACC Clin Electrophysiol; doi: https://doi.org/10.1016/j.jacep.2016.02.003. Published online ahead of print April 2016.
732. Luik A, et al. Cryoballoon Versus Open Irrigated Radiofrequency Ablation in Patients With Paroxysmal Atrial Fibrillation: The Prospective, Randomized, Controlled, Noninferiority FreezeAF Study. Circulation 2015; 132: 1311–1319.
733. Schmidt M, et al. Cryoballoon versus RF ablation in paroxysmal atrial fibrillation: results from the German Ablation Registry. J Cardiovasc Electrophysiol 2014; 25: 1–7.
734. Kuck KH, et al. Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med 2016; 374: 2235–2245.
735. Verma A, et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med 2015; 372: 1812–1822.
736. Dong JZ, et al. Prospective randomized comparison between a fixed ‘2C3L’ approach vs. stepwise approach for catheter ablation of persistent atrial fibrillation. Europace 2015; 17: 1798–1806.
737. Hunter RJ, et al. Maintenance of sinus rhythm with an ablation strategy in patients with atrial fibrillation is associated with a lower risk of stroke and death. Heart 2012; 98: 48–53.
738. Providencia R, et al. Is There Still a Role for Complex Fractionated Atrial Electrogram Ablation in Addition to Pulmonary Vein Isolation in Patients With Paroxysmal and Persistent Atrial Fibrillation? Meta-Analysis of 1415 Patients. Circ Arrhythm Electrophysiol 2015; 8: 1017–1029.
739. Mohanty S, et al. Impact of Rotor Ablation in Non-Paroxysmal AF Patients: Results from a Randomized Trial (OASIS). J Am Coll Cardiol; doi: 10.1016/j.jacc.2016.04.015. Published online ahead of print 6 May 2016.
740. Rolf S, et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol 2014; 7: 825–833.
741. Shah AJ, et al. Prevalence and types of pitfall in the assessment of mitral isthmus linear conduction block. Circ Arrhythm Electrophysiol 2012; 5: 957–967.
742. Macle L, et al. Adenosine-guided pulmonary vein isolation for the treatment of paroxysmal atrial fibrillation: an international, multicentre, randomised superiority trial. Lancet 2015; 386: 672–679.
743. Kobori A, et al. Adenosine triphosphate-guided pulmonary vein isolation for atrial fibrillation: the UNmasking Dormant Electrical Reconduction by Adenosine TriPhosphate (UNDER-ATP) trial. Eur Heart J 2015; 36: 3276–3287.
744. Berntsen RF, et al. Focal impulse and rotor modulation as a stand-alone procedure for treatment of paroxysmal atrial fibrillation. A within patient controlled study with implanted cardiac monitoring. Heart Rhythm 2016; doi: https://doi.org/10.1016/j.hrthm.2016.04.016.
745. Lee G, et al. Low risk of major complications associated with pulmonary vein antral isolation for atrial fibrillation: results of 500 consecutive ablation procedures in patients with low prevalence of structural heart disease from a single center. J Cardiovasc Electrophysiol 2011; 22: 163–168.
746. Wynn GJ, et al. Efficacy of catheter ablation for persistent atrial fibrillation: a systematic review and meta-analysis of evidence from randomized and nonrandomized controlled trials. Circ Arrhythm Electrophysiol 2014; 7: 841–852.
747. Seaburg L, et al. Shared decision making in atrial fibrillation: where we are and where we should be going. Circulation 2014; 129: 704–710.
748. Dagres N, et al. Complications of atrial fibrillation ablation in a high-volume center in 1,000 procedures: still cause for concern? J Cardiovasc Electrophysiol 2009; 20: 1014–1019.
749. Deneke T, et al. Silent cerebral events/lesions related to atrial fibrillation ablation: a clinical review. J Cardiovasc Electrophysiol 2015; 26: 455–463.
750. Gupta A, et al. Complications of catheter ablation of atrial fibrillation: a systematic review. Circ Arrhythm Electrophysiol 2013; 6: 1082–1088.
751. Cappato R, et al. Delayed cardiac tamponade after radiofrequency catheter ablation of atrial fibrillation: a worldwide report. J Am Coll Cardiol 2011; 58: 2696–2697.
752. Haeusler KG, et al. Left atrial catheter ablation and ischemic stroke. Stroke 2012; 43: 265–270.
753. Kosiuk J, et al. Early cerebral thromboembolic complications after radiofrequency catheter ablation of atrial fibrillation: incidence, characteristics, and risk factors. Heart Rhythm 2014; 11: 1934–1940.
754. Gaita F, et al. Incidence of silent cerebral thromboembolic lesions after atrial fibrillation ablation may change according to technology used: comparison of irrigated radiofrequency, multipolar nonirrigated catheter and cryoballoon. J Cardiovasc Electrophysiol 2011; 22: 961–968.
755. Hsu LF, et al. Incidence and prevention of cardiac tamponade complicating ablation for atrial fibrillation. Pacing Clin Electrophysiol 2005; 28: S106–109.
756. Michowitz Y, et al. Effects of sex on the incidence of cardiac tamponade after catheter ablation of atrial fibrillation: results from a worldwide survey in 34 943 atrial fibrillation ablation procedures. Circ Arrhythm Electrophysiol 2014; 7: 274–280.
757. Nair KK, et al. The prevalence and risk factors for atrioesophageal fistula after percutaneous radiofrequency catheter ablation for atrial fibrillation: the Canadian experience. J Interv Card Electrophysiol 2014; 39: 139–144.
758. Shah RU, et al. Procedural complications, rehospitalizations and repeat procedures after catheter ablation for atrial fibrillation. J Am Coll Cardiol 2012; 59: 143–149.
759. Straube F, et al. Comparison of the first and second cryoballoon: high-volume single-center safety and efficacy analysis. Circ Arrhythm Electrophysiol 2014; 7: 293–299.
760. Di Biase L, et al. Periprocedural Stroke and Bleeding Complications in Patients Undergoing Catheter Ablation of Atrial Fibrillation With Different Anticoagulation Management: Results From the Role of Coumadin in Preventing Thromboembolism in Atrial Fibrillation (AF) Patients Undergoing Catheter Ablation (COMPARE) Randomized Trial. Circulation 2014; 129: 2638–2644.
761. Di Biase L, et al. Feasibility and safety of uninterrupted periprocedural apixaban administration in patients undergoing radiofrequency catheter ablation for atrial fibrillation: Results from a multicenter study. Heart Rhythm 2015; 12: 1162–1168.
762. Hohnloser SH, et al. Safety and efficacy of dabigatran etexilate during catheter ablation of atrial fibrillation: a meta-analysis of the literature. Europace 2013; 15: 1407–1411.
763. Lakkireddy D, et al. Feasibility and safety of uninterrupted rivaroxaban for periprocedural anticoagulation in patients undergoing radiofrequency ablation for atrial fibrillation: results from a multicenter prospective registry. J Am Coll Cardiol 2014; 63: 982–988.
764. Providencia R, et al. Rivaroxaban and dabigatran in patients undergoing catheter ablation of atrial fibrillation. Europace 2014; 16: 1137–1144.
765. Stepanyan G, et al. Safety of new oral anticoagulants for patients undergoing atrial fibrillation ablation. J Interv Card Electrophysiol 2014; 40: 33–38.
766. Aryal MR, et al. Meta-analysis of efficacy and safety of rivaroxaban compared with warfarin or dabigatran in patients undergoing catheter ablation for atrial fibrillation. Am J Cardiol 2014; 114: 577–582.
767. Kaess BM, et al. Comparison of safety of left atrial catheter ablation procedures for atrial arrhythmias under continuous anticoagulation with apixaban versus phenprocoumon. Am J Cardiol 2015; 115: 47–51.
768. Cappato R, et al. Uninterrupted rivaroxaban vs. uninterrupted vitamin K antagonists for catheter ablation in non-valvular atrial fibrillation. Eur Heart J 2015; 36: 1805–1811.
769. Wu S, et al. Meta-Analysis of Efficacy and Safety of New Oral Anticoagulants Compared With Uninterrupted Vitamin K Antagonists in Patients Undergoing Catheter Ablation for Atrial Fibrillation. Am J Cardiol 2016; 117: 926–934.
770. Santarpia G, et al. Efficacy and Safety of Non-Vitamin K Antagonist Oral Anticoagulants versus Vitamin K Antagonist Oral Anticoagulants in Patients Undergoing Radiofrequency Catheter Ablation of Atrial Fibrillation: A Meta-Analysis. PLoS One 2015; 10: e0126512.
771. Karasoy D, et al. Oral anticoagulation therapy after radiofrequency ablation of atrial fibrillation and the risk of thromboembolism and serious bleeding: long-term follow-up in nationwide cohort of Denmark. Eur Heart J 2015; 36: 307–314a.
772. Themistoclakis S, et al. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol 2010; 55: 735–743.
773. Bunch TJ, et al. Atrial fibrillation ablation patients have long-term stroke rates similar to patients without atrial fibrillation regardless of CHADS2 score. Heart Rhythm 2013; 10: 1272–1277.
774. Nedios S, et al. Left atrial appendage morphology and thromboembolic risk after catheter ablation for atrial fibrillation. Heart Rhythm 2014; 11: 2239–2246.
775. Reynolds MR, et al. Health outcomes with catheter ablation or antiarrhythmic drug therapy in atrial fibrillation: results of a propensity-matched analysis. Circ Cardiovasc Qual Outcomes 2012; 5: 171–181.
776. Gallo C, et al. Long-term events following atrial fibrillation rate control or transcatheter ablation: a multicenter observational study. J Cardiovasc Med (Hagerstown) 2016; 17: 187–193.
777. Di Biase L, et al. Ablation vs. Amiodarone for Treatment of Persistent Atrial Fibrillation in Patients With Congestive Heart Failure and an Implanted Device: Results From the AATAC Multicenter Randomized Trial. Circulation; doi: https://doi.org/10.1161/CIRCULATIONAHA.115.019406. Published online ahead of print 30 March 2016.
778. Hunter RJ, et al. A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure (the CAMTAF trial). Circ Arrhythm Electrophysiol 2014; 7: 31–38.
779. MacDonald MR, et al. Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction: a randomised controlled trial. Heart 2011; 97: 740–747.
780. Dagres N, et al. Catheter ablation for atrial fibrillation in patients with left ventricular systolic dysfunction. A systematic review and meta-analysis. J Card Fail 2011; 17: 964–970.
781. Piorkowski C, et al. Value of different follow-up strategies to assess the efficacy of circumferential pulmonary vein ablation for the curative treatment of atrial fibrillation. J Cardiovasc Electrophysiol 2005; 16: 1286–1292.
782. Verma A, et al. Discerning the incidence of symptomatic and asymptomatic episodes of atrial fibrillation before and after catheter ablation (DISCERN AF): a prospective, multicenter study. JAMA Intern Med 2013; 173: 149–156.
783. Cox JL, et al. Successful surgical treatment of atrial fibrillation. Review and clinical update. JAMA 1991; 266: 1976–1980.
784. Cox JL, et al. The surgical treatment of atrial fibrillation. III. Development of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991; 101: 569–583.
785. Stulak JM, et al. Surgical ablation for atrial fibrillation for two decades: are the results of new techniques equivalent to the Cox maze III procedure? J Thorac Cardiovasc Surg 2014; 147: 1478–1486.
786. Basu S, et al. How effective is bipolar radiofrequency ablation for atrial fibrillation during concomitant cardiac surgery? Interact Cardiovasc Thorac Surg 2012; 15: 741–748.
787. Lin Z, et al. The effect of microwave and bipolar radiofrequency ablation in the surgical treatment of permanent atrial fibrillation during valve surgery. Thorac Cardiovasc Surg 2011; 59: 460–464.
788. McCarthy PM, et al. Where does atrial fibrillation surgery fail? Implications for increasing effectiveness of ablation. J Thorac Cardiovasc Surg 2010; 139: 860–867.
789. Abreu Filho CA, et al. Effectiveness of the maze procedure using cooled-tip radiofrequency ablation in patients with permanent atrial fibrillation and rheumatic mitral valve disease. Circulation 2005; 112: I20–25.
790. Blomstrom-Lundqvist C, et al. A randomized double-blind study of epicardial left atrial cryoablation for permanent atrial fibrillation in patients undergoing mitral valve surgery: the SWEDish Multicentre Atrial Fibrillation study (SWEDMAF). Eur Heart J 2007; 28: 2902–2908.
791. Chevalier P, et al. Left atrial radiofrequency ablation during mitral valve surgery: a prospective randomized multicentre study (SAFIR). Arch Cardiovasc Dis 2009; 102: 769–775.
792. Deneke T, et al. Efficacy of an additional MAZE procedure using cooled-tip radiofrequency ablation in patients with chronic atrial fibrillation and mitral valve disease. A randomized, prospective trial. Eur Heart J 2002; 23: 558–566.
793. Doukas G, et al. Left atrial radiofrequency ablation during mitral valve surgery for continuous atrial fibrillation: a randomized controlled trial. JAMA 2005; 294: 2323–2329.
794. Schuetz A, et al. Surgical treatment of permanent atrial fibrillation using microwave energy ablation: a prospective randomized clinical trial. Eur J Cardiothorac Surg 2003; 24: 475–480; discussion 480.
795. Liu X, et al. Efficacy of catheter ablation and surgical CryoMaze procedure in patients with long-lasting persistent atrial fibrillation and rheumatic heart disease: a randomized trial. Eur Heart J 2010; 31: 2633–2641.
796. Cheng DC, et al. Surgical ablation for atrial fibrillation in cardiac surgery: a meta-analysis and systematic review. Innovations (Phila) 2010; 5: 84–96.
797. Barnett SD, Ad N. Surgical ablation as treatment for the elimination of atrial fibrillation: a meta-analysis. J Thorac Cardiovasc Surg 2006; 131: 1029–1035.
798. Ad N, et al. The state of surgical ablation for atrial fibrillation in patients with mitral valve disease. Curr Opin Cardiol 2013; 28: 170–180.
799. Gammie JS, et al. Atrial fibrillation correction surgery: lessons from the Society of Thoracic Surgeons National Cardiac Database. Ann Thorac Surg 2008; 85: 909–914.
800. Chen MC, et al. Preoperative atrial size predicts the success of radiofrequency maze procedure for permanent atrial fibrillation in patients undergoing concomitant valvular surgery. Chest 2004; 125: 2129–2134.
801. Sunderland N, et al. What size of left atrium significantly impairs the success of maze surgery for atrial fibrillation? Interact Cardiovasc Thorac Surg 2011; 13: 332–338.
802. Chaiyaroj S, et al. Predictors of sinus rhythm after radiofrequency maze and mitral valve surgery. Asian Cardiovasc Thorac Ann 2008; 16: 292–297.
803. Gillinov AM, et al. Surgery for permanent atrial fibrillation: impact of patient factors and lesion set. Ann Thorac Surg 2006; 82: 502–513; discussion 513–504.
804. Beukema WP, et al. Predictive factors of sustained sinus rhythm and recurrent atrial fibrillation after a radiofrequency modified Maze procedure. Eur J Cardiothorac Surg 2008; 34: 771–775.
805. Gillinov AM, et al. Surgery for paroxysmal atrial fibrillation in the setting of mitral valve disease: a role for pulmonary vein isolation? Ann Thorac Surg 2006; 81: 19–26; discussion 27–18.
806. Onorati F, et al. Impact of lesion sets on mid-term results of surgical ablation procedure for atrial fibrillation. J Am Coll Cardiol 2011; 57: 931–940.
807. Saint LL, et al. Cox-Maze IV results for patients with lone atrial fibrillation versus concomitant mitral disease. Ann Thorac Surg 2012; 93: 789–794; discussion 794–785.
808. Lawrance CP, et al. A minimally invasive Cox maze IV procedure is as effective as sternotomy while decreasing major morbidity and hospital stay. J Thorac Cardiovasc Surg 2014; 148: 955–961; discussion 962–952.
809. Edgerton JR, et al. Pulmonary vein isolation and autonomic denervation for the management of paroxysmal atrial fibrillation by a minimally invasive surgical approach. J Thorac Cardiovasc Surg 2010; 140: 823–828.
810. McClelland JH, et al. Preliminary results of a limited thoracotomy: new approach to treat atrial fibrillation. J Cardiovasc Electrophysiol 2007; 18: 1289–1295.
811. Castella M, et al. Thoracoscopic pulmonary vein isolation in patients with atrial fibrillation and failed percutaneous ablation. J Thorac Cardiovasc Surg 2010; 140: 633–638.
812. Krul SP, et al. Thoracoscopic video-assisted pulmonary vein antrum isolation, ganglionated plexus ablation, and periprocedural confirmation of ablation lesions: first results of a hybrid surgical-electrophysiological approach for atrial fibrillation. Circ Arrhythm Electrophysiol 2011; 4: 262–270.
813. La Meir M, et al. The hybrid approach for the surgical treatment of lone atrial fibrillation: one-year results employing a monopolar radiofrequency source. J Cardiothorac Surg 2012; 7: 71.
814. Wang S, et al. Comparative study of video-assisted thoracoscopic surgery ablation and radiofrequency catheter ablation on treating paroxysmal atrial fibrillation: a randomized, controlled short-term trial. Chin Med J (Engl) 2014; 127: 2567–2570.
815. Phan K, et al. Thoracoscopic surgical ablation versus catheter ablation for atrial fibrillation. Eur J Cardiothorac Surg 2016; 49: 1044–1051.
816. Hu QM, et al. Analysis of risk factors for recurrence after video-assisted pulmonary vein isolation of lone atrial fibrillationresults of 5 years of follow-up. J Thorac Cardiovasc Surg 2014; 148: 2174–2180.
817. Edgerton JR, et al. Minimally invasive pulmonary vein isolation and partial autonomic denervation for surgical treatment of atrial fibrillation. Ann Thorac Surg 2008; 86: 35–38; discussion 39.
818. Wang J, et al. Minimally invasive surgical versus catheter ablation for the long-lasting persistent atrial fibrillation. PLoS One 2011; 6: e22122.
819. Wang JG, et al. Ablation in selective patients with long-standing persistent atrial fibrillation: medium-term results of the Dallas lesion set. Eur J Cardiothorac Surg 2014; 46: 213–220.
820. Sirak JH, et al. Interim results of the 5-box thoracoscopic maze procedure. Ann Thorac Surg 2012; 94: 1880–1884.
821. Kasirajan V, et al. Minimally invasive surgery using bipolar radiofrequency energy is effective treatment for refractory atrial fibrillation. Ann Thorac Surg 2012; 93: 1456–1461.
822. Weimar T, et al. Approaching a paradigm shift: endoscopic ablation of lone atrial fibrillation on the beating heart. Ann Thorac Surg 2012; 94: 1886–1892.
823. La Meir M, et al. Minimally invasive surgical treatment of lone atrial fibrillation: early results of hybrid versus standard minimally invasive approach employing radiofrequency sources. Int J Cardiol 2013; 167: 1469–1475.
824. Gelsomino S, et al. Hybrid thoracoscopic and transvenous catheter ablation of atrial fibrillation. Eur J Cardiothorac Surg 2014; 45: 401–407.
825. Pison L, et al. Hybrid thoracoscopic surgical and transvenous catheter ablation of atrial fibrillation. J Am Coll Cardiol 2012; 60: 54–61.
826. De Maat GE, et al. Surgical vs. transcatheter pulmonary vein isolation as first invasive treatment in patients with atrial fibrillation: a matched group comparison. Europace 2014; 16: 33–39.
827. Vadmann H, et al. Atrial flutter and thromboembolic risk: a systematic review. Heart 2015; 101: 1446–1455.
828. Stulak JM, et al. Left ventricular dysfunction in atrial fibrillation: restoration of sinus rhythm by the Cox-maze procedure significantly improves systolic function and functional status. Ann Thorac Surg 2006; 82: 494–501.
829. Chen YW, et al. Pacing or ablation: which is better for paroxysmal atrial fibrillation-related tachycardia-bradycardia syndrome? Pacing Clin Electrophysiol 2014; 37: 403–411.
830. Khaykin Y, et al. Pulmonary vein isolation for atrial fibrillation in patients with symptomatic sinus bradycardia or pauses. J Cardiovasc Electrophysiol 2004; 15: 784–789.
831. Ad N, et al. Current role for surgery in treatment of lone atrial fibrillation. Semin Thorac Cardiovasc Surg 2012; 24: 42–50.
832. Weimar T, et al. The cox-maze procedure for lone atrial fibrillation: a single-center experience over 2 decades. Circ Arrhythm Electrophysiol 2012; 5: 8–14.
833. Ad N, et al. Do we increase the operative risk by adding the Cox Maze III procedure to aortic valve replacement and coronary artery bypass surgery? J Thorac Cardiovasc Surg 2012; 143: 936–944.
834. Prakash A, et al. Catheter ablation of inducible atrial flutter, in combination with atrial pacing and antiarrhythmic drugs („hybrid therapy”) improves rhythm control in patients with refractory atrial fibrillation. J Interv Card Electrophysiol 2002; 6: 165–172.
835. Tai CT, et al. Persistent atrial flutter in patients treated for atrial fibrillation with amiodarone and propafenone: electrophysiologic characteristics, radiofrequency catheter ablation, and risk prediction. J Cardiovasc Electrophysiol 1999; 10: 1180–1187.
836. Stabile G, et al. Response to flecainide infusion predicts long-term success of hybrid pharmacologic and ablation therapy in patients with atrial fibrillation. J Am Coll Cardiol 2001; 37: 1639–1644.
837. Anastasio N, et al. Nearly uniform failure of atrial flutter ablation and continuation of antiarrhythmic agents (hybrid therapy) for the long-term control of atrial fibrillation. J Interv Card Electrophysiol 2012; 35: 57–61.
838. Garcia Seara J, et al. Failure of hybrid therapy for the prevention of long-term recurrence of atrial fibrillation. Int J Cardiol 2014; 176: 74–79.
839. Saksena S, et al. Improved suppression of recurrent atrial fibrillation with dual-site right atrial pacing and antiarrhythmic drug therapy. J Am Coll Cardiol 2002; 40: 1140–1150; discussion 1151–1142.
840. Wharton JM, et al. Effect of pacing modality on atrial tachyarrhythmia recurrence in the tachycardia-bradycardia syndrome: preliminary results of the Pacemaker Atrial Tachycardia Trial. Circulation 1998; 98: I–494.
841. Marinigh R, et al. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. J Am Coll Cardiol 2010; 56: 827–837.
842. Gage BF, et al. Adverse outcomes and predictors of underuse of antithrombotic therapy in medicare beneficiaries with chronic atrial fibrillation. Stroke 2000; 31: 822–827.
843. Andreotti F, et al. Antithrombotic therapy in the elderly: expert position paper of the European Society of Cardiology Working Group on Thrombosis. Eur Heart J 2015; 36: 3238–3249.
844. Priori SG, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36: 2793–2867.
845. Elliott PM, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733–2779.
846. Johnson JN, et al. Prevalence of early-onset atrial fibrillation in congenital long QT syndrome. Heart Rhythm 2008; 5: 704–709.
847. Kirchhof P, et al. Prolonged atrial action potential durations and polymorphic atrial tachyarrhythmias in patients with long QT syndrome. J Cardiovasc Electrophysiol 2003; 14: 1027–1033.
848. Zellerhoff S, et al. Atrial Arrhythmias in long-QT syndrome under daily life conditions: a nested case control study. J Cardiovasc Electrophysiol 2009; 20: 401–407.
849. Moss AJ, et al. ECG T-wave patterns in genetically distinct forms of the hereditary long QT syndrome. Circulation 1995; 92: 2929–2934.
850. Schwartz PJ, et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001; 103: 89–95.
851. Eckardt L, et al. Brugada syndrome and supraventricular tachyarrhythmias: a novel association? J Cardiovasc Electrophysiol 2001; 12: 680–685.
852. Kaufman ES. Mechanisms and clinical management of inherited channelopathies: long QT syndrome, Brugada syndrome, catecholaminergic polymorphic ventricular tachycardia, and short QT syndrome. Heart Rhythm 2009; 6: S51–55.
853. Antzelevitch C, et al. Loss-of-function mutations in the cardiac calcium channel underlie a new clinical entity characterized by ST-segment elevation, short QT intervals, and sudden cardiac death. Circulation 2007; 115: 442–449.
854. London B, et al. Mutation in glycerol-3-phosphate dehydrogenase 1 like gene (GPD1-L) decreases cardiac Na+ current and causes inherited arrhythmias. Circulation 2007; 116: 2260–2268.
855. Watanabe H, et al. Sodium channel beta1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest 2008; 118: 2260–2268.
856. Brugada R, et al. Sudden death associated with short-QT syndrome linked to mutations in HERG. Circulation 2004; 109: 30–35.
857. Gaita F, et al. Short QT Syndrome: a familial cause of sudden death. Circulation 2003; 108: 965–970.
858. Giustetto C, et al. Short QT syndrome: clinical findings and diagnostic-therapeutic implications. Eur Heart J 2006; 27: 2440–2447.
859. Bhuiyan ZA, et al. Expanding spectrum of human RYR2-related disease: new electrocardiographic, structural, and genetic features. Circulation 2007; 116: 1569–1576.
860. Napolitano C, et al. Diagnosis and treatment of catecholaminergic polymorphic ventricular tachycardia. Heart Rhythm 2007; 4: 675–678.
861. Mohamed U, et al. Molecular and electrophysiological bases of catecholaminergic polymorphic ventricular tachycardia. J Cardiovasc Electrophysiol 2007; 18: 791–797.
862. Lee CH, et al. Clinical characteristics and outcomes of hypertrophic cardiomyopathy in Taiwan—a tertiary center experience. Clin Cardiol 2007; 30: 177–182.
863. Losi MA, et al. Determinants of atrial fibrillation development in patients with hypertrophic cardiomyopathy. Am J Cardiol 2004; 94: 895–900.
864. Maron BJ, et al. Clinical profile of stroke in 900 patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 2002; 39: 301–307.
865. Gollob MH, et al. Novel PRKAG2 mutation responsible for the genetic syndrome of ventricular preexcitation and conduction system disease with childhood onset and absence of cardiac hypertrophy. Circulation 2001; 104: 3030–3033.
866. Postma AV, et al. A gain-of-function TBX5 mutation is associated with atypical Holt-Oram syndrome and paroxysmal atrial fibrillation. Circ Res 2008; 102: 1433–1442.
867. Marcus FI, et al. Genetics of arrhythmogenic right ventricular cardiomyopathy: a practical guide for physicians. J Am Coll Cardiol 2013; 61: 1945–1948.
868. Chu AF, et al. Atrial arrhythmias in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia and ventricular tachycardia. Am J Cardiol 2010; 106: 720–722.
869. Blomstrom-Lundqvist C, et al. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias—executive summary. a report of the American college of cardiology/American heart association task force on practice guidelines and the European society of cardiology committee for practice guidelines (writing committee to develop guidelines for the management of patients with supraventricular arrhythmias) developed in collaboration with NASPE-Heart Rhythm Society. J Am Coll Cardiol 2003; 42: 1493–1531.
870. Tischenko A, et al. When should we recommend catheter ablation for patients with the Wolff-Parkinson-White syndrome? Curr Opin Cardiol 2008; 23: 32–37.
871. Kibos A, et al. Clinical and electrophysiological study of asymptomaticWolff-Parkinson-White syndrome. Ann Cardiol Angeiol (Paris) 2007; 56: 237–240.
872. Pappone C, et al. A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff-Parkinson-White syndrome. N Engl J Med 2003; 349: 1803–1811.
873. Boahene KA, et al. Termination of acute atrial fibrillation in the Wolff-Parkinson-White syndrome by procainamide and propafenone: importance of atrial fibrillatory cycle length. J Am Coll Cardiol 1990; 16: 1408–1414.
874. O’Nunain S, et al. A comparison of intravenous propafenone and flecainide in the treatment of tachycardias associated with the Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol 1991; 14: 2028–2034.
875. Manolis AS, et al. Supraventricular tachycardia. Mechanisms and therapy. Arch Intern Med 1987; 147: 1706–1716.
876. Simonian SM, et al. Challenging the superiority of amiodarone for rate control in Wolff-Parkinson-White and atrial fibrillation. Intern Emerg Med 2010; 5: 421–426.
877. Guttmann OP, et al. Atrial fibrillation and thromboembolism in patients with hypertrophic cardiomyopathy: systematic review. Heart 2014; 100: 465–472.
878. Olivotto I, et al. Impact of atrial fibrillation on the clinical course of hypertrophic cardiomyopathy. Circulation 2001; 104: 2517–2524.
879. Cecchi F, et al. Prognostic value of non-sustained ventricular tachycardia and the potential role of amiodarone treatment in hypertrophic cardiomyopathy: assessment in an unselected nonreferral based patient population. Heart 1998; 79: 331–336.
880. Bunch TJ, et al. Substrate and procedural predictors of outcomes after catheter ablation for atrial fibrillation in patients with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol 2008; 19: 1009–1014.
881. Di Donna P, et al. Efficacy of catheter ablation for atrial fibrillation in hypertrophic cardiomyopathy: impact of age, atrial remodelling, and disease progression. Europace 2010; 12: 347–355.
882. Gaita F, et al. Usefulness and safety of transcatheter ablation of atrial fibrillation in patients with hypertrophic cardiomyopathy. Am J Cardiol 2007; 99: 1575–1581.
883. Kilicaslan F, et al. Efficacy of catheter ablation of atrial fibrillation in patients with hypertrophic obstructive cardiomyopathy. Heart Rhythm 2006; 3: 275–280.
884. McCready JW, et al. Predictors of recurrence following radiofrequency ablation for persistent atrial fibrillation. Europace 2011; 13: 355–361.
885. Ritchie MD, et al. Chromosome 4q25 variants are genetic modifiers of rare ion channel mutations associated with familial atrial fibrillation. J Am Coll Cardiol 2012; 60: 1173–1181.
886. Mann SA, et al. Epistatic effects of potassium channel variation on cardiac repolarization and atrial fibrillation risk. J Am Coll Cardiol 2012; 59: 1017–1025.
887. Giustetto C, et al. Atrial fibrillation in a large population with Brugada electrocardiographic pattern: prevalence, management, and correlation with prognosis. Heart Rhythm 2014; 11: 259–265.
888. Darbar D, et al. Cardiac sodium channel (SCN5A) variants associated with atrial fibrillation. Circulation 2008; 117: 1927–1935.
889. Olson TM, et al. Sodium channel mutations and susceptibility to heart failure and atrial fibrillation. JAMA 2005; 293: 447–454.
890. Ellinor PT, et al. . Mutations in the long QT gene, KCNQ1, are an uncommon cause of atrial fibrillation. Heart 2004; 90: 1487–1488.
891. Priori SG, et al. Quek SC. Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Europace 2013; 15: 1389–1406.
892. Antz M, et al. Risk of sudden death after successful accessory atrioventricular pathway ablation in resuscitated patients with Wolff-Parkinson-White syndrome. J Cardiovasc Electrophysiol 2002; 13: 231–236.
893. Timmermans C, et al. Aborted sudden death in the Wolff-Parkinson-White syndrome. Am J Cardiol 1995; 76: 492–494.
894. Bromberg BI, et al. Impact of clinical history and electrophysiologic characterization of accessory pathways on management strategies to reduce sudden death among children with Wolff-Parkinson-White syndrome. J Am Coll Cardiol 1996; 27: 690–695.
895. Al-Khatib SM, et al. Risk stratification for arrhythmic events in patients with asymptomatic pre-excitation: A systematic review for the 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm 2016; 13: e222–237.
896. Maron BJ, et al. Hypertrophic cardiomyopathy: present and future, with translation into contemporary cardiovascular medicine. J Am Coll Cardiol 2014; 64: 83–99.
897. Robinson K, et al. Atrial fibrillation in hypertrophic cardiomyopathy: a longitudinal study. J Am Coll Cardiol 1990; 15: 1279–1285.
898. Mozaffarian D, et al. Physical activity and incidence of atrial fibrillation in older adults: the cardiovascular health study. Circulation 2008; 118: 800–807.
899. Elosua R, et al. Sport practice and the risk of lone atrial fibrillation: a case-control study. Int J Cardiol 2006; 108: 332–337.
900. Mont L, et al. Long-lasting sport practice and lone atrial fibrillation. Eur Heart J 2002; 23: 477–482.
901. Abdulla J, et al. Is the risk of atrial fibrillation higher in athletes than in the general population? A systematic review and meta-analysis. Europace 2009; 11: 1156–1159.
902. Thelle DS, et al. Resting heart rate and physical activity as risk factors for lone atrial fibrillation: a prospective study of 309,540 men and women. Heart 2013; 99: 1755–1760.
903. Wilhelm M, et al. Atrial remodeling, autonomic tone, and lifetime training hours in nonelite athletes. Am J Cardiol 2011; 108: 580–585.
904. Guasch E, et al. Atrial fibrillation promotion by endurance exercise: demonstration and mechanistic exploration in an animal model. J Am Coll Cardiol 2013; 62: 68–77.
905. Andersen K, et al. Risk of arrhythmias in 52 755 long-distance cross-country skiers: a cohort study. Eur Heart J 2013; 34: 3624–3631.
906. Karjalainen J, et al. Lone atrial fibrillation in vigorously exercising middle aged men: case-control study. BMJ 1998; 316: 1784–1785.
907. Biffi A, et al. Patterns of ventricular tachyarrhythmias associated with training, deconditioning and retraining in elite athletes without cardiovascular abnormalities. Am J Cardiol 2011; 107: 697–703.
908. Calvo N, et al. Efficacy of circumferential pulmonary vein ablation of atrial fibrillation in endurance athletes. Europace 2010; 12: 30–36.
909. Koopman P, et al. Efficacy of radiofrequency catheter ablation in athletes with atrial fibrillation. Europace 2011; 13: 1386–1393.
910. Heidbuchel H, et al. Recommendations for participation in leisure-time physical activity and competitive sports in patients with arrhythmias and potentially arrhythmogenic conditions Part I: Supraventricular arrhythmias and pacemakers. Eur J Cardiovasc Prev Rehabil 2006; 13: 475–484.
911. Silversides CK, et al. Recurrence rates of arrhythmias during pregnancy in women with previous tachyarrhythmia and impact on fetal and neonatal outcomes. Am J Cardiol 2006; 97: 1206–1212.
912. Salam AM, et al. Atrial Fibrillation or Flutter During Pregnancy in Patients With Structural Heart Disease: Data From the ROPAC (Registry on Pregnancy and Cardiac Disease). JACC Clin Electrophysiol 2015; 1: 284–292.
913. Baumgartner H, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31: 2915–2957.
914. Page RL. Treatment of arrhythmias during pregnancy. Am Heart J 1995; 130: 871–876.
915. Magee LA, et al. Oral beta-blockers for mild to moderate hypertension during pregnancy. Cochrane Database Syst Rev 2003; 3: CD002863.
916. Mitani GM, et al. The pharmacokinetics of antiarrhythmic agents in pregnancy and lactation. Clin Pharmacokinet 1987; 12: 253–291.
917. Gowda RM, et al. Cardiac arrhythmias in pregnancy: clinical and therapeutic considerations. Int J Cardiol 2003; 88: 129–133.
918. Joint Formulary Committee. British National Formulary (online). http://www.medicinescomplete.com (2 December 2014).
919. Bartalena L, et al. Effects of amiodarone administration during pregnancy on neonatal thyroid function and subsequent neurodevelopment. J Endocrinol Invest 2001; 24: 116–130.
920. Jaeggi ET, et al. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 2011; 124: 1747–1754.
921. Tromp CHN, et al. Electrical cardioversion during pregnancy: safe or not? Neth Heart J 2011; 19: 134–136.
922. Ghosh N, et al. The acute treatment of maternal supraventricular tachycardias during pregnancy: a review of the literature. J Obstet Gynaecol Can 2011; 33: 17–23.
923. Bates SM, et al. American College of Chest Physicians. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e691S–736S.
924. Ahlsson AJ, et al. Postoperative atrial fibrillation is not correlated to C-reactive protein. Ann Thorac Surg 2007; 83: 1332–1337.
925. Arsenault KA, et al. Interventions for preventing post-operative atrial fibrillation in patients undergoing heart surgery. Cochrane Database Syst Rev 2013; 1: Cd003611.
926. Mathew JP, et al. A multicenter risk index for atrial fibrillation after cardiac surgery. JAMA 2004; 291: 1720–1729.
927. Steinberg BA, et al. Management of postoperative atrial fibrillation and subsequent outcomes in contemporary patients undergoing cardiac surgery: insights from the Society of Thoracic Surgeons CAPS-Care Atrial Fibrillation Registry. Clin Cardiol 2014; 37: 7–13.
928. Khan MF, et al. Prevention of post-coronary artery bypass grafting (CABG) atrial fibrillation: efficacy of prophylactic beta-blockers in the modern era: a meta-analysis of latest randomized controlled trials. Ann Noninvasive Electrocardiol 2013; 18: 58–68.
929. Burgess DC, et al. Interventions for prevention of postoperative atrial fibrillation and its complications after cardiac surgery: a meta-analysis. Eur Heart J 2006; 27: 2846–2857.
930. Chatterjee S, et al. Timing and route of amiodarone for prevention of postoperative atrial fibrillation after cardiac surgery: a network regression meta-analysis. Pacing Clin Electrophysiol 2013; 36: 1017–1023.
931. Zhu J, et al. Meta-analysis of amiodarone versus beta-blocker as a prophylactic therapy against atrial fibrillation following cardiac surgery. Intern Med J 2012; 42: 1078–1087.
932. Fauchier L, et al. Statin therapy and atrial fibrillation: systematic review and updated meta-analysis of published randomized controlled trials. Curr Opin Cardiol 2013; 28: 7–18.
933. Zheng H, et al. The use of statins to prevent postoperative atrial fibrillation after coronary artery bypass grafting: a meta-analysis of 12 studies. J Cardiovasc Pharmacol 2014; 64: 285–292.
934. Zheng Z, et al. Perioperative Rosuvastatin in Cardiac Surgery. N Engl J Med 2016; 374: 1744–1753.
935. Cook RC, et al. Prophylactic magnesium does not prevent atrial fibrillation after cardiac surgery: a meta-analysis. Ann Thorac Surg 2013; 95: 533–541.
936. De Oliveira GS Jr, et al. Systemic magnesium to reduce postoperative arrhythmias after coronary artery bypass graft surgery: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth 2012; 26: 643–650.
937. Costanzo S, et al. Prevention of postoperative atrial fibrillation in open heart surgery patients by preoperative supplementation of n-3 polyunsaturated fatty acids: an updated meta-analysis. J Thorac Cardiovasc Surg 2013; 146: 906–911.
938. Farquharson AL, et al. Effect of dietary fish oil on atrial fibrillation after cardiac surgery. Am J Cardiol 2011; 108: 851–856.
939. Heidarsdottir R, et al. Does treatment with n-3 polyunsaturated fatty acids prevent atrial fibrillation after open heart surgery? Europace 2010; 12: 356–363.
940. Mariani J, et al. N-3 polyunsaturated fatty acids to prevent atrial fibrillation: updated systematic review and meta-analysis of randomized controlled trials. J Am Heart Assoc 2013; 2: e005033.
941. Rodrigo R, et al. A randomized controlled trial to prevent post-operative atrial fibrillation by antioxidant reinforcement. J Am Coll Cardiol 2013; 62: 1457–1465.
942. Saravanan P, et al. Omega-3 fatty acid supplementation does not reduce risk of atrial fibrillation after coronary artery bypass surgery: a randomized, double-blind, placebo-controlled clinical trial. Circ Arrhythm Electrophysiol 2010; 3: 46–53.
943. Wu JH, et al. Plasma phospholipid omega-3 fatty acids and incidence of postoperative atrial fibrillation in the OPERA trial. J Am Heart Assoc 2013; 2: e000397.
944. Xin W, et al. Fish oil and atrial fibrillation after cardiac surgery: a meta-analysis of randomized controlled trials. PLoS One 2013; 8: e72913.
945. Zhang B, et al. Polyunsaturated fatty acids for the prevention of atrial fibrillation after cardiac surgery: an updated meta-analysis of randomized controlled trials. J Cardiol 2014; 63: 53–59.
946. Imazio M, et al. Colchicine for prevention of postpericardiotomy syndrome and postoperative atrial fibrillation: the COPPS-2 randomized clinical trial. JAMA 2014; 312: 1016–1023.
947. Cappabianca G, et al. Protective effects of steroids in cardiac surgery: a meta-analysis of randomized double-blind trials. J Cardiothorac Vasc Anesth 2011; 25: 156–165.
948. Viviano A, et al. Is perioperative corticosteroid administration associated with a reduced incidence of postoperative atrial fibrillation in adult cardiac surgery? Interact Cardiovasc Thorac Surg 2014; 18: 225–229.
949. Kaleda VI, et al. Does posterior pericardiotomy reduce the incidence of atrial fibrillation after coronary artery bypass grafting surgery? Interact Cardiovasc Thorac Surg 2012; 14: 384–389.
950. Dunning J, et al. Guidelines on the prevention and management of de novo atrial fibrillation after cardiac and thoracic surgery. Eur J Cardiothorac Surg 2006; 30: 852–872.
951. LaPar DJ, et al. Postoperative atrial fibrillation significantly increases mortality, hospital readmission, and hospital costs. Ann Thorac Surg 2014; 98: 527–533; discussion 533.
952. Saxena A, et al. Usefulness of postoperative atrial fibrillation as an independent predictor for worse early and late outcomes after isolated coronary artery bypass grafting (multicenter Australian study of 19,497 patients). Am J Cardiol 2012; 109: 219–225.
953. Gialdini G, et al. Perioperative atrial fibrillation and the long-term risk of ischemic stroke. JAMA 2014; 312: 616–622.
954. Ahlsson A, et al. Patients with postoperative atrial fibrillation have a doubled cardiovascular mortality. Scand Cardiovasc J 2009; 43: 330–336.
955. Ahlsson A, et al. Postoperative atrial fibrillation in patients undergoing aortocoronary bypass surgery carries an eightfold risk of future atrial fibrillation and a doubled cardiovascular mortality. Eur J Cardiothorac Surg 2010; 37: 1353–1359.
956. Mariscalco G, et al. Atrial fibrillation after isolated coronary surgery affects late survival. Circulation 2008; 118: 1612–1618.
957. Villareal RP, et al. Postoperative atrial fibrillation and mortality after coronary artery bypass surgery. J Am Coll Cardiol 2004; 43: 742–748.
958. Phan K, et al. New-onset atrial fibrillation following coronary bypass surgery predicts long-term mortality: a systematic review and meta-analysis. Eur J Cardiothorac Surg 2015; 48: 817–824.
959. El-Chami MF, et al. New-onset atrial fibrillation predicts long-term mortality after coronary artery bypass graft. J Am Coll Cardiol 2010; 55: 1370–1376.
960. Anderson E, et al. Anticoagulation strategies for the management of postoperative atrial fibrillation. Clin Lab Med 2014; 34: 537–561.
961. Heldal M, et al. Pharmacological conversion of recent-onset atrial fibrillation: a systematic review. Scand Cardiovasc J Suppl 2013; 47: 2–10.
962. Gillinov AM, et al. Rate Control versus Rhythm Control for Atrial Fibrillation after Cardiac Surgery. N Engl J Med 2016; 374: 1911–1921.
963. Triedman JK. Arrhythmias in adults with congenital heart disease. Heart 2002; 87: 383–389.
964. Ammash NM, et al. Outcome of direct current cardioversion for atrial arrhythmias in adults with congenital heart disease. Int J Cardiol 2012; 154: 270–274.
965. Greason KL, et al. Surgical management of atrial tachyarrhythmias associated with congenital cardiac anomalies: Mayo Clinic experience. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2003; 6: 59–71.
966. Payne L, et al. Acute cardiac arrhythmias following surgery for congenital heart disease: mechanisms, diagnostic tools, and management. Crit Care Nurs Clin North Am 2011; 23: 255–272.
967. Koyak Z, et al. Sudden cardiac death in adult congenital heart disease. Circulation 2012; 126: 1944–1954.
968. Jensen AS, et al. Anticoagulation in adults with congenital heart disease: The who, the when and the how? Heart 2014; 101: 424–429.
969. Fujita S, et al. Management of late atrial tachyarrhythmia long after Fontan operation. J Cardiol 2009; 53: 410–416.
970. Feltes TF, et al. Transesophageal echocardiographic detection of atrial thrombi in patients with nonfibrillation atrial tachyarrhythmias and congenital heart disease. J Am Coll Cardiol 1994; 24: 1365–1370.
971. Nagao K, et al. [Studies on atrial arrhythmias in atrial septal defect. The influences of aging on atrial fibrillation]. Nihon Ronen Igakkai Zasshi 1995; 32: 27–32.
972. Giamberti A, et al. Surgical treatment of arrhythmias in adults with congenital heart defects. Int J Cardiol 2008; 129: 37–41.
973. Roos-Hesselink JW, et al. Excellent survival and low incidence of arrhythmias, stroke and heart failure long-term after surgical ASD closure at young age. A prospective follow-up study of 21-33 years. Eur Heart J 2003; 24: 190–197.
974. Yamada T, et al. Pulmonary vein isolation in patients with paroxysmal atrial fibrillation after direct suture closure of congenital atrial septal defect. Circ J 2007; 71: 1989–1992.
975. Van De Bruaene A, et al. The importance of pulmonary artery pressures on late atrial arrhythmia in transcatheter and surgically closed ASD type secundum. Int J Cardiol 2011; 152: 192–195.
976. de Salle P, et al. [Rhythm disorders occurring after surgical closure of the interatrial communication]. Acta Cardiol 1975; 30: 239–249.
977. Scaglione M, et al. Very long-term results of electroanatomicguided radiofrequency ablation of atrial arrhythmias in patients with surgically corrected atrial septal defect. Europace 2014; 16: 1800–1807.
978. Kanter RJ, et al. Atrial arrhythmias during chronic follow-up of surgery for complex congenital heart disease. Pacing Clin Electrophysiol 1997; 20: 502–511.
979. Porter CJ, et al. Incidence and management of dysrhythmias after Fontan procedure. Herz 1993; 18: 318–327.
980. Gelatt M, et al. Risk factors for atrial tachyarrhythmias after the Fontan operation. J Am Coll Cardiol 1994; 24: 1735–1741.
981. Peters NS, et al. Arrhythmias after the Fontan procedure. Br Heart J 1992; 68: 199–204.
982. Kwak JG, et al. Surgical therapy of arrhythmias in singleventricle patients undergoing Fontan or Fontan conversion. J Card Surg 2009; 24: 738–741.
983. Backer CL, et al. Maze procedure in single ventricle patients. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2008; 11: 44–48.
984. Deal BJ, et al. The role of concomitant arrhythmia surgery in patients undergoing repair of congenital heart disease. Pacing Clin Electrophysiol 2008; 31: S13–16.
985. Gandhi SK. Atrial arrhythmia surgery in congenital heart disease. J Interv Card Electrophysiol 2007; 20: 119–125.
986. Correa R, et al. Mechanism and ablation of arrhythmia following total cavopulmonary connection. Circ Arrhythm Electrophysiol 2015; 8: 318–325.
987. Khairy P, et al. Arrhythmia burden in adults with surgically repaired tetralogy of Fallot: a multi-institutional study. Circulation 2010; 122: 868–875.
988. Kobayashi J, et al. Maze procedure for atrial fibrillation associated with atrial septal defect. Circulation 1998; 98: II399–402.
989. Shim H, et al. Efficacy of the maze procedure for atrial fibrillation associated with atrial septal defect. Korean J Thorac Cardiovasc Surg 2013; 46: 98–103.
990. Gutierrez SD, et al. Atrial tachyarrhythmias and the Cox-maze procedure in congenital heart disease. Congenit Heart Dis 2013; 8: 434–439.
991. Sherwin ED, et al. Update on interventional electrophysiology in congenital heart disease: evolving solutions for complex hearts. Circ Arrhythm Electrophysiol 2013; 6: 1032–1040.
992. Wellens HJ. Contemporary management of atrial flutter. Circulation 2002; 106: 649–652.
993. Bertaglia E, et al. Long term follow up of radiofrequency catheter ablation of atrial flutter: clinical course and predictors of atrial fibrillation occurrence. Heart 2004; 90: 59–63.
994. Seara JG, et al. Risk of atrial fibrillation, stroke, and death after radiofrequency catheter ablation of typical atrial flutter. Clin Res Cardiol 2014; 103: 543–552.
995. Brembilla-Perrot B, et al. Risk of atrial fibrillation after atrial flutter ablation: impact of AF history, gender, and antiarrhythmic drug medication. J Cardiovasc Electrophysiol 2014; 25: 813–820.
996. Bronis K, et al. Vernakalant: review of a novel atrial selective antiarrhythmic agent and its place in current treatment of atrial fibrillation. Hosp Chronicles 2012; 7: 171–181.
997. Nair M, et al. Safety and efficacy of ibutilide in cardioversion of atrial flutter and fibrillation. J Am Board Fam Med 2011; 24: 86–92.
998. Reisinger J, et al. Optimization of initial energy for cardioversion of atrial tachyarrhythmias with biphasic shocks. Am J Emerg Med 2010; 28: 159–165.
999. Pinski SL, et al. A comparison of 50-J versus 100-J shocks for direct-current cardioversion of atrial flutter. Am Heart J 1999; 137: 439–442.
1000. Manolis AS, et al. Transesophageal overdrive pacing: A simple and versatile tool. Hosp Chronicles 2013; 8: 143–145.
1001. Poulidakis E, et al. Transvenous temporary cardiac pacing. Rhythmos 2014; 9: 20–27.
1002. Spector P, et al. Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol 2009; 104: 671–677.
1003. Schmieder S, et al. Acute and long-term results of radiofrequency ablation of common atrial flutter and the influence of the right atrial isthmus ablation on the occurrence of atrial fibrillation. Eur Heart J 2003; 24: 956–962.
1004. Bandini A, et al. Atrial fibrillation after typical atrial flutter ablation: a long-term follow-up. J Cardiovasc Med (Hagerstown) 2011; 12: 110–115.
1005. Dewland TA, et al. Healthcare utilization and clinical outcomes after catheter ablation of atrial flutter. PLoS One 2014; 9: e100509.
1006. Esato M, et al. Color-coded threedimensional entrainment mapping for analysis and treatment of atrial macroreentrant tachycardia. Heart Rhythm 2009; 6: 349–358.
1007. Huo Y, et al. Atrial Arrhythmias Following Surgical AF Ablation: Electrophysiological Findings, Ablation Strategies, and Clinical Outcome. J Cardiovasc Electrophysiol 2014; 25: 725–738.
1008. Institute of Medicine Committee on Quality of Health Care in America. Crossing the Quality Chasm: A New Health System for the 21st Century. Washington (DC): National Academies Press (US); 2001.
1009. Bodenheimer T, et al. Improving primary care for patients with chronic illness. JAMA 2002; 288: 1775–1779.
1010. Hibbard JH, et al. What the evidence shows about patient activation: better health outcomes and care experiences; fewer data on costs. Health Aff (Millwood) 2013; 32: 207–214.
1011. McCabe PJ. Self-management of atrial fibrillation: a new frontier for nursing research. Prog Cardiovasc Nurs 2008; 23: 37–40.
1012. Lip GY, et al. Ethnic differences in patient perceptions of atrial fibrillation and anticoagulation therapy: the West Birmingham Atrial Fibrillation Project. Stroke 2002; 33: 238–242.
1013. Clarkesmith DE, et al. Educational and behavioural interventions for anticoagulant therapy in patients with atrial fibrillation. Cochrane Database Syst Rev 2013; 6: Cd008600.
1014. Clarkesmith DE, et al. Educational intervention improves anticoagulation control in atrial fibrillation patients: the TREAT randomised trial. PLoS One 2013; 8: e74037.
1015. Smith DE, et al. TRial of an Educational intervention on patients’ knowledge of Atrial fibrillation and anticoagulant therapy, INR control, and outcome of Treatment with warfarin (TREAT). BMC Cardiovasc Disord 2010; 10: 21.
1016. Smith MB, et al. Warfarin knowledge in patients with atrial fibrillation: implications for safety, efficacy, and education strategies. Cardiology 2010; 116: 61–69.
1017. Aliot E, et al. Atrial Fibrillation AWareness and Risk Education group [comprising the Atrial Fibrillation Association (AFA), the European Heart Rhythm Association (EHRA), Stroke Alliance for Europe (SAFE), and the World Heart Federation (WHF)]. An international survey of physician and patient understanding, perception, and attitudes to atrial fibrillation and its contribution to cardiovascular disease morbidity and mortality. Europace 2010; 12: 626–633.
1018. Hendriks JM, et al. The atrial fibrillation knowledge scale: development, validation and results. Int J Cardiol 2013; 168: 1422–1428.
1019. McCabe PJ. What patients want and need to know about atrial fibrillation. J Multidiscip Healthc 2011; 4: 413–419.
1020. Lorig KR, et al. Self-management education: history, definition, outcomes, and mechanisms. Ann Behav Med 2003; 26: 1–7.
1021. Stiggelbout AM, et al. Shared decision making: really putting patients at the centre of healthcare. BMJ 2012; 344: e256.
1022. Stacey D, et al. Decision aids for people facing health treatment or screening decisions. Cochrane Database Syst Rev 2014; 1: CD001431.
1023. Elwyn G, et al. Shared decision making: a model for clinical practice. J Gen Intern Med 2012; 27: 1361–1367.
1024. VanWagoner DR, et al. Progress toward the prevention and treatment of atrial fibrillation: A summary of the Heart Rhythm Society Research Forum on the Treatment and Prevention of Atrial Fibrillation, Washington, DC, December 9-10, 2013. Heart Rhythm 2015; 12: e5–e29.
1025. van Nieuwenhuizen KM, et al. Apixaban versus Antiplatelet drugs or no antithrombotic drugs after anticoagulation-associated intraCerebral HaEmorrhage in patients with Atrial Fibrillation (APACHE-AF): study protocol for a randomised controlled trial. Trials 2015; 16: 393.
1026. Gronberg T, et al. Arrhythmic complications after electrical cardioversion of acute atrial fibrillation: the FinCV study. Europace 2013; 15: 1432–1435.
1027. Tse HF, et al. Does sinus rhythm beget sinus rhythm? Effects of prompt cardioversion on the frequency and persistence of recurrent atrial fibrillation. Card Electrophysiol Rev 2003; 7: 359–365.
1028. Van Gelder IC, et al. The progressive nature of atrial fibrillation: a rationale for early restoration and maintenance of sinus rhythm. Europace 2006; 8: 943–949.
1029. Liu ZJ, et al. Updated systematic review and meta-analysis of randomized clinical trials comparing carotid artery stenting and carotid endarterectomy in the treatment of carotid stenosis. Ann Vasc Surg 2012; 26: 576–590.
1030. Taylor DW, et al. Low-dose and high-dose acetylsalicylic acid for patients undergoing carotid endarterectomy: a randomised controlled trial. Lancet 1999; 353: 2179–2184.
1031. Watanabe M, et al. The effect of atrial fibrillation on outcomes in patients undergoing carotid endarterectomy or stent placement in general practice. J Vasc Surg 2015; 61: 927–932.
1032. Breithardt G, et al. ROCHET AF Steering Committee & Investigators. Clinical characteristics and outcomes with rivaroxaban vs. warfarin in patients with non-valvular atrial fibrillation but underlying native mitral and aortic valve disease participating in the ROCKET AF trial. Eur Heart J 2014; 35: 3377–3385.
1033. Philippart R, et al. Prognostic value of CHA2DS2-VASc score in patients with ‘non-valvular atrial fibrillation’ and valvular heart disease: the Loire Valley Atrial Fibrillation Project. Eur Heart J 2015; 36: 1822–1830.
1034. Breithardt G, et al. Valvular heart disease among non-valvular atrial fibrillation: a misnomer, in search of a new term. Eur Heart J 2015; 36: 1794–1797.
1035. Wolf RK, et al. Video-assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J Thorac Cardiovasc Surg 2005; 130: 797–802.
1036. Yilmaz A, et al. Completely thoracoscopic bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J Thorac Cardiovasc Surg 2008; 136: 521–522.
1037. Salzberg SP, et al. Left atrial appendage clip occlusion: early clinical results. J Thorac Cardiovasc Surg 2010; 139: 1269–1274.
1038. Papworth Hospital NHS Foundation Trust. A randomised controlled trial to investigate the clinical and cost effectiveness of adding an ablation device-based maze procedure as a routine adjunct to elective cardiac surgery for patients with pre-existing atrial fibrillation. http://www.isrctn.com/ISRCTN82731440 (5 May 2016).
1039. Amit G, et al. Efficacy and safety of ablation for patients with nonparoxysmal atrial fibrillation. Cochrane Database of Systematic Reviews 2016; 8: CD012088. DOI: https://doi.org/10.1002/14651858.CD012088.pub2.
1040. Huffman MD, et al. Concomitant atrial fibrillation surgery for people undergoing cardiac surgery. Cochrane Database of Systematic Reviews 2016; 8: CD011814. DOI: https://doi.org/10.1002/14651858.CD011814.pub2.
1041. Allen V, et al. Net clinical benefit of warfarin in individuals with atrial fibrillation across stroke risk and acros primary and secondary care. Heart, http://dx.doi.org/10.1136/heartjnl-2016-309910.
1042. Kirchhof P, et al. Catheter ablation in patients with persistent atrial fibrillation. Eur Heart J 2016; https://doi.org/10.1093/eurheartj/ehw260.