Primary, secondary and tertiary preventions in the kaleidoscope of newer lipid guidelines
█ Review
DOI: 10.26430/CHUNGARICA.2019.49.1.44
Authors:
Bajnok László
Pécsi Tudományegyetem, Klinikai Központ, I. sz. Belgyógyászati Klinika, Endokrinológiai és Anyagcsere Tanszék, Pécs
Summary
Even at extremely low cholesterol levels cardiovascular events do not show a J curve and neither are the side effects more common. As a result of the cardiovascular risk classification, the most important question refers to lipid therapy, whether cholesterol lowering is necessary and if so, what target and starting dose should be considered. According to the Guidelines of European Atherosclerosis Society, statin is currently to be considered at 1 to 4% SCORE and from 2.6 mmol/L LDL-C that is deeply below median values, if uncontrolled by lifestyle interventions. The new American ACC/AHA cholesterol management guidelines recommend the use of thresholds for LDL-C targets in some cases again, but these have become more conservative and overcomplicated with regard for primary prevention. An LDL-C target below 1.4 mmol/L in the extreme high risk category appeared in the recommendations. Regarding usage of non-statin drugs and/or treatments of elderly, the guidelines are fairly divided, in both primary and secondary preventions. The dose or drug dependence of “statin intolerance” has not been demonstrated in randomized controlled trials. Most of the potential side effects listed in leaflets are not evidence based, while they may generate complaints by a nocebo effect.
ISSUE: CARDIOLOGIA HUNGARICA | 2019 | VOLUME 49, ISSUE 1
Összefoglalás
Extrémen alacsony koleszterin elérésénél sem rajzolódik ki J-görbe a kardiovaszkuláris eseményekből és a mellékhatások sem szaporodnak meg. A kardiovaszkuláris kockázatbesorolás eredményeként megfogalmazható legfontosabb kérdés a lipidterápiára vonatkozik: kell-e koleszterincsökkentő, s amennyiben igen, milyen célértékkel és induló dózissal. Az európai ateroszklerózis irányelv szerint a statin megfontolása jelenleg 1-4% közötti SCORE-nál és mélyen átlag alatti, 2,6 mmol/l LDL-C-től javasolt, ha az életmódkezelés nem elegendő. Az új amerikai ACC/AHA koleszterinkezelési irányelv bizonyos esetekben ismét javasolja a küszöb LDL-C-célértékek alkalmazását is, ugyanakkor tartózkodóbbá és a primer prevenció szempontrendszere tekintetében sokkal bonyolultabbá vált. Az ajánlásokban 1,4 mmol/l alatti LDL-C-célérték is megjelent az extrém magas kockázati kategóriában. A kombinációs és/vagy időskori koleszterincsökkentés tekintetében az irányelvek eléggé megosztottak, mind a primer, mind a szekunder prevenció területén. A „statin-intolerancia” dózis vagy szer szerinti függése nem igazoldott a véletlen besorolásos vizsgálatokban. A betegtájékoztatóban felsorolt lehetséges mellékhatások nagy része nem bizonyítékokon alapuló, miközben – nocebohatás miatt – panaszokat generál.
Bevezetés
A koleszterinszint és a kockázat összefüggésében az epidemiológia szorzását a kezelés osztása teljesen visszaigazolja ‒ extrémen alacsony koleszterin elérésénél (0,2 mmol/l LDL-C) sem rajzolódik ki J-görbe és a mellékhatások sem szaporodnak meg (1).
A kardiovaszkuláris kockázatbesorolás eredményeként megfogalmazható legfontosabb kérdés a lipidterápiára vonatkozik: kell-e koleszterincsökkentő, s amennyiben igen, milyen célértékkel és induló dózissal. Az életmódkezelés ugyanis elsősorban a motiváció és nem a kockázat kérdése (Kérdés: kinél nem indokolt az egészséges életmód?). A vérnyomáscélérték(ek) nem (vagy alig) függnek a kardiovaszkuláris kockázattól (2). A diabétesz kezelése a felismerésétől kell, hogy kezdődjön, gyógyszeres megelőzése pedig a diabétesz és nem a kardiovaszkuláris betegségek kockázatától függ. Az acetil-szalicilát (ASA) primer prevencióban semmilyen kockázat mellett sem javasolt (3).
Az európai lipidajánlás erősen célérték-orientált, különösen magas vagy igen magas kockázat esetén. A javasolt aterogén lipidszint-célértékeket az 1. táblázatban tüntettük fel (3, 4), aminek elérésére, az ezetimib használatát is megfontolandónak tartják (IIa ajánlás), ha statin monoterápia nem elegendő, primer prevencióban is.
Az új amerikai ACC/AHA koleszterinkezelési irányelv – legalább 50%-os csökkentése mellett – ismét javasolja a küszöb LDL-C-célértékek alkalmazását: hypercholesterinaemia (LDL-C ≥4,9 mmol/l) esetén 2,6 mmol/l, szekunder prevenció esetén pedig általában 1,8 mmol/l alatti értéket (5). Ugyanakkor tartózkodóbb és a primer prevenció szempontrendszere tekintetében sokkal bonyolultabb, mint az elődje (6). A nem statin kombinációs kezelés például jelentősen visszaszorult, megfontolása csak azon célértéket el nem érők esetében megfontolandó (IIa ajánlás), akiknél primer prevencióban hypercholesterinaemia, szekunderben pedig (egyéb klinikai körülmények, többek között kockázati tényezők, társbetegségek és szövődmények alapján megállapítható) különösen magas kockázat áll fenn; a többi esetben csak megfontolható lehet (IIb ajánlás).

A Magyar Kardiovaszkuláris Konszenzus Konferencia koleszterincsökkentő irányelvei alapvetően az európai ateroszklerózis ajánlással harmonizálnak (7).
Az LDL-C szigorú, 1,8 mmol/l alatti küszöb célértéke és legalább 50%-os csökkentése az esetek 99%-ában elvileg elérhető. A betegek kétharmadában ehhez a szükség esetén maximálisra emelt intenzitású statin monoterápia is elegendő; a fennmaradó esetek nagyobbik részében ezetimib hozzáadása a megoldás, a kisebbik részében pedig Proprotein convertase subtilisin/kexin type 9 (PCSK9) gátló kombinálása (8). (A PCSK9 a máj által szintetizált és vérben keringő fehérje, ami csökkenti az LDL-receptorok számát. A PCSK9 gátlása 60% körüli LDL-C-csökkenést eredményez.)
Ha a direkt LDL-C-mérés nem elérhető és a triglicerid emelkedett, a számolt LDL-C helyett a koleszterin és HDL-C különbségéből képzett másik aterogén lipidszint-paraméter, a non HDL-C használata jobb, aminek célértékei 0,8 mmol/l-rel nagyobbak, mint az adott kategóriára előirányzott LDL-C-célérték (4).
Primer prevenció
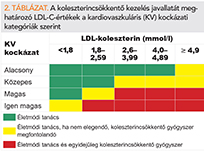
Az európai prevenciós irányelv
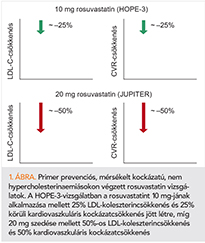
Az európai prevenciós irányelv elsődleges megelőzésben alkalmazandó koleszterincsökkentési javaslatát az 2. táblázatban tüntettük fel (3, 4). Ezek szerint a statinkezelés megfontolása 1-4% közötti SCORE-nál és mélyen átlag alatti, 2,6 mmol/l LDL-C-től javasolt, ha az életmódkezelés nem elegendő (ami általában inkább kiegészíti, és nem helyettesíti a gyógyszerest). Ebben a mérsékelt kockázati kategóriában végzett statinkezeléssel kapcsolatban két rosuvastatinos vizsgálat, a HOPE-3 és a JUPITER szolgáltatott bizonyítékot (1. ábra) (9, 10).
Az új amerikai ACC/AHA koleszterinkezelési irányelv
Az új amerikai ACC/AHA koleszterinkezelési irányelv statin indikációs kockázati küszöbértékei emelkedtek: 5-7,5%-os ASCVD kockázati tartományban megfontolandóból megfontolható lett az ajánlás osztálya (IIa-ból II.b), 7,5-20% között pedig további körülmények mérlegelését javasolják. Amennyiben a kérdéses klinikai, laboratóriumi, eszközös (bonyolult) leletek alapján indikált a statin, akkor is csak mérsékelt intenzitású (5). Magyarázatként az olvasható, hogy „ha maximális kockázatcsökkenést szeretnénk elérni, jogos a nagy intenzitású statin választása”. (Kérdés: mikor nem szeretnénk ezt?)
Hypercholesterinaemiások
Bár az európai táblázat a 4,9 mmol/l-t elérő LDL-C statin kezelését csak megfontolandónak tartja, a szöveges rész alapján ez egyértelműen ajánlott. Ugyanis az ilyen érték az illetőt önmagában is a magas KV kockázatú kategóriába emeli, ahol 2,6 mmol/l alatti az LDL-C-célérték (ha koronáriabetegség vagy diabétesz is társul, akkor 1,8 mmol/l alatti) – ez pedig intenzív koleszterincsökkentő kezelést involvál (3, 4). Ennek megfelelő (maradt) az amerikai ajánlás is, ami szerint ebben a betegcsoportban 20–75 év között nagy intenzitású statinkezelés javasolt és, ha
- az LDL-C-csökkenés <50% vagy
- az LDL-C így is eléri a 2,6 mmol/l-t, ezetimib megfontolása is (IIa ajánlás) (5). Kardiovaszkuláris szempontból terhelt családi előzmény esetén már 4,1 mmol/l LDL-C-től és 20 éves kortól megfontolandó a statin.
Diabéteszesek
Az európai ajánlások szerint igen nagy kockázatúak azon diabéteszesek, akiknél célszervkárosodás vagy dohányzás társul; az EAS szerint még ide tartozik a hipertónia vagy dyslipidaemia jelenléte általában is (4), nemcsak ezek súlyos formái, mint a prevenciós irányelvben (3). Az amerikai koleszterinkezelési ajánlás lényegesen nem változott a diabéteszek esetében: 40–75 év között rutinszerű statinkezelés indikált, bizonyos mértékű ASCVD-kockázat felett (hosszú diabétesztartam vagy szervkárosodás) intenzív formában (5).
Idősek
Időseknél a rendelkezésre álló adatok szűkösebbek és a mellékhatások (miatti félelmek) fenyegetőbbek. Lehet, hogy gyakoribbak a mellékhatások, de ez a nagy vizsgálatok radarja alatt marad (11), miközben a hatásosság egyértelmű (12). Figyelemre méltó ilyen szempontból az a nagy megfigyeléses vizsgálat, ami az intenzív statinkezelés mortalitáscsökkentő relatív hatását hasonlónak találta 75 év felett és alatt (13). Tehát a hatás/mellékhatás különbsége időseknél is (legalább) egy nagyságrendnyi különbséget mutat. Ezzel szemben az idősek primer prevenciós statinkezelését az európai prevenciós és amerikai (ACC/AHA) irányelv csak megfontolhatónak (IIb ajánlás) (3, 5). Az európai dyslipidaemia ajánlás proaktívabb: megfontolandónak tartja a statint (IIa ajánlás), különösen egyéb kockázati körülmények, így hipertónia esetén (4). Az ACC/AHA odáig megy, hogy szerintük 76 és 80 év között a koronária kalcium score meghatározása is megfontolható a statinkezelés indikációjának szűkítésében (IIb ajánlás) (5).
Szekunder prevenció
Az 1,4 mmol/l alatti az LDL-C-célérték
Új fejezetet nyitott a lépcsőzetesen lefelé haladó LDL-C-célértékek történetében a Klinikai Endokrinológusok Amerikai Társasága és az Endokrinológia Amerikai Kollégiuma (American Association of Clinical Endocrinologists and American College of Endocrinology; AACE/ACE) 2017-es dyslipidaemia ajánlása, amelyben 1,4 mmol/l alatti az LDL-C célértéke az extrém magasként definiált kockázati kategóriában (14). Ide sorolódnak azok, akiknél az ateroszklerotikus kardiovaszkuláris betegség
- progresszív, így 1,8 mmol/l alatti LDL-C ellenére ACS következik be,
- olyan betegségekkel társult, mint diabétesz, 3. vagy 4. stádiumú idült vesebetegség, illetve familiáris hypercholesterinaemia, vagy
- korai kezdetű (férfi esetében 55, nőnél 65 év előtti).
A francia ACS utáni lipidellátásra vonatkozó útmutató is ennek szellemében íródott: ezetimib hozzáadását javasolja, ha az alkalmazott statin monoterápiával az LDL-C-célérték felett marad (15), ami 1,8 mmol/l vagy 1,4 mmol/l, attól függően, hogy – sorrendben – mérsékelt vagy intenzív-e az alkalmazott statindózis. (Az 1,4 mmol/l alatti LDL-C általában nem érhető el statin monoterápiával.)
Az európiai nemzeti ajánlások proaktív példája az olasz, ami ACS kapcsán 80 mg atorvastatint javasol rutinszerűen, valamint primer ezetimib kombinációt diabétesz esetén (megfontolásra), illetve 4,2 mmol/l feletti spontán LDL-C mellett (határozottan); 40 mg atorvastatint csak kivételesen tart elegendőnek (ha nem történt PCI, nincs diabétesz, nem volt előzetes statinkezelés és az LDL-C így sem éri el a 2,6 mmol/l-t) (16).
Az időskori szekunder prevenció
Az idősek manifeszt kardiovaszkuláris betegségének lipidkezelésének ajánlásaiban is van eltérés: az EAS ugyanazt a stratégiát javasolja, mint fiatalabbak esetén (4), míg az ACC/AHA-ajánlás tartózkodóbb: a 2013-as verzió 75 év felett mérsékelt intenzitású statint javasolt (I. osztályú ajánlás) (6), míg a megújítása csak megfontolást (IIa), de akár intenzív dózistartományban is (5).
A PCSK9-gátló kezelés javallatáról
Az európai ajánlás a PCSK9-gátló javallatának meghatározásakor a kockázat és LDL-C-érték együttesének mérlegelését javasolja, olyan szempontok szerint, ami meghaladja jelen közlemény kereteit (17).
Az új amerikai ACC/AHA koleszterinkezelési irányelv a szekunder prevenciós PCSK9-gátló kezelést elsősorban a különösen magas kockázatú alcsoport esetében ajánlja megfontolásra, nem megfelelő hatású ezetimib kezelést követő lépcsőben (5). Ez jelentős visszalépés az egy évvel korábbi ACC szakértői konszenzushoz képest (18).
Tercier prevenció – Statin szívelégtelenségben
Obszervációs és bizonyos kisebb randomizált vizsgálatok, illetve nagyobbak post hoc elemzése alapján a statinok szívelégtelenséget javító hatása volt vélelmezhető. Ezt azonban az erre tervezett két nagy vizsgálat a GISSI HF (19) és a CORONA (20) nem erősítette meg. Az utóbbiban, bár 10 mg rosuvastatin iszkémiás szívelégtelenségben csökkentette a hospitalizációk számát, sem az elsődleges – kombinált kemény kardiovaszkuláris – végpontesemények, sem a koronáriatörténések gyakorisága nem különbözött érdemlegesen.
Az európai szívelégtelenség irányelv nem tanácsolja statin indítását, de iszkémiás eredet esetén annak további folytatását megfontolandónak (IIa ajánlás), más szövegkörnyezetben megfontolhatónak (IIb ajánlás) tartja; a polifarmácia csökkentésére vonatkozó javaslatban pedig (az irányelv 14.3. táblázata) a statin elhagyását hozzák fel példaként (21).
Az új amerikai ACC/AHA koleszterinkezelési irányelv alapján iszkémiás eredetű csökkent EF szívelégtelenségben is csak megfontolható (IIb ajánlás) a statin (5).
A „maximálisan tolerált” statindózisról
Az irányelvek intenzív statinterápia szükségessége esetén a „maximálisan tolerált” dózist javasolják (3–6). Ez azt sugallja, mintha a „statin-intolerancia” dózis függése kellően bizonyított lenne. (Az idézőjel egy neves szakértői grémiumtól származik) (22). Ezzel szemben a 80 mg-os dózist összehasonlító kettős vak klinikai vizsgálatok közül nemcsak az atorvastatinnal végzettek esetében (PROVE IT, TNT, SPARCL) nem volt különbség a myalgia vagy egyéb panaszok gyakoriságában, hanem – az A–Z és SEARCH-vizsgálatokban, az egyébként a myopathia tekintetében ma már nem biztonságosnak tekintett – 80 mg adagú simvastatin mellett sem volt meggyőző differencia. (A pravastatin előnye sem igazolódott.) Az esetek nagyobb részében a myalgia a kezelés újrakezdésekor nem ismétlődik (23). Jó példa volt az előzetesen „abszolút statin-intoleránsnak” minősítetteken végzett GAUSS 3, amelynek bevezető szakában a betegek véletlenszerűen 20 mg atorvastatint vagy placebót kaptak (24). A kezelést elhagyók aránya 42,6% volt az atorvastatin és 26,5% a placebo mellett. Tehát a statin melletti myalgia még ilyen, válogatott esetekben is gyakrabban nem ismétlődik, mint igen, és ha mégis, gyakrabban a statinhatás (lehetőségének a) tudata, mint maga a statin okozza. Arra sincs RCT-adat, hogy közepes adagú statin+ezetimib mellett kevesebb lenne az izommellékhatás, mint maximális statindózis esetén.
Az izompanaszokkal szemben a türelmes állhatatosság lehet a leghatékonyabb eszközünk. Például a panaszok és a gyógyszerbevétel naptárban történő feljegyzése, annak ellenőrzése, megbeszélése. Abszolút intoleráns esetben ezetimib vagy fibrát monoterápia esetleg a kettő kombinációja jön szóba (4, 23).
Különösen az akut iszkémiás események kapcsán bevezetett kezelés és néhánynapos követés mellett tűnik a „maximálisan tolerált dózis” meghatározás óvatoskodónak, ami mérhetően szubmaximális tartományba tolja le az alkalmazott rutinadagokat. Holott ez a gyakorlat – a maximálishoz képest, a TNT adatainak extrapolálása alapján – 70 körülivel kevesebb elkerülhető eseményért felelős, 10 000 koronáriabeteg ötéves kezelése esetén, miközben csak kettővel kevesebb, új diabéteszből eredő kardiovaszkuláris eseményt előz meg (a rhabdomyolysis sem volt gyakoribb 80 mg atorvastatin mellett) (25). (Ha a hatás bizonyítéka RCT-ken alapszik, miért nem lehet ugyanígy a mellékhatások esetében is, ott ahol van elég adat?) Ezt egy nagy megfigyeléses vizsgálat is megerősítette, ami a maximális intenzitású statint szignifikánsan előnyösebbnek találta a szubmaximálishoz képest (13).
Nem beszélhetünk statin hepatopathiáról, mert bár a statin okozta májenzim-emelkedés gyakorisága − dózistól és szertől függően − 0,2–2,1% közötti (rosuvastatin mellett ritkább, mint atorvastatin mellett), a progresszív idült és/vagy fatális esetek megszaporodását nem lehetett kimutatni (22, 26). Ezért furcsa, hogy az új ACC/AHA-ajánlás az időskorban megfontolandó kisebb adagok mellett a „májfunkciós abnormitásokat” hozza fel érvként (5).
Kifejezetten kártékonyak a veszélyeket eltúlzó, többé-kevésbé elfogult közlemények (27, 28). Az iatrogén kockázatnál például csak a bizonyítottak veendők figyelembe (22, 26), de ott is csak arányosan. Például nem az új keletű diabéteszt egészében kell a mérleg másik serpenyőjébe helyezni, hanem csak ennek vaszkuláris kockázatot emelő hatását.
Nem „ész nélküli” kezelésre van szükség, hanem a kockázat mérlegelésére (pl. egyidejűleg 70 év feletti életkor és/vagy női nem és/vagy alacsony testsúly?, hypothyreosis kizárva? stb.) és észszerű vállalására.
Egyéb lipidológiai kezelések
Az Európai Atherosclerosis Társaság szerint a 2,3 mmol/l-nél magasabb triglicerid gyógyszeres csökkentése megfontolandó (IIa ajánlás), statin mellé adott fibrát formájában, nagy rizikójú betegnél pedig megfontolható (IIb) (4). Ennek szelleméhez hasonlatos évek óta az MKKK, ami legújabban is azt mondja ki, hogy magas vagy igen magas kockázat és hypertriglyceridaemia vagy atherogen dyslipidaemia társulása esetén a statinok kombinációja fibrát, esetleg omega-3 zsírsav alkalmazásával megfontolható (7, 29). Az új amerikai ACC/AHA koleszterinkezelési irányelv csak 5,6 mmol/l feletti trigliceridtől javasolja ennek gyógyszeres kezelését megfontolni (5).
Bár a pleiotróp célzatú, 1 g körüli halolajjal végzett vizsgálatok metaanalízise semleges eredményű (30), az ennél nagyobb adag alkalmazása korábban is és legújabban is sikeres volt (31, 32). Az új vizsgálat, a REDUCE IT keretében hypertriglyceridaemiás (medián 2,43 mmol/l), 70%-ban szekunder prevenciós betegek kerültek bevonásra és napi 4 g tisztított, stabilizált EPA (ikozapentetil) volt a vizsgálati készítmény (32). A kardiovaszkuláris − koronária és cerebrovaszkuláris − események száma 25%-kal csökkent, de kevesebb volt az anémia és gasztrointesztinális tünet, így hasmenés is; igaz a pitvarfibrilláció és perifériás ödéma szignifikánsan gyakoribb lett. A jótékony hatás mechanizmusa nem világos, mert ez az induló és elért triglicerid-értékektől független volt. (További nagy vizsgálatok vannak folyamatban.)
A koleszterinszint-csökkentés adherenciájának javítása
A gyógyszerszedési együttműködés javítását szolgálhatja, ha rendre kitérünk a statinellenességre. „Mostanában sok rosszat mondanak a koleszterincsökkentőkről, Ön is találkozott ezekkel? Ezek egyáltalán nem igazak (nehezen érthető, hogy miért ez a gyógyszercsalád vált bűnbakká),” Az LDL-C beépített marker: ha intenzív koleszterincsökkentés mellett értéke 2,5 mmol/l feletti, sokkal valószínűbb (minél magasabb, annál inkább), hogy a beteg nem szedi (pontosan) a gyógyszer(ei)t, mint az, hogy a kezelés nélküli koleszterin ilyen magas és/vagy a statinra adott válasz ilyen gyenge.
A páciensek sajnos nem értesülnek a – nocebohatás miatt egyéb panaszgenerátor – betegtájékoztatóból, hogy a felsorolt mellékhatások nagy része nem bizonyítékokon alapuló (33).
Következtetések
A koleszterinszint-csökkentők a legjobban bevizsgált készítmények közé tartoznak, mind a hatás, mind a mellékhatás tekintetében. Páratlan sajátságuk – például az antitrombotikumokhoz vagy kardio-vazoaktív szerekhez képest – a kockázatnál (legalább egy) nagyságrendnyivel nagyobb várható haszon, még maximális dózisok esetén is.
A nemzetközi ajánlások trendjei divergálnak a koleszterinszint-csökkentés hatóköre, intenzitása és a kombinációs kezelés vonatkozásában. Az azonban nem kérdőjeleződött meg, hogy szekunder prevencióban az intenzív koleszterincsökkentés a standard, de ezen gyakorlat primer prevencióban is legitim. A napi esetek nagyobbik részében nem található olyan biztonsági kockázat, ami a többletelőnnyel bíró maximális statindózisok kerülését indokolná. Az ezetimib nem helyettesíti, hanem sokkal inkább kiegészíti a megfelelő intenzitású statint.
Anyagi támogatás
Szakértői javadalmazás és/vagy kongresszusi támogatás (2012–2018): MSD, Sanofi Aventis, Amgen, Genzyme, Sandoz, Astra Zeneca, Novo, Novartis, Boehringer Ingelheim, Ipsen, Krka, Merck, Research Flow
Érdekeltségek: nincsenek.
Rövidítések
AACE/ACE: Klinikai Endokrinológusok Amerikai Társasága és az Endokrinológia Amerikai Kollégiuma; American Association of Clinical Endocrinologists and American College of Endocrinology; ACC/AHA: Amerikai Kardiológiai Társaságok; American College of Cardiology/American Heart Association; ACS: akut koronária szindróma; acute coronary syndrome; CK: kreatinin-kináz; creatinine kinase; FH: familiáris hypercholesterinaemia; familial hypercholesterolemia; GAUSS 3: Efficacy and Tolerability of Evolocumab vs. Ezetimibe in Patients With Muscle Related Statin Intolerance: The GAUSS 3 Randomized Clinical Trial; HOPE 3: HOPE 3 Investigators. Cholesterol lowering in intermediate risk persons without cardiovascular disease; EAS: Európai Atherosclerosis Társaság; European Atherosclerosis Society; ESC: Európai Kardiológiai Társaság; European Society of Cardiology; EPA: Eikozapentaénsav; JUPITER: Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin trial; KV: kardiovaszkuláris; LDL-C: alacsony sűrűségű koleszterin; low density cholesterol; PCSK9: Proprotein convertase subtilisin/kexin type 9; TNT: Treating to New Targets study; PROVE IT: PRavastatin Or atorVastatin Evaluation and Infection Therapy (TIMI 22) trial; RCT: véletlen besorolásos vizsgálat; SPARCL: The Stroke Prevention by Aggressive Reduction in Cholesterol Levels trial
Irodalom
1. Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet 2017; 390: 1962–1971. doi: https://doi.org/10.1016/S0140-6736(17)32290-0
2. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39: 3021–3104. doi: https://doi.org/10.1093/eurheartj/ehy339.
3. Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J 2016; 37: 2315–81. doi: https://doi.org/10.1093/eurheartj/ehw106
4. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias: The Task Force for the Management of Dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016; 37:2999–3058. doi: https://doi.org/10.1016/j.atherosclerosis.2016.08.018
5. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2018. pii: S0735–1097(18)39033 8. doi: https://doi.org/10.1016/j.jacc.2018.11.002. [Epub ahead of print]
6. Stone NJ, Robinson J, Lichtenstein AH, et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2013; pii: S0735–1097(13)06028–2. doi: https://doi.org/10.1016/j.jacc.2015.11.019
7. Pados Gy, Karádi I, Kiss RG, et al. Kardiovaszkuláris kockázatbesorolás: igen nagy, nagy, közepes, kis kockázat 2017. Cardiologia Hung 2018; 48: 141–145. doi: https://doi.org/10.26430/CHUNGARICA.2018.48.2.141
8. Cannon CP, Khan I, Klimchak AC, et al. Simulation of Lipid Lowering Therapy Intensification in a Population With Atherosclerotic Cardiovascular Disease. JAMA Cardiol 2017; 2: 959–966. doi: https://doi.org/10.1001/jamacardio.2017.2289.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C reactive protein. N Engl J Med 2008; 359:2195–207. doi: https://doi.org/10.1056/NEJMoa0807646
10. Yusuf S, Bosch J, Dagenais G, et al.; HOPE-3 Investigators. Cholesterol lowering in intermediate risk persons without cardiovascular disease. N Engl J Med 2016; 374: 2021–2031. doi: https://doi.org/10.1056/NEJMoa1600176
11. Iwere RB, Hewitt J. Myopathy in older people receiving statin therapy: a systematic review and meta-analysis. Br J Clin Pharmacol 2015; 80: 363–71. doi: https://doi.org/10.1111/bcp.12687
12. Cholesterol Treatment Trialists’ (CTT) Collaborators. The effects of lowering LDL-cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380(9841): 581–90. doi: https://doi.org/10.1016/S0140-6736(12)60367-5
13. Rodriguez F, Maron DJ, Knowles JW, et al. Association Between Intensity of Statin Therapy and Mortality in Patients With Atherosclerotic Cardiovascular Disease. JAMA Cardiol 2017; 2: 47–54. doi: https://doi.org/10.1001/jamacardio.2016.4052
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. American Association of Clinical Endocrinologists and American College of Endocrinology: Guidelines for Management of Dyslipidemia and Prevention of Cardiovascular Disease. Endocr Pract 2017; 23:479–497. doi: https://doi.org/10.4158/EP171764.APPGL
15. Schiele F, Farnier M, Krempf M, et al. A consensus statement on lipid management after acute coronary syndrome. Eur Heart J Acute Cardiovasc Care 2016; pii: 2048872616679791. doi: https://doi.org/10.1177/2048872616679791
16. Colivicchi F, Massimo Gulizia M, Arca M, el al. ANMCO Scientific Statement: clinical management of hypercholesterolaemia in patients with acute coronary syndromes. Eur Heart J Suppl 2017; 19(Suppl D): D64–D69. doi: https://doi.org/10.1093/eurheartj/sux018
17. Landmesser U, Chapman MJ, Stock JK, et al. 2017 Update of ESC/EAS Task Force on practical clinical guidance for proprotein convertase subtilisin/kexin type 9 inhibition in patients with atherosclerotic cardiovascular disease or in familial hypercholesterolaemia. Eur Heart J 2018; 39:1131–1143. doi: https://doi.org/10.1093/eurheartj/ehx549.
18. Lloyd Jones DM, Morris PB, Ballantyne CM, et al. 2017 Focused Update of the 2016 ACC Expert Consensus Decision Pathway on the Role of Non Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol 2017; 70: 1785–1822. doi: https://doi.org/10.1016/j.jacc.2017.07.745
19. Tavazzi L, Maggioni AP, Marchioli R, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI HF trial): a randomised, double blind, placebo controlled trial. Lancet 2008; 372:1231–39. doi: https://doi.org/10.1016/S0140-6736(08)61240-4
20. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007; 357:2248–61. doi: https://doi.org/10.1056/NEJMoa0706201
21. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37:2129–2200. doi: https://doi.org/10.1002/ejhf.592
22. Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016; 388: 2532–2561. doi: https://doi.org/10.1016/S0140-6736(16)31357-5
23. Stroes ES, Thompson PD, Corsini A, et al. Statin associated muscle symptoms: impact on statin therapy European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015; 36: 1012–22. doi: https://doi.org/10.1093/eurheartj/ehv043
24. Nissen SE, Stroes E, Dent Acosta RE, et al. Efficacy and Tolerability of Evolocumab vs Ezetimibe in Patients With Muscle Related Statin Intolerance: The GAUSS 3 Randomized Clinical Trial. JAMA 2016; 315: 1580–90. doi: https://doi.org/10.1001/jama.2016.3608
25. LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352: 1425–1435. doi: https://doi.org/10.1056/NEJMoa050461
26. Mach F, Ray KK, Wiklund O, et al. Adverse effects of statin therapy: perception vs. the evidence – focus on glucose homeostasis, cognitive, renal and hepatic function, haemorrhagic stroke and cataract. Eur Heart J. 2018; 39: 2526–2539. doi: https://doi.org/10.1093/eurheartj/ehy182.
27. Abramson JD, Rosenberg HG, Jewell N, Wright JM. Should people at low risk of cardiovascular disease take a statin? BMJ 2013; 347:f6123. doi: https://doi.org/10.1136/bmj.f6123
28. Yebyo HG, Aschmann HE, Puhan MA. Finding the Balance Between Benefits and Harms When Using Statins for Primary Prevention of Cardiovascular Disease: A Modeling Study. Ann Intern Med 2018 Dec 4. doi: https://doi.org/10.7326/M18–1279. [Epub ahead of print]
29. Karádi I. Kardiovaszkuláris rizikó és lipidterápia 2014 (VI. MKKK) Metabolizmus 2015; 13: 16–20.
30. Abdelhamid AS, Brown TJ, Brainard JS, et al. Omega 3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev 2018 Jul 18; 7: CD003177. doi: https://doi.org/10.1002/14651858.CD003177.pub3.
31. Yokoyama M, Origasa H, Matsuzaki M, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open label, blinded endpoint analysis. Lancet 2007; 369: 1090–8. doi: https://doi.org/10.1016/S0140-6736(07)60527-3
32. Bhatt DL, Steg PG, Miller M, et al. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med 2018 Nov 10. doi: https://doi.org/10.1056/NEJMoa1812792. [Epub ahead of print]
33. Finegold JA, Manisty CH, Goldacre B, et al. What proportion of symptomatic side effects in patients taking statins are genuinely caused by the drug? Systematic review of randomized placebo controlled trials to aid individual patient choice. Eur J Prev Cardiol 2014; 21: 464–74. doi: https://doi.org/10.1177/2047487314525531