Cardiac Sarcoidosis and Arrhythmias
█ Review
DOI: 10.26430/CHUNGARICA.2019.49.3.174
Authors:
Sághy László1, Besenyi Zsuzsanna2, Benák Attila1
1SZTE ÁOK, II. sz. Belgyógyászati Klinika és Kardiológiai Központ, Szeged
2SZTE ÁOK, Nukleáris Medicina Intézet, Szeged
Summary
Cardiac sarcoidosis is a rare and underdiagnosed disease. The first clinical manifestation can be high degree atrioventricular (AV) block or malignant ventricular arrhythmias (VAs), when further diagnostics are recommended. The key of the diagnosis is the extracardiac or cardiac biopsy, which can be targeted based on advanced cardiovascular imaging (cardiac MRI or FDG PET/CT scan). The conduction abnormalities can be reversible, but in case of high degree AV block, an implantable pulse generator is recommended. The pathophysiology of VAs can be due to inflammation or ventricular remodeling. Treatment is based on immunosuppressants, but catheter ablation can be necessary in drug-refractory cases. Primary prophylactic ICD implantation is a complex decision, which is based on anamnestic, imaging and electrophysiological study findings.
ISSUE: CARDIOLOGIA HUNGARICA | 2019 | VOLUME 49, ISSUE 3
Összefoglalás
A szívsarcoidosis egy ritka, aluldiagnosztizált kórkép. Gyakran más okkal nem magyarázható magas fokú pitvar-kamrai (AV) blokk vagy malignus kamrai aritmiák (VA) formájában jelentkezik, amely esetekben további komplex diagnosztika javasolt. Ebben fontos szerepe van a szív MRI-n kívül az FDG PET/CT-vizsgálatnak, amely alapján célzott biopszia tervezhető. A vezetési zavarok megfelelő immunszuppresszív terápiára reverzibilisek lehetnek, azonban magas fokú AV-blokk esetén ritmusszabályzó készülék beültetése javasolt. A kamrai ritmuszavarok hátterében inflammatorikus tényezők, illetve későbbi fázisban kamrai remodelláció is állhat. Míg előbbi immuszuppresszív kezelésre jól reagál, utóbbi esetben gyakran szükséges katéteres abláció. Primer profilaktikus ICD-implantáció elbírálásában az anamnesztikus adatok és képalkotó vizsgálatok mellett az elektrofiziológiai vizsgálatnak is létjogosultsága van.
Bevezetés
A sarcoidosis egy progresszív, granulomatosus betegség, amely egy – egyelőre ismeretlen – antigénre adott immunológiai válasz folytán jön létre. Leggyakrabban a tüdőt involválja, azonban számos más szervet is érinthet, többek között a szívizmot is. Prevalenciája földrajzi elhelyezkedéstől és rassztól függően 4,7-64/100 000 közöttire becsülhető. Az esetek 70%-a a 25–45 éves korosztályban fordul elő, immunológiai jellegéből adódóan nők körében gyakrabban észlelhető (1). Kórbonctani adatok alapján a szívizom-érintettség legalább 25%-ban jelen van, azonban kardiológiai klinikai manifesztációra az esetek nagyjából 5%-ában lehet számítani (2). Bizonyított, hogy szívsarcoidosis (CS) a betegek túlélését negatívan érinti, amelynek legfontosabb prediktora a bal kamrai (BK) ejekciós frakció (EF) (3). Mivel válogatott esetekben a sarcoidosis első tünete pitvar-kamrai blokk vagy kamrai ritmuszavar (VA) lehet, ezért minden olyan esetben, ahol az életkor és a klinikai körülmények alapján felmerül a betegség fennállása, további diagnosztikus lépések szükségesek.
Diagnosztika
A CS diagnózisa két módon állapítható meg: szívizom-biopszia, illetve klinikai adatok alapján. Mivel a myocardium érintettsége nem diffúz, ezért a biopszia találati aránya még irányított mintavétellel is alacsony. Klinikailag valószínűsíthető a diagnózis, hogyha szövettanilag igazolt extrakardiális sarcoidosis mellett egyéb más okra vissza nem vezethető strukturális vagy vezetési zavar áll fenn (2, 4). Mivel a diagnózis pozitív hisztológiai mintán alapszik, így a CS bizonyítása az esetek nagy részében komoly diagnosztikus kihívást jelent, főleg ott ahol az első klinikai manifesztáció kardiológiai jellegű. Ennek megfelelően a japán szakmai irányvonal bizonyos kritériumrendszer és klinikai eltérések fennállása esetén eltekint a szövettani igazolástól, de a szerzők véleménye szerint ez növelheti a diagnosztikus tévedés esélyét (4). Irodalmi adatok alapján a 60 évnél fiatalabb, egyéb más okkal nem magyarázható magas fokú pitvar-kamrai blokkok hétterében 11,2-14%-ban CS áll (5). Ezen esetekben tehát megfontolandó a betegek szűrése, amely történhet CT-vizsgálattal (az esetleg pulmonalis érintettség kimutatására), valamint lehetséges szív-MRI és/vagy egésztest FDG (fluoro-dezoxi-glükóz)-PET/CT-vizsgálattal is. A diagnosztikus algoritmust az 1. ábra mutatja.
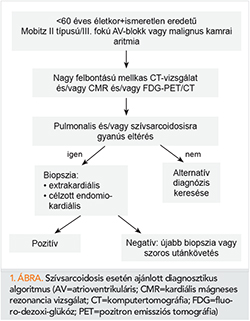
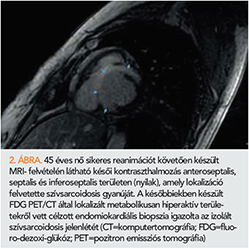
MRI-vizsgálattal a szívsarcoidosisra specifikus eltérés nem igazolható. Gyakran látható foltos jellegű késői kontrasztanyag-halmozás (LGE), amely a koronária ellátási területeket nem respektálja, leggyakrabban a szeptum érintett (2. ábra), valamint midmiokardiális és szubepikardiális régiók. Mindkét kamrát involválhatja, gyakran ARVD-kritériumok is teljesülnek, amely miatt előfordulhat téves diagnózis (6).
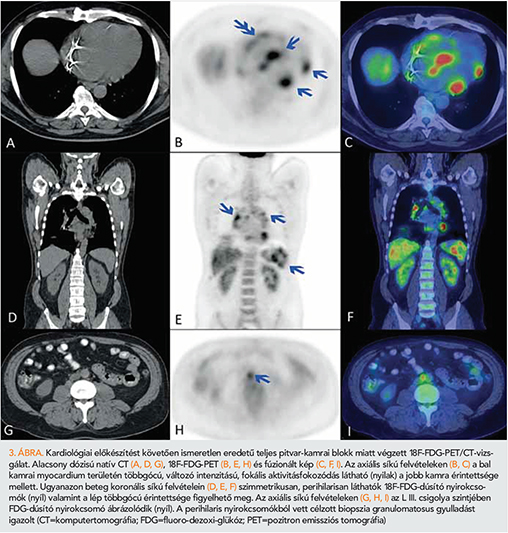
Az FDG-PET/CT az onkológiában széles körben használt diagnosztikus vizsgálat, azonban a kardiológiában is egyre bővülő indikációs sorral (miokardiális viabilitás, endocarditis) rendelkezik, amelyhez már korán csatlakozott a CS is. Megfelelő diétás előkészületek után a metabolikusan aktív, sarcoid granulomákat tartamazó myocardium részek fokozott radiofarmakon felvétele látható. Ha nem izolált CS-ről van szó, akkor az FDG-PET/CT-vizsgálat az extrakardiálisan jelen lévő, sarcoid granulomákat tartalmazó szerveket/nyirokcsomókat is láthatóvá teszi (7) (3. ábra). Mindezek alapján a vizsgálatnak kiemelt jelentősége van mind extrakardiális, mind kardiális célzott biopsziás mintavétel tervezésekor (8).
Az elektrokardiográfiás- és echokardiográfiás vizsgálatnak a végső diagnosztikában csak kiegészítő szerepe van. A fent említetteken kívül számos egyéb, nem specifikus EKG-eltérések fordulhatnak elő: intraventikuláris vezetési zavarok, QRS-fragmentáció, ST-depresszió vagy eleváció (9), T-hullám inverzió (10). Echokardiográfiás vizsgálatra jellemzőek a nonkoronáriás eloszlású falmozgászavarok, amelyek leggyakrabban a szeptumot és a laterális falat érintik. Kezdeti stádiumban előfordulhat myocardium-hipertrófia, későbbiekben a hegesen elvékonyodott, sokszor aneurizmaszerűen kitágult inferobazális septum diszkinézise alakulhat ki (11).
Kezelés
Alapbetegség kezelése
A sacroidosis kezelésének alapja az immunszuppresszív (IS) terápia, azonban nincs egyértelmű ajánlás arra vonatkozóan, hogy szívérintettség esetén mikor, milyen módon és mennyi ideig történjen a kezelés. Abban egyetértés van, hogy azon betegeknél, ahol súlyos kamrai ritmuszavarok, pitvar-kamrai blokk vagy BK szisztolés diszfunkció alakult ki, a kezelés mihamarabbi elkezdése szükséges. Kérdéses azonban, hogy panaszmentes, jelentős szívizom-érintettség nélküli esetekben szükséges-e az IS-terápia. A kezdő kortikoszteroid dózisára sincs egyértelmű iránymutatás, de egy korábbi vizsgálat azt mutatta, hogy magasabb (>30 mg) dózistól mortalitásban érdemi előny nem várható (12). Egyes munkacsoportok szteroid monoterápiát javasolnak, máshol pedig annak leépítésével párhuzamosan egyéb immunszuppresszáns (methotrexat, azathiporin) kezelést indítanak hosszabb távú fenntartó kezelésnek. A terápia hatékonyságának monitorizálására FDG- PET/CT-t, illetve szív-MRI-t javasolják.
Bradycardia kezelése
A szívsarcoidosis az esetek jelentős részében érinti a bazális septumot, ezért gyakran jár együtt magasabb fokú pitvar-kamrai blokkal. Immunszuppreszív kezelésre a vezetési zavar javulhat, mivel azonban a kezelésre adott választ előre megbecsülni nem lehet, ezért a jelenlegi ajánlás minden esetben ritmusszabályozó készülék implantációját javasolja. Korábbi vizsgálatok azt mutatták, hogy pitvar-kamrai blokkal járó CS esetén magas arányban fordult elő VA az után követés alatt, így ezen betegeknél pacemaker helyett az ICD-implantáció megfontolandó.
Kamrai ritmuszavarok kezelése
A kamrai ritmuszavarok patomechanizmusában szerepet játszik részben az aktív gyulladásos folyamat, másrészt pedig az annak következtében kialakult miokardiális hegesedés is. Ezzel magyarázható, hogy szívsarcoidosisban még megtartott BK-funkció esetén is magas arányban fordul elő tartós VA és hirtelen szívhalál azon esetekben, ahol MRI-vizsgálaton LGE igazolható vagy FDG-PET/CT-vizsgálat kóros halmozást mutatott (13). A komplex kezelés ezért magában foglalja az immunszuppresszív-, antiaritmiás (AAD) kezelést, katéterablációt és az ICD-implantációt is.
Az IS-kezelés akár önmagában is csökkentheti a VA-számot, amit több esetriport és kis esetszámú vizsgálat is igazolt, azonban a betegség késői fázisában akár ronthatja is a prognózist. Ez azzal magyarázható, hogy ebben a stádiumban a VA mechanizmusa inkább szubsztrát-dependens, amit a szteroid miokardiális remodellációt fokozó hatása tovább ront. Igazán látványos javulást az IS-kezeléstől tehát a betegség korai fázisában lehet remélni (14).
Az antiartimiás szerek hatékonyságára sincs erős bizonyíték, de IS-kezelés AAD-vel kombinálva egyértelműen hatékonyabb. Az esetek közel fele így is gyógyszeres kezelésre refrakter (15). Ezen betegeknél merül fel katéteres abláció, amivel 80-90%-ban szignifikáns csökkenést lehet elérni a VA-események számában, míg teljes aritmiamentességet 25-50%-ban közöltek (15, 16).
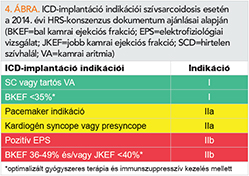
ICD-implantácó minden olyan esetben indokolt, ahol szekunder profilaktikus indikáció áll fenn, illetve azon betegeknél, ahol IS-kezelés ellenére is súlyosan csökkent BK-funkció maradt vissza*. A döntés nehezebb azon klinikai szituációkban, ahol relatív megőrzött EF mellett mutatható ki a CS. Mint korábban említésre került, ha a betegnek pacemaker-implantációt igénylő vezetési zavar alakult ki, akkor ICD-implantáció erősen megfontolandó. Ugyancsak IIa indikációval szerepel a legfrissebb ajánlásban az anamnesztikus kardiogén jellegű syncope, illetve a pozitív elektrofiziológiai vizsgálat (2). Utóbbi pozitív prediktív értéke 75%, míg negatív prediktív értéke 90% (17). Mivel korábbi vizsgálatok azt mutatták, hogy kiterjedt jobb kamrai érintettség a VA prediktora, azért ha a jobb kamrai ejekciós frakció 40% alatt van, ICD-implantáció megfontolható akkor is, ha a BK-funkció csak mérsékelten csökkent (13) (4. ábra).
Következtetések
A klinikailag releváns CS ritkán előforduló és még ritkábban diagnosztizált betegség. Mivel leggyakrabban bradycardia, illetve kamrai tachiaritmiák formájában jelentkezik, ezért az aritmológiának kiemelt fontosságú szerepe van a diagnózisban, a komplex gyógyszeres és invazív kezelésben, valamint a betegség prognózisában. Utóbbit ugyanis nagyban meghatározza, hogy a betegség mely stádiumában kezdik meg a definitív terápiát. Mivel még sok kérdés megválaszolatlan, a kis betegszám miatt hiányoznak a nagy esetszámú randomizált vizsgálatok, így egyelőre a CS kezelése nagyban individualizált.
Irodalom
1. Hillerdal G, et al. Sarcoidosis: epidemiology and prognosis. A 15-year European study. Am Rev Respir Dis 1984; 130(1): 29–32. doi: https://doi.org/10.1164/arrd.1984.130.1.29
2. Birnie DH, et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014; 11(7): 1305–23. doi: https://doi.org/10.1016/j.hrthm.2014.03.043
3. Sadek MM, et al. Corticosteroid therapy for cardiac sarcoidosis: a systematic review. Can J Cardiol 2013; 29(9): 1034–41. doi: https://doi.org/10.1016/j.cjca.2013.02.004
4. The Japanese Circulation Society (JCS). Guidelines for the diagnosis and treatment of cardiac sarcoidosis (JCS 2016) (Chair: Fumio Terasaki). Published on February 24, 2017 [in Japanese] (http://www.j-circ.or.jp/guideline/pdf/JCS2016_terasaki_h.pdf) doi: https://doi.org/10.17996/anc.17-00042
5. Kandolin R, Lehtonen J, Kupari M. Cardiac sarcoidosis and giant cell myocarditis as causes of atrioventricular block in young and middle-aged adults. Circ Arrhythm Electrophysiol 2011; 4(3): 303–9. doi: https://doi.org/10.1161/CIRCEP.110.959254.
6. Kumar S, et al. Ventricular tachycardia in cardiac sarcoidosis: characterization of ventricular substrate and outcomes of catheter ablation. Circ Arrhythm Electrophysiol 2015; 8(1): 87–93. doi: https://doi.org/10.1161/CIRCEP.114.002145.
7. Besenyi Zs, Nagy FT, Sághy L, Pávics L. [18F-fluoro-deoxy-lucose positron emission tomography/computer tomography (18F-DG-PET/CT) imaging in cardiology]. Orv Hetil 2019; 160(26): 1015–1024. doi: https://doi.org/10.1556/650.2019.31414
8. Chareonthaitawee P, et al. Joint SNMMI-ASNC expert consensus document on the role of (18)F-FDG PET/CT in cardiac sarcoid detection and therapy monitoring. J Nucl Cardiol 2017; 24(5): 1741–1758. doi: https://doi.org/10.2967/jnumed.117.196287
9. Tomcsányi J, Wettstein A, Bózsik B, Simor T, Strausz J, Hubay M. Primary cardiac sarcoidosis causing persistent ST-segment elevation. International Journal of Case Reports and Images 2012; 3(4): 15–18.
10. Sipila K, et al. Novel ECG parameters are strongly associated with inflammator(18)F-FDG PET findings in patients with suspected cardiac sarcoidosis. Int J Cardiol 2017; 249: 454–460. doi: https://doi.org/10.1016/j.ijcard.2017.07.027
11. Kurmann R, Mankad SV, Mankad R. Echocardiography in Sarcoidosis. Curr Cardiol Rep 2018; 20(11): 118. doi: https://doi.org/10.1007/s11886-018-1065-9.
12. Yazaki Y, et al. Prognostic determinants of long-term survival in Japanese patients with cardiac sarcoidosis treated with prednisone. Am J Cardiol 2001; 88(9): 1006–10. doi: https://doi.org/10.1016/s0002-9149(01)01978-6
13. Blankstein R, et al. Cardiac positron emission tomography enhances prognostic assessments of patients with suspected cardiac sarcoidosis. J Am Coll Cardiol 2014; 63(4): 329–36. doi: https://doi.org/10.1016/j.jacc.2013.09.022
14. Kusano KF, Satomi K. Diagnosis and treatment of cardiac sarcoidosis. Heart 2016; 102(3): 184–90. doi: https://doi.org/10.1136/heartjnl-2015-307877
15. Okada DR, et al. Ventricular Arrhythmias in Cardiac Sarcoidosis. Circulation 2018; 138(12): 1253–1264. doi: https://doi.org/10.1161/CIRCULATIONAHA.118.034687
16. Papageorgiou N, et al. Catheter ablation for ventricular tachycardia in patients with cardiac sarcoidosis: a systematic review. Europace 2018; 20(4): 682–691. doi: https://doi.org/10.1093/europace/eux077.
17. Aizer A, et al. Usefulness of programmed ventricular stimulation in predicting future arrhythmic events in patients with cardiac sarcoidosis. Am J Cardiol 2005; 96(2): 276–82. doi: https://doi.org/10.1016/j.amjcard.2005.03.059