Partial epicardial coronary artery occlusion during percutaneous transcoronary septal myocardial ablation (PTSMA)
█ Case report
DOI: 10.26430/CHUNGARICA.2019.49.5.365
Authors:
Szűcsborus Tamás1, Pálinkás Attila2, Takács Hedvig1, Pálinkás Eszter1, Ungi Imre1
1Szegedi Tudományegyetem, II. sz. Belgyógyászati Klinika és Kardiológiai Központ, Szeged
2Erzsébet Kórház, Belgyógyászati Osztály, Hódmezővásárhely
Summary
Background: Percutaneous transcoronary septal myocardium ablation (PTSMA) is a catheter-based method to relieve the left ventricular outflow tract (LVOT) obstruction in hypertrophic cardiomyopathy (HCM).
Case history: A female patient, aged 42 years at the time of assessment, has been diagnosed with obstructive hypertrophic cardiomyopathy (HCM) 8 years earlier. Echocardiography revealed a resting left ventricular outflow tract (LVOT) peak gradient of 50 mmHg, which rose to 70 mmHg on provocation and to 125 mmHg on exercise, associated frequently with near-syncope. Because of the NYHA III functional status and the repeated syncopal attacks, persisting despite of optimal pharmacologic therapy, PTSMA was performed. During PTSMA selective and sub-selective angiography and contrast echocardiography was performed which did not reveal evident abnormal collateral connections. However, the alcohol, injected during ablation, may have propagated to the distal part of the right coronary artery, through functional abnormal collaterals, causing unwanted partial vessel closure and myocardial necrosis. Short and mid-term follow up indicated that hemodynamic results of PTSMA was excellent with no relevant clinical outcomes regarding the distal right coronary partial occlusion.
Conclusion: PTSMA is a safe and effective treatment modality for gradient reduction in patients with obstructive HCM selected on appropriate criteria for the procedure. The rigorous assessment of potential abnormal collateral connections between coronary branches are mandatory and frequently requires the modification of the original treatment plan. However, non-visible, functional collaterals might be present which may cause unwanted myocardial necrosis in remote myocardial areas, as was demonstrated in our case.
ISSUE: CARDIOLOGIA HUNGARICA | 2019 | VOLUME 49, ISSUE 5
Összefoglalás
Háttér: A perkután transzkoronáriás septalis myocardium abláció (PTSMA) a bal kamra kifolyótraktus gradiens csökkentésére kifejlesztett eljárás obstruktív hipertrófiás cardiomyopathiában (HCM).
Esetismertetés: Az észlelésekor 42 éves nőbeteg 8 évvel korábban diagnosztizált obstruktív HCM miatt állt rendszeres kardiológiai gondozás alatt. Echokardiográfiával a bal kamrai kifolyótraktusban (LVOT) mért csúcsgradiens 50 Hgmm volt, amely provokációra 70 Hgmm-re, terhelésvizsgálat során 125 Hgmm-re emelkedett és rendszeresen kollapszus közeli állapot alakult ki. A NYHA III. funkcionális stádiumban lévő nőbetegnél, gyógyszeres kezelés mellett is ismételten jelentkező kollapszusok és EKG-val igazolt kamrai ritmuszavarok miatt PTSMA történt. A PTSMA során sem szelektív és szubszelektív angiográfia, sem kontraszt echokardiográfia nem mutatott abnormis septalis kollaterális ágakat, azonban az abláció során alkalmazott alkohol jobb koronária disztális érszakaszába is eljutott, ott nem tervezett miokardiális infarktust hozott létre. A beteg rövid- és középtávú utánkövetése alapján az elvégzett PTSMA kiváló hemodinamikai eredménnyel járt, a járulékosan elszenvedett disztális jobb koronária-okklúzió klinikailag jelentős hatással nem bírt.
Következtetések: A PTSMA biztonságos és hatásos kezelési eljárás a megfelelő kritériumok alapján beválasztott tünetes obstruktív HCM-betegek számára. Az abláció során az esetlegesen meglévő abnormis kollaterális ágak rigorózus vizsgálata kötelező. A beadott alkohol szigorú szabályok betartása mellett is a nem látható, funkcionálisan megjelenő abnormis kollaterálisokon keresztül propagálhat epikardiális koronária felé, amely ritkán előforduló szövődményünk hátterében is állhat.
Bevezetés
A hipertrófiás cardiomyopathia (HCM) az esetek mintegy 25%-ában (provokációs manőverek alkalmazásával 60-70%-ban) obstruktív formában jelentkezik, amely esetekben nyomásgradiens detektálható a bal kamra kifolyótraktusában (left ventricular outflow tract, LVOT) a bal kamraüreg csúcsa és a szubaortikus régió között (1, 2). Tekintettel arra, hogy az obstruktív HCM-es betegek gyakran optimális gyógyszeres kezelés ellenére sem válnak tünetmentessé (3–6), az obstrukció csökkentésére gyakran invazív módszerek válnak szükségessé.
A perkután transzkoronáriás septalis myocardium abláció (PTSMA) a bal kamra kifolyótraktus gradiens csökkentésére kifejlesztett invazív eljárás (7). Utóbbi során a hipertrofizált septalis területet ellátó septalis ágba jutatott etil-alkohol alkalmazásával művi infarktust hoznak létre, amely során a septalis területre lokalizált szövetnekrózis után hegszövet alakul ki, amely csökkenti a hipertrófia mértékét, ezáltal a gradiens is megszűnik vagy jelentősen csökken. Az eljárás mind a típusosan sarcomer fehérjéket kódoló gének mutációja következtében kialakult HCM (8), mind HCM fenokópiák esetén is alkalmazható (9–12).
A beavatkozás leggyakoribb peri- és posztoperatív komplikációja a mintegy 60%-ban előforduló, de az esetek többségében átmeneti teljes AV-blokk v. trifaszcikuláris blokk, amelyek miatt permanens pacemaker beültetésére mintegy 5%-ban van csak szükség (13). Szárblokk, amely típusosan jobb Tawara-szár-blokk, az esetek mintegy 50%-ában alakul ki. Major ritmuszavar kialakulása a beavatkozás alatt vagy után ritka. Az egyéb közölt komplikációk közé a szubakut kamrai septumdefektus, agyembólia, ramus descendens anterior vagy bal közös törzs disszekció, heveny mitralis inszufficiencia kialakulása, illetve jobb és/vagy bal kamra szabad fali infarktus tartozik. Jelen elérhető adatok azt igazolják, hogy a HCM-es betegekben meglévő hirtelen szívhalál rizikót (14–16) a PTSMA nem növeli (17).
Jelen közleményünkben a PTSMA egy ritka szövődményét, egy epikardiális koronária ág részleges okklúzióját mutatjuk be, amelyet feltehetően a PTSMA során bejuttatott alkohol egy, a beavatkozás során nem detektált, abnormis kollaterális ágon való propagációja okozott.
Esetismertetés
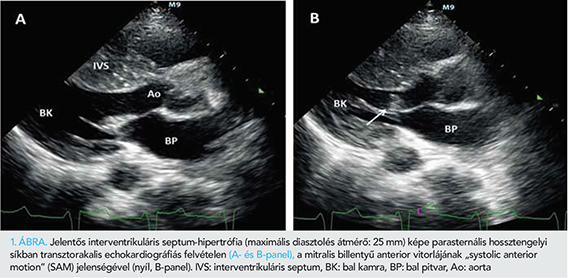
A PTSMA idején 42 éves nőbetegnél 34 éves korában diagnosztizáltak hipertrófiás cardiomyopathiát. Rizikófaktorai közül a családjában előforduló hirtelen szívhalál (SCD) emelendő ki. Echokardiográfiás vizsgálattal jó globális balkamra-funkció mellett dominálóan a septumra lokalizálódó hipertrófia igazolódott (basalis inferior septum: 14 mm, mid-inferior septum: 25 mm, basalis anterior septum: 17 mm, mid-anterior septum: 23 mm). „Systolic anterior motion” (SAM) jelenség látható volt (1. ábra, A–B-panelek). A bal kamrai kiáramlási pályában (LVOT) nyugalomban 50 Hgmm-es csúcsgradiens volt mérhető, amely Valsalva-manőver hatására 70 Hgmm-re emelkedett. A mitralis billentyűn posterior irányú jet-tel I-II. fokú inszufficiencia volt látható, a becsült pulmonalis nyomás 35+5 Hgmm volt. Ismétlődő eszméletvesztések miatt a HOCM diagnózis felállítása után 3 évvel, 37 éves korában primer prevenciós indikációval kétüregi ICD-implantáció történt. Ezt követően is jelentkezett eszméletvesztése, ICD-memória alapján malignus ritmuszavar nem volt. A beteg mindvégig optimális és tolerálható gyógyszeres kezelésen volt (2×5 mg bisoprolol és 2×120 mg verapamil). Gyógyszeres kezelés mellett is több alkalommal jelentkezett EKG-val dokumentált nem tartós kamrai tachycardia (nsVT), amely miatt ICD-sokk is bekövetkezett. Észlelése alatt a beteg terhelhetősége fokozatosan csökkent és 41 éves korára funkcionális státusza a NYHA III. szintet érte el, CCS 2 anginastátusszal.
A 42 éves korában intézetünkben végzett terheléses EKG során mellkasi panasz nem jelentkezett, a maximális prediktált szívfrekvencia elérése után, a levezető szakaszban széles QRS-tachycardia indult megszédüléssel, amely 15 perc alatt spontán terminálódott. Terheléses echokardiográfia 75 wattos terhelési fokozat második percéig történt, a terhelés során vérnyomásesés, mellkasi panasz nem volt. Levezető szakban kollapszus közeli állapot alakult ki, amelyhez EKG-eltérés nem társult. A nyugalmi LVOT csúcsgradiens 48 Hgmm-ről 125 Hgmm-ig emelkedett. Hemodinamikai vizsgálattal szignifikáns mértékű nyugalmi (47 Hgmm) és provokálható gradiens (122 Hgmm) volt mérhető az LVOT-ban.
A fennálló klinikai és hemodinamikai indikációk alapján a gradiens invazív módon való csökkentése, PTSMA mellett döntöttünk.
PTSMA
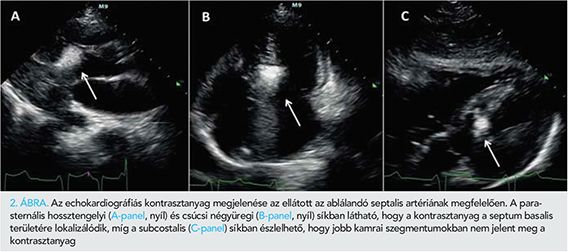
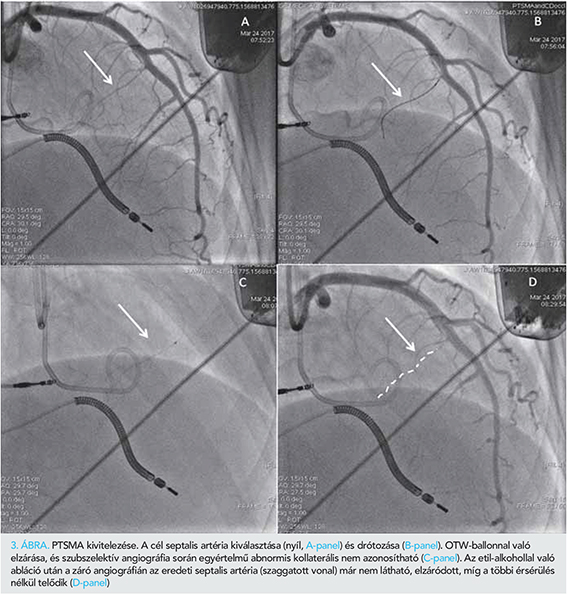
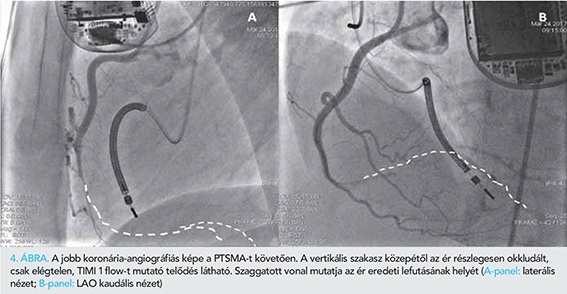
A bal kamra csúcsában egy 5 F „pigtail” (Cordis Europa N.V., Roden, Hollandia) katétert pozícionáltunk nyomásmérés céljából. Egy 6 F JL 3,5 felvezető katéterrel (Medtronic Inc., Minneapolis, MN, USA) kanüláltuk a bal koronáriaszájadékot. Egy BMW PTCA vezetődrótot helyeztünk el az ablálni kívánt septalis artériában, amelyet egy 1,2×8 mm over-the-wire (OTW) ballonnal okkludáltunk. Az elzárt septalis artériába echokardiográfiás kontrasztanyagot (kavitált Gelofusin) adtunk, amelynek megjelenését parasternalis hossz- és rövidtengelyi, csúcsi 3-üregi és subcostalis echokardiográfiás síkokból identifikáltuk. Az echokardiográfia során különös figyelmet fordítottunk a septumon kívüli myocardium területek (papilláris izmok, jobb kamra) esetleges opacifikációjának felismerésére, valamint a septalis kontraszthalmozódás kiterjedésének megítélésére. A kontraszt echokardiográfia csak az ablálni kívánt basalis septum területén észleltünk opacifikációt (2. ábra, A-C-panelek). Szubszelektív angiográfia során nem láttunk egyértelműen abnormis kollaterálisnak megfelelő eltérést (3. ábra, C-panel), némi szellemképszerű, a jobb koronária vetülete felé tartó, halvány kontrasztanyag megjelenéstől eltekintve. A PTSMA-protokollnak megfelelően 97%-os tisztaságú abszolút alkohol adását megkezdtük, de a beadás alatt fellépő hipotónia és PM-ritmus miatt a mindösszesen 1,5 ml alkohol beadására került sor. Kontroll angiográfia során a bal koronáriarendszerben szövődményt nem észleltünk, a cél septais artéria ablációja sikeres volt (3. ábra, D-panel). A jobb koronáriatöltés során azonban a disztális jobb koronária jelentős spazmusa és véráramlás csökkenése volt látható (Thrombolysis in Myocardial Infaction [TIMI] 1 áramlás) a ramus descending posterior (PD) és postero-laterális (PL) ág elzáródása mellett (4. ábra, A-B-panel). Egy 6 F JR 4.0 felvezető katéterrel (Medtronic Inc., Minneapolis, MN, USA) kanüláltuk a jobb koronáriát és egy BMW PTCA vezetődrótot a jobb koronária PD-ágába vezettünk. Egy 6 F Export AP (Medtronic Inc., Minneapolis, MN, USA) thrombus aspirációs katéterrel thrombuseltávolítást végeztünk, amely során kisméretű thrombusok voltak eltávolíthatók. Egy 2×20 mm-es Euphora (Medtronic Inc., Minneapolis, MN, USA) ballonnal alacsony nyomással (4-6 atm-mel) tágítást végeztünk. Gyógyszeresen intrakoronáriásan (IC) alkalmazott bolus Integrillint adtunk, IC nitrát és adenozin mellett. A záró angiográfiás felvételen a jobb koronáriában TIMI 1 áramlás volt detektálható.
Posztoperatív megfigyelése alatt laborértékeiben a beavatkozás után 24 órával 2631 U/l csúcs kreatin-kináz (CK) értéket észleltünk, a Troponin T 1,79 µg/l, az LDH 2182 U/l, a GOT 257 U/l értéken tetőzött. Vesefunkció, vérképeltérést nem mutatott. A beavatkozás után 48 órával kontroll koronarográfiát végeztünk, amely során a jobb koronária disztális harmadának elzáródását tapasztaltuk.
Echokardiográfivával beavatkozás alatt a gradiens megszűnése volt látható. PTSMA után egy nappal a LVOT-ban a turbulens áramlás, a SAM-jelenség megszűnt. A nyugalomban mérhető gradiens LVOT-ban 10 Hgmm volt, amely Valsalva-manőver hatására sem emelkedett. A jobb kamra szabad falának hipokinézise igazolódott, a disztális fele normokinetikus volt, akinetikus volt az inferior és az anterior septum basalis szegmentuma, az inferior fal basalis szegmentuma. A mitralis és tricuspidalis inszufficiencia jelzett mértékű volt.
Kilenchónapos utánkövetés után a beteg funkcionális státusza és terhelhetősége javult (NYHA II. funkcionális stádium). Bizonytalan megszédülések hátterében ICD Holteren ismételten nsVT igazolódott, 1 alkalommal sokk is leadásra került. Amiodaronnal való telítését elvégezték, rosszullétek nem ismétlődtek. Echokardiográfiás vizsgálattal az LVOT-ban turbulens áramlás vagy SAM-jelenség nem volt látható, nyugalomban 5 Hgmm gradiens volt mérhető az LVOT-ban, amely provokációra sem emelkedett. Az inferior fal és az anterior fal basalis szegmentumában és az inferior fal basalis felében akinézis volt látható, I. fokú mitralis és tricuspidalis inszufficiencia mellett.
Megbeszélés
Az alkoholos septumabláció célja a basalis septum lokalizált nekrózisa, amely septalis akinezishez vezet és a kifolyótraktus gradiens következményes csökkenését okozza. Mindazonáltal, a septalis ágrendszer mérete, lefutása és kiterjedtsége, valamint a basalis septum vérellátása igen nagy variábilitást mutat, amely a beavatkozás szempontjából jelentős kihívásokat jelent. A septalis ágrendszer variábilitásának mértékét jól illusztrálja Singh és munkatársai 2001-ben megjelent közleménye, amelyben az első septalis ág méretét és eloszlását vizsgálták (18). Munkájukban 10, nem HCM-es, illetve koronáriabetegségtől mentes, boncolásra került szívet vizsgáltak. A septalis ág méretét 8, PTSMA-ra került beteg koronarográfiára került betegben is meghatározták. A 10, boncolásra került szív közül kettőben fejlett (≥1 mm maximális átmérő), kettőben közepes méretű (0,5-0,9 mm), kettőben kisméretű (0,1-0,4 mm), és háromban csökevényes (<0,1 mm) septalis ágat találtak. Egy szívben a septalis ág ostiuma nem volt azonosítható. Két betegben a septalis ág a jobb kamra szabad falához is adott ágakat. Négy betegben a septum basalis része inkomplett módon volt ellátva a septalis ág által. A PTSMA-ra került HCM-es betegekben, két betegben ≥2 mm átmérőjű, 4 betegben 1-2 mm átmérőjű, és 2 betegben <1 mm átmérőjű septalis ágat észleltek.
Az általunk észlelt epikardiális koronária-okklúzió a PTSMA egy ritka szövődménye. Esetünkben a kontraszt echokardiográfia nem utalt abnormis kollaterálisok által perfundált myocardium területre, a szubszelektív angiográfia alatt sem észleltük abnormis kollaterálisok egyértelmű jelenlétét. A látott halvány kontrasztanyag-megjelenés alapján nem lehetett feltételezni érdemi kommunikációt a septalis ág és a jobb koronária között. Mégis, talán a septalis ág okklúziója következtében kialakult iszkémia miatt az időközben megnyíló, jobb koronária és a septalis ág között meglévő kollaterálison keresztül az alkohol a jobb koronária disztális részébe juthatott, annak részleges okklúzióját okozva.
A septalis ágak közötti kolletarális áramlás kialakulása HCM-betegekben korábban csak feltételezés volt, vagy távoli területek nem kívánt infarktusa után kialakulóan írták le (19, 20). Az első ilyen közleményben a bal kamra csúcsához futó kollaterális áramlást dinamikus jelenségnek tartották, amely a septalis ág okklúziója után lépett fel és az alkohol injekció ideje alatt tartott (19). Egy másik közleményben az alkohol második bólusa, ismételt kontraszt-echokardiográfia után jutott feltételezett kollaterálisok útján a disztális LAD-ba (20). Munkacsoportunk által korábban észlelt esetben az alkohol beadása előtt észleltük a két septalis ágat összekötő kollaterálist (21). Lehetséges, hogy a kollaterális keringés csak egy kis idővel az iszkémia indukálása után jelenik meg, de egy erős szubszelektív septalis angiográfiával láthatóvá tehető.
Az alkoholos abláció során a célzott területeken kívüli kardiális struktúrák infarcerációja kollaterálisok nélkül is egy lehetséges potenciális szövődmény. Az okkludáló ballon megrepedése, vagy nem megfelelő átmérőjű ballonnal való okklúzió az alkohol visszajutását eredményezheti a LAD-ba, következményes disztális nekrózissal (22). Utóbbi enyhén túlméretezett ballon használatával megelőzhető. Hasonlóképpen, amennyiben az alkohol beadása utáni 10 perces várakozási idő után távolítjuk el az okkludáló ballont, LAD felé történő alkohol visszafolyás szintén nem várható.
Hangsúlyozni kell, hogy a kontraszt-echokardiográfia (myocardial contrast echocardiography, MCE) használata a beavatkozás közben szintén csökkenti a potenciális komplikációk számát, a célzott septumterület pontos vizualizálásával (23). Az MCE segítségével az ablálni kívánt septalis area tökéletesen vizualizálható, s amennyiben adott septalis ágba jutatott kontraszt nem az ablálni kívánt lokalizációban jelenik meg, más septalis ág választható az alkohol bejuttatására (21). Amennyiben ilyen septalis ág MCE-vel nem azonosítható, az alkoholos abláció kontraindikált.
Következtetések
Összefoglalva, munkánkban a PTSMA egy ritka szövődményét, egy epikardiális koronária ág részleges okklúzióját mutatjuk be, amelyet feltehetően a PTSMA során bejuttatott alkohol egy, a beavatkozás során nem detektált, abnormis kollaterális ágon való propagációja okozott. Hangsúlyozni kell, hogy a kollaterális keringés potenciális kimutatása és annak észlelése az operátor részéről nagyfokú figyelmet és a standard metodika esetleges „ad hoc” modifikációját teheti szükségessé.
Köszönetnyilvánítás
A munka a „Ritka betegségek patogenezisének kutatása, új diagnosztikai és terápiás eljárásokat megalapozó fejlesztések” (GINOP-2.3.2-15-2016-00039) és a „Életet veSzélyezTető Akut megbetegedések súlYossági és hALálozási mutatólnak jaVítása transzlációs orvostudományi mEgközelítésben – STAY ALIVE” (GINOP-2.3.2-15-2016-00048) támogatásával készült.
Irodalom
1. Maron MS, Olivotto I, Betocchi S, et al. Effect of Left Ventricular Outflow Tract Obstruction on Clinical Outcome in Hypertrophic Cardiomyopathy. N Engl J Med 2003; 348: 295–303.
2. Wigle E, Sasson Z, Henderson M, et al. Hypertrophic cardiomyopathy. The importance of the site and extent of hypertrophy: a review. Prog Cardiovasc Dis 1985; 28: 1–83.
3. Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733–2779.
4. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2011; 58: e212–260.
5. Ungi I, Palinkas A, Nemes A, Ungi T, Thury A, et al. Myocardial protection with enalaprilat in patients unresponsive to ischemic preconditioning during percutaneous coronary intervention. CANADIAN JOURNAL OF PHYSIOLOGY AND PHARMACOLOGY 2008; 86(12): 827–834.
6. Olivotto I, Camici PG, Merlini PA, et al. Efficacy of Ranolazine in Patients With Symptomatic Hypertrophic Cardiomyopathy The RESTYLE-HCM randomized, Double-Blind, Placebo-Controlled Study. Circ Heart Fail 2018; 11: e004124. DOI: https://doi.org/10.1161/CIRCHEARTFAILURE.117.004124
7. Sigwart U. Non-surgical myocardial reduction for hypertrophic obstructive cardiomyopathy. Lancet 1995; 346: 211–14.
8. Toth T, Nagy V, Faludi R, Csanady M, Nemes A, et al. The Gln1233ter mutation of the myosin binding protein C gene: Causative mutation or innocent polymorphism in patients with hypertrophic cardiomyopathy? INTERNATIONAL JOURNAL OF CARDIOLOGY 2011; 153(2): 216–219.
9. Nemes A, Földeák D, Domsik P, Kalapos A, Sepp R, et al. Different patterns of left ventricular rotational mechanics in cardiac amyloidosis—results from the three-dimensional speckle-tracking echocardiographic MAGYAR-Path Study. QUANTITATIVE IMAGING IN MEDICINE AND SURGERY 2015; 5(6): 853–857.
10. Csanyi B, Popoiu A, Hategan L, Hegedus Z, Nagy V, et al. Identification of two novel LAMP2 gene mutations in Danon disease. CANADIAN JOURNAL OF CARDIOLOGY 2016; 32(11): 1355.e23–1355.e30.
11. Csányi B, Hategan L, Nagy V, Obál I, Varga ET, et al. Identification of a Novel GLA Gene Mutation, p.Ile239Met, in Fabry Disease with a Predominant Cardiac Phenotype. INTERNATIONAL HEART JOURNAL 2017; 58(3): 454–458.
12. Sepp R, Hategan L, Bácsi A, Cseklye J, Környei L, ET AL.Timothy Syndrome 1 Genotype without Syndactyly and Major Extracardiac Manifestations. AMERICAN JOURNAL OF MEDICAL GENETICS PART A 2017; 173(3): 784–789.
13. Qin JX, Shiota T, Lever HM, et al. Conduction System Abnormalities in Patients With Obstructive Hypertrophic Cardiomyopathy Following Septal Reduction Interventions. Am J Cardiol 2004; 93: 171–175.
14. Nemes A, Balazs E, Soliman OI, Sepp R, Csanady M, Forster T. Long-term prognostic value of coronary flow velocity reserve in patients with hypertrophic cardiomyopathy: 9-year follow-up results from SZEGED study. HEART AND VESSELS 2009; 24(5): 352–356.
15. Gavaller H, Sepp R, Csanady M, Forster T, Nemes A. Hypertrophic Cardiomyopathy Is Associated with Abnormal Echocardiographic Aortic Elastic Properties and Arteriograph-Derived Pulse-Wave Velocity. ECHOCARDIOGRAPHY-A JOURNAL OF CARDIOVASCULAR ULTRASOUND AND ALLIED TECHNIQUES 2011; 288: 848–852.
16. Orosz A, Baczko I, Nagy V, Gavaller H, Csanady M, ET AL. Sgort-term beat-to-beat variability of the QT interval is increased and correlates with parameters of left ventricular hypertrophy in patients with hypertrophic cardiomyopathy. CANADIAN JOURNAL OF PHYSIOLOGY AND PHARMACOLOGY 2015; 93(9): 765–772.
17. Leonardi RA, Kransdorf EP, Simel DL, Wang A. Meta-analyses of septal reduction therapies for obstructive hypertrophic cardiomyopathy: comparative rates of overall mortality and sudden cardiac death after treatment. Circ Cardiovasc Interv 2010; 3(2): 97–104. doi: https://doi.org/10.1161/CIRCINTERVENTIONS.109.916676
18. Singh M, Edwards WD, Holmes DR, Jr., Tajil AJ, Nishimura RA. Anatomy of the first septal perforating artery: a study with implications for ablation therapy for hypertrophic cardiomyopathy. Mayo Clin Proc 2001; 76: 799–802.
19. Agarwal SC, Purcell IF, Furniss SS. Apical myocardial injury caused by collateralisation of a septal artery during ethanol septal ablation. Heart 2005; 91: e2.
20. Parham WA, Kern MJ. Apical infarct via septal collateralization complicating transluminal alcohol septal ablation for hypertrophic cardiomyopathy. Catheter Cardiovasc Interv 2003; 60: 208–211.
21. Rigopoulos A, Sepp R, Palinkas A, Ungi I, Kremastinos D Th, Seggewiss H. Alcohol septal ablation for hypertrophic obstructive cardiomyopathy: Collateral vessel communication between septal branches. INTERNATIONAL JOURNAL OF CARDIOLOGY 2006; 113(2): E67–E69.
22. Antolinos Perez MJ, de la Morena Valenzuela G, Gimeno Blanes JR, Cerdan Sanchez Mdel C, et al. [Balloon rupture and alcohol leakage into the left anterior descending coronary artery during percutaneous septal ablation for hypertrophic obstructive cardiomyopathy]. Rev Esp Cardiol 2005; 58: 872–874.
23. Faber L, Seggewiss H, Welge D, et al. Echo-guided percutaneous septal ablation for symptomatic hypertrophic obstructive cardiomyopathy: 7 years of experience. Eur J Echocardiography 2004; 5: 347–355.