Inhibition of the renin-angiotensin-aldosterone system during severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) epidemic
█ Review
DOI: 10.26430/CHUNGARICA.2020.50.2.93
Authors:
Nagy Viktor
Semmelweis Egyetem, Általános Orvostudományi Kar, II. sz. Belgyógyászati Klinika, Budapest
Summary
The receptor for the novel severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) is the angiotensin-converting enzyme 2. From another point of view, if the expression of angiotensin-converting enzyme2 is excessively reduced during infection, coronavirus disease-2019 (COVID-19) becomes more severe and, in the case of reexpression, much milder. Many patients with coronavirus disease-2019 suffer from cardiovascular disease. However, the disease can have severe lung and heart complications. Angiotensin converting enzyme inhibitors and angiotensin receptor blockers may increase the levels of angiotensin converting enzyme2 in the body. However, there is no evidence to hypothesize that these agents increase the risk of infection. Therefore, to the best of our knowledge, discontinuation of angiotensin converting enzyme inhibitors and angiotensin receptor blocker therapy is not professionally justified.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
Az új súlyos akut légzőszervi tünetegyüttest okozó koronavírus 2 (SARS-CoV-2) receptora az angiotenzin-konvertáló enzim 2. Más nézőpont alapján, ha a fertőzés során az angiotenzin-konvertáló enzim 2 expressziója túlzottan csökken, akkor a koronavírus-betegség 2019 súlyosabbá válik, reexpresszió esetén pedig sokkal enyhébbé. A koronavírus-betegség 2019 (COVID-19) betegei között sokan szenvednek szív- és érrendszeri betegségben. A betegség ugyanakkor súlyos tüdő és szívszövődményekkel járhat. Az angiotenzin-konvertáló-enzim-gátlóval és angiotenzinreceptor-blokkolóval végzett kezelés megemelheti a szervezet angiotenzin-konvertáló-enzim 2-szintjét. Azonban nincs bizonyítéka annak a hipotézisnek, hogy ezek a szerek megemelik a koronavírus-betegség 2019 kockázatát. Emiatt jelen ismereteink szerint az angiotenzin-konvertáló-enzim-gátlók és angiotenzinreceptorblokkoló-kezelés elhagyása szakmailag nem megalapozott.
„Háború van most a nagy világban.” Valóban háború, csak ezúttal nem az ágyúk csatáznak egymással, hanem az ember egy vírussal. A háborút úgy lehet megnyerni, ha a sereg mozgatása pontos felderítésen alapul, a vírust pedig úgy lehet legyőzni, ha a kezelés megválasztása nem tévhitekre, hanem evidenciákra épül.
Definíció
A 2019-es koronavírus-betegség (COVID-19) egy potenciálisan súlyos, akár életveszélyes légúti fertőzés, amelyet a koronavírusok családjába tartozó „súlyos akut légzőszervi tünetegyüttest okozó koronavírus 2” (SARS-CoV-2) okoz. A vírust egy ismeretlen okú tüdőgyulladás járványszerű kitörése után, 2019. decemberben Wuhan városában (Hubei tartomány, Kína (1) azonosították. A klinikai megjelenés általában légzőszervi fertőzésben nyilvánul meg, amelynek tünetei az enyhe meghűléstől a súlyos vírusos tüdőgyulladásig változatosak lehetnek, és amely potenciálisan heveny légúti distressz szindrómán (ARDS) keresztül halálhoz vezethet. A nagyszámú fertőzött beteg klinikumának elemzése azonban módosította már ezt a meghatározást, mert egyre gyakoribbak az eltérő behatolási kapunak megfelelő panaszok és tünetek (gyomor–bél rendszeri, kardiális), valamint a myocardium károsodását jelző biokémiai markerek emelkedése. A koronavírusok a nevüket a felszíni, tüske, vagy spike („S”) glikoprotein által borított virion elektronmikroszkópos képéről kapták, amely a Nap koszorúszerű kisüléseire hasonlít.
Patomechanizmus
A koronavírusok általában – ezen belül a SARS-CoV-2 is –, egy enzimet használnak fel receptorként a sejtbe jutáshoz, ez az angiotenzin-konvertáló enzim 2 (ACE2), amely a renin–angiotenzin–aldoszteron rendszer (RAAS) része, és a szervezet fontos szabályozó molekulája (2, 3). A vírusburokban levő „S”-protein a fertőzés során alegységekre hasad, az „S1” felismer a gazdaszervezeti ACE2-enzimfehérjén egy receptorkötő helyet, majd létrehozza a kötődést. Ha az ACE2 a sejtmembránban van, ezt követi az „S2” közvetítésével a vírus- és a sejtmembrán fúziója, a vírus bekerült a sejtmembránba, majd a sejtbe (4–6). A szerin-proteáz TMPRSS2 elősegíti a virion belépését a sejtekbe, tehát a bejutáshoz mindkét enzim interakciója szükséges (7).
Az ACE2 azonban egy rövidebb, oldható formában is megtalálható a szervezetben, kis mennyiségben kering a vérben, és nem tartalmazza a kiegészítő membránhorgonyt (8). A kapcsolódási lehetőségeket mutatja az 1. ábra. A SARS-CoV-2 receptorkötő doménnek nagyobb affinitása van az ACE2-höz, mint az eddig ismert koronavírusoknak (9). A SARS-CoV-2 egy jövendőbeli kezelési formája kihasználhatja ezt az amúgy erős ACE2-receptorkötést, valamint a szolúbilis változat jelenlétét (10, 11).
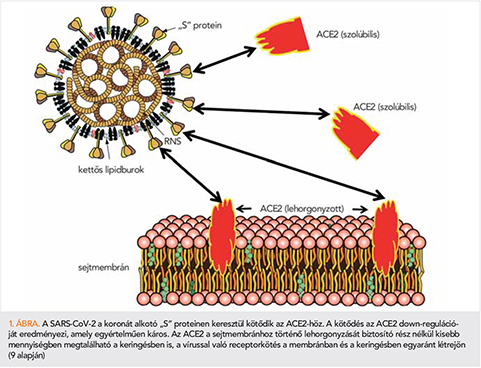
A renin–angiotenzin–aldoszteron rendszer sémás felépítése és működése
A RAAS-ról tudjuk, hogy legalább kétféle (szisztémás és lokális, vagy endokrin és szöveti) formában található meg a szervezetben. Eredeti, ún. szisztémás értelmezése a következőképpen foglalható össze (12, 13). A májban termelődik a 15 aminosavból álló angiotenzinogén, és kijut a keringésbe. A vese juxtaglomerularis apparátusának endokrin funkciójú, granuláris sejtjeiben szintetizálódik a prorenin, amiből proteolízissel alakul ki a renin. A reninelválasztás legfőbb ingere a volumenhiány és a vérnyomásesés. A renin az angiotenzinogénből a C-terminális felől 5 aminosavat lehasít, létrehozva az inaktív köztiterméket, az angiotenzin (A) I-et. Ezt a pulmonalis eredetű ACE további két aminosavval rövidíti, a végtermék pedig a több receptorral rendelkező 8 aminosavból álló AII (A1–8). Fő hatásaiért az 1-es típusú angiotenzin-receptor (AT1-receptor) felel (2. ábra). Ezen keresztül változik a szükségletnek megfelelően az extracelluláris folyadék homeosztázisa, és megemelkedik a csökkenő vérnyomás. A szöveti rendszer főbb hatásai élettani körülmények között nem annyira a vérnyomás-szabályozásban keresendők, hanem pl. a sejtdifferenciálódásban (angioproliferáció, szívizom-hipertrófia, neurondifferenciálódás, reparáció, apoptosis, sebgyógyulás, fibrózis stb.), gyulladásban, reprodukcióban, memóriában, a gyomor–bél rendszeri só és folyadék visszaszívásában. Aktivációja, metabolizmusa minden szervben más és más. A rendszer terminációja nem az AII-nek az AT1-receptoron keresztül elinduló hatását, majd a hormon egyszerű inaktiválódását jelenti, mivel számos metabolit, enzim és receptor része még a rendszernek, amelyet a 3. ábra mutat be. Ide tartozik az ACE2-enzim is, amely inaktiválja az AII-t, és annak hasításával éppen az erősen vazodilatátor hatású A1–7-et készíti el. Az A1–7-agonista hatású a MAS-receptorra (vazodilatáció, nátriurézis, antiproliferáció, antiinflammáció), és gátolja az AT1-receptort. Az ACE2 expressziója kifejezett a szívben, az arteriolák simaizomsejtjeiben, a tüdő alveoláris epithelsejtjeiben, a gyomor–bél rendszer és a vesetubulusok epithelsejtjeiben. Emiatt a SARS-CoV-2-fertőzéssel szemben ezek a szervek sebezhetőbbnek tűnnek, amelyet alátámaszthat a behatolási kapura jellemző tünetek és panaszok dominanciája (14).
A RAAS a felvázoltnál sokkal bonyolultabb felépítésű és hatású, a metabolizmusa, lokalizációja, receptorsűrűsége, az összetevők genetikai transzkripciója és aktivitása, más rendszerekkel való interakciója és életkorspecifikus működése miatt. Ennek részletes ismertetése meghaladja e dolgozat kereteit.
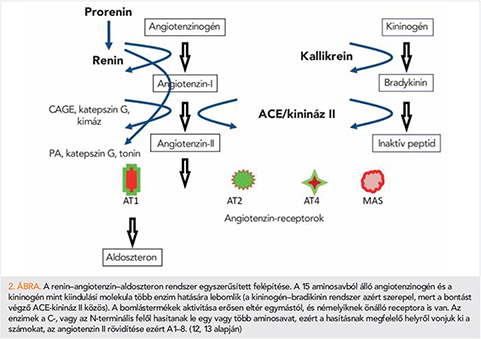
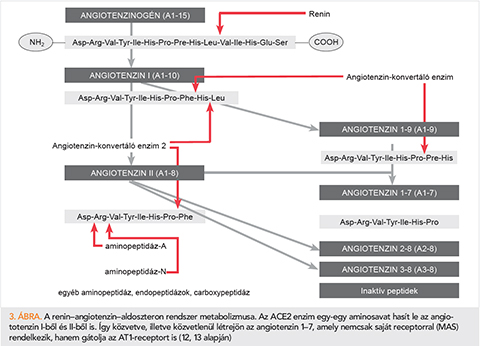
A renin–angiotenzin–aldoszteron rendszer és a SARS-CoV-2-infekció
Korábbi kutatásokból kiderült, hogy a RAAS egyes elemeinek (AII, ACE, AT1-receptor) expressziója rontja a különféle okok miatt kialakult légzési elégtelenséget, megnöveli a pulmonalis vaszkuláris rezisztenciát és permeabilitást, indukálja a tüdőödémát. Ugyanakkor állatkísérletben a rekombináns ACE2 megvédte az egereket a szepszis által kiváltott súlyos akut tüdőkárosodástól, és hasonló volt az észlelés ACE knock out egerekben is. Ez azt jelenti, hogy a RAAS gátlása és az ACE2 expressziója csökkenti a tüdőkárosodást. Ezek az eredmények a kieső vagy csökkent AII hatás következményei (15). Ugyanakkor azt találták, hogy az ACE2 expressziója a tüdőszövetekben szignifikáns mértékben csökkent az egerekben a SARS-CoV-fertőzés után, tehát csökken a szervezet potenciális védekező mechanizmusa (16). Az állatkísérletekből származó adatok azonban emberre egyértelműen nem vonatkoztathatók. ARDS-ben kipróbálták a humán rekombináns ACE2-t, amely biztonságos volt, a RAAS-t a vártnak megfelelően befolyásolta, de nem eredményezett jelentős hemodinamikai változást (17).
Ezek az észlelések komoly dilemma elé állítják a gyógyító orvost, mivel a SARS-CoV-2 receptora az ACE2, és vélhetően azok a szervek a bejutás kapui, amelyek a többinél erőteljesebben expresszálják az ACE2-t (18). Azonban az is igaz, ha a fertőzés során az ACE2 expressziója túlzottan csökken, akkor a COVID-19-betegség súlyosabbá válik, ha pedig reexpresszálódik, akkor, ellensúlyozva az ACE-hatásokat, sokkal enyhébbé. Az ACE2 tehát egyrészt receptora a fertőzésnek, másrészt a tüdőparenchyma, és tegyük azonnal hozzá: a szív épségéért felel, hiszen a RAAS protektív ágát képviseli. Egyszerűen fogalmazva, az AII proinflammatorikus hatású, az ACE2 pedig egyrészt hasítja a molekulát, másrészt a létrejövő A1-7 éppen gátolja a gyulladást.
A renin–angiotenzin–aldoszteron rendszer gátlása SARS-CoV-2-pandémia idején
Ezek után sokakban érthetően megfogalmazódott a kérdés: mivel a SARS-CoV-2 intracelluláris bejutásának a receptora az ACE2, szabad-e folytatni a járvány idején az ACE-gátló- és az angiotenzinreceptorblokkoló- (ARB-) kezelést (a rendszer egyéb gátlószereinek felfüggesztése érdekes módon általában nem kerül szóba)?
A kérdés megválaszolása igen nagy nehézségbe ütközik, mivel nem áll rendelkezésre megbízható adat az epidemiológiát és komorbiditást illetően, de nem ismert az sem, hogy az infekció alatt a betegek milyen mértékben folytatják krónikus gyógyszereik szedését. Nagyon fontos azt is megérteni, hogy az ACE-gátlók és az ARB-k semmiféle direkt hatással nem bírnak az ACE2 expressziójára. Az ACE ≠ ACE2!
Egy metaanalízisben (13 tanulmány, 2893 beteg, ezen belül a hipertónia és mortalitás összefüggéséről 2 tanulmány 341 betegében volt használható adat) azt találták, hogy hipertóniában a súlyosabb lefolyású COVID-19 kockázata 2,49-szor, a mortalitásé pedig 2,42-szor volt nagyobb. A súlyosabb lefolyás másik kockázati tényezője a 60 évnél idősebb életkor volt (19). Mindegyik tanulmány kínai volt, nem ismerhető a vérnyomásmérés metodikája és a kezelés.
Egy másik metaanalízis szintén kínai betegek klinikai adatait értékelte a 2020. március 6-ig megjelent közlemények alapján. A talált 1250 munkából csak 10 volt elemzésre alkalmas! 3403 kórházban kezelt beteg adatai szerint 16%-uk volt hipertóniás, 12,1% szenvedett szív- és érrendszeri betegségben, 7,63% dohányzott, 7,87% volt cukorbeteg, 0,83% volt krónikus vesebeteg, 0,92% szenvedett rosszindulatú daganatos betegségben, 0,95%-nál volt ismert krónikus obstruktív tüdőbetegség (20). Speciálisan a szív- és érrendszeri komorbiditások előfordulási arányát elemezték egy másik metaanalízisben (2019. december és 2020. február között megjelent 6 kínai tanulmány, 1527 beteg). A kardiovaszkuláris kardiovaszkuláris-metabolikus társbetegségek közül a leggyakoribb a magas vérnyomás (17,1%), a kardio-cerebrovaszkuláris betegség (16,4%), valamint a cukorbetegség (9,7%) volt. Az intenzív osztályos ápolást is igénylő, súlyos állapotú betegek között a vizsgált célváltozók 2-2,5-szor gyakoribbak voltak, mint az egyéb súlyos, de intenzívet nem igénylő betegek között. Mintavételtől függően e betegek 8-11,5%-ában észleltek szívspecifikus biomarker-emelkedést (21).
A közölt adatok szerint a COVID-19-ben szenvedők között a leggyakoribb társbetegség a hipertónia és a szív-ér rendszeri megbetegedés volt. A komorbiditást illetően azonban úgy tűnik, meg kell várni az amerikai és európai adatokat, hiszen az idős betegek nagy aránya miatt jóval több társbetegségre kell számítani. Emlékeztetőül, a 2014-es hazai ELEF-felmérés szerint a 15 éves és annál idősebb népesség 28%-a dohányzott, és önbevallás szerint 31%-a volt hipertóniás (22).
A hipertónia, koszorúér-betegség, szívelégtelenség, diabétesz, vesebaj bázisterápiáját a RAAS-gátlószerek jelentik, miközben ezek a betegségek, úgy tűnik, hogy nagy arányban fordulnak elő a SARS-CoV-2-infekció során.
A kérdés természetesen a klasszikus, melyik az elsődleges: a járvány az idős, számos társbetegségben szenvedőket érinti, akik érthetően éppen RAAS-gátlót szednek, vagy a RAAS-gátló szedőket érinti, akik a sok társbetegség miatt szedik ezeket a szereket? Mindkét megközelítés azonban oda vezet, hogy a megfertőződött betegek valószínűleg nagy arányban kapnak ACE-gátlót vagy ARB-t.
Régóta kutatott téma, hogy ezek a gyógyszerosztályok hogyan befolyásolják az ACE2- és az angiotenzin-1-7-szintet, valószínűleg közvetetten inkább növelik (23), ami potenciálisan megnövelheti a SARS-CoV-2-behatolás kockázatát. Ez utóbbiról azonban eddig nincsen semmiféle hiteles humán adat. Arról viszont van, hiszen erről szól az összes témába vágó guideline, hogy ezen gyógyszerek elhagyása az alapbetegségek relapszusát okozzák pl. a markerek kedvezőtlen alakulása miatt (vérnyomás-emelkedés, balkamra-hipertrófia romlása, proteinuria-növekedés, crescendo angina stb.). A SARS-CoV-2-fertőzés során gyakran megemelkedő szívspecifikus biomarkerszint szintén óvatosságra int (21, 24). Ezért jelent meg a különböző nemzetközi kardiológiai és hipertóniatársaságok felhívása, illetve vezető orvosszakmai folyóiratok közleményei: „Ne hagyd el járvány idején a RAAS-gátlókat” (25-33). Ez a felhívás természetesen nem keverhető össze azokkal az esetekkel, amelyekben pl. szeptikus sokkban inkább keringéstámogatásra van szükség, mintsem vérnyomáscsökkentésre.
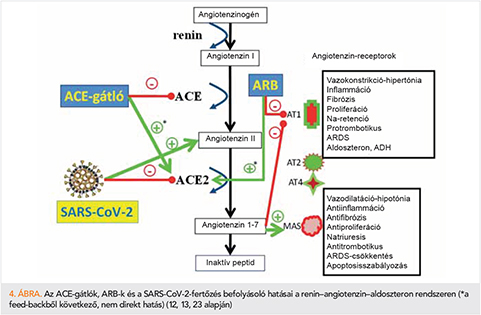
Következtetések
A jelenlegi bizonyítékok azt mutatják, hogy az ACE-gátlók és az ARB-k közismert protektív hatásaikon felül fokozhatják az ACE2 expresszióját és aktivitását a szívben, további védő szerepet töltve be a szív- és érrendszerben. Ez az aktivitásnövekedés a tüdőben is jelen lehet, amely állatkísérletekben kedvezően befolyásolta az ARDS alakulását. Az ACE2 magasabb szintje növeli a sejtek SARS-CoV-2-re való érzékenységét. Az ACE-gátlók és az ARB-k, valamint a SARS-CoV-2-fertőzés közötti interakcióról nincsen semmiféle hiteles adat. Erről természetesen – ahogyan ezt minden, a témával foglalkozó véleményben, felhívásban megfogalmazták – nagyon sürgősen ismereteket kell szerezni, de addig az evidenciák szerint az ACE-gátlók és az ARB-k elhagyása a járvány idején nemcsak a betegek kardiovaszkuláris kockázatát növeli meg, de rontja a pulmonalis kimenetelt is.
Utóhang
Közvetlenül a kézirat nyomdába kerülése előtt megjelent egy retrospektív obszerváció. 2019. december 19–2020 február 20. között Hubei tartomány kórházaiban elhunyt hipertóniások adatait elemezték.
Az egyéb vérnyomáscsökkentőket kapókkal összehasonlítva, az ACE-gátlóval és ARB-vel kezeltek között kisebb volt az összmortalitás kockázata (kiigazított HR, 0,37; 95% Cl: 0,15–0,89; p=0,03) (34). Az eredmények nyilvánvalóan megerősítésre szorulnak.
Lehetséges érdekbeli ütközések számbavétele
A közzétett dolgozat megjelenését az Egis támogatta. A dolgozat megállapításai új ismereteket tartalmaznak. RAAS-gátlók forgalmazásával kapcsolatosan a szerzőnek pénzügyi érdekeltsége nincs.
References
1. Ren LL, Wang YM, Wu ZQ, Xiang ZC, Guo L, et al. Identification of a novel coronavirus causing severe pneumonia in human: a descriptive study. Chin Med J (Engl) 2020 Feb 11. https://doi.org/10.1097/CM9.0000000000000722.
2. Li W, Moore MJ, Vasilieva N, Sui J, Wong SK, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 2003; 426: 450–454.
3. Letko M, Marzi A, Munster V. Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses. Nat Microbiol. 2020; 5: 562–569. https://doi.org/10.1038/s41564-020-0688-y.
4. Beniac DR, Andonov A, Grudeski E, Booth TF. Architecture of the SARS coronavirus prefusion spike. Nat Struct Mol Biol 2006; 13: 751–52.
5. Lu G, Hu Y, Wang Q, Qi J, Gao F, Li Y, et al. Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26. Nature 2013; 500: 227–2231. https://doi.org/10.1038/nature12328.
6. Li F. Structure, Function, and Evolution of Coronavirus Spike Proteins. Annu Rev Virol 2016; 3: 237–261.
7. Matsuyama S, Nagata N, Shirato K, Kawase M, Takeda M, Taguchi F. Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. J Virol 2010; 84: 12658–12664. https://doi.org/10.1128/JVI.01542-10.
8. Wysocki J, Ye M, Rodriguez E, González-Pacheco FR, Barrios C, et al. Targeting the degradation of angiotensin II with recombinant angiotensin-converting enzyme 2: prevention of angiotensin II-dependent hypertension. Hypertension 2010; 55: 90–98. https://doi.org/10.1161/HYPERTENSIONAHA.109.138420.
9. Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV. Biochem Biophys Res Commun 2020 Feb 17. pii: S0006-291X(20)30339-9. https://doi.org/10.1016/j.bbrc.2020.02.071.
10. Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020; 367: 1260–1263. https://doi.org/10.1126/science.abb2507.
11. Batlle D, Wysocki J, Satchell K. Soluble angiotensin-converting enzyme 2: a potential approach for coronavirus infection therapy? Clin Sci (Lond) 2020; 134: 543–545. https://doi.org/10.1042/CS20200163.
12. Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother 2017; 94: 317–325. https://doi.org/10.1016/j.biopha.2017.07.091.
13. Fournier D, Luft FC, Bader M, Ganten D, Andrade-Navarro MA. Emergence and evolution of the renin-angiotensin-aldosterone system. J Mol Med (Berl) 2012; 90: 495–508. https://doi.org/10.1007/s00109-012-0894-z.
14. Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med 2020 Mar 12. https://doi.org/10.1007/s11684-020-0754-0.
15. Imai Y, Kuba K, Rao S, Huan Y, Guo F, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 2005; 436: 112–116.
16. Kuba K, Imai Y, Rao S, Gao H, Guo F, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med 2005; 11: 875–879.
17. Khan A, Benthin C, Zeno B, Albertson TE, Boyd J, et al. A pilot clinical trial of recombinant human angiotensin-converting enzyme 2 in acute respiratory distress syndrome. Crit Care 2017; 21: 234. https://doi.org/10.1186/s13054-017-1823-x.
18. Chen L, Li X, Chen M, Feng Y, Xiong C. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020 Mar 30. pii: cvaa078. https://doi.org/10.1093/cvr/cvaa078.
19. Lippi G, Wong J, Henry BM. Hypertension and its severity or mortality in Coronavirus Disease 2019 (COVID-19): a pooled analysis. Pol Arch Intern Med 2020 Mar 31. https://doi.org/10.20452/pamw.15272.
20. Emami A, Javanmardi F, Pirbonyeh N, Akbari A. Prevalence of Underlying Diseases in Hospitalized Patients with COVID-19: a Systematic Review and Meta-Analysis. Arch Acad Emerg Med 2020; 8(1): e35.
21. Li B, Yang J, Zhao F, Zhi L, Wang X, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020 Mar 11. https://doi.org/10.1007/s00392-020-01626-9
22. https: //www.ksh.hu/docs/hun/xftp/stattukor/elef14.pdf (letöltve 2020. április 5.)
23. Ferrario CM, Jessup J, Chappell MC, Averill DB, Brosnihan KB, et al. Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation 2005; 111: 2605–2610.
24. Guo T, Fan Y, Chen M, Wu X, Zhang L, et al. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol 2020 Mar 27. https://doi.org/10.1001/jamacardio.2020.1017.
25. https: //www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position-statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang (letöltve 2020. április 7.)
26. https: //www.eshonline.org/spotlights/esh-stabtement-on-covid-19-2/ (letöltve 2020. április 7.)
27. https: //ish-world.com/news/a/A-statement-from-the-International-Society-of-Hypertension-on-COVID-19/ (letöltve 2020. április 7.)
28. https: //www.acc.org/latest-in-cardiology/articles/2020/03/17/08/ 59/hfsa-acc-aha-s (letöltve 2020. április 7.)
29. https: //www.doki.net/tarsasag/hypertension/hirek.aspx?&nid= 99089&cid=474#99089 (letöltve 2020. április 7.)
30. Kékes E, Nagy J, Kovács T. COVID-19-fertőzés és a RAAS-gátlók. Hypertonia és Nephrologia 2020; 24(suppl 1): S1–S9.
31. Kuster GM, Pfister O, Burkard T, Zhou Q, Twerenbold R, et al. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J 2020 Mar 20. pii: ehaa235. https://doi.org/10.1093/eurheartj/ehaa235.
32. Sommerstein R, Kochen MM, Messerli FH, Gräni C. Coronavirus Disease 2019 (COVID-19): Do Angiotensin-Converting Enzyme Inhibitors/Angiotensin Receptor Blockers Have a Biphasic Effect? J Am Heart Assoc 2020 Apr 7; 9(7): e016509. https://doi.org/10.1161/JAHA.120.016509
33. Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD. Renin-Angiotensin-Aldosterone System Inhibitors in Patients with COVID-19. N Engl J Med. 2020 Mar 30. https://doi.org/10.1056/NEJMsr2005760.
34. Zhang P, Zhu L, Cai J, et al. Association of Inpatient Use of Angiotensin Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers with Mortality Among Patients With Hypertension Hospitalized With COVID-19. Circ Res. 2020 Apr 17. https://doi.org/10.1161/CIRCRESAHA.120.317134.