Risk Stratification – Guide of the Medical Therapy in Pulmonary Hypertension
█ Review
Authors:
Faludi Réka
Pécsi Tudományegyetem, Klinikai Központ, Szívgyógyászati Klinika, Pécs
Summary
The use of specific vasodilator drugs unequivocally improved the survival of the pulmonary arterial hypertension (PAH) during the last decades, but it still should be considered as a progressive condition with high mortality rate. The survival rate in PAH was also affected by the development of the therapeutic strategies: The regular risk stratification allows us to find the appropriately aggressive medical therapy. The multiparametric risk stratification approach suggested by the current ESC/ERS guideline reflects the real risk of the patients and may be reliably used both at baseline and during the follow-up. The overall treatment goal is achieving a low-risk status. Although patients with intermediate risk may appear clinically stable, generally this is a metastable state, therefore the use of more aggressive therapeutic strategies is pivotal also in this population. The efficiency of double or triple combination therapy is supported by strong evidences and their application is suggested in almost all patients with PAH.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, Supplement B
Összefoglalás
Az elmúlt néhány évtized során a bevezetésre került specifikus vazodilatátor szerek használata egyértelműen javította a pulmonalis artériás hipertónia (PAH) túlélését, de továbbra is progresszív, magas mortalitású betegségnek kell tekintenünk. A PAH-betegek túlélési esélyeit döntően befolyásolta a terápiás stratégiák fejlődése is: A rendszeres rizikóstratifikáció lehetővé teszi a megfelelően agresszív gyógyszeres terápia kiválasztását. Az ESC/ERS ajánlásában szereplő, több paraméteres rizikóbecslő táblázat valódi rizikót tükröz, és egyaránt használható a terápia megkezdésekor és a követés során. A terápiás cél az alacsony rizikóprofil elérése kell hogy legyen. A közepes rizikójú populáció állapota stabilnak tűnhet, de valójában „metastabil” helyzetről van szó, így ebben a csoportban is agresszívabb kezelési stratégiák alkalmazása szükséges. A kettes vagy hármas kombinációs terápia hatékonyságát erős evidenciák támogatják, és majdnem minden PAH-betegben ajánlható az alkalmazásuk.
Bevezetés
A pulmonalis artériás hipertónia (PAH) hátterében egyfajta obliteratív vaszkulopátia áll, ami a pulmonalis vaszkuláris rezisztencia emelkedését eredményezi. A magas pulmonalis nyomás hosszabb távon jobbszívfél-elégtelenség kialakulásához, majd a beteg halálához vezet (1). Kezeletlenül a kórkép rendkívül rossz prognózisú (2). Az elmúlt néhány évtized során a bevezetett specifikus vazodilatátor szerek használata határozottan javította a PAH túlélését, de továbbra is progresszív, magas mortalitású betegségnek kell tekintenünk (3).
A nemzetközi ajánlások a terápia megkezdése előtt, majd időről időre a gondozás során is javasolják az adott beteg rizikójának a felmérését. Az így nyert eredmények jól korrelálnak a beteg prognózisával, és lehetővé teszik személyre szabott terápiás stratégia kialakítását (1).
Jelen összefoglalás célja a PAH kezelése során rizikóbecslésre használt paraméterek, score-rendszerek áttekintése, valamint annak bemutatása, hogyan befolyásolja a beteg rizikója az alkalmazott terápiát.
Rizikóbecslésre alkalmas paraméterek PAH-ban
A beteg panaszainak részletes megismerése és a fizikális vizsgálat döntő fontosságú. A nyugalomban is jelentkező légszomj, syncope és vérköpés az előrehaladott esetek jellemzői. Rossz prognózisra utal a manifeszt jobbszívfél-elégtelenség jelenléte is.
Számos tanulmány igazolta, hogy a betegek funkcionális kapacitása szoros összefüggést mutat a túléléssel. A National Institute of Health (NIH) regiszterben a WHO I/II. funkcionális osztályban levő betegek átlagos túlélése 6 év, III. osztályban 2,5 év, míg IV. osztályban 6 hónap volt (2). A jelenlegi, jóval fejlettebb terápiás lehetőségek javították a túlélési mutatókat, de a funkcionális kapacitás prognosztikus szerepe bizonyítást nyert a későbbiekben is, többek között a REVEAL (Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management) regiszterben is (4). Ez a tény hangsúlyozza a korai diagnózis és bizonyos magas rizikójú populációkban a szűrés fontosságát (1).
Még megbízhatóbban ítélhető meg a betegek terhelhetősége megfelelő tesztek segítésével. A hatperces séta teszt (6MWT) könnyen kivitelezhető, ismételhető, és a beszűkült terhelhetőségű betegek is teljesíteni tudják. A megtett távolság nagy változatosságot mutat, mivel az életkor, a nem, a testméret és a társbetegségek egyaránt befolyásolják. Így ez a teszt egyazon beteg követésére alkalmasabb, mint különböző betegek összehasonlítására. A terápia megkezdése előtti 6MWT-eredmény és a terápia bevezetése után teljesített távolság prognosztikus szerepe egyaránt bizonyított. Ugyanakkor nem bír prognosztikus erővel, hogy a terápia hatására mennyit javult az adott beteg sétatávolsága (5). A REVEAL-regiszter adatai alapján a 440 m-t meghaladó eredmény jó prognózist jelent (4). A spiroergometria segítségével mért maximális oxigénfogyasztás (peak VO2) szintén jó korrelációt mutat a betegek túlélésével PAH-ban, ám mérése speciális felszerelést és szakértelmet igényel (6).
Az echokardiográfia fontos szerepet játszik a PAH diagnózisának felállításában, de a jobb kamra méretét és funkcióját jellemző klasszikus echokardiográfiás paraméterek prognosztikus szerepével kapcsolatban csak kevés adat áll rendelkezésre. Ennek egyik oka, hogy a jobb kamra komplex alakja miatt ezek a paraméterek korlátozottan reprodukálhatók. Az új echokardiográfiás technikák (3D, strain) részben kiküszöbölik ezeket a nehézségeket (1), de speciális szoftver alkalmazását igénylik, és még nem váltak a rutin részévé. A REVEAL-regiszterben a perikardiális folyadék jelenléte bizonyult a rossz prognózis egyértelmű jelének (4). A jobb pitvar méretével (area) kapcsolatban állnak még rendelkezésre evidenciák (6).
A jobb kamrai volumen és funkció megítélésében a szív-MR tekinthető az arany standard vizsgálatnak. Jó prognózist jelent, ha a jobb kamrai végdiasztolés volumenindex <84 ml/m², a bal kamrai végdiasztolés volumenindex >40 ml/m², és a stroke volumenindex >25 ml/m² (7). Ugyanakkor a 35% alatti jobb kamrai ejekciós frakció rossz prognózist jósol (8).
Bár számos potenciális biomarkerrel történtek vizsgálatok, a PAH-ra jellemző pulmonalis vaszkuláris remodelling kimutatására máig nem áll rendelkezésre specifikus laboratóriumi teszt. A jobbszívfél-elégtelenség következtében kialakult szervi károsodások jól monitorozhatók a szokásos vese- és májfunkciós paraméterek vizsgálatával. A B típusú nátriuretikus peptidek (BNP és NT-proBNP) szintje a szívelégtelenség minden formájában emelkedést mutat. Nem specifikus biomarkerek tehát, de jól alkalmazhatók PAH-ban is a betegek állapotának követésére, és prognosztikus szerepük is igazolt (9, 10).
Az NIH-regiszterben vizsgált hemodinamikai paraméterek közül három esetében igazolódott, hogy összefüggést mutat a betegek túlélésével: az emelkedett pulmonalis artériás középnyomás, az emelkedett jobb pitvari nyomás, valamint az alacsony cardiac index (CI) a rossz prognózis jelének bizonyultak (2). A betegség előrehaladott fázisában ugyanakkor a jobbkamra-funkció hanyatlásával párhuzamosan a pulmonalis artériás középnyomás is csökken, így ez a paraméter korlátozottan használható rizikóbecslésre. Ezt támasztja alá Sandoval és munkatársainak egy későbbi tanulmánya, amelyben a magas jobb pitvari nyomás, az alacsony CI és a csökkent kevert vénás oxigénszaturáció (SvO2) prognosztikus szerepét igazolták (11).
Komplex rizikóstratifikáció PAH-ban
A betegek aktuális állapotának pontos felmérésére és ezzel együtt a prognózis megítélésére alkalmas paraméterek utáni kutatás már az NIH-regiszter eredményeinek bemutatásakor megkezdődött (2). A vizsgálatok során nyilvánvalóvá vált, hogy egyetlen paraméter használata nem elégséges. Klinikailag stabilnak tűnő betegekben is megindulhat a jobbkamra-funkció progresszív romlása, miközben a funkcionális kapacitásuk még kielégítő (12). Komplikált esetekben pedig az invazív vizsgálatok megismétlése is szükségessé válhat a helyes terápiás döntések meghozatalához. A REVEAL-regiszter eredményei segítségével kidolgozott pontrendszer 12 paraméter felhasználásával öt különböző rizikójú csoportba sorolja a betegeket az egyéves várható túlélésük alapján (13). Hátránya, hogy az összes paraméter szükséges a helyes értékeléshez.
A 2015-ben megjelent ESC/ERS-ajánlás egy ennél rugalmasabb rizikóbecslő táblázat alkalmazását javasolja (1. táblázat). Ebben csak olyan paraméterek szerepelnek, amelyek értéke megfelelő terápiával befolyásolható, és prognosztikus értékük bizonyított. Ugyanakkor számos paraméter esetében a konkrét cut-off értékek csak szakértői vélemények alapján kerültek meghatározásra, mivel nem állnak rendelkezésre ezzel kapcsolatos evidenciák (1). Az egy éven belül bekövetkező halálozás esélye alapján alacsony (a halálozás rizikója <5%), közepes (5-10%) és magas rizikójú (>10%) kategóriába sorolhatók a betegek a táblázat segítségével. Rizikóbecslés szükséges már a specifikus vazodilatátorkezelés megkezdése előtt, majd 3-6 havonta, a kontrollvizsgálatok során.
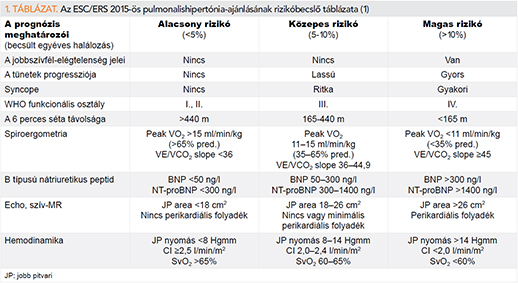
A közelmúltban három nagy regiszter eredményeinek retrospektív analízise segítségével validálták az ESC/ERS-ajánlás rizikóbecslő táblázatát, vagy annak egyszerűsített változatát, a terápia megkezdése előtt és a követéses vizsgálatok során is (14-16).
A svéd SPAHR-regiszter feldolgozása során az ESC/ERS-ajánlásban szereplő paramétereket pontozták (1 pont = alacsony rizikó, 2 pont = közepes rizikó, 3 pont = magas rizikó), így kalkulálva a betegek egyéni rizikóját (14). A német COMPERA-regiszter adatait hasonlóképpen értékelték, de az echokardiográfiás paraméterek kihagyásával történt az analízis (16). A francia regiszter adatainak feldolgozása során mindössze négy paramétert használtak: WHO funkcionális osztály I. vagy II., a 6 perces séta távolsága >440 m, jobb pitvari nyomás <8 Hgmm, CI ≥2,5 l/min/m2 (illetve kiegészítő paraméterként BNP <50 ng/l vagy NT-proBNP <300 ng/l). A betegeket az alapján csoportosították, hogy hány paraméterük felelt meg ezeknek az alacsony rizikót tükröző értékeknek (15). Az első két tanulmány eredményei igazolták, hogy az ESC/ERS-ajánlásban szereplő rizikóbecslő táblázat kiválóan alkalmas az alacsony, közepes és magas rizikójú populáció elkülönítésére, és egyaránt jól használható a terápia megkezdésekor és a követés során is (14, 16). A francia regiszter adatai alapján jó prognózist jelent, ha a vizsgált paraméterek közül mind a négy, vagy legalább három alacsony rizikót tükröz. Hasonlóan jó diszkriminatív erőt tapasztaltak akkor is, ha csak három noninvazív paramétert (WHO funkcionális osztály, a 6 perces séta távolsága, BNP/NT-proBNP) használtak a rizikóstratifikáció céljaira (15). Az utóbbi eredmény arra utal, hogy kontroll jobbszívfél-katéterezésre csak válogatott, valóban magas rizikójú betegeknél van szükség.
Terápiás stratégiák
A PAH kezelésére jelenleg engedélyezett speciális, vazodilatátor hatású szerek három fő hatástani csoportba sorolhatók: prosztanoidok, endothelinreceptor-antagonisták és NO útvonalon ható szerek. Az első csoportba a régóta és jellemzően parenterálisan alkalmazott prosztanoidok mellett a per os szedhető prosztaciklinreceptor-agonisták tartoznak. A foszfodiészteráz-5-inhibitorok és a guanilát-cikláz-stimulátorok az NO útvonal különböző támadáspontjain hatnak (1).
Amikor 2003-ban megszületett a PAH kezelésére vonatkozó első terápiás algoritmus, mindhárom hatástani csoport képviselői elérhetők voltak már (17). Az elmúlt 15 évben természetesen új gyógyszerek is kifejlesztésre kerültek, de emellett a PAH-betegek túlélési esélyeit döntően befolyásolta a terápiás stratégiák fejlődése is. A 2003-as ajánlás csak WHO III-IV. funkcionális osztályban javasolta a kezelés megkezdését, ám később számos study igazolta, hogy a még csak II. funkcionális osztályban levő betegek állapotát is képes javítani a specifikus vazodilatátorterápia, és ezáltal a betegek prognózisa is jelentősen javul (18, 19).
Fontos továbbá, hogy ne elégedjünk meg a progresszió gátlásával: tűzzünk ki terápiás célokat, amelyek elérése javítja a betegek prognózisát (19). A 2009-es, majd a 2015-ös ESC/ERS-ajánlásban közölt rizikóbecslő táblázatok egyben terápiás célokként is szolgálnak. A PAH-betegek gyógyszeres terápiájának célja az alacsony rizikójú állapot elérése kell hogy legyen, minden, vagy a lehető legtöbb paraméter tekintetében. Amennyiben adott gyógyszerelés mellett a beteg nem kerül az alacsony rizikójú csoportba, a terápia intenzifikálása szükséges (1, 20).
A 2003-as terápiás algoritmus még döntően monoterápia alkalmazását javasolta (17). Ám a 2000-es évek elején, amikor a parenterális prosztanoidok mellett az első, per os szedhető endothelinreceptor-antagonista és foszfodiészteráz-5-inhibitor szerek is széles körben elérhetővé váltak, megkezdődtek a kombinációs terápia hatékonyságát vizsgáló kísérletek. Hoeper és munkatársai az elsők között alkalmazták a szekvenciális kombináció módszerét: ha az első gyógyszer segítségével a kitűzött terápiás célok nem voltak megvalósíthatók, 2-6 hónap elteltével újabb – más hatástani csoportba tartozó – szert vezettek be, majd újabb 2-6 hónap múlva egy harmadik szert is beépítettek a beteg terápiájába, amennyiben ezt szükségesnek ítélték az újabb rizikóbecslés eredményei alapján. Ez a stratégia szignifikánsan javította a betegek túlélését, és tüdőtranszplantáció lényegesen ritkábban vált szükségessé, mint a korábbi terápiás lehetőségek mellett (21). A kombinációs terápia hatékonyságát ezt követően számos gyógyszerstudy (22, 23) és metaanalízis (24) igazolta. A magyarországi finanszírozási protokoll jelenleg is a szekvenciális kombináció elvén alapul: 3-3 hónap elteltével teszi lehetővé második, majd harmadik szer beépítését, ha a beteg állapota ezt megkívánja.
Ennél is hatékonyabb terápiás lehetőséget jelent az úgynevezett upfront kombináció, amikor a beteg rizikójának függvényében két vagy akár három, különböző hatástani csoportba tartozó vazodilatátor szer egyszerre kerül bevezetésre rögtön a betegség felismerését követően. A módszer hatékonyságát elsőként az Ambition studyban igazolták (25). A 2015-ös ESC/ERS-ajánlás már a WHO II-III. funkcionális osztályban levő betegek esetében is megfontolandónak tartja az upfront kombinációs terápia bevezetését a helyi lehetőségek függvényében. A WHO IV. funkcionális osztályban felismert PAH esetén pedig kötelezőnek tartják olyan upfront kombináció bevezetését, amely vénás prosztanoidot is tartalmaz (1). A 2018-ban lezajlott 6th World Symposium on Pulmonary Hypertension ajánlásai ennél is messzebb mennek: már az alacsony és közepes kockázatú betegek esetében is egyértelműen az upfront kombináció alkalmazását javasolják, néhány kivételtől eltekintve. Iniciális monoterápia alkalmazását csak hat speciális populációban javasolják:
- Több mint 5–10 éve monoterápiával kezelt betegek, akiknek tartósan stabil az állapota, alacsony a becsült rizikója.
- Atípusos PAH-os betegek (idiopátiás PAH-os beteg, >75 év, számos kardiovaszkuláris rizikófaktorral).
- PVOD (pulmonary veno-occlusive disease) valószínűsíthető.
- HIV fertőzéshez, portális hipertenzióhoz vagy nem korrigált congenitális szívbetegséghez társuló PAH esetén, abban az esetben, ha a betegek nem vettek/vesznek részt multicentrikus studykban.
- PAH nagyon enyhe formája (WHO I., PVR 3–4 WU, mPAP <30 Hgmm, normál jobb kamra méret és funkció echokardiográfiával).
- Kombinációs terápia nem elérhető vagy kontraindikált (pl. súlyos májbetegség miatt) (26).
Kombinációs terápia alkalmazása a regiszterek adatai alapján
A hosszú távú multicentrikus tanulmányok és a metaanalízisek eredményei egyértelművé tették, hogy a specifikus vazodilatátor szerek kombinálása nemcsak a funkcionális kapacitást, de a túlélést is javítja PAH-ban. Ennek következtében a jelenlegi ajánlások egyre hangsúlyosabban javasolják a kombinációs terápia alkalmazását. Ugyanakkor a mindennapokban a kombinációs terápia, és különösen a parenterális prosztanoidok használata nem éri el a kívánatos mértéket. A REVEAL-regiszterben a WHO IV. funkcionális osztályban levő betegek 40%-a nem volt prosztanoidterápián, és a betegek 34,9%-a csak monoterápiát kapott haláláig (27).
A COMPERA-regiszterben a terápia megkezdésekor a betegek 83%-ánál egyetlen gyógyszer került bevezetésre. A magas rizikójú csoportba tartozó betegeknek is csak 27%-a kapott upfront kombinációs terápiát. Prosztaciklin útvonalon ható szer pedig csak a betegek 5%-ánál került bevezetésre. Az ismételt rizikóbecslést követően a betegek 57%-a monoterápián maradt. A magas rizikójú csoportba tartozó betegek 36%-a részesült kombinációs kezelésben. A prosztaciklin útvonalon ható szerek aránya pedig 5%-on stagnált (16).
A svéd regiszter adatai hasonlóképpen alakultak: a terápia megkezdésekor a betegek 76%-a egyetlen gyógyszerre lett beállítva (14). Kissé kedvezőbb képet tükröznek a francia regiszter adatai: iniciálisan a betegek 47%-a kapott monoterápiát (15).
Mindhárom említett tanulmányban a közepes rizikóval bíró betegek fordultak elő a legnagyobb arányban. WHO III. funkcionális osztályú betegekről van szó, akik nem mutatják a manifeszt jobbszívfél-elégtelenség jeleit, így gyakran stabilként értékeljük az állapotukat, ezért nem erőltetjük a kezelés intenzifikálását. A regiszterek adatai szerint ugyanakkor mortalitásuk sokkal rosszabb, mint az alacsony rizikójú populációé. Ez arra utal, hogy valójában „metastabil” állapotról van szó: bármely külső tényező (fertőzés, lázas állapot, műtét, gyógyszerkihagyás, gyógyszer-interakciók stb.) könnyen felboríthatja e betegek állapotát, manifeszt jobbszívfél-elégtelenséget eredményezve. Agresszívabb kezelési stratégia alkalmazása lenne szükséges ahhoz, hogy ezek a betegek valóban stabil állapotba kerüljenek (14-16).
Összefoglalás
A PAH napjainkban is súlyos, progresszív betegség, de adekvát kezeléssel javítható a betegek állapota és túlélése. A betegek rizikóprofiljának felmérése teszi lehetővé a megfelelően agresszív terápiás stratégia kiválasztását. Rizikóbecslésre van szükség a terápia bevezetése előtt, és rendszeresen a követés során is. Több paraméter együttes értékelése szükséges. A jelenlegi ESC/ERS-ajánlásban szereplő rizikóbecslő táblázat jól használható, valódi rizikót tükröz, ami a terápia megkezdésekor és a követés során is használható. A terápiás cél az alacsony rizikóprofil elérése kell hogy legyen. A közepes rizikójú populáció, bár stabilnak tűnik az állapotuk, általában „metastabil” helyzetről van szó, így ebben a csoportban is agresszívabb kezelési stratégiák alkalmazása szükséges. A kettes vagy hármas kombinációs terápia hatékonyságát erős evidenciák támogatják, és majdnem minden PAH-betegben ajánlható az alkalmazásuk.
Irodalom
1. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2016; 37: 67–119. doi: 10.1093/eurheartj/ehv317
2. D’Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115: 343–9. doi: 10.7326/0003-4819-115-5-343
3. Benza RL, Miller DP, Barst RJ, et al. An evaluation of long-term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL Registry. Chest 2012; 142: 448–56. doi: 10.1378/chest.11-1460.
4. Benza RL, Miller DP, Gomberg-Maitland M, et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation 2010; 122: 164–72. doi: 10.1161/CIRCULATIONAHA.109.898122.
5. Sitbon O, Humbert M, Nunes H, et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival. J Am Coll Cardiol 2002; 40: 780–8. doi: 10.1016/s0735-1097(02)02012-0
6. McLaughlin V. Managing pulmonary arterial hypertension and optimizing treatment options: prognosis of pulmonary artery hypertension. Am J Cardiol 2013; 111(8 Suppl): 10C–5C. doi: 10.1016/j.amjcard.2013.01.319.
7. van Wolferen SA, Marcus JT, Boonstra A, et al. Prognostic value of right ventricular mass, volume, and function in idiopathic pulmonary arterial hypertension. Eur Heart J 2007; 28: 1250–7. doi: 10.1093/eurheartj/ehl477
8. van de Veerdonk MC, Kind T, Marcus JT, et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol 2011; 58: 2511–9. doi: 10.1016/j.jacc.2011.06.068.
9. Nagaya N, Nishikimi T, Okano Y, et al. Plasma brain natriuretic peptide levels increase in proportion to the extent of right ventricular dysfunction in pulmonary hypertension. J Am Coll Cardiol 1998; 31: 202–8. doi: 10.1016/s0735-1097(97)00452-x
10. Park MH, Scott RL, Uber PA, et al. Usefulness of B-type natriuretic peptide as a predictor of treatment outcome in pulmonary arterial hypertension. Congest Heart Fail 2004; 10: 221–5. doi: 10.1111/j.1527-5299.2004.03881.x
11. Sandoval J, Bauerle O, Palomar A, et al. Survival in primary pulmonary hypertension. Validation of a prognostic equation. Circulation 1994; 89: 1733–44. doi: 10.1161/01.cir.89.4.1733
12. van de Veerdonk MC, Marcus JT, Westerhof N, et al. Signs of right ventricular deterioration in clinically stable patients with pulmonary arterial hypertension. Chest 2015; 147: 1063–71. doi: 10.1378/chest.14-0701.
13. Benza RL, Gomberg-Maitland M, Miller DP, et al. The REVEAL Registry risk score calculator in patients newly diagnosed with pulmonary arterial hypertension. Chest 2012; 141: 354–62. doi: 10.1378/chest.11-0676.
14. Kylhammar D, Kjellstrom B, Hjalmarsson C, et al. A comprehensive risk stratification at early follow-up determines prognosis in pulmonary arterial hypertension. Eur Heart J 2018; 39: 4175–81. doi: 10.1093/eurheartj/ehx257.
15. Boucly A, Weatherald J, Savale L, et al. Risk assessment, prognosis and guideline implementation in pulmonary arterial hypertension. Eur Respir J 2017;50. pii: 1700889. doi: 10.1183/13993003.00889-2017.
16. Hoeper MM, Kramer T, Pan Z, et al. Mortality in pulmonary arterial hypertension: prediction by the 2015 European pulmonary hypertension guidelines risk stratification model. Eur Respir J 2017; 50. pii: 1700740. doi: 10.1183/13993003.00740-2017.
17. Galie N, Seeger W, Naeije R, et al. Comparative analysis of clinical trials and evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43: 81S–8S. doi: 10.1016/j.jacc.2004.02.038
18. Galie N, Rubin L, Hoeper M, et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. Lancet 2008; 371: 2093–100. doi: 10.1016/S0140-6736(08)60919-8.
19. Sitbon O, Galie N. Treat-to-target strategies in pulmonary arterial hypertension: the importance of using multiple goals. Eur Respir Rev 2010; 19: 272–8. doi: 10.1183/09059180.00008210.
20. Galie N, Hoeper MM, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2009; 30: 2493–537. doi: 10.1093/eurheartj/ehp297.
21. Hoeper MM, Markevych I, Spiekerkoetter E, et al. Goal-oriented treatment and combination therapy for pulmonary arterial hypertension. Eur Respir J 2005; 26: 858–63. doi: 10.1183/09031936.05.00075305
22. Jansa P, Pulido T. Macitentan in pulmonary arterial hypertension: A focus on combination therapy in the SERAPHIN Trial. Am J Cardiovasc Drugs 2018; 18: 1–11. doi: 10.1007/s40256-017-0260-1.
23. Coghlan JG, Channick R, Chin K, et al. Targeting the prostacyclin pathway with selexipag in patients with pulmonary arterial hypertension receiving double combination therapy: Insights from the randomized controlled GRIPHON Study. Am J Cardiovasc Drugs 2018; 18: 37–47. doi: 10.1007/s40256-017-0262-z.
24. Galie N, Manes A, Negro L, et al. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J 2009; 30: 394–403. doi: 10.1093/eurheartj/ehp022.
25. Galie N, Barbera JA, Frost AE, et al. Initial use of ambrisentan plus tadalafil in pulmonary arterial hypertension. N Engl J Med 2015; 373: 834–44. doi: 10.1056/NEJMoa1413687.
26. Galie N, Channick RN, Frantz RP, et al. Risk stratification and medical therapy of pulmonary arterial hypertension. Eur Respir J 2019; 53. pii: 1801889. doi: 10.1183/13993003.01889-2018.
27. Badesch DB, Raskob GE, Elliott CG, et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry. Chest 2010; 137: 376–87. doi: 10.1378/chest.09-1140.