Decompensated aortic valve stenosis: case report of a TAVI performed in time
█ Case report
DOI: 10.26430/CHUNGARICA.2021.51.4.268
Authors:
Szántó Gyula, Szűcsborus Tamás, Sasi Viktor, Nagy Viktória, Rácz Gergely, Makai Attila, Pap Róbert, Ungi Imre
Szegedi Tudományegyetem, Általános Orvostudományi Kar, Szent-Györgyi Albert Klinikai Központ, Belgyógyászati Klinika
Summary
In this article, we present the case of an 81-year-old male patient having left ventricular systolic dysfunction partly due to chronic myocardial ischaemia who was diagnosed with true severe aortic valve stenosis. After treatment of coronary artery stenosis, transcatheter aortic valve implantation (TAVI) was indicated, but the course of the disease was rapidly progressive, left ventricular systolic dysfunction became very severe by the time of the planned intervention, and acute right ventricular failure developed as a consequence as well. No haemodynamic instability occurred therefore the intervention could be postponed and could be performed routinely without any significant risks after successful inotropic therapy. Based on the one-year follow-up, TAVI was successful, left and right ventricular systolic function almost completely normalized.
ISSUE: CARDIOLOGIA HUNGARICA | 2021 | VOLUME 51, ISSUE 4
Összefoglaló
Közleményünkben egy 81 éves férfi beteg esetét mutatjuk be, akinél részben krónikus miokardiális iszkémia indukálta bal kamrai szisztolés diszfunkció mellett valódi súlyos fokú aortabillentyű-szűkületet diagnosztizáltunk. Koszorúér-szűkületeinek kezelését követően transzkatéteres aortabillentyű-implantációt (TAVI) indikáltunk, azonban betegségének lefolyása rapidan progresszív volt, a beavatkozás tervezett időpontjában az addigra nagyon súlyossá váló bal kamra szisztolés diszfunkció következtében heveny jobbkamra-elégtelenség is fellépett. Hemodinamikai összeomlás nem következett be, így halasztható volt az intervenció, amit végül eredményes inotróp kezelést követően már rutinszerűen, jelentős kockázat nélkül tudtunk elvégezni. Egyéves utánkövetése alapján a TAVI eredményes volt, bal és jobb kamrai szisztolés funkciója is csaknem teljesen normalizálódott.
Bevezetés
Az elmúlt 15 évben a tünetes, súlyos aortabillentyű-szűkülettel élő betegek gyógyításában a katéteres aortabillentyű-implantáció (TAVI) a mindennapi rutin részévé vált és mostanra a gyarapodó tapasztalatoknak és az egyre kifinomultabbá váló eszközöknek köszönhetően már nemcsak a túlontúl magas perioperatív rizikóval bíró betegek kezelésében alkalmazzuk, hanem létjogosultságot nyert az alacsonyabb kockázati csoportokban is, mint a sebészi aortabillentyű-csere (SAVR) alternatívája (1, 2). Mindemellett régiónkban az esetek jelentős része napjainkban is az első betegcsoportból kerül ki és ebben a jellemzően idős korosztályban a társbetegségek, valamint az előrehaladott vitium által okozott szekunder kardiológiai kórképek miatt a perkután beavatkozás rizikója is számottevő lehet. Közleményünkben egy súlyos aortabillentyű-szűkület okozta bal-, majd következményes heveny jobbszívfél-elégtelenségben szenvedő beteg példájával demonstráljuk, hogy a TAVI mégoly kilátástalannak tűnő helyzetben is hosszú távon eredményes oki terápiára nyújt lehetőséget.
Esetismertetés
A 81 éves férfi beteg anamnézisében számos kardiovaszkuláris esemény és invazív beavatkozás szerepelt: szignifikáns háromér-betegség miatt 1995-ben komplett műtéti revaszkularizáción esett át (bal a. mammaria graftot kapott a ramus descendens anteriorra és egy-egy v. saphena graftot az a. coronaria dextra posterior descendens ágára, valamint a ramus circumflexusra). 2009-ben kiújuló angina pectoris hátterében a ramus circumflexust ellátó vénagraft okklúzióját igazoltuk és 2010-ben jó eredményű bal közös törzs-ramus circumflexus-obtus marginalis perkután koronáriaintervenciót (PCI) végeztünk 2 db. gyógyszerkibocsátó stent implantációjával; még abban az évben incessant pitvari flutter miatt rádiófrekvenciás abláció vált szükségessé; 2011-ben múló látens hemiparézissel járó bal a. cerebri media területi iszkémiás stroke-ot is elszenvedett. A kardiológiai gondozása részeként ezt követően történt képalkotó terheléses vizsgálatok nem igazoltak tranziens vagy nagy kiterjedésű perzisztens iszkémiát, transthoracalis echokardiográfiák (TTE) jó globális szisztolés balkamra-funkciót, inferobasalis hypokinesist, lassan progrediáló, de még 2019 őszén sem szignifikáns mértékű aortabillentyű-szűkületet mutattak (1. táblázat a oszlop).
A beteget 2020. március elején újkeletű NYHA IV. stádiumú balszívfél-elégtelenség miatt sürgősséggel kellett hospitalizálni, proBNP-je 6500 pg/ml volt, TTE 35%-os bal kamrai ejekciós frakciót (EF), novumként kiterjedt inferior és inferoseptalis, emellett bazális inferolateralis és anterolateralis falmozgászavart igazolt, valamint szignifikánsnak imponáló aortabillentyű-szűkületet (AS) – a számított aortabillentyű-felszín (AVA) 0,7 cm2, az indexált aortabillentyű-felszín (AVAi) 0,35 cm²/m² volt (1. táblázat b oszlop). Akut koronáriaszindrómát ki tudtunk zárni, viszont szívketéterezéssel a posterior descendenst ellátó graft kritikus szűkületét, illetve intermedier ág szűkületet találtunk, amelyek miatt ad hoc PCI-t végeztünk 1-1 gyógyszerkibocsátó stent implantációjával, jó eredménnyel. Bár az aortabillentyű felett mért átlag szisztolés gradiens nem érte el a sarkalatos diagnosztikus kritériumnak tartott 40 Hgmm-t és így a csökkent szisztolés balkamra-funkció miatt – főként a koronáriastátusz progressziójának ismeretében – látszólag akár pseudo low flow low gradient (LFLG) AS gyanúja is felmerülhetett, a billentyű felett mérhető 4,0 m/s-os áramlási csúcssebesség és a 35 ml-t elérő indexált stroke-volumen (SVi) ezt a lehetőséget kizárta. Heart team konzultáció során súlyos vitiumának kezelése érdekében TAVI-t indikáltunk, nem utolsó sorban a működő graftokra tekintettel (későbbi CT igazolta anatómiai alkalmasságát). Mivel optimalizált gyógyszeres kezelés mellett panaszmentessé vált, a beavatkozást szemielektíven terveztük elvégezni.
Azonban ekkor kezdődött a COVID-19-pandémia, így az intervenciót halasztani kényszerültünk, annak ellenére, hogy néhány hetes látenciát követően kiújuló dyspnoe miatt a beteg több ízben SBO-s, majd kardiológiai osztályos kezelést is igényelt. Ez idő alatt echokardiográfiás paraméterei nem mutattak jelentős változást (1. táblázat c oszlop).
Júniusban nyílt lehetőségünk TAVI végzésére. A beteg felvételre ismét NYHA IV. stádiumú balszívfél-elégtelenségnek megfelelő panasszal érkezett. A beavatkozás tervezett napján vett laborok heveny, súlyos jobbszívfél-elégtelenségre utaló eltéréseket mutattak, a két nappal korábban még normáltartományban lévő LDH, GOT és GPT 2200, 3300, illetve 2400 U/l-es értékre, a spontán INR 2,0-re emelkedett (antikoagulálása néhány hónapja már apixabannal történt). Fizikális vizsgálattal hepatomegaliát találtunk, hasi ultrahang megerősítette a pangásos máj gyanúját. Szívultrahang magyarázatot adott a gravis progresszióra, a korábban tudottnál is súlyosabb szisztolés balkamra-diszfunkciót igazolt, mindössze 15%-os EF-et mértünk, szegmentális falmozgászavart nem láttunk, kisfokú pulmonalis regurgitáció és csökkent szisztolés jobbkamra-funkció mellett diasztolés D-jel ábrázolódott (1. táblázat d oszlop). EKG-ján normofrekvenciás pitvarfibrilláció és jobb Tawara-szár-blokk látszott 0,12 s szélességű QRS-sel.
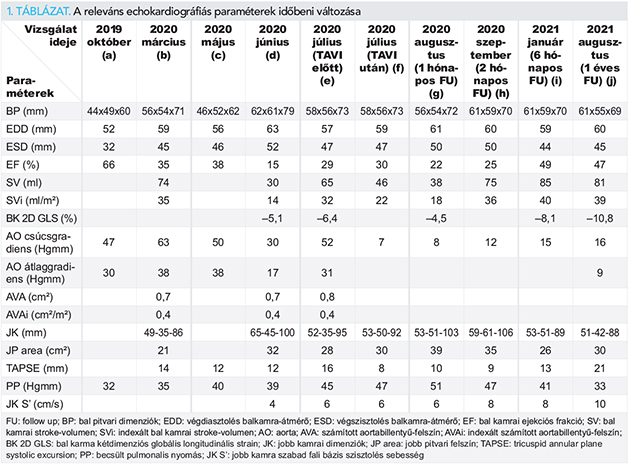
Az intervenciót halasztottuk, levosimendan kezelést és parenterális diuretikumot alkalmaztunk, amelyre a beteg jól reagált, máj- és mérsékelten beszűkült vesefunkciója rövid időn belül javult. Néhány nappal később viszont pitvarfibrillációja flutterre váltott, amelytől ismét dekompenzálttá vált. Transoesophagealis echokardiográfia (TEE) a bal fülcsét thrombusmentesnek mutatta, ezért amiodaronnal kardioverziót kíséreltünk meg, ami eredményesnek bizonyult. Ismeretlen eredetű szepszis azonban kisvártatva újfent felborította az addig elért egyensúlyi állapotot, fent részletezett laborparaméterei romlottak, átmenetileg gyógyszeres keringéstámogatást igényelt. Széles spektrumú antibiotikum hatására az infekció végül szanálódott, hemodinamikai paraméterei normalizálódtak. 17 000 pg/ml-es értéken tetőző proBNP-je nagyságrendileg ugyan nem változott, csak 12 500-ig csökkent, de TTE egyértelműen javuló, igaz továbbra is jelentősen károsodott szisztolés balkamra-funkciót igazolt (1. táblázat e oszlop).
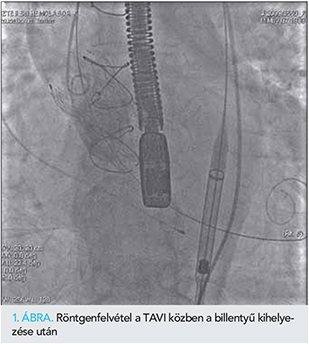
Az eredetileg tervezetthez képest csaknem három héttel később érkezett el a TAVI optimális időpontja. Intratrachealis altatásban ultrahang- és röntgenvezérelte jobb a. femoralis behatolásból ideiglenes pacemaker védelmében Confida-vezetődrót segítségével aortapozícióba Medtronic Evolut R 34 mm-es billentyűt implantáltunk 6 mm-es mélységben (1. ábra). Megfelelő hemodinamikai, angiográfiás és TEE-eredményt értünk el, a szisztolés gradiens megszűnt, kezelendő paravalvularis leak nem maradt. A koronáriák telődtek. A behatolási kaput dedikált eszközzel szövődménymentesen zártuk. Az intervenciót követően átmenetileg komplett pitvar-kamrai blokk lépett fel, pacemaker-ritmus mellett kifogástalan volt a hemodinamika, majd 3 nappal később visszatért saját ritmusa, sinusritmus és pitvari flutter váltakozott, komplett bal Tawara-szár-blokkal vezetődött. Reszinkronizációs kezelés mellett döntöttünk, a TAVI utáni 5. napon az iszkémiás szívbetegségre és a csökkent szisztolés balkamra-funkcióra tekintettel biventricularis implantábilis kardioverter-defibrillátor-beültetést végeztünk szövődménymentesen. Obszervációja ezt követően már jelentős esemény nélkül telt, jobbszívfél-elégtelenség tünetei nem tértek vissza, az elbocsátása előtt végzett TTE 30%-os bal kamrai EF-et, jó műbillentyű-funkciót igazolt és nem mutatkozott sem valvularis, sem paravalvularis aortabillentyű-regurgitáció (1. táblázat f oszlop).
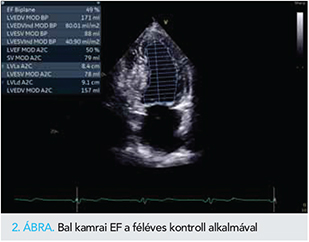
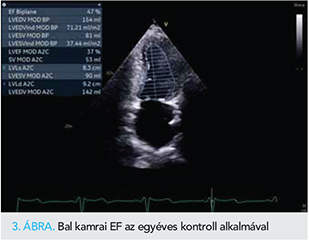
A változó átvezetésű pitvari flutter definitív kezelése azonban még szükséges volt, amit az altatás esetleges szövődményét kerülendő ablációval terveztünk megoldani, az ICD-implantációra tekintettel, néhány héttel halasztva. A beavatkozást röviddel megelőző TTE ismét romló szisztolés balkamra-funkciót igazolt, amit tachyarrhythmia következményének tartottunk (1. táblázat g oszlop); klinikai állapota ezúttal számottevően nem romlott. Elektroanatómiai térképezést követően sikeres jobb pitvari atípusos flutterablációt végeztünk. Újabb hónap elteltével TTE még nem mutatott érdemi változást (1. táblázat h oszlop), azonban a TAVI-t követő féléves kontroll során a perzisztáló balkamra-dilatáció mellett is jelentős javulást tapasztaltunk, bal kamrai EF-jét a korábbi 25%-kal szemben 49%-nak mértük (1. táblázat i oszlop, 2. ábra). ProBNP-je ugyanekkor 1550 pg/ml volt, funkcionális stádiuma NYHA II. Az elért eredmény tartósnak bizonyult, az egyéves ellenőrzés alkalmával nem tapasztaltunk visszaesést sem klinikai állapotában, sem az echokardiográfiás paraméterekben, sőt, a jobbkamra-bázis szisztolés elmozdulásának (tricuspid annular plane systolic excursion, TAPSE) értéke normalizálódó jobbkamra-funkció, a növekvő kétdimenziós globális longitudinális strain (BK 2D GLS) pedig valamelyest tovább javuló balkamra-kontraktilitás mellett szólt (1. táblázat j oszlop, 3. ábra). Hospitalizációt a flutterabláció óta nem igényelt.
Megbeszélés
Noha az implantáció technikáját illetően egyre kevésbé, a társuló betegségek által megkívánt komplex perioperatív menedzsment miatt napjainkban is nagy kihívást jelenthet a súlyos aortabillentyű-szűkülettel élő betegek TAVI-val történő kezelése. Esetünkben objektív ok miatt az intervencióra nem kerülhetett sor az arra leginkább megfelelő márciusi időpontban, a beteg intézetünkbe történő ismételt, júniusi felvételekor pedig már olyannyira előrehaladott és progresszív volt a szisztolés balkamra-funkció romlása, hogy még a tervezett billentyűimplantáció előtt heveny jobbszívfél-elégtelenségbe torkollott. Nem tisztázott egyértelműen, hogy ebben a helyzetben mi az optimális terápiás stratégia, mindenesetre a dekompenzált AS miatti sürgős/sürgető TAVI vagy ballonos aortabillentyű-tágítás (BAV) a többnyire viszonylag kis esetszámú közlések alapján járható útnak tűnik (3–6), még ha a prognózis ilyen kondíciók esetén rosszabb is, mint elektív beavatkozásoknál, és a BAV inkább csak áthidaló kezelésre alkalmas a kívánt állapotjavulásig és későbbi döntéshozatalig (billentyűimplantáció vs. gyógyszeres/palliatív terápia). Esetünkben a döntést heveny jobbszívfél-elégtelenség is befolyásolta, aminek a sürgős/sürgető TAVI rövid és hosszú távú kimenetelére gyakorolt hatása nem ismert; a jobbkamra-diszfunkció következménye elektív TAVI esetén is meglehetősen ellentmondásos (7–10). Klinikánkon a strukturális intervenciókat ez időben intratrachealis narkózisban végeztük, az ezzel járó rizikóval is számolva az azonnali TAVI-t el kellett vetnünk. A kevésbé megterhelő BAV-ot a rapid pace szélsőségesen alacsony EF és heveny jobbszívfél-elégtelenség miatti, potenciálisan kontrollálhatatlan hemodinamikai hatásától tartva szintén nem kockáztattuk, azt csak ultimum refugium, kardiogén sokk bekövetkeztekor végeztük volna el, azonban a beteg vérgáz-paraméterei – beleértve a laktátszintet is – fiziológiás tartományon belül maradtak, így számottevő globális hipoperfúzió kizárható volt. Inotróp terápiát kezdtünk azt célozva, hogy szívelégtelenségét rövidtávon kontrolláljuk, igaz, nem lehettünk benne biztosak, hogy a beteg rendelkezik még számottevő kontraktilis rezervvel, hiszen ekkor már LFLG AS állt fenn. Az ezen kórkép miatt elektíven végzett TAVI hosszú távú eredményét a kontraktilis rezerv megléte vagy hiánya némileg meglepő módon összességében nem befolyásolja (11, 12), valószínűleg azért, mert az utóterhelés jelentős csökkenése mindkét esetben jótékony hatású. Az esetünknek megfelelő speciális betegcsoportban (nagyon súlyosan csökkent szisztolés balkamra-funkció, 20% alatti EF) viszont az American College of Cardiology jelenleg csak kontraktilis rezerv megléte esetén javasolja SAVR/TAVR elvégzését, anélkül az egyelőre kisszámú és kedvezőtlen eredményű, bár még a TAVI-éra előttről származó vizsgálatokra alapozva mindössze gyógyszeres kezelést, esetleg BAV-ot (13). A levosimendanterápia ezúttal eredményesnek bizonyult, a beteg dekompenzációja jelentősen mérséklődött, EF-je látványosan nőtt, így alkalmassá vált a TAVI-ra, amely rutinszerűen, már jelentős kockázat nélkül volt elvégezhető. Rehabilitációját ugyan szívritmus- és vezetési zavar hátráltatta és az előbbi következtében szisztolés balkamra-funkciója a két hónapos kontroll idejére még nem mutatott további javulást, azonban a fél- és egyéves ellenőrzés során a bal kamrai szegmentumok az inferior fal és septum kivételével mindenütt normokinetikusak voltak. Bár a jobb kamrai szisztolés funkció a TAVI-t követő évben jellemzően nem javul (10), ez esetben örvendetes módon ennek ellenkezőjét tapasztaltuk.
Következtetések
Az optimális perioperatív ellátással kiegészülő katéteres aortabillentyű-implantáció súlyos, heveny szívelégtelenség esetén is lehetőséget biztosít az aortabillentyű-szűkület definitív kezelésére.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
References
1. Elmaraezy A, Ismail A, Abushouk AI, et al. Efficacy and safety of transcatheter aortic valve replacement in aortic stenosis patients at low to moderate surgical risk: a comprehensive meta-analysis. BMC Cardiovasc Disord 2017; 17(1): 234. Published 2017 Aug 24.
https://doi.org/10.1186/s12872-017-0668-1
2. Al-Abdouh A, Upadhrasta S, Fashanu O, et al. Transcatheter Aortic Valve Replacement in Low-Risk Patients: A Meta-Analysis of Randomized Controlled Trials. Cardiovasc Revasc Med 2020; 21(4): 461–466. https://doi.org/10.1016/j.carrev.2019.08.008
3. Abdelaziz M, Khogali S, Cotton JM, et al. Transcatheter aortic valve implantation in decompensated aortic stenosis within the same hospital admission: early clinical experience Open Heart 2018; 5: e000827. https://doi.org/10.1136/openhrt-2018-000827
4. Chen K, Polcari K, Michiko T, et al. Outcomes of Urgent Transcatheter Aortic Valve Replacement in Patients With Acute Decompensated Heart Failure: A Single-Center Experience. Cureus 2020; 12(9): e10425. Published 2020 Sep 13.
https://doi.org/10.7759/cureus.10425
5. Papadopoulos K, Chrissoheris M, Halapas A, et al. Emergency TAVI in a critically ill patient: A case report. Clin Case Rep 2020; 9(2): 1024–1026. Published 2020 Dec 31.
https://doi.org/10.1002/ccr3.3732
6. Bouleti C, Chauvet M, Franchineau G, et al. The impact of the development of transcatheter aortic valve implantation on the management of severe aortic stenosis in high-risk patients: treatment strategies and outcome. Eur J Cardiothorac Surg 2017; 51(1): 80–88. https://doi.org/10.1093/ejcts/ezw211
7. Poliacikova P, Cockburn J, Pareek N, et al. Prognostic impact of pre-existing right ventricular dysfunction on the outcome of transcatheter aortic valve implantation. J Invasive Cardiol 2013; 25(3): 142–145
8. Ito S, Pislaru SV, Soo WM, et al. Impact of right ventricular size and function on survival following transcatheter aortic valve replacement. Int J Cardiol 2016; 221: 269–274.
https://doi.org/10.1016/j.ijcard.2016.07.085
9. Koifman E, Didier R, Patel N, et al. Impact of right ventricular function on outcome of severe aortic stenosis patients undergoing transcatheter aortic valve replacement. Am Heart J 2017; 184: 141–147. https://doi.org/10.1016/j.ahj.2016.09.018
10. Ren B, Spitzer E, Geleijnse ML, et al. Right ventricular systolic function in patients undergoing transcatheter aortic valve implantation: A systematic review and meta-analysis. Int J Cardiol 2018; 257: 40–45. https://doi.org/10.1016/j.ijcard.2018.01.117
11. Buchanan KD, Rogers T, Steinvil A, et al. Role of contractile reserve as a predictor of mortality in low-flow, low-gradient severe aortic stenosis following transcatheter aortic valve replacement. Catheter Cardiovasc Interv 2019; 93(4): 707–712.
https://doi.org/10.1002/ccd.27914
12. Maes F, Lerakis S, Barbosa Ribeiro H, et al. Outcomes From Transcatheter Aortic Valve Replacement in Patients With Low-Flow, Low-Gradient Aortic Stenosis and Left Ventricular Ejection Fraction Less Than 30%: A Substudy From the TOPAS-TAVI Registry. JAMA Cardiol 2019; 4(1): 64–70.
https://doi.org/10.1001/jamacardio.2018.4320
13. Aortic Stenosis Writing Group, Bonow RO, Brown AS, et al. ACC/AATS/AHA/ASE/EACTS/HVS/SCA/SCAI/SCCT/SCMR/STS 2017 Appropriate Use Criteria for the Treatment of Patients With Severe Aortic Stenosis: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, European Association for Cardio-Thoracic Surgery, Heart Valve Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, and Society of Thoracic Surgeons. J Am Soc Echocardiogr 2018; 31(2): 117–147.
https://doi.org/10.1016/j.echo.2017.10.020