Atherosclerotic and arterial complications in malignant diseases
█ Review
DOI: 10.26430/CHUNGARICA.2023.53.2.110
Authors:
Süveges Péter1,2, Boussoussou Nora1,2, Sármán Balázs1
1Uzsoki Utcai Kórház, Kardiológia Osztály, Budapest
2Semmelweis Egyetem, Szív- és Érgyógyászati Klinika, Budapest
Levelezési cím:
Dr. Sármán Balázs PhD, 1145 Budapest, Uzsoki utca 29–41., e-mail: balazs.sarman@gmail.com
Summary
The 21st century can be defined as an anthropogenic age, in which, in addition to the rapid economic growth by the industrial revolution, many environmental and health damages were also created, including the increased incidence of serious chronic diseases. Nowadays atherosclerotical, arterial and oncological diseases are one of the biggest public health challenges all over the world with high mortality rate. Survival rates of cancers are improving thanks to increasingly effective treatment options. There are currently approximately 12 million cancer survivors in Europe. Cardiovascular diseases are the leading cause of death globally, taking an estimated 17.9 million lives each year. In the future patients affected by both these illnesses are become more common. Due to both diseases have multifactorial etiology there are numerous identical molecular pathways, etiological factor and pathomechanism behind their development. Cancerous diseases can cause atherosclerosis and arterial disease directly, or indirectly via chemo and/or radiotherapy. Our aim is to present the correlation between cancer, atherosclerotic and arterial changes.
ISSUE: CARDIOLOGIA HUNGARICA | 2023 | VOLUME 53, ISSUE 2
Összefoglalás
A 21. századot antropogenikus korként lehet meghatározni, amelyben az ipari forradalom gazdasági fellendülést okozó hatása mellett a súlyos krónikus betegségek előfordulási aránya is növekedett (környezeti és egészségügyi károsító tényezők miatt). Korunk legelterjedtebb népegészségügyi terhei közé tartozó, világszerte vezető mortalitási tényezőnek számító krónikus betegségcsoportba tartoznak a daganatos elváltozások, az ateroszklerózis, és az artériás megbetegedések. Az egyre hatékonyabb kezelési lehetőségeknek köszönhetően a daganatos betegségek túlélési rátája mindinkább javul, jelenleg megközelítően 12 millió daganatos betegséget túlélő egyén él Európában. Mindemellett évente, világszerte közel 17,9 millió a szív- és érrendszeri betegségek mortalitási rátája. A jövőben egyre több olyan betegre számíthatunk, akiket mind a két betegségtípus érint. Tekintettel arra, hogy mindkét betegség kialakulása multifaktoriális okokra vezethető vissza, számos megegyező molekuláris kialakulási útvonal, patomechanikus tényező, illetve etiológiai faktor játszik szerepet a kórképek előfordulásában. A daganatos betegségek direkt úton, illetve a radio és/vagy kemoterápián keresztül indirekt úton is rendelkeznek ateroszklerózis és artériás megbetegedést okozó hatásokkal. Összefoglaló cikkünkben a daganatos megbetegedések ateroszklerotikus és artériás elváltozásokkal való összefüggését mutatjuk be.
A daganatos megbetegedések és az ateroszklerózis napjaink talán legnagyobb népegészségügyi kihívásai, többek között az idősödő társadalom, a helytelen életmód, illetve a karcinogén környezeti tényezők miatt (1). Megközelítően 19 millió daganatos megbetegedést diagnosztizáltak a 2020-as évben (2). Évente a világ összes halálozásának 32%-a szív és érrendszeri betegséghez köthető (3). Stoltzfus és munkatársai 7,5 millió daganatos beteget vizsgáló kutatásukban kimutatták, hogy közel 400 ezer volt a szív- és érrendszeri mortalitás a malignus elváltozással rendelkező egyének között (4). Egy kis történeti kitekintést megengedve, az első detektált ateroszklerotikus lézió az 5300 éves gleccsermúmiáról, Ötziről készült CT-felvételen látható. A kutatók ateromatosus léziót találtak az aortán, a koronáriákon, a carotisokon és az iliacalis artériák régióiban (5). Az egyiptomi istenről elnevezett Horus-tanulmány, az egyiptomi és egyéb ókori populációk mumifikált egyéneit vizsgálta CT képalkotó diagnosztika segítségével. Az első ábrázolódó arteria coronaria ateroszklerózis a 21. egyiptomi királyi dinasztiában élt, Lady Teye nevű múmiának a CT-felvételén látható (6). A daganatos megbetegedések első írásos emléke szintén Egyiptomhoz köthető. Kr. e. a 30. században, a Djoser fáraó uralkodása alatt dolgozó, orvos és építész végzettségű Imhotep tett említést írásban először a Smith papirusztekercsen, egy mellkasfalon megjelent tumoros elváltozásról. Az első képalkotóval is bizonyított malignus elváltozást egy kr. e. 1500-ban élő egyiptomi múmia vizsgálata során találták (7). Az első daganatos megbetegedések és kardiovaszkuláris morbiditás közötti összefüggést feltételező vizsgálat a 20. század elejére tehető, amelyben Thibauduau és munkatársai kutatásaik során bizonyították, hogy a vizsgált radioterápiás kezelésen átesett betegeknél myocardium-elváltozás alakulhat ki (8). Későbbi kutatások azt is igazolták, hogy radioterápia hatására ateroszklerózis és egyéb artériás eltérések jönnek létre. A daganatos elváltozások és az ateroszklerotikus vagy artériás elváltozások kialakulásában szerepet játszó számos közös rizikófaktor megnehezíti annak az elkülönítését, hogy kialakulásuk hátterében a közös kockázati faktorok játszanak fontosabb szerepet vagy a daganatok közvetlen hatása a nagyobb rizikótényező. Jelen összefoglalóban kitérünk a daganatok ateroszklerotikus hatására, tromboembóliás szövődményeire, az iszkémiás szívbetegségek kialakulásában játszott szerepére és a daganatterápiák ateroszklerotikus és artériás szövődményeire.
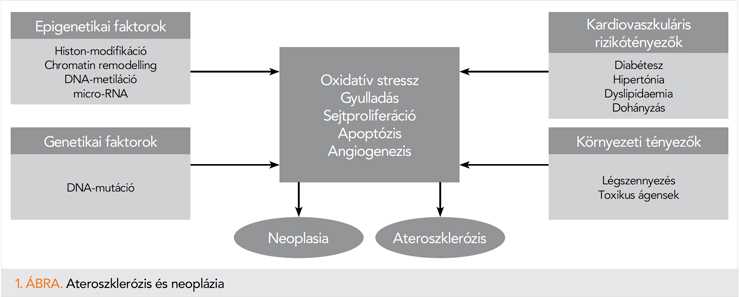
Az ateroszklerózis az artériák falának különböző patomechanizmussal létrejövő megvastagodásával járó folyamat. Az ateroszklerózis a nagy, elasztikus típusú́ artériák és a közepes elastomuscularis artériák jellegzetes intimaelváltozása (9). Néhány kutató úgy véli, hogy az arteria coronaria betegségeken belül a stabil plakk az artériafal benignus daganatos elváltozásának felel meg és az akut miokardiális infarktus ennek a malignus megjelenési formája (10). A daganatos megbetegedések is rendelkeznek közvetlen ateroszklerotikus hatással. A tumorszövet nekrotizáló faktorokat termel, amelyek endothelialis felszínen gyulladást hoznak létre, jelentős rizikótényezőt jelentve az ateroszklerózis kialakulásában (11). A daganatok granulocytakolónia-stimuláló faktorokat is szekretálhatnak, amely hatására emelkedik a neutrofil granulocytaszám, ami következtében a makrofágok aktiválódnak és a gyulladásos citokinek szintjének emelésével, illetve az endothelsejtekhez történő immunsejtkötődés fokozásával szintén tovább növelik az ateroszklerózis kialakulásának kockázatát (12).
A malignitás és az ateroszklerózis egyaránt lokális szövetelváltozásból indulnak ki. Mindkét elváltozás során megfigyelhető az oxidatív stressz hatására kialakuló sejtproliferáció deregulációja, sejtadhéziós molekulák változása, megváltozott proteáz-expresszió, illetve az angiogenezis modulációja (13). A sejtproliferációt re-guláló útvonalak, beleértve a G1S-ellenőrző pontban részt vevő gének (p53, pRb, p15, p16 és ciklinek A, D, E és cdk) összefüggésbe hozhatóak a plakk, illetve a daganatos megbetegedés progressziójával egyaránt (14). Preklinikai kutatások kimutatták, hogy közös genetikai mutáció is szerepet játszhat mindkét elváltozás előfordulásában. A TET2-sejtek génmutációja a hematológiai daganatos megbetegedésekben is kimutatható, illetve a szív- és érrendszeri betegséggel rendelkező egyénekben is. Ezek a mutálódott sejtek fokozzák az IL-1β-szintet, amely által endothelialis gyulladás alakul ki (15).
Daganatellenes terápia hatásai
A malignus elváltozás közvetlen hatásain túl, a daganat-ellenes terápia is rendelkezik olyan hatásokkal, amelyek az ateroszklerotikus és artériás elváltozásokban játszanak szerepet.
Állatkísérletes modellekben besugárzás után már néhány nappal az artériákban koleszterin-plakk és trombózis jelentkezik (16). Mellrák besugárzása már 5 éven belül szignifikánsan emelte az iszkémiás szívbetegségek előfordulását, és a folyamat lineárisan emelkedett a terápiát követő évtizedekben is. A major koronáriaesemények egyenes arányban nőttek a besugárzási dózisával; 7,4%-ban grey mértékegységenként (95% CI: 2,9–14,5; p<0,001) (17). Egy Hodgkin-kór miatt legalább 35 Gy besugárzást kapott betegeket vizsgáló, 294 fős tanulmányban, 6,5 éves utánkövetés során 21,4%-ban (63 beteg) találtak kontroll ultrahangon miokardiális sérülést okozó falmozgászavart. Terheléses vizsgálatnál a betegek 14%-a (n=42) bizonyult kórosnak. Koronarográfia során ezen betegek 55%-ánál, 50%-ot meghaladó, szignifikáns szűkületet találtak. 7 betegnél történt szívsebészeti revaszkularizáció. Összességében a 6,5 év alatt a betegek 7,8%-ánál történt koronáriákat érintő esemény, 10 szívizominfarktus (2 halálos) (18). A mediasztinális és bal mellkasfélre adott sugárkezelés a tapasztalatok szerint, az arteritist és ateroszklerózis okozásán keresztül 4-7-szeresére emelheti a későbbi iszkémiás szívbetegség kialakulásának kockázatát (19). A szövődmények okozta tünetek általában 15-20 évvel a sugárkezelést követően alakulnak ki (20). Az iszkémiás károsodás kialakulását fokozza a magasabb összesített, illetve egy adagban leadott sugárdózis, a fiatal életkor, a szív nagyobb részét érő sugárzás, a kemoterápiás kezelés, a besugárzás óta eltelt hosszabb idő, valamint a hagyományos rizikófaktorok jelenléte és a már meglévő koronáriabetegség (21).
A kemoterápiás szerek alkalmazása szintén növeli az iszkémiás szívbetegség előfordulási arányát, amely hátterében a koszorúerek trombózisa, arteritis kialakulása, oxidatív stressz, endothelsérülés és vazo-spazmus játszhat szerepet (22) (1. táblázat). Az artériás trombózis előfordulási aránya emelkedő tendenciát mutat az aktív kemoterápia, majd a követési időszak alatt is. Navi és munkatársai vizsgálati eredményei alapján az artériás trombózis előfordulása jelzi a daganatos megbetegedés rossz prognózisát, amely megháromszorozza a mortalitási rátát. Az artériás trombózisrekurrencia aránya fél éven belül 37% (23). Egy többszázezer daganatos beteget vizsgáló kutatás során 4,4%-ban fordult elő artériás trombózis, míg a nem daganatos kontrollcsoportnál ez az arány 2,2% volt csupán (24).

Ha az egyes specifikus terápiákat nézzük, a platinatartalmú vegyületek (pl. cisplatin) kemoterápia során való alkalmazásakor az artériás trombózisok gyakoribb előfordulását figyelték meg (1,5-7-szeres rizikó) (25). Az iszkémiás szívbetegség leginkább a terápia első három ciklusának valamelyikében fordul elő (26). Az antimetabolitok közül az 5-fluorouracil (5-FU) és származékainak (pl. capecitabin) használata során a betegek akár 68%-ában észleltek az EKG-n iszkémiás eltéréseket, az esetek többségében a kezelés megkezdését követő 2-5. nap között (27). Az így kezelt betegek 18%-ában panaszokkal járó iszkémia (általában nyugalmi mellkasi fájdalom) jelentkezett, míg 7-17%-ban „néma” iszkémia volt csupán kimutatható (23). A kardiális iszkémia hátterében a koszorúerek endothelsérülése, trombózisa, az oxidatív stressz, arteritis kialakulása, és vazo-spazmus állhat (28). A VEGF-gátlók (sunitinib, sorafenib, bevacizumab) használatakor szintén megfigyelték a kardiális iszkémia és az artériás trombózisok gyakoribb előfordulását, amelyek kialakulásában érremodelling, vazokonstrikció, gyulladás és thrombocytaaktiváció játszhat szerepet (29). A kardiális iszkémia incidenciája 0,6-1,5% VEGFi mono-klonálisantitest-terápia esetén (30). Paclitaxelkezelés során 5%-ban írtak le vezetési zavarokat, ritmuszavarokat és miokardiális iszkémia kialakulását, amelyek patomechanizmusa általában vazospazmus volt (31).
Tromboembóliás események
Az ateroszklerózis és a daganatellenes terápia mellékhatásai mellett önmagában a daganatos elváltozások is fokozott rizikót jelentenek a tromboembóliás megbetegedések kialakulásában (32). Egy közel 300 ezer fős retrospektív, daganatos betegeket és kontrollcsoportot bevonó vizsgálatban, a malignus betegségben szenvedők 4,7%-ában fordult elő tromboembólia, a kontrollcsoportban ezzel szemben fele ennyi egyénnek volt tromboembóliás megbetegedése (33). A trombózis kialakulását eredményező Virchow-triász mindhárom tényezőjének kialakulási kockázatát fokozza a malignus elváltozás. Hiperkoaguabilis állapotot idéz elő prokoaguláns faktorok szekretálása révén (pl. cisztein-proteáz) (34). A mell-, a vastagbél- és a májdaganatokban fokozott expressziót mutató heparanáz egy érújdonképződésben szerepet játszó heparin-szulfát endo-D-glükuronidáz, amely szabályozza a szöveti faktor (tissue factor, TF) expresszióját, és ez által emelni tudja az aktivált X. faktor (Xa) mennyiségét, hiperkoaguabilis állapotot hozva létre (35). A tumorszövet által termelt citokinek szintén hiperkoaguabilitást okoznak azáltal, hogy a citokinek hatására a transzmembrán-fehérje aktiválja az extrinszik koagulációs kaszkádot (36). Az endothelkárosodás létrejön, a már az előzőekben tárgyalt ateroszklerózis kialakulása révén is.
Számos kutatás bizonyította, hogy a malignitás és az ateroszklerózis, illetve artériás elváltozások együttes előfordulásában közös rizikótényezők is szerepet játszanak, többek között a magas vérnyomás, cukorbetegség, metabolikus szindróma, életkor, illetve káros környezeti tényezők (1. ábra).
Akut koronáriaszindróma
A fentieket egybevetve látható, hogy a malignus elváltozások esetén a fokozott gyulladásos folyamatok, pro-trombotikus tényezők és a tumorellenes terápia kardiotoxikus hatásai miatt fokozottan nő a krónikus és akut iszkémiás szívbetegségek előfordulási aránya (2. táblázat). A daganatos megbetegedéssel diagnosztizáltak körében az akut koronáriaszindróma előfordulási aránya magasabb, gyakorisága 3%-ra tehető (37).

Daganatos betegekben kialakuló iszkémiás szívbetegség mortalitási kockázata jelentősen nagyobb a nem daganatos betegekéhez képest (38). A perkután koronáriaintervenció elvégzése előtt 6 hónapon belül felfedezett daganat háromszorosára növeli a kardiális eredetű mortalitást (39). A legyengült állapot, fokozott vérzési kockázat, thrombocytopenia, hiperkoaguabilitás, illetve az esetleges műtétek/intervenciók szükségessége okán, ezeknek a betegeknek az ellátása fokozott körültekintést igényel (40). A klinikai megjelenési forma atípusos lehet vagy a tumor által elfedett, azonban a diagnózishoz vezető algoritmus nem tér el a nem tumoros betegek vizsgálatától (41). Invazív beavatkozás javasolt azoknál a daganatos, akut koronáriaszindrómában szenvedő betegeknél, akiknek a várható élettartama 6 hónapnál több, vagy akkor, ha valamilyen akut komplikációval lép fel (kardiogén sokk, pulmonalis ödéma, kamrai tachyarrhytmiák) és a PCI megoldaná a tüneteket (42). Szívkatéterezés során javasolt atraumatikus hidrofil sheat-ek és katéterek használata, valamint a behatolási kapu és annak környezetének beavatkozás utáni kontrollja az esetleges infekció és kései vérzések elkerülése miatt. A tumorok prokoaguláns és proinflammatorikus tulajdonságai stenttrombózis, illetve az instent resztenózis gyakoribb előfordulását okozhatják, ezért a fenti komplikációk elkerülésére III. generációs DES használata javasolt, mindemellett kerülni kell a bifurkációba helyezett és átfedő stentek használatát (43). A ballonos angioplasztika rosszabb végeredménnyel jár, ezért csak súlyos thrombocytopenia vagy sürgős műtét szükségessége esetén alkalmazható (44). FFR (fractional flow reserve) vagy iFR (instantaneous free wave ratio) mérése javasolt a szükségtelen intervenció elvégzésének elkerülésére, illetve intravaszkuláris ultrahang vagy optikaikoherencia-tomográfia alkalmazható az optimális sztentbehelyezéshez a trombotikus szövődmények elkerülésének érdekében (45, 46). Ezzel szemben a PCI elvégzése, a konzervatív orvosi terápiához képest nem mutatott előnyt a mortalitás szempontjából az NSTEMI-diagnózissal rendelkező előrehaladott daganatos betegekben (47). A rossz túlélési prognózissal rendelkező (<6 hó), kis kockázatú (zajló iszkémiás folyamat jele nélküli, hemodinamikai instabilitást nem mutató), NSTEMI-diagnózisú tumoros betegekben noninvazív megoldás ajánlott.
Gyógyszerkibocsátó stent berakását követően, a nagyobb vérzéses kockázatú betegeknél (leginkább az aktív gasztrointesztinális daganatos betegek) kettős thrombocytagátló kezelés javasolt, aszpirin és clopidogrel alkalmazásával. A kettős thrombocytagátló kezelés a lehető legrövidebb ideig alkalmazandó (1-3 hónap) (48). Terápiás véralvadásgátló és thrombocytaaggregáció-gátló kezelésre szoruló betegeknél a NOAC és az egyszeri orális thrombocytaaggregáció (lehetőleg clopidogrel) az elsődlegesen választandó stratégia a rövid idejű, hármas antitrombotikus terápia után (legfeljebb 1 hét kórházban). A koronária-bypass (CABG) műtét megfontolandó olyan kiterjedt koronáriabetegeknél, akik PCI-beavatkozással nem kezelhetőek, illetve akiknek a daganatprognózisa >12 hónap (49).
A tumoros betegek kb. 10%-ánál fordul elő thrombocytopenia (100 G/l alatti thrombocytaszám), amelynek oka lehet a csontvelő infiltrációja, a kemoterápia, a lépben történő fokozott szekvesztrálódás és a fokozott perifériás pusztulás (50). A nem tumoros thrombocytopenia esetén extrém ritka az akut koronáriaszindróma előfordulása, ezzel szemben a tumoros thrombocytopeniások körében az ACS aránya akár 39% is lehet (51). A koszorúér-angiográfia biztonságosan elvégezhető, amennyiben megfelelő intézkedéseket tesznek a vérzés elkerülése érdekében: vérlemezke-transzfúzió katéterezés előtt (<20 000/µl esetén), radiális hozzáférés, gondos vérzéscsillapítás és alacsonyabb heparindózis alkalmazása (30-50 E/kg) (52). A thrombocytaaggregáció alkalmazását nem szabad elhagyni, kivéve az aszpirin esetében, ha a vérlemezkeszám <10 000/µl vagy clopidogrel esetében, ha a vérlemezkeszám <30 000/µl. A PCI és a CABG tekintetében a szakértők legalább 30 000/µl, illetve 50 000/µl vérlemezkeszámot javasolnak (53). Az ACS esetén javasolt a daganatellenes gyógyszerek felülvizsgálata, és a trombózissal és iszkémiával összefüggő rák-ellenes gyógyszerek alkalmazását pedig le kell állítani. Az iszkémiával nem összefüggő terápiák újra indíthatók, amint a revaszkularizáció befejeződött, és a beteg az ACS-t követően szövődmények nélkül stabilizálódott.
Krónikus koronáriaszindróma
Azoknál a betegeknél, akiknek stabil anginája jelentkezik és korábban kemoterápiában részesültek szoros klinikai után követés szükséges a rizikótényezők pontos detektálásával és a tünetek kezelésével (54). A krónikus koronáriaszindróma kezelése megegyezik a tumoros és a nem tumoros betegekben. Az elvégzett PCI, az adott daganattípustól függő mértékben, magasabb vérzéses kockázattal, 90 napon belüli újabb miokardiális infarktus előfordulásával, kórházi és hosszú távú mortalitási kockázattal, illetve újbóli revaszkularizációval jár (55). A vérzéses kockázat csökkentésére a DAPT-terápiának lehető legrövidebb időre való csökkentése szükséges (56).
Ahhoz, hogy daganatos megbetegedések esetén az iszkémiás szövődmények megelőzhetőek legyenek, a daganatos megbetegedés detektálása, illetve a kemoterápia megkezdése előtt (különösen az ismert kardiotoxicitással rendelkező kezeléseknél) a kardiovaszkuláris rizikók becslése elengedhetetlen. Ezeket egybe véve kezdhető el a megfelelő prevenció, illetve szükség esetén a célzott kezelés. Mindenképpen EKG-vizsgálat szükséges; a panaszok, az anamnézis és rizikófaktorok függvényében további vizsgálatok (terheléses EKG, szívultrahang-vizsgálat, koronarográfia) elvégzése is megfontolandó (23). Fennálló iszkémiás szívbetegség vagy magas kardiovaszkuláris rizikó esetén β-blokkoló, statin, ACE-gátló, illetve ellenjavallat hiányában, ismert CV-betegek esetén, aszpirin alkalmazása protektív hatással lehet a későbbi kardiális események megelőzése szempontjából, kemo-, illetve radioterápia esetén (57–60). ACE-gátlók és diuretikumok elkezdésekor legyünk különös figyelemmel az elektroliteltérésekre és a vesefunkcióra.
Amennyiben tumorkezelés során koronáriaspazmus jelentkezik, úgy a kezelést fel kell függeszteni. A terápia folytatása egyéb terápiás lehetőség hiányában, csak szoros monitorozás mellett jöhet szóba. Amennyiben a beteg státusza megengedi nitrát és kalciumantagonista terápiát alkalmazhatunk.
A szövődmények késői jelentkezése miatt a kardio-onkológia legfrissebb irányelvei alapján fontos a betegek hosszú távú, élethosszig tartó követése, szív- és érrendszeri betegségek irányában történő rendszeres szűrése (47) (2. ábra). A rendszeres szűrések megtervezésénél megkülönböztethetünk alacsony, közepes és magas rizikójú betegcsoportokat. Nagyon magas CV-rizikó esetén a rendszerese EKG mellett, biomarker-követés és echokardiogáfiás kontroll is javasolt. A Children’s Oncology Csoport évenkénti fizikális kontrollt, EKG-, és időnként terheléses vizsgálatot javasolt azoknak a betegeknek, akiknél teljestest-besugárzás történt, vagy a teljes mediasztinális besugárzás meghaladta a 20 Gy-t, vagy akik kardiotoxikus kemoterápián (pl. anthracyclindózis >300 mg/m2) estek át (62).
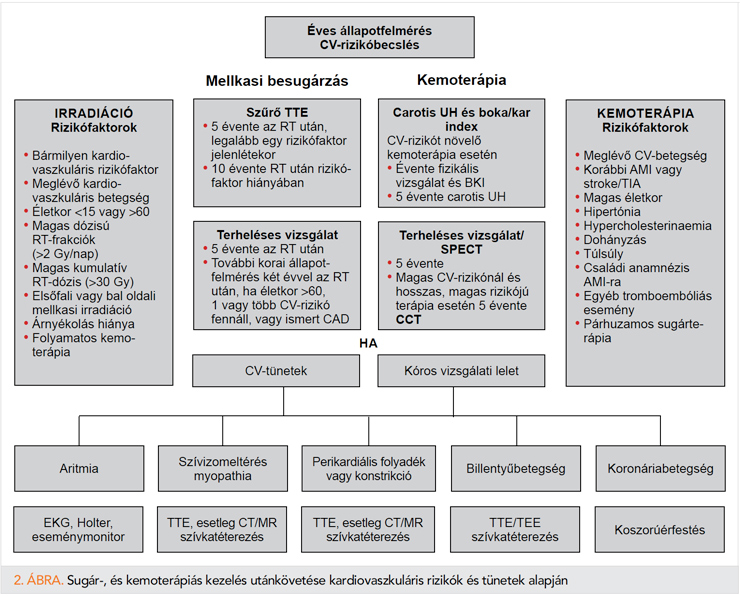
A kisebb CV-rizikójú, kemoterápián átesett betegek esetében is évente szív- és érrendszeri rizikóbecslés szükséges. Amennyiben a betegnek új kardiovaszkuláris tünete jelentkezik, szükséges kardiológiai gondozásba vétele, 5 évente a szív- és érrendszeri rizikótényezők újbóli ratifikálása. Mindezek mellett kiemelendő a beteg edukációja és a rizikótényezőiknek minimalizálása (63, 64).
Következtetések
Összességében elmondható, hogy a daganatos megbetegedések és az ateroszklerózis együttes előfordulása jelentős mortalitási kockázattal jár. Fontos felismerni a kialakulásukhoz hozzájáruló rizikótényezőket, megtalálni az optimális prevenciós lehetőségeket és a célzott terápiát, amely eredményeként a szív- és érrendszeri szövődmények minimalizálhatóak. A jövőben a kardio-onkológia tudományterületének nagy szerepe van abban, hogy a malignitáshoz társuló ateroszklerotikus és artériás szövődmények csökkenjenek. Mindehhez elengedhetetlen az onkológia és kardiológia szakterületek multidiszciplináris együttműködése.
Nyilatkozat
A cikk szerzői nyilatkoznak arról, hogy a közlemény más folyóiratban korábban nem jelent meg, és máshová beküldésre sem került. A levelező szerző nyilatkozik arról, hogy elolvasta a szerzői útmutatót.
Anyagi támogatás
A szerzők a cikk megírásához anyagi támogatásban nem részesültek.
Szerzői munkamegosztás
S.B. a cikk szerkesztésében, a többi szerző S.P., B.N. a szakirodalmi adatok feldolgozásában működtek közre. A cikk végleges változatát valamennyi szerző elolvasta és jóváhagyta.
Nyilatkozat
A szerzők kijelentik, hogy az összefoglaló közlemény megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
IRODALOM
1.Strongman H, Gadd S, Matthews A, et al. Medium and long-term risks of specific cardiovascular diseases in survivors of 20 adult cancers: a population-based cohort study using multiple linked UK electronic health records databases. Lancet 2019; 21; 394(10203): 1041–1054. http://dx.doi.org/10.1016/
2. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71: 209–49. https://doi.org/10.3322/caac.21660
3. Rapsomaniki E, Timmis A, George J, et al. Blood pressure and incidence of twelve cardiovascular diseases: lifetime risks, healthy life-years lost, and age-specific associations in 125 million people. Lancet 2014; 383: 1899–911. https://doi.org/10.1016/s0140-6736(14)60685-1
4. Stoltzfus KC, Zhang Y, Sturgeon K, et al. Fatal heart disease among cancer patients. Nat Commun 2020; 24; 11(1): 2011. https://doi.org/10.1038/s41467-020-15639-5
5. Murphy WA Jr, Zur Nedden D, Gostner, et al. The Iceman: discovery and imaging. Radiology 2003; 226(3): 614–629. https://doi.org/10.1148/radiol.2263020338
6.Thompson RC, Allam AH, Lombardi GP, et al. Atherosclerosis across 4000 years of human history: the Horus study of four ancient populations. Lancet 2013; 6; 381(9873): 1211–22. https://doi.org/10.1016/s0140-6736(13)60598-x
7.Faguet GB. A brief history of cancer: age-old milestones underlying our current knowledge database. Int J Cancer 2015; 136(9): 2022–36. https://doi.org/10.1002/ijc.29134
8. Schreiner BF, Thibaudeau AA. Sarcoma of the Breast: A Report of Seven Cases. Ann Surg 1932; 95(3): 433–9. https://doi.org/10.1097/00000658-193203000-00007
9. Blankenhorn DH, Kramsch DM. Reversal of atherosis and sclerosis. The two components of atherosclerosis. Circulation 1989; 79(1): 1–7. https://doi.org/10.1161/01.cir.79.1.1
10.Ross JS, Stagliano NE, Donovan MJ, et al. Atherosclerosis: a cancer of the blood vessels? Am J Clin Pathol 2001; 97–S107. https://doi.org/10.1309/ynck-9r19-5ja3-k2k9
11. Jain MV, Paczulla AM, Klonisch T, et al. Interconnections between apoptotic, autophagic and necrotic pathways: implications for cancer therapy development. J Cell Mol Med 2013; 17(1): 12–29. https://doi.org/10.1111/jcmm.12001
12.Demers M, Krause DS, Schatzberg D, et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancer-associated thrombosis. Proc Natl Acad Sci USA 2012; 109: 13076–13081. https://doi.org/10.1073/pnas.1200419109
13. Tapia-Vieyra JV, Delgado-Coello B, Mas-Oliva J. Atherosclerosis and Cancer; A Resemblance with Far-reaching Implications. Arch Med Res 2017; 48(1): 12–26. https://doi.org/10.1016/j.arcmed.2017.03.005
14. Stone RC, Horvath K, Kark JD, et al. Telomere Length and the Cancer-Atherosclerosis Trade-Off. PLoS Genet 2016; 12(7): e1006144. https://doi.org/10.1371/journal.pgen.1006144
15. Evans MA, Sano S, Walsh K. Cardiovascular disease, aging, and clonal hematopoiesis. Annu Rev Pathol 2020; 15: 419–38. https://doi.org/10.1146/annurev-pathmechdis-012419-032544
16. Stewart FA, Heeneman S, Te Poele J, et al. Ionizing radiation accelerates the development of atherosclerotic lesions in ApoE-/-mice and predisposes to an inflammatory plaque phenotype prone to hemorrhage. Am J Pathol 2006; 168: 649–658. https://doi.org/10.2353/ajpath.2006.050409
17. Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 2013; 368: 987–998. https://doi.org/10.1056/nejmoa1209825
18. Screening for coronary artery disease after mediastinal irradiation for Hodgkin’s disease. Heidenreich PA, Schnittger I, Strauss HW et al. J Clin Oncol 2007 Jan 1;25(1): 43–9. https://doi.org/10.1200/jco.2006.07.0805
19. 2022 ESC Guidelines on cardio-oncology. 2022; 6.
20. Orth M, Lauber K, Niyazi M, et al. Current concepts in clinical radiation oncology. Radiat Environ Biophys 2014; 53(1): 1–29. https://doi.org/10.1007%2Fs00411-013-0497-2
21. Lee MS, Finch W, Mahmud E. Cardiovascular Complications of Radiotherapy. Am J Cardiol 2013; 112: 1688–1696. https://doi.org/10.1016/j.amjcard.2013.07.031
22. van Nimwegen FA, Schaapveld M, Cutter DJ, et al. Radiation dose-response relationship for risk of coronary heart disease in survivors of Hodgkin lymphoma. J Clin Oncol 2016; 34: 235–243. https://doi.org/10.1200/jco.2015.63.4444
23. Zamorano JL, Lancelotti P, Munoz DR, et al. Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committeefor Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016; 36: 2768–2801. https://doi.org/10.1093/eurheartj/ehw211
24. Polk A, Vistisen K, Vaage-Nilsen M, et al. A systematic review of the patophysiology of 5-fluorouracil-induced cardiotoxicity. BMC Pharmacol Toxicol 2014; 15: 47. https://doi.org/10.1186/2050-6511-15-47
25. Navi BB, Reiner AS, Kamel H, et al. Risk of arterial thromboembolism in patients with cancer. J Am Coll Cardiol 2017; 70(8): 926–938. https://doi.org/10.1016/j.jacc.2017.06.047
26. Zamorano JL, Lancelotti P, Munoz DR, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016; 36: 2768–2801. https://doi.org/10.1093/eurheartj/ehw211
27. Qi WX, Shen Z, Tang LN, et al. Risk of arterial thromboembolic events with vascular endothelial growth factor receptor tyrosine kinase inhibitors: an up-to-date meta-analysis. Crit Rev Oncol Haematol 2014; 92(2): 71–82. https://doi.org/10.1016/j.critrevonc.2014.04.004
28. Polk A, Vistisen K, Vaage-Nilsen M et al. A systematic review of the patophysiology of 5-fluorouracil-induced cardiotoxicity. BMC Pharmacol Toxicol 2014;15: 47. https://doi.org/10.1186/2050-6511-15–47
29. Polk A, Vistisen K, Vaage-Nilsen M, et al. A systematic review of the patophysiology of 5-fluorouracil-induced cardiotoxicity. BMC Pharmacol Toxicol 2014; 15: 47. https://doi.org/10.1161/circresaha.115.303633
30. Polk A, Vistisen K, Vaage-Nilsen M, et al. A systematic review of the patophysiology of 5-fluorouracil-induced cardiotoxicity. BMC Pharmacol Toxicol 2014; 15: 47. https://doi.org/10.1093/annonc/mdf108
31. Rowinsky EK, McGuire WP, Guarnieri T, et al. Cardiac disturbances during the administration of taxol. J Clin Oncol 1991; 9: 1704–1712. https://doi.org/10.1200/jco.1991.9.9.1704
32. Ranpura V, Hapani S, Chuang J, et al. Risk of cardiac ischemia and arterial thromboembolic events with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis of randomized controlled trials. Acta Oncol 2010; 49(3): 287–97. https://doi.org/10.3109/02841860903524396
33. Yeh ETH, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol 2009; 53: 2231–2247. https://doi.org/10.1016/j.jacc.2009.02.050
34. Aronson D, Brenner B. Arterial thrombosis and cancer. Thromb Res. 2018 Apr;164 Suppl 1:S23-S28. https://doi.org/10.1016/j.thromres.2018.01.003
35. Navi BB, Reiner AS, Kamel H, et al. Risk of Arterial Thromboembolism in Patients With Cancer. J Am Coll Cardiol 2017; 70(8): 926–938. https://doi.org/10.1016/j.jacc.2017.06.047
36. Abdol Razak, NB Jones G, Bhandari M, et al. Cancer-associated thrombosis: an overview of mechanisms, risk factors, and treatment. Cancers 2018; 10: 380. https://doi.org/10.3390/cancers10100380
37. Hajnóczky N, Bereczki D. A malignus daganatok és az ischaemiás stroke kapcsolata: I. A thrombosis kialakulása, átfedő kockázati tényezők. Orv Hetil 2022 Jan 2; 163(1): 3–11. https://doi.org/10.1556/650.2022.32329
38. Abdol Razak, NB, Jones G, Bhandari M, et al. Cancer-associated thrombosis: an overview of mechanisms, risk factors, and treatment. Cancers (Basel) 2018; 10: 380. https://doi.org/10.3390/cancers10100380
39. Bharadwaj A, Potts J, Mohamed MO, et al. Acute myocardial infarction treatments and outcomes in 6.5 million patients with a current or historical diagnosis of cancer in the USA. Eur Heart J 2020; 41: 2183–2193. https://doi.org/10.1093/eurheartj/ehz851
40. Velders MA, Boden H, Hofma SH, et al. Outcome after ST elevation myocardial infarction in patients with cancer treated with primary percutaneous coronary intervention. Am J Cardiol 2013; 112(12): 1867–72. https://doi.org/10.1016/j.amjcard.2013.08.019
41. Krone RJ. Managing Coronary Artery Disease in the Cancer Patient. Prog Cardiovasc Dis 2010; 53: 149–156. https://doi.org/10.1016/j.pcad.2010.06.004
42. Gevaert SA, Halvorsen S, Sinnaeve PR, et al. Evaluation and management of cancer patients presenting with acute cardiovascular disease: a Consensus Document of the Acute CardioVascular Care (ACVC) association and the ESC council of Cardio-Oncology – Part 1: acute coronary syndromes and acute pericardial diseases. Eur Heart J Acute Cardiovasc Care 2021; 10: 947–959. https://doi.org/10.1093/ehjacc/zuab056
43. Yusuf SW, Daraban N, Abbasi N, et al. Treatment and outcomes of acute coronary syndrome in the cancer population. Clin Cardiol 2012; 35: 443–450. https://doi.org/10.1002/clc.22007
44. Mohamed MO, Van Spall HGC, Kontopantelis E, et al. Effect of primary percutaneous coronary intervention on in-hospital outcomes among active cancer patients presenting with ST-elevation myocardial infarction: a propensity score matching analysis. Eur Heart J Acute Cardiovasc Care 2021; 10: 829–839. https://doi.org/10.1093/ehjacc/zuaa032
45. Iliescu CA, Grines CL, Herrmann J et al. SCAI Expert Consensus Statement: Evaluation, Management, and Special Considerations of Cardio-Oncology Patients in the Cardiac Catheterization Laboratory (Endorsed by the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencionista). Catheter Cardiovasc Interv 2016; 87: E202-E223. https://doi.org/10.1002/ccd.26379
46. Iannaccone M, D’Ascenzo F, Vadalà P et al. Prevalence and outcome of patients with cancer and acute coronary syndrome undergoing percutaneous coronary intervention: a BleeMACS substudy. Eur Heart Journal Acute Cardiovasc Care 2018;7: 631–638. https://doi.org/10.1177/2048872617706501
47. Iliescu CA, Grines CL, Herrmann J et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (endorsed by the Cardiological Society of India, and Sociedad Latino Americana de Cardiologıa Intervencionista). Catheter Cardiovasc Interv 2016;87: E202–E223. 485. https://doi.org/10.1002/ccd.26379
48. Iliescu CA, Cilingiroglu M, Giza DE, et al. ‘Bringing on the light’ in a complex clinical scenario: optical coherence tomography–guided discontinuation of antiplatelet therapy in cancer patients with coronary artery disease (PROTECT-OCT registry). Am Heart J 2017; 194: 83–91. https://doi.org/10.1016/j.ahj.2017.08.015
49. Guddati AK, Joy PS, Kumar G. Analysis of outcomes of percutaneous coronary intervention in metastatic cancer patients with acute coronary syndrome over a 10-year period. J Cancer Res Clin Oncol 2016; 142: 471–479. https://doi.org/10.1007/s00432-015-2056-5
50. Ueki Y, Vögeli B, Karagiannis A, et al. Ischemia and bleeding in cancer patients undergoing percutaneous coronary intervention. JACC CardioOncology 2019; 1: 145–155. https://dx.doi.org/10.1016/j.jaccao.2019.11.001
51. Collet J-P, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021; 42: 1289–1367. https://doi.org/10.1093/eurheartj/ehaa575
52. Sarkiss MG, Yusuf SW, Warneke CL, et al. Impact of Aspirin Therapy in Cancer Patients With Thrombocytopenia and Acute Coronary Syndromes. Cancer 2007; 109: 621–7. https://doi.org/10.1002/cncr.22434
53. Yusuf SW, Iliescu C, Bathina JD, et al. Antiplatelet Therapy and Percutaneous Coronary Intervention. Tex Heart Inst J 2010; 37(3): 336–40. http://www.ncbi.nlm.nih.gov/pmc/articles/pmc2879212/
54. Iliescu C, Balanescu DV, Donisan T, et al. Safety of diagnostic and therapeutic cardiac catheterization in cancer patients with acute coronary syndrome and chronic thrombocytopenia. Am J Cardiol 2018; 122: 1465–1470. https://doi.org/10.1016/j.amjcard.2018.07.033
55. Bharadwaj AS, Swamy PM, Mamas MA. Outcomes of percutaneous coronary interventions in cancer patients. Expert Rev Cardiovasc Ther 2020; 18: 25–32. https://doi.org/10.1080/14779072.2020.1718493
56. Kwok CS, Wong CW, Kontopantelis E, et al. Percutaneous coronary intervention in patients with cancer and readmissions within 90 days for acute myocardial infarction and bleeding in the USA. Eur Heart J 2021; 42: 1019–1034. https://doi.org/10.1093/eurheartj/ehaa1032
57. Iliescu CA, Grines CL, Herrmann J et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (endorsed by the Cardiological Society of India, and Sociedad Latino Americana de Cardiologıa Intervencionista). Catheter Cardiovasc Interv 2016; 87: E202–E223. https://doi.org/10.1002/ccd.26379
58. Knuuti J, Wijns W, Saraste A et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J 2020; 41: 407–477. https://doi.org/10.1093/eurheartj/ehz425
59. Kaya MG, Ozkan M, Gunebakmaz O, et al. Protective effects of nebivolol against anthracycline-induced cardiomyopathy: A randomized control study. Int J Cardiol 2013; 167: 2306–2310. https://doi.org/10.1016/j.ijcard.2012.06.023
60. Elitok A, Oz F, Cizgici AY, et al. Effect of carvedilol on silent anthracycline-induced cardiotoxicity assessed by strain imaging: A prospective randomized controlled study with six-month follow-up. Cardiol J 2014; 21: 509–515. https://doi.org/10.5603/cj.a2013.0150
61. S Bosch X, Rovira M, Sitges M, et al. Enalapril and carvedilol for preventing chemotherapy-induced left ventricular systolic dysfunction in patients with malignant hemopathies: The OVERCOME trial J Am Coll Cardiol 2013; 61: 2355–2362. https://doi.org/10.1016/j.jacc.2013.02.072
62. Steingart RM, Yadav N, Manrique C et al. Cancer survivorship: Cardiotoxic therapy in the adult cancer patient; -cardiac outcomes with recommendations for patient management. Semin Oncol 2013; 40: 690–708. https://doi.org/10.1053/j.seminoncol.2013.09.010
63. van Werkum JW, Heestermans AA, Zomer AC et al. Predictors of coronary stent thrombosis. The Dutch Stent Thrombosis Registry. J Am Coll Cardiol 2009; 53: 1399–1409. https://doi.org/10.1016/j.jacc.2008.12.055
64. Urban P, Mehran R, Colleran R et al. Defining high bleeding risk in patients undergoing percutaneous coronary intervention. Circulation 2019;140: 240–261. https://doi.org/10.1161/circulationaha.119.040167
65. Gulácsi-Bárdos P, Szokol M, Lódi M et al. Ischaemiás szívbetegség és tumoros betegségek együttes előfordulása. Kérdések és problémák (Ischaemic heart disease in cancer patients. Questions and problems). Orv Hetil 2017 Oct; 158 (43): 1691–1697. https://doi.org/10.1556/650.2017.30897