Practical issues in the assessment of left ventricular dysfunction in cancer patients
█ Review
DOI: 10.26430/CHUNGARICA.2023.53.2.103
Authors:
Fogarassy György
Állami Szívkórház, Balatonfüred
Levelezési cím:
Dr. Fogarassy György, e-mail: gyorgy.fogarassy@gmail.com
Summary
Based on the 2022 European cardio-oncology guideline, cardiovascular (CV) risk assessment is recommended before the use of oncotherapeutic agents with CV toxicity. In addition to the clinical evaluation, echocardiographic assessment of the left ventricle (LV) (ejection fraction (EF) and global longitudinal strain – GLS) also has importance. The 3-dimensional method is recommended for testing EF. With treatment using anthracycline, human epidermal growth factor receptor-2 inhibitors, proteasome inhibitors applied in multiple myeloma, rapidly accelerated fibrosarcoma and mitogen-activated extracellular signal-regulated kinase (RAF + MEK) inhibitors (used in melanoma) and, as well as vascular endothelial growth factor (VEGF)-inhibiting tyrosine kinase inhibitors (TKIs) and antibodies, an increased risk of cardiotoxicity with heart failure should be expected in case of an initial LV EF value of less than 55%. Echocardiography is important in assessing the risk of coronary disease, which is crucial if the planned oncological treatment increases this risk (fluoropyrimidines; VEGF inhibitors; TKI, especially the 2nd or 3rd generation BCR-ABL inhibitors). Early recognition of cardiotoxicity is especially important with anthracycline treatment, this can be achieved most effectively by the detection of LV GLS decrease. If cardioprotective treatment is started with a revealed significant relative GLS reduction (15%), the myocardial damage causing EF decrease can be prevented with a greater chance than with the follow-up based on EF. GLS-based follow-up can also lead to earlier recognition of the myocarditis rarely complicating the immune checkpoint inhibitor treatment.
ISSUE: CARDIOLOGIA HUNGARICA | 2023 | VOLUME 53, ISSUE 2
Összefoglalás
A 2022-es európai kardio-onkológiai irányelv alapján a kardiovaszkuláris (CV) toxicitással rendelkező onkoterápiás szerek alkalmazása előtt a CV-rizikó felmérése javasolt. Ebben a klinikai értékelés mellett a bal kamra (BK) echokardiográfiás megítélése (ejekciós frakció (EF) és globális longitudinális strain – GLS) is fontos szereppel bír. Az EF vizsgálatára lehetőleg a 3 dimenziós módszer javasolt. Szívelégtelenséggel járó kardiotoxicitás fokozott kockázatával kell számolni 55%-nál kisebb kiinduló BK EF-érték esetén antraciklin, humán epidermális növekedésifaktor-receptor-2 elleni kezelés, a myeloma multiplexben hasznát proteaszómagátlók, a melanomában alkalmazott rapidly accelerated fibrosarcoma és mitogen-activated extracellular signal-regulated kinase (RAF + MEK) inhibitor kezelés, valamint vaszkuláris endotheliális növekedési faktort (VEGF) gátló tirozinkináz-inhibitorok (TKI) és antitestek alkalmazása során. Az echokardiográfia segíthet a koronáriabetegség rizikójának értékelésében, ami akkor fontos, ha a tervezett onkológiai kezelés ennek rizikóját fokozza (fluoropirimidinek; VEGF-gátlók; TKI-k, különösen a 2., vagy 3. generációs BCR-ABL-gátlók). A kardiotoxicitás korai felismerése különösen antraciklinkezelés mellett fontos, ez leginkább a BK GLS csökkenésének észlelésével érhető el. Ha már szignifikáns relatív GLS-csökkenés (15%) mellett megkezdődik a kardioprotektív kezelés, akkor a csökkent EF-fel járó szívizom-károsodás nagyobb eséllyel megelőzhető, mint az EF-re épített követéssel. Az immunellenőrzésipont-gátló kezelés szövődményeként ritkán kialakuló, súlyos következményekkel fenyegető myocarditis korai felismerésében is segíthet a GLS-alapú követés.
Bevezetés
A daganat elleni kezeléshez kapcsolódó kardiovaszkuláris toxicitás (cancer therapy-related cardiovascular toxicity, CTR-CVT) sokféle kórkép formájában manifesztálódhat (cardiomypathia, myocarditis, akut koronáriaszindróma, tromboembólia, hipertónia, ritmuszavar, valvuláris és perikardiális betegség). A 2022-ben megjelent európai onko-kardiológiai irányelv a kardiovaszkuláris (CV) toxicitással rendelkező onkológiai terápiák alkalmazása előtt individualizált CV-rizikófelmérést javasol. Mind az előzetes rizikóstratifikációban, mind a kialakult CV-szövődmények észlelése és kezelése terén az echokardiográfiának jelentős szerep jut (1).
A daganat elleni kezeléshez kapcsolódó kardiális diszfunkció vizsgálatának echokardiográfiás paraméterei
A daganat elleni kezeléshez kapcsolódó kardiális diszfunkció (CTRCD) alatt a daganat elleni kezeléshez kapcsolódóan kialakult szívizombetegséget értjük. Klinikailag ez manifeszt szívelégtelenségként, vagy csökkent szisztolés funkcióval járó tünetmentes szívizombetegségként jelenhet meg. Ebből adódóan a CTRCD jelenlegi, európai irányelvben megjelenő definíciója is a szívelégtelenség tüneteire és az echokardiográfiás eltérésekre alapul (1. táblázat). Látható, hogy a legnagyobb prognosztikai jelentőségű paraméter, a bal kamrai ejekciós frakció (BK EF) mellett a bal kamra globális szisztolés longitudinális deformálódása (global longitudinal strain, GLS) is szerepel a definícióban (1).

A BK EF pontos meghatározása tehát kiemelt fontossággal bír az onko-kardiológiai ellátás során. A magas inter- és intraobszerver variabilitás miatt a 2 dimenziós BK EF-meghatározás a bal kamrai szisztolés diszfunkció korai jeleinek észlelésére limitáltan alkalmas, több rosszul vizualizálható szegmentum esetén ultrahangos kontrasztanyag alkalmazásával ez a variabilitás csökkenthető. Azonban ennél is pontosabb a 3 dimenziós BK EF-meghatározás (1–4). Emiatt elsősorban ez utóbbi metódus javasolt a daganatterápia során a betegek követésére. A módszer alkalmazásához szükséges képminőség elérése azonban nem ritkán jelentős kihívást jelent és gyakorlatot igényel. A térbeli (volumenbeállítás és erősítés) és időbeli (szívfrekvencia értékének 20%-át meghaladó képkocka/s) felbontás optimalizációja mellett, stabil ritmus esetén a több ciklusos leképezés segíti a megfelelő felvétel elkészítését, azonban az elérhető eredmény jelentősen függ a használt géptől és szoftvertől is. Amennyiben a 3 dimenziós kép nem kielégítő, vagy nincs rá lehetőség, a módosított Simpson-módszer használandó (kettő, vagy három síkból vizsgálva) (1, 2). A kezdődő bal kamrai szisztolés diszfunkció korai azonosítására azonban alkalmasabb a myocardium kontraktilitását közvetlenül vizsgáló deformálódás (strain) analízis (5, 6). A speckle-tracking alapú echokardiográfiás strain-vizsgálat a kardiotoxicitás észlelésében az szív MR-hez hasonló érzékenységgel bír. Kis interobszerver variabilitása miatt az onko-kardiológiában a bal kamra globális longitudinális deformálódásának 2 dimenziós echokardiográfiás vizsgálata javasolt (1, 2, 6). A 3 dimenziós strain-vizsgálat fizikai alapjait tekintve többlet információkat hordozhat, mivel ezzel a teljes myocardium egyidejű leképezésére nyílik mód, és nem csak az egy vizsgálati síkon belül mozgó szívizomrészek (speckle) analizálhatóak (7). Azonban a strain-vizsgálathoz optimálisan szükséges, minimum 40 képkocka/s időbeli felbontás biztosítása megfelelő 3 dimenziós képminőség mellett gyakran nem lehetséges, emiatt a 3 dimenziós strainhez 25 képkocka/s a javasolt minimum. A nagyobb pontossága miatt jelenleg a 2 dimenziós strain-vizsgálat a legelterjedtebb, ezen belül a szisztoléban észlelt csúcsérték (peak sytolic strain) (6). Ez az érzékeny módszer ad lehetőséget a CTRCD korai echokardiográfiás észlelésére még megtartott BK EF mellett (1. ábra).
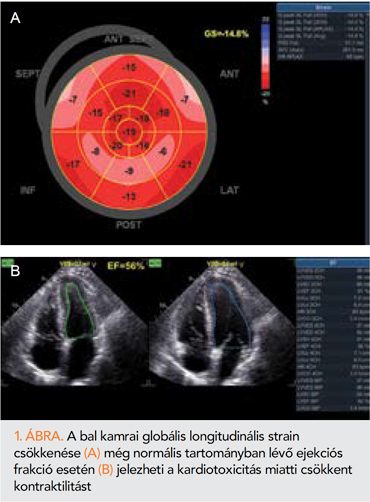
Számos vizsgálat igazolta, hogy a kiindulási értékhez képest csökkenő 2 dimenziós GLS-érték előre jelzi antraciklin- és trasztuzumabkezelés mellett a későbbi, súlyosabb bal kamrai szisztolés diszfunkciót (8–10). A CTRCD korai észlelése nagy klinikai haszonnal jár, mivel a kialakult súlyos kardiális diszfunkció már nem mindig reverzibilis, de korai beavatkozás és kezelés révén a reverzibilitás nagyobb mértékű (1, 11). A GLS értéke nem függ a myocardium elmozdulási irányának és a vizsgálófejnek az egymáshoz viszonyított pozíciójától, de értékét befolyásolja a bal kamra elő- és utóterhelése (5). Mivel onkológiai betegeken az előforduló gyógyszermellékhatások, hányás, étvágytalanság és hasmenés miatt mindkettő változatos lehet, így a GLS is változhat kardiotoxicitás nélkül is. Emiatt az elmúlt években vita tárgya volt, hogy a kiinduló értékhez képest mekkora GLS-csökkenést kell szignifikánsnak tekinteni. A jelenlegi európai ajánlás, a nagyobb specificitás érdekében, a GLS 15%-ot elérő csökkenését tekinti klinikailag jelentősnek a kardiotoxicitás szempontjából (1). A GLS-analízist mesterséges intelligenciával támogatott szoftverek végzik, de a korrekt kivitelezéséhez több szempontra is érdemes figyelni, ezek összefoglalása a 2. táblázatban található. Az egyes gyártók GLS szoftverei közötti különbségek miatt kívánatos, hogy egy beteget ugyanazon fejlesztő szoftverének használatával ellenőrizzenek (6).
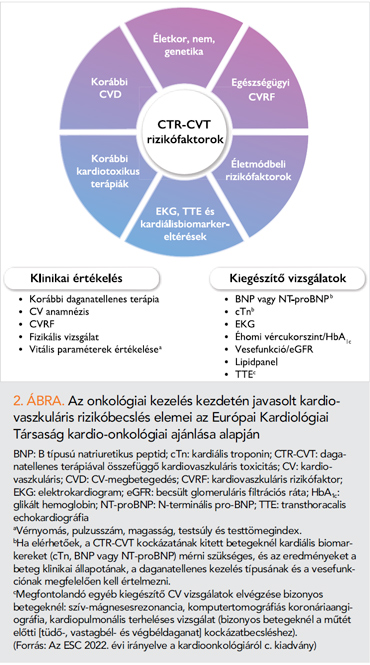
Az echokardiográfia szerepe a CTR-CVT rizikójának előzetes felmérésében
Az európai onko-kardiológiai irányelv szerint minden olyan betegnél javasolt a CTR-CVT rizikójának előzetes felmérése, akinél CV-toxicitással bíró onkológiai kezelést terveznek (2. ábra) (1). Erre a célra a HFA-ICOS rizikóbecslő algoritmusai használandóak (12), ezekben a pontrendszerekben a daganat elleni kezelések hatóanyagcsoportjaira lebontva, az életkor (>60–65 év), a korábbi onkológiai kezelések, az ismert CV-rizikótényezők, thrombophilia, vesebetegség, EKG-paraméterek (QTc, ritmuszavar), az ismert CV-betegségek megítélése, továbbá a troponin és nátriuretikus peptidek kiinduló értéke és az echokardiográfia (kiinduló BK EF, becsült pulmonalis nyomás) kap szerepet. E mellett az echokardiográfia fényt deríthet több, fokozott onko-kardiológiai rizikóval járó, addig nem ismert CV-betegségre (lezajlott szívinfarktus, cardiomyopathia, szignifikáns vitium, perikardiális betegség, lezajlott tüdőembólia). Ezek alapján nem csupán a rizikópontok számítását befolyásolja a vizsgálat, hanem további gyógyszeres és invazív beavatkozások szükségességét is felvetheti. 55%-nál kisebb kiinduló BK EF-érték alatt már fokozódik a szív-elégtelenséggel járó CTRCD kockázata antraciklin, humán epidermális növekedésifaktor-receptor-2 (HER2) elleni kezezés, a myeloma multiplex kezelésében használt proteaszómagátlók, a melanomában alkalmazott rapidly accelerated fibrosarcoma (RAF) és mitogen-activated extracellular signal-regulated kinase (MEK)-inhibitor kezelés, valamint a vaszkuláris endothelialis növekedési faktort (VEGF) gátló tirozinkináz-inhibitorok és antitestek alkalmazása során. Amennyiben az echokardiográfia (szegmentális falmozgászavar, jelentősen csökkent GLS szegmentális mintázattal) (3. ábra), vagy a panaszok alapján koronáriabetegség merül fel, az iszkémia vizsgálata megfontolandó, különösen akkor, ha a tervezett kezelés ennek rizikóját fokozza (fluoropirimidinek; VEGF-gátlók; 2., vagy 3. generációs breakpoint cluster region–Abelson oncogene locus (BCR-ABL) gátlók; egyéb tirozinkináz-inhibitorok) (1, 12).
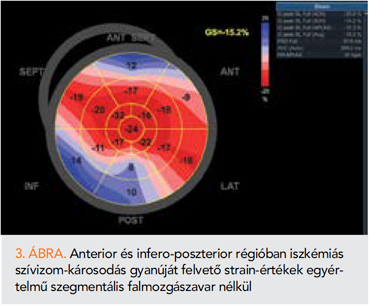
A kiinduló GLS vizsgálata a közepes, vagy nagyobb kockázatú betegeknél kiemelt fontossággal bír. A kiinduló GLS meghatározásának a referenciaérték rögzítésén túl prognosztikai szerepe is van. Az antraciklinnel kezelt, megtartott ejekciós frakciójú betegek esetében ugyanis az onkoterápia előtt észlelt csökkent GLS-értéknek a későbbi szívelégtelenség vonatkozásában prediktív értéke van (13, 14). A 16%-os, vagy az alatti érték esetén 4,7-szeresére nő a szívelégtelenség kialakulásának kockázata. Szintén fokozta a kockázatot a megtartott BK EF mellett észlelt nagyobb bal kamrai indexált végdiasztolés volumen (>61 ml/m2) is (13). A GLS nemcsak a szisztolés és diasztolés balkamra-funkcióval mutat összefüggést, hanem koronáriabetegség súlyosságának és szívizominfarktusnak is független prediktora (15, 16). A koronáriabetegség fokozza a szív-izom kemoterápiával szembeni sérülékenységét (17, 18), tehát valószínű, hogy a megtartott ejekciós frakciójú, de csökkent GLS-t mutató betegek esetében észlelt nagyobb CTRCD-rizikó részben a háttérben meghúzódó súlyosabb koszorúér-betegségből adódhat.
A bal kamra szisztolés diszfunkció vizsgálata az onkológiai kezelés alatt és után
A kardiológiai és laboratóriumi ellenőrzés gyakoriságát és időzítését az új európai ajánlások részletesen tárgyalják a CTR-CVT rizikójával járó onkológiai kezelések vonatkozásában. Általános elv, hogy a 3. fejezetben említett, multifaktoriális, HFA-ICOS kiindulási CV-rizikó meghatározási pontrendszer (12) eredménye (alacsony, közepes, magas, vagy igen magas) alapján kell megadni az utánkövetés intenzitását (1, 2, 19). Az antraciklinkezelés speciális követést igényel (4. ábra), mivel ennél a kezelésnél a bal kamrai szisztolés diszfunkció az esetek többségében nem a kemoterápia alatt, hanem annak befejezése után manifesztálódik, általában egy éven belül. Erre tekintettel határozza meg az új irányelv a követési protokollt (1). Gyermekkori kezelés esetén pedig több év múlva is kialakulhat a CTRCD antraciklinterápia következtében (11, 20).
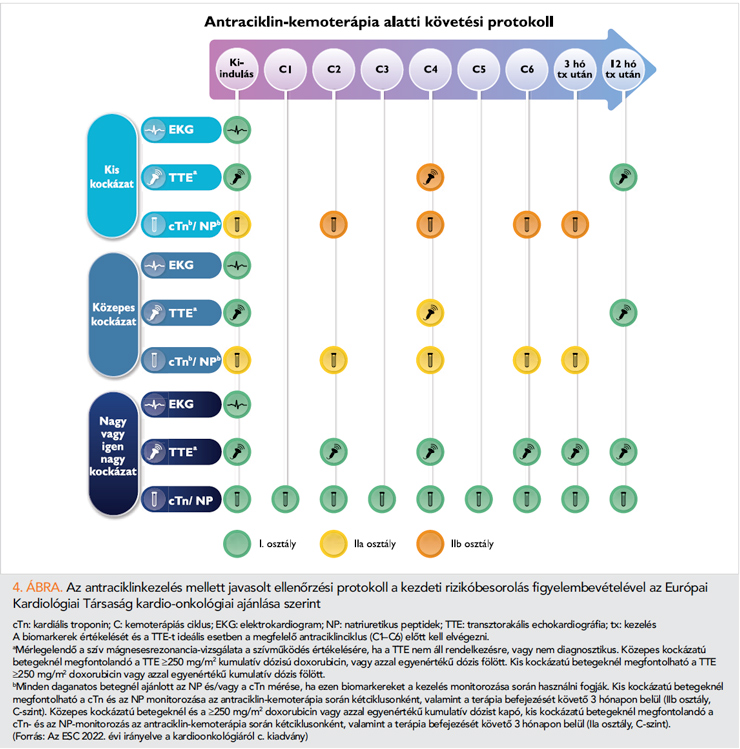
A CTRCD korai észlelésének nagy klinikai jelentősége van, ugyanis a balkamra-diszfunkció nem mindig reverzibilis, a korai észlelés és hatékony kezelés mellett nagyobb arányban várható a BK-funkció helyreállása. Ennek révén csökkenthető a CV-mortalitás és elkerülhetővé válik a hatékony, potenciálisan nagyobb CV-toxicitású onkológiai kezelés megszakítása, ami az onkológiai prognózist is javítja. A CTRCD korai felismerésének vonatkozásában az echokardiográfiának kritikus szerepe van. A bal kamrai szisztolés funkció vizsgálatára a fentebb említettek alapján első sorban a 3 dimenziós módszer javasolt, ha ez nem elérhető, akkor a 2 dimenziós Simpson-módszer alkalmazandó 2, vagy 3 csúcsi vizsgálati síkból. Amennyiben mód van rá, minden vizsgálatnál javasolt BK GLS vizsgálata, ennek főleg a normál tartomány alsó részében lévő BK EF esetén van nagy jelentősége, így ugyanis korábban felismerhető a kezdődő CTRCD (GLS-csökkenés a kiinduláshoz képest >15%) (1, 2, 6).
Antraciklinkezeléshez kacsolódóan, a CTRCD korai észlelése céljából végzett, gondos, BK EF ellenőrzésére épülő echokardiográfiás ellenőrzési protokoll sem tudja biztosítani, hogy a kialakult BK szisztolés diszfunkció az esetek többségében teljesen reverzibilis legyen (11). A közelmúltban publikált SUCCOUR-vizsgálat adatai alapján a GLS-alapú onko-kardiológiai követés révén, a CTRCD enyhe stádiumban való felismerésével és kezelésével ilyenkor is megelőzhető a csökkent a bal kamrai szisztolés funkcióval járó, súlyosabb fokú kardiotoxicitás kifejlődése (21).
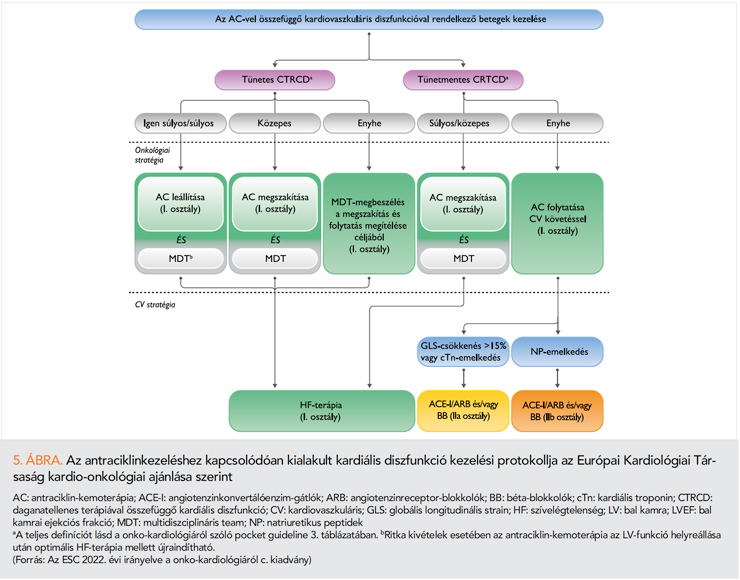
Az új európai onko-kardiológiai irányelv hatóanyag-csoportokra bontva, a súlyosságnak megfelelően tárgyalja a tünetes és tünetmentes CTRCD (1. táblázat) észlelésekor követendő onkológiai és kardiológiai teendőket. Szívelégtelenségi gyógyszerelés indítása minden esetben javasolt, ennek intenzitása a súlyosságtól függ. Tünetes szívelégtelenség esetén, a súlyosságtól és az alkalmazott onkológiai szertől függően mérlegelendő, vagy javasolt az onkológiai kezelés átmeneti, vagy végleges felfüggesztése. Tünetmentes CTRCD esetén antraciklin mellett már közepes súlyosság esetén is javasolt az onkológiai kezelés felfüggesztése (5. ábra), egyéb szerek esetében csak 40% alatti BK EF-fel járó, súlyos esetben szükséges az onkológiai kezelés megszakítása. Az antraciklin nélküli protokollok mellett a mérsékelt, vagy enyhe (BK EF >40%) tünetmentes CTRCD esetén a szívelégtelenségi gyógyszerek beépítése után folytatható az onkológiai kezelés szoros kardiológiai ellenőrzés (2 havonta) mellett. Általános elv, hogy 40% alatti BK EF-fel járó CTRCD esetén, csak a szívelégtelenségi gyógyszerek mellett észlelt echokardiográfiás (ideálisan EF >50%) és laboratóriumi (nátriuretikus peptid) regresszió után mérlegelhető az onkológiai kezelés folytatása. Amennyiben az onko-kardiológiai konzultáció a megszakított onkológiai kezelés folytatása mellett dönt, úgy mérlegelendő kevésbé kardiotoxikus protokoll vagy formula (liposzómás) alkalmazása. Ilyenkor is 2 havonta szükséges az echokardiográfiás és nátriuretikus peptid ellenőrzése az állapot stabilizálódásáig (1).
Az immunellenőrzőpont-inhibitor (immune checkpoint inhibitor) kezeléshez kapcsolódó CTRCD ritkán alakul ki, általában a kezelés első 3 hónapjában jön létre, patomechanizmusában autoimmun myocarditis szerepelhet, amely gyakran fatális kimenetelű fulmináns gyulladás irányába progrediál (22). Erre tekintettel, ebben a kórképben kritikus fontosságú a korai felismerés, ezt segítheti a GLS-vizsgálat is, ugyanis a szívizomgyulladás kialakulásának kezdeti fázisában, még megtartott BK EF esetén jelzi a myocardium károsodását és a súlyos kardiális kimenetel predikciójára szolgáltat adatot (23), ez alapján felvetheti szív-MR-vizsgálat és szívizom-biopszia indikációját. Amennyiben a szív-izomgyulladás igazolódik, intenzív immunszuppresszív kezelés szükséges.
Következtetések
A bal kamrai szisztolés funkció echokardiográfiás vizsgálata (EF és GLS) a kezdeti onko-kardiológiai rizikóbecslésben, majd az erre épülő további követés során is kiemelt fontossággal bír. A bal kamrai ejekciós frakció releváns meghatározásának (lehetőleg 3 dimenziós elemzés, vagy 2 síkból számított Simpson-módszer) kiegészítése 2 dimenziós bal kamrai GLS-analízissel a kardiális kockázattal járó onkológiai kezelés előtt/elején kifejezetten nagy jelentőségű. A követés során ugyanis az ezen paraméterekben bekövetkező változások észlelése teszi lehetővé a daganat elleni kezeléshez kapcsolódó kardiotoxicitás korai felismerését és hatékony kezelését.
Nyilatkozat
A szerző kijelenti, hogy az összefoglaló közlemény megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
IRODALOM
1. Lyon AR, López-Fernández T, Couch LS et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J 2022: ehac244.
2. Čelutkienė J, Pudil R, López-Fernández T et al. Role of cardiovascular imaging in cancer patients receiving cardiotoxic therapies: a position statement on behalf of the Heart Failure Association (HFA), the European Association of Cardiovascular Imaging (EACVI) and the Cardio-Oncology Council of the European Society of Cardiology (ESC). Eur J Heart Fail 2020; 22: 1504–1524. https://doi.org/10.1002/ejhf.1957
3. Lang RM, Badano LP, Mor-Avi V et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of, Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2016; 17: 412. https://doi.org/10.1093/ehjci/jew041
4. Thavendiranathan P, Grant AD, Negishi T et al. Reproducibility of echocardiographic techniques for sequential assessment of left ventricular ejection fraction and volumes: application to patients undergoing cancer chemotherapy. J Am Coll Cardiol 2013; 61: 77–84. https://doi.org/10.1016/j.jacc.2012.09.035
5. Zito C, Longobardo L, Citro R et al. Ten Years of 2D Longitudinal Strain for Early Myocardial Dysfunction Detection: A Clinical Overview. Biomed Res Int 2018: 8979407. https://doi.org/10.1155/2018/8979407
6. Liu JE, Barac A, Thavendiranathan P et al. Strain Imaging in Cardio-Oncology. JACC CardioOncol 2020; 2: 677–689. https://doi.org/10.1016/j.jaccao.2020.10.011
7. Zhang KW., Finkelman BS., Gulati G. Abnormalities in 3-dimensional left ventricular mechanics with anthracycline chemotherapy are associated with systolic and diastolic dysfunction. J Am Coll Cardiol Img 2018; 11: 1059–1068. https://doi.org/10.1016/j.jcmg.2018.01.015
8. Oikonomou EK, Kokkinidis DG, Kampaktsis PN et al. Assessment of Prognostic Value of Left Ventricular Global Longitudinal Strain for Early Prediction of Chemotherapy-Induced Cardiotoxicity: A Systematic Review and Meta-analysis. JAMA Cardiol 2019; 4: 1007–1018. https://doi.org/10.1001/jamacardio.2019.2952
9. Sawaya H, Sebag IA, Plana JC et al. Assessment of echocardiography and biomarkers for the extended prediction of cardiotoxicity in patients treated with anthracyclines, taxanes, and trastuzumab. Circ Cardiovasc Imaging 2012; 5: 596–603. https://doi.org/10.1161/circimaging.112.973321
10. Kang Y, Xu X, Cheng L et al. Two-dimensional speckle tracking echocardiography combined with high-sensitive cardiac troponin T in early detection and prediction of cardiotoxicity during epirubicine-based chemotherapy. Eur J Heart Fail 2014; 16: 300–308. https://doi.org/10.1002/ejhf.8
11. Cardinale D, Colombo A, Bacchiani G et al. Early detection of anthracycline cardiotoxicity and improvement with heart failure therapy. Circulation 2015; 131: 1981–1988. https://doi.org/10.1161/CIRCULATIONAHA.114.013777
12. Lyon AR, Dent S, Stanway S et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail 2020; 22: 1945-1960. https://doi.org/10.1002/ejhf.1920
13. Mousavi N, Tan TC, Ali M et al. Echocardiographic parameters of left ventricular size and function as predictors of symptomatic heart failure in patients with a left ventricular ejection fraction of 50-59% treated with anthracyclines. Eur Heart J Cardiovasc Imaging 2015; 16: 977-84. https://doi.org/10.1093/ehjci/jev113
14. Charbonnel C, Convers-Domart R, Rigaudeau S et al. Assessment of global longitudinal strain at low-dose anthracycline-based chemotherapy, for the prediction of subsequent cardiotoxicity. Eur Heart J Cardiovasc Imaging 2017; 18: 392–401. https://doi.org/10.1093/ehjci/jew223
15. Biering-Sørensen T, Biering-Sørensen SR, Olsen FJ et al. Global Longitudinal Strain by Echocardiography Predicts Long-Term Risk of Cardiovascular Morbidity and Mortality in a Low-Risk General Population: The Copenhagen City Heart Study. Circ Cardiovasc Imaging 2017; 10: e005521. https://doi.org/10.1161/circimaging.116.005521
16. Biswas K, Mukherjee A, Nandi S etal. Utility of global longitudinal strain to detect significant coronary artery disease, its extent and severity in patients with stable ischemic heart disease. Echocardiography 2020; 37: 2000-2009. https://doi.org/10.1111/echo.14908
17. Pinder MC, Duan Z, Goodwin JS et al. Congestive heart failure in older women treated with adjuvant anthracycline chemotherapy for breast cancer. J Clin Oncol 2007; 25: 3808–15. https://doi.org/10.1200/jco.2006.10.4976
18. Fogarassy G, Vathy-Fogarassy Á, Kenessey I et al. Risk prediction model for long-term heart failure incidence after epirubicin chemotherapy for breast cancer – A real-world data-based, nationwide classification analysis. Int J Cardiol 2019; 285: 47–52. https://doi.org/10.1016/j.ijcard.2019.03.013
19. Pudil R, Mueller C, Čelutkienė J et al. Role of serum biomarkers in cancer patients receiving cardiotoxic cancer therapies: a position statement from the Cardio-Oncology Study Group of the Heart Failure Association and the Cardio-Oncology Council of the European Society of Cardiology. Eur J Heart Fail 2020; 22: 1966–1983. https://doi.org/10.1002/ejhf.2017
20. van Dalen EC, van der Pal HJ, Kok WE et al. Clinical heart failure in a cohort of children treated with anthracyclines: a long-term follow-up study. Eur J Cancer 2006; 42: 3191–3198. https://doi.org/10.1016/j.ejca.2006.08.005
21. Thavendiranathan P, Negishi T, Somerset E et al. SUCCOUR Investigators. Strain-Guided Management of Potentially Cardiotoxic Cancer Therapy. J Am Coll Cardiol 2021; 77: 392–401. https://doi.org/10.1016/j.jacc.2020.11.020
22. Brahmer JR, Abu-Sbeih H, Ascierto PA et al. Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events. J Immunother Cancer 2021; 9: e002435. https://doi.org/10.1136/jitc-2021-002435
23. Awadalla M, Mahmood SS, Groarke JD et al. Global Longitudinal Strain and Cardiac Events in Patients With Immune Checkpoint Inhibitor-Related Myocarditis. J Am Coll Cardiol 2020; 75: 467–478. https://doi.org/10.1016/j.jacc.2019.11.049