Coenzyme-Q10: evidence-based case series in Hungary
█ Review
DOI: 10.26430/CHUNGARICA.2018.48.3.211
Authors:
Nagy Viktor, Borbély Attila1, Kohut László2, Mohay Sándor3, Eke Nándor3, Andrássy Gábor3, Borbola József4, Édes István1
Semmelweis Egyetem, Általános Orvostudományi Kar, II. sz. Belgyógyászati Klinika, Budapest
1Debreceni Egyetem, Általános Orvostudományi Kar, Kardiológiai Tanszék, Debrecen
2Állami Egészségügyi Központ Balatonfüredi Kardiológiai Rehabilitációs Intézet, Kardiológiai Rehabilitációs Osztály, Balatonfüred
3Szt. Ferenc Kórház, Kardiológiai Rehabilitációs Osztály, Budapest
4Gottsegen György Országos Kardiológiai Intézet, Budapest
Summary
The vitamin-like coenzyme Q10 is a compound found naturally in virtually every cell in the human body. It is found in cell membranes and is particularly well known for its role in the electron transport chain in mitochondrial membranes during aerobic cellular respiration. Coenzyme Q10 deficiency has been implicated in several clinical disorders, including heart failure. Primary deficiency has been well described and results from mutations in genes involved in coenzyme Q10 biosynthesis. Based on evidence-based medicine, coenzyme Q10 appears to be a safe supplement for heart failure therapies and also for cardiovascular prevention.
ISSUE: CARDIOLOGIA HUNGARICA | 2018 | VOLUME 48, ISSUE 3
Összefoglalás
Koenzim-Q10 egy olyan, a természetben előforduló vitaminszerű anyag, amely az emberi szervezet szinte minden sejtjében előfordul. A sejtmembránokban helyezkedik el, és különösen jól ismert a szerepe a mitokondrium membránban zajló aerob sejtlégzés elektron szállítási láncában. A koenzim-Q10 hiánya szerepet játszhat számos betegségben, például a szívelégtelenségben. Elsődleges hiánya már jól leírható a bioszintézisében résztvevő génmutációkkal. A bizonyítékokon alapuló orvoslás alapján a koenzim-Q10 biztonságos terápia-kiegészítőnek tűnik a szívelégtelenség kezelésében, valamint a kardiovaszkuláris prevencióban.
A koenzim-Q10-ről általában
A koenzim-Q10 (2,3-dimethoxy-5-methyl-6-multiprenyl-1,4-benzoquinone) zsíroldékony vitaminszerű anyag, amely az összes energiatermelést folytató emberi sejtben, értelemszerűen elsősorban a mitokondriumban található meg. Más közismert nevei: ubidekarenon, ubikinon, Q10-koenzim (elterjedt rövidítése CoQ10). Az „ubi” előtag arra utal, hogy az élőlényekben általánosan fellelhető (ubiquitus: mindenhol jelenlevő), a „Q”, vagy a „kinon” a „fej” kémiai szerkezetét jelenti, a 10 pedig azt, hogy a „farok” ennyi izoprenil alegységet tartalmaz. Három redox állapota ismert, a teljesen oxidált (ubikinon), a teljesen redukált (ubikinol) és az átmeneti forma (ubiszemikinon). Plazmából történő meghatározása során az ubikinon és ubikinol együttes szintjét mérik, emberi plazmában a redukált forma (ubikinol) dominál (1, 2).
1957-ben Frederick Loring Crane izolálta marhaszívből (3), 1958-ban Karl August Folkers írta le a kémiai szerkezetét, aki 1972-ben Gian Paolo Littarruval együtt közölte először hiányát szívelégtelenségben (4). 1961-ben Peter Mitchell fedezte fel az elektrontranszport láncban betöltött létfontosságú szerepét (5), aki a mitokondriumokban zajló energetikai folyamatok terén elért kutatási eredményeiért, a kemiozmotikus hipotézis megalkotásáért (terminális oxidáció, vagy más néven oxidatív foszforiláció lépéseinek értelmezése) 1978-ban megkapta a Nobel-díjat. A kemiozmotikus hipotézis mai is helytálló, e szerint a tápanyagok oxidációjával keletkező energiát a mitokondrium belső membránjában ATP-molekulák kötik meg. A reakciósorozat egy elektronszállító rendszeren keresztül valósul meg, amelyben a CoQ10 elektronhordozóként működik (6). Lipidoldékonysága miatt a membránban szabadon „úszva” viszi át a hidrogénionokat az enzimkomplexekre, s eközben ubikinolból visszaoxidálódik ubikinonná. A szervezetben ezt az elektronátadást csak a CoQ10 képes elvégezni (7, 8).
Számos betegségben érhető tetten a szabad gyökök jelenléte, pl. a gyulladásokban, hypoxiás keringészavarokban, az ateroszklerózisban, vagy a rákos megbetegedésekben. A szabad gyökös reakciók arányának emelkedése tapasztalható az öregedési folyamatokban is (9–11). A szabad gyökök rendkívül reakcióképesek, mert az energiaállapot szempontjából a páratlan számú elektron jelenléte túlságosan labilis. A keletkezett gyökök ezért általában egy destruktív kémiai reakcióban intenzíven igyekeznek páros számú elektronszámot elérni. A CoQ10 redukált formája a feltételezések szerint erélyesen, lipofil antioxidánsként védi a sejtmembránokat, illetve a keringő lipoproteineket az oxidációtól, megelőzi a lipid-peroxil gyökök termelődését. Részben megköti a szabad gyököket, részben pedig elősegíti az endogén E-vitamin regenerációját az alfa-tokoferoxilból (9).
A CoQ10 vitaminszerű anyag, ami azt jelenti, hogy a szervezet bár képes előállítani, ám az életkor előrehaladtával és fehérjében szegény táplálkozás esetén a létrehozott mennyiség nem mindig elegendő az anyagcsere-folyamatokhoz, ezért szükség van a táplálkozással külső bevitelre is. Az egyes szervek CoQ10-tartalma az életkorral általában csökken, pl. a hasnyálmirigy és a mellékvese CoQ10-szintje már 1 éves korban eléri a maximumát, majd csökkenni kezd, az agy, szív, tüdő szintjének maximuma pedig 20 éves korban van, ezt követően észlelhető a folyamatos csökkenés (6).
A koenzim-Q10 primer hiánya és a pótlás hatása
A CoQ10 veleszületett hiányállapotát két lánytestvérben írták le először. A klinikai képet a myopathia jellemezte, rhabdomyolysissel asszociált rohamokat és mentális retardációt észleltek. A vázizomzatban a mitokondriális légzési lánc I+III és II+III enzimkomplex aktivitása kifejezetten alacsony volt, a CoQ10-szint pedig 3,7, illetve 5,4%-a volt a normális kontrollénak (13).
A hiányállapot dokumentálása után kiderült, hogy a CoQ10 benzoquinone gyűrűjének szintéziséért felelős enzimek, vagy szabályozó-fehérjék genetikai mutációi számos klinikai szindrómához vezethetnek (1. táblázat) (14–17).

A klinikai vizsgálatok bebizonyították azt, hogy CoQ10 bevitellel a plazmakoncentráció növelhető (18, 19), sőt pl. szívelégtelen betegek napi 150 mg CoQ10-zel – és egyéb étrend-kiegészítőkkel – való kezelése során 30-45 nap után szignifikáns mértékben megemelkedett a myocardium CoQ10 szöveti szintje is (20).
A CoQ10 plazmaszintjének vizsgálata a könnyű mintavételezés miatt terjedt el, egészségesekben ez 0,40–1,91 μmol/l (0,34–1,65 μg/ml) értéknek bizonyult (21). A CoQ10 pótlása kedvezően befolyásolta primer CoQ10-hiány során fellépő klinikai tünet együttesek bármelyikét (24), de amíg az izomrendellenességek és a nephropathia javulása szembeötlő volt, sőt olykor teljes, az agyi tünetek csak már irreverzibilisek, illetve a vér–agy-gáton az exogén CoQ10 rosszul jut át (14–18).
A CoQ10-pótlás hatásaival kapcsolatosan ugyanakkor több intenzív kutatás alatt álló tisztázandó kérdés van, pl. a dózis-plazmaszint változásának lineáris/nem lineáris összefüggése, a kiindulási alacsonyabb/magasabb CoQ10 plazmaszint befolyásoló hatása, az egyensúlyi állapot kialakulásának ideje, a szupplementáció elhagyása utáni plazmaszint-csökkenés időbeli lefutása és a plazmaszintek és különféle szövetek CoQ10-tartalmának összefüggése (18).
Vélhetően az olajos szuszpenziót tartalmazó lágy gél kapszulák szívódnak fel legjobban (18). Az exogén CoQ10 a plazmából a szövetekhez kerül, észlelhető entero-hepatikus körforgás is. Egy vizsgálatban napi 300 mg-ot adtak két héten keresztül. A szubsztitúció megszakítása után mintegy 33 órával a plazmaszint csökkenni kezdett, de egy hónappal később még mindig 74%-kal volt magasabb a kiindulási értéknél, sőt a kiindulási plazmaszint csak 6 hónappal később tért vissza (22).
Legtöbb CoQ10-et a marha és disznó belsőségek, a szardínia és a vörös húsú halak, az olajok és az olajos magvak tartalmazzák, a táplálékkal bevihető mennyiséget azonban csak napi 3-5 mg-ra becsülik (18, 19, 23).
Mivel a CoQ10 veleszületett hiányállapotai kedvezően reagáltak a molekula szubsztitúciójára, a kutatók figyelme arra irányult, hogy milyen más kórfolyamatokban lehetne kedvező hatást elérni a CoQ10 pótlásával. Ígéretesnek tűnt a hipertónia kezelése (24, 25), de az utolsó Cochrane-elemzés ezt nem tudta megerősíteni (26). A koleszterin és a kinonok szintézise egy darabig közös úton történik, a statinok pedig a szintézist még ennek a közös útnak az elején, a mevalonsav kialakulásának szintjén gátolják. A statinvizsgálatokban a koleszterincsökkenés mellett CoQ10-csökkenést is feltártak. A HMG-CoA-reduktáz gátlása során az izomzattal kapcsolatosan alkalmanként kedvezőtlen szövődmények észlehetők, ám ezeket a CoQ10-bevitel nem csökkentette (27). A statinkezelés során feltételezhetően akkor helyes a CoQ10 pótlása, ha a kiindulási plazmakoncentráció túlzottan alacsony. Ilyen társult állapot pl. éppen a szívelégtelenség, amelyet azért kell kiemelni, mert a rosuvastatinnal végzett nagy esetszámú, randomizált CORONA-tanulmányban az alacsonyabb CoQ10-szintű szívelégtelen betegeken észlelték a legrosszabb prognózist az egyváltozós elemzés alapján. A többváltozós statisztikai elemzés szerint azonban ebben a tanulmányban az alacsony koenzim-Q10-szint nem volt független előjelzője a klinikai kimenetelnek (28).
A koenzim-Q10-pótlás bizonyítékai
A KiSel-10 (Intervention With Selenium and Q10 on Cardiovascular Mortality and Cardiac Function in the Elderly Population in Sweden) vizsgálatban (1. ábra) egy vidéki svéd régióban élő, idős lakosságban 222-en placebót, 221-en pedig napi 2×100 mg CoQ10 kapszulát (Caps. Bio-Quinon®) és napi 200 μg szerves kötésben levő szelén tablettát (Tabl. SelenoPrecise®) kaptak (29). A tanulmány 5,2 éven keresztül tartott. A szív- és érrendszeri halálozás 28/222 (12,6%) volt a placebocsoportban és 13/221 (5,9%) az aktív szerrel kezelt csoportban, amely szignifikáns különbség (χ2: 5,97, p=0,015) és jelentős mértékű, 55%-os csökkenésnek felel meg. Az összhalálozás csökkenése nem érte el a szignifikancia szintjét. Az NT-proBNP plazmakoncentrációja a placebocsoportban nőtt, az aktív szerrel kezelt csoportban nem változott, a különbség szignifikáns (p=0,014). A vizsgálat végén az aktív kezelési csoport résztvevői nagyobb arányban voltak a magasabb ejekciós frakciójú osztályokban, mint a placebocsoport tagjai.

Lehetőség nyílott arra, hogy a KiSel-10-tanulmányba bevont személyek sorsának alakulását a kezelés után is kövessék (30). Azt találták, hogy a szív- és érrendszeri mortalitás a placebocsoportban 86/222, az aktív karon 46/221 volt (χ2: 17,01, p<0,0001). Ez 38,6% vs. 20,8%-nak felel meg. Ha a kardiovaszkuláris mortalitás alakulását egyetlen ábrában ábrázoljuk, fel kell figyelni arra, a két csoport mortalitása az idő múlásával egyre jobban eltér egymástól és a kezelés lezárulása után sem állt meg ez a folyamat! Ez arra hívja fel a figyelmet, hogy az idős szervezet 5,2 éven keresztül való feltöltése szelénnel és nagy dózisú CoQ10-zel a metabolikus memória analógiájára igencsak megtérül.
Megvizsgálva a szívelégtelenségben adott CoQ10 hatékonyságát, két metaanalízis és egy Cochrane-kutatás szerény, de szignifikáns javulást észlelt a CoQ10 plazmaszintekben, bal kamrai ejekciós frakcióban, a perctérfogatban, a NYHA osztályokban és az életminőségben (31–33). A Q-SYMBIO (CoQ10 as adjunctive treatment of chronic heart failure focusing on changes in SYMptoms, BIomarker status, and long-term Outcome) tanulmányt a CoQ10 szívelégtelenségre gyakorolt hatásának tisztázása érdekében szervezték meg (34). A résztvevő 17 központ Dániából, Svédországból, Ausztriából, Szlovákiából, Lengyelországból, Magyarországból, Indiából, Malajziából és Ausztráliából került ki.
Q-SYMBIO-tanulmány
A Q-SYMBIO-tanulmányba csak súlyos, NYHA III. vagy IV. stádiumú szívelégtelenségben szenvedő beteget lehetett bevonni, miután a vizsgálók az érvényben levő szívelégtelenség ajánlásoknak megfelelően a javasolt gyógyszereket bevezették és dózisukat a tolerált maximális szintig feltitrálták. Amennyiben a beteg állapota nem javult, akkor kerülhetett sor a randomizációra. A 420 beválasztott beteg közül véletlenszerűen vagy 3×100 mg CoQ10-et (202 beteg), vagy placebót (218 beteg) kaptak két éven át (35).
A primer végpontot (kórházi felvétel a szívelégtelenség rosszabbodása miatt, szív- és érrendszeri halál, sürgős szívtranszplantáció, vagy mechanikus keringéstámogatás) 29 beteg (14%) érte el a CoQ10 betegcsoportban és 55-en (25%) a placebocsoportban (p=0,003), a kockázatcsökkenés 43% volt. Szignifikáns mértékben, 42%-kal (p=0,035) csökkent az összmortalitás, a CoQ10 csoportban 21 beteg, a placebocsoportban 39 beteg halt meg, valamint 43%-kal a szív-ér rendszeri halálozás (p=0,039). Egy NYHA funkcionális osztály javulása a CoQ10 csoportban 86, a placebocsoportban 68 esetben (p=0,028) volt. A tanulmány során nemkívánatos események előfordulása a következő volt: CoQ10: 26, placebo: 41 (p=0,11). Kritikaként a betegszámot kell megemlíteni, amely elmaradt a nagy szívelégtelenség tanulmányokétól.
Szívelégtelenségben a CoQ10 hatásai korábban elsősorban megfigyeléseken alapultak. A két randomizált CoQ10-tanulmány, a kardiovaszkuláris prevenció vizsgálatára szervezett KiSel-10 és a szívelégtelenség kezelését kiegészítő Q-SYMBIO eredményei egymást támogatják (29, 35). A Q-SYMBIO volt az első nagy dózisú, randomizált, kontrollált CoQ10 morbiditás/mortalitás vizsgálat szívelégtelenségben, eredménye pedig bőven eléri a nagy ACE-gátló/bétareceptor-blokkoló tanulmányokét. A végeredmény magyarázata talán az lehet, hogy mivel a CoQ10 nélkülözhetetlen az ATP termeléséhez és idősebb korban, továbbá szívelégtelenségben a szervezet CoQ10-szintje alacsony, a pótlás csökkentené a szívizomsejt energiaszükséglete és a kínálat közötti különbséget (36, 37). Ehhez járulhat hozzá a CoQ10 antioxidáns hatása, amely a szabad gyökök által okozott szívizomsejt-károsodást mérsékelheti (38). Az eddigi kutatások alapján bizonyítottnak tekinthető, hogy szívelégtelenségben az alacsony CoQ10-nek fontos, a halálozást előjelző szerepe van, hasonlóan a BNP/NT-proBNP-hez (39, 40) (2. ábra).

Koenzim-Q10 alkalmazásával nyert hazai tapasztalatok szívelégtelenségben
Magyarország a nagy kardiovaszkuláris kockázatú európai országok közé tartozik (54). A szívelégtelenség világszerte hozzávetőleg 26 millió embert érint, Európában a prevalencia országonként változóan 1-2% közötti (42). Egy felmérés szerint Magyarországon a XXI. század elején a szívelégtelenség prevalenciája kb. 1,6% (43).
Az Európai Unióban Magyarországon a 100 mg CoQ10 tartalmú Myoqinon®-t gyógyszerként törzskönyvezték a szívelégtelenség kiegészítő kezelésére (alkalmazási előírás Országos Gyógyszerészeti Intézet engedélyszáma: 2513/40/05. Ez azért fontos előrelépés a CoQ10 történetében, mert a gyógyszerekkel szemben támasztott formulázási, farmakokinetikai, farmakodinámiás elvárásoknak nem kell megfelelnie egy táplálékkiegészítő készítménynek. A gyógyszerként törzskönyvezett CoQ10 tartalmú készítmény azonban egyrészt megfelelt ezen követelményeknek, másrészt pedig hatékonyságát randomizált kontrollált tanulmány igazolta (34, 35).
1. eset
A CoQ10 alkalmazásával kapcsolatos első tapasztalatokat a Q-SYMBIO-vizsgálat adta meg. Egy 1936-ban született nőbeteg bevonása 2008-ban történt. A számítógépes archiválás miatt a beteg kórtörténete jól dokumentált. Testmagasság: 156 cm, utolsó testsúly: 48 kg. Anamnézisben 2000-ben szívinfarktus, 2008-ig folyamatosan progrediáló panaszokkal és tünetekkel járó szívelégtelenség, 2008. VI. pitvarfibrilláció, szívelégtelenség (NYHA IV.), gyógyszeres kezelés beállítása, majd 3 hónapon keresztül az alkalmazott kezelés dózisának feltitrálása történt. Így kevés javulás volt csak elérhető, megmaradt a NYHA III-IV. stádium, ezt követően került sor a beválasztásra a Q-SYMBIO-vizsgálatba. A tanulmány lezárása után anyagi megfontolások miatt 2×100 mg CoQ10-et szedett. A beteg gondozása 2017. VI. hónapig folyamatosan történt, az utolsó évben háromszor került sor hospitalizációra súlyos folyadékretenció miatt. Ezek háttere minden esetben a kacs diuretikum dózisának túlzott csökkentése, illetve a fölöslegesen nagy fizikai aktivitás kipróbálása volt. Intravénás furosemid kezelés állapotát mindig rendezte, utolsó hazamenetelkor NYHA stádiuma II-III. volt. Ezután pár hónappal melaena, ileus tünetei között hunyt el.

A beteggondozás során a mindenkori hemodinamikai paramétereknek (szívfrekvencia, önvérnyomásmérés eredménye), életminőségnek (NYHA-besorolás), klinikai tüneteknek (lábszárödéma), laboratóriumi leleteknek (elsősorban a vesefunkcióknak) megfelelően kellett változtatni a kezelést, az alkalmazott gyógyszerek dózisát. A 3. ábra mutatja a beteg lineáris ejekciós frakciójának alakulását. 2 évig erőteljes javulás volt észlehető (37%-ról 56%-ig), ezzel párhuzamosan helyreállt a sinusritmus, majd lassan fokozatosan csökkent a szisztolés funkció a vizsgálatba való beválasztás körüli értékre és később visszaállt a pitvarfibrilláció is. A bal pitvar nagysága 8 éven keresztül változatlan maradt (55 mm), majd fokozatos dilatáció volt megfigyelhető, 75 mm-ig. Kilenc év alatt a szérum kreatinin 98 µmol/l-ről 110 µmol/l-ig romlott. A szérum nátriumszint 138–148 mmol/l, a szérum káliumszint pedig 3,7–5 mmol/l között ingadozott. Az utolsó javasolt kezelés a következő volt: reggel 25 mg spironolacton, 2×2,25 mg ramipril, 1×0,625 mg bisoprolol, 1×80 mg furosemid, másnaponta 50 mg ethacrinsav, 2×600 mg kálium, napi váltásban 1-0,5-1-0,5 mg acenocumarol, 1×100 mg allopurinol, 2×100 mg Koenzim-Q10. 2017-ben derült ki a Q-SYMBIO biztonsági kódja, ennek alapján a beteg a CoQ10 csoportban volt, tehát 2008-tól szedte folyamatosan a nagy dózisú ubikinont. A beteg állapotának kedvező javulása annyira szembeötlő volt, hogy az eset ismertetése még azelőtt megtörtént, hogy a Q-SYMBIO-besorolása ismert lett (44).
A Q-SYMBIO-tanulmány lezárása és az eredmények ismertetése után a szívelégtelenség miatt kezelt betegeknek az ajánlásban javasolt gyógyszeres kezelés beállítását követően, amennyiben nem észlelhető javulás a beteg állapotában, vagy a javulás mértéke csupán olyan kicsi, hogy az nem jelent a beteg számára érdemi életminőség-változást, vagy a kezelés ellenére a beteg állapota romlik, az orvosnak érdemes végiggondolnia alternatív kezelési lehetőségek, így pl. a CoQ10 alkalmazását is. Ezt példázza a 2. eset.
2. eset
Egy 1931-ben született nőbeteg testmagassága: 162 cm, utolsó testsúlya: 58 kg. Anamnézisében a következő szerepel: 1990 óta ismert hipertónia, kb. 2005 óta típusos mellkasi fájdalmak/stabil angina pectoris, amelyet eltitkolt környezete elől, 2007. II. hóban palpitáció-érzés lépett fel, majd III. hóban került sor klinikai felvételére új keletű pitvarfibrilláció, szívelégtelenség (NYHA III/IV.) miatt. Típusos előkészítés után IV. hóban sikeres elektromos kardioverzió történt. A pitvarfibrilláció 2012-ben tért vissza, a gondozás során az interventricularis septum fokozatosan hypoakinetikussá vált, rákérdezésre a beteg anginás panaszokat említett, de a megfelelő felvilágosítás ellenére nem kívánta a koronarográfiát. Végül 2015-ben orthopnoe lépett fel, a lineáris ejekciós frakciója a kezdeti 49%-ról 28%-ra csökkent. Ekkor került sor a CoQ10 bevezetésére. 2017-ig állapota folyamatosan javult, folyadékretencióját kiürítette, ejekciós frakciója 42%-ra javult (4. ábra).
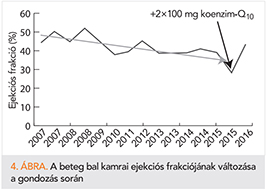
Utolsó kezelés: reggel 1,5 tabletta 2,5 mg-os bisoprolol, reggel 0,625 mg enalapril, 2×12,5 mg spironolacton, reggel 0,125 mg digoxin (minden harmadik nap 0,0625 mg), 2×35 mg trimetazidin retard, másnaponta 20 mg furosemid (túlzott lábszárdagadás esetén +40 mg), napi váltásban 1-1,5-1-1,5 mg acenocumarol, este 20 mg simvastatin, 2×100 mg koenzim-Q10.
A betegben valószínűleg posztinfarktusos remodelling okozta szívelégtelenség észlelhető. 8 éven keresztül tartó kardiológiai gondozás után lépett fel a szívelégtelenség NYHA IV. stádiuma. Végső lehetőségként került sor a CoQ10 alkalmazására, amely mellett elérhető volt az ejekciós frakció javulása és a NYHA II-III. közötti állapot stabilizálása (közlés alatt).
3. eset
Egy 44 éves férfi beteg korábbi anamnézisében említésre méltó betegség nem szerepelt. 2014 szeptemberében banális felső légúti infekció kapcsán lábszárödémát észleltek, amely orális kacsdiuretikum adása mellett megszűnt. Két hónappal később köhögés, fulladás, csökkent terhelhetőség miatt jelentkezett orvosánál, aki dilatált szívet, hydrothoraxot és keskeny QRS-tachycardiát észlelt. Az echokardiográfia csökkent balkamra-funkciót (EF: 32%), dilatált üregeket, jelentős mértékű mitralis és tricuspidalis regurgitációt írt le. A cardiomyopathia etiológiájának tisztázása céljából koronarográfia történt negatív eredménnyel. A súlyosan romló általános állapot miatt felmerült az ICD, sőt a szívtranszplantáció lehetősége is, végül az állapot hátterében elektrofiziológiai vizsgálat során fokális pitvari tachycardia igazolódott, amely gyors és lassú pályán felváltva vezetődött le. A bal pitvari septum anterior részén találták meg a legkorábbi aktivációt, amelyet sikerrel abláltak.
A szívelégtelenségben alkalmazott gyógyszeres kezelés dózisait lépcsőzetesen a tolerált maximumra titrálták, kibocsájtáskor a beteg a következő kezelést kapta: 2×5 mg ramipril, 2×12,5 mg carvedilol, 2×25 mg spironolacton, 2×100 mg CoQ10, 2×100 mg allopurinol, naponta 40 mg furosemid és 600 mg kálium, napi váltásban 5-7,5 mg warfarin.
Egy évvel később az echokardiográfia a szisztolés és diasztolés bal kamrai átmérők csökkenését, a balkamra-funkció jelentős mértékű javulását mutatta (ejekciós frakció 37%-ról 52%-ra nőtt), a mitralis és tricuspidalis regurgitáció mértéke nagymértékben csökkent. A korábban jelentősen emelkedett NT-proBNP-érték normalizálódott (187 pg/ml). A beteg szívelégtelenségének hátterében mindezek alapján tachycardia-indukálta cardiomyopathiát véleményeztek (45).
4. eset
Egy 61 éves nőbeteg anamnézisében hipertónia, 2-es típusú diabetes mellitus, 2009-ben elszenvedett, ST-elevációval nem járó szívinfarktus (NSTEMI) szerepelt. Utóbbi miatt megtörtént a jobb artéria koronária percutan intervenciója is. Két évvel később ismét akut koronária szindróma gyanúja miatt szállították kardiológiai osztályra. Az EKG V1–6 elvezetésekben 2-5 mm-es ST-elevációt ábrázolt. Az echokardiográfia tágabb bal szívfelet (bal kamra végdiasztolés átmérő [DD]: 57 mm, végszisztolés átmérő [DS]: 41 mm], elvékonyodott septumot, aszimmetrikus balkamra-kontrakciót, jelentős mértékben csökkent szisztolés balkamra-funkciót (ejekciós frakció [EF] 28%), anterior fal csúcsi és középső harmadának akinézisét, az anterior fal basalis részének hipokinézisét, valamint az inferior fal hipokinézisét, II-III. fokú mitralis regurgitációt tárt fel. ST-elevációval járó szívinfarktus (STEMI) (anterior, szubakut) gyanú miatt azonnal koronarográfia történt, amelyen a bal elülső leszálló koronária ág (LAD) proximális harmadának trombotikus elzáródása volt látható. A 2009-ben behelyezett RCA-stent jól vezetett. A LAD-ot rekanalizálták, a thrombust eltávolították, majd a proximális harmadba bevonat nélküli fémstentet (BMS) helyeztek. A gyógyszeres kezelés megkezdése és a beteg állapotának stabilizációja után rehabilitációs osztályra helyezték át.
A rehabilitációt követően a beteget három hónap után kontrollvizsgálatra visszarendelték, aki panaszként említette csökkent fizikai terhelhetőségét, fáradékonyságát, effort dyspnoéját. RR: 105/70 Hgmm, szívfrekvencia 72/perc volt. Az echokardiográfia tágabb bal szívfelet, csökkent szisztolés balkamra-funkciót (EF: 39%), akinetikus septumot, inferior hipokinézist, középsúlyos mitralis regurgitációt látott. A kezelést (100 mg acetilszalicilsav, 75 mg clopidogrel, napi 2 mg acenokumarol, 2×10 mg enalapril, reggel 5 mg bisoprolol, napi 20 mg furosemid, napi 12,5 mg chlortalidon – már nem kapható hazánkban –, napi 1200 mg kálium chloratum, 5 mg/24 óra glicerin-trinitrát, este 80 mg atorvastatin, 25 mg eplerenon, 2×40 mg pantoprazol) 100 mg CoQ10 adásával bővítették. Három hónapos kontrollvizsgálata során elmondása szerint a panaszai jelentős mértékben csökkentek, funkcionális besorolása NYHA II-re javult (46).
5. eset
Egy 66 éves férfi beteg 2016-ban felső légúti fertőzést követően jelentkező terheléses nehézlégzés és ödémaképződés miatt került kórházi felvételre. Anamnézisében évtizedek óta fennálló, enyhe-középsúlyos hipertónia szerepelt. 2008-ban szívritmuszavar kapcsán dilatatív cardiomyopathiát (DCM) igazoltak, amely 4:1 arányú pitvarlebegéssel szövődött. Amiodaron kezelés mellett sinusritmusa helyreállt, de ezt követően a beteg nyolc éven át nem jelentkezett ellenőrzésre.
Az aktuális kórházi felvétel alkalmával klinikuma NYHA III. stádiumú szívelégtelenségnek felelt meg. A felvételi EKG 100/perc kamrafrekvenciájú, 2:1 arányú pitvarlebegést regisztrált. A szívultrahang-vizsgálat szerint a bal pitvar 57 mm, a jobb pitvar 61 mm, az ejekciós frakció 13% volt. Emellett kiterjedt falmozgászavarok – anteroseptalis akinezis és inferior hipokinezis – ábrázolódtak. A módosított kezelés a következő lett: 1×100 mg alllopurinol, 1×25 mg metoprolol, 1×200 mg amiodaron, 1×40 mg furosemid, +600 mg kálium, 1×25 mg spironolacton, 1×5 mg ramipril, 1×20 mg atorvastatin, 3×100 mg CoQ10. Az ödéma és a nehézlégzés gyorsan megszűnt, a pitvarlebegés változó átvezetésűvé vált normális kamrafrekvenciával, így végeredményben NYHA II. stádium volt elérhető. A diagnosztikus koronarográfia koszorúér-szűkületet nem mutatott. A pitvarlebegés kardioverziója megtörtént, a beteg sinusritmusa azóta is stabil.
Kontrollvizsgálaton a beteg 3 hónappal később jelentkezett. Ekkori echokardiográfiás leletén a bal pitvar végdiasztolés átmérője 66 mm, a jobb pitvaré 60 mm, a bal kamrai ejekciós frakció 32% volt. Az anteroseptalis akinezis hipokinezissé mérséklődött. A sinusritmus stabilan 50–60/perc, a beteg állapota továbbra is NYHA II. stádiumnak felelt meg (47).
6. eset
Egy 73 éves hipertóniás férfi beteg 2010-ben anterior STEMI-t szenvedett el, ami miatt LAD-stentelés történt. Ennek ellenére iszkémiás cardiomyopathia alakult ki, a szívüregek kitágultak, a szisztolés balkamra-funkció 20%-ra csökkent. 2016-ban került sor a szívelégtelenség okozta panaszok és tünetek miatt rehabilitációs kezelésére. Hatperces járástávolsága ekkor 120 méter volt, lépcsőn járni nem tudott.
Az echokardiográfiás felvétel szerint a bal pitvar 68 mm, a jobb pitvar 64 mm, a bal kamrai ejekciós frakció 15% volt, a laterális fal kivételével hipo- és akinetikus falmozgászavar volt észlelhető. A laborleletek enyhe fokú, de később rendeződő hyponatraemiát (133 mmol/l) és beszűkült vesefunkciót (kreatinin: 138–164 µmol/l) igazoltak.
A beteg felvételkori gyógyszeres kezelése a következőkből állt: 1×100 mg acetilszalicilsav, 1×125 mg furosemid, 1×5 mg bisoprolol, 1×20 mg pantoprazol, 1×20 mg rivaroxaban, 1×600 mg kálium.
Gyógytorna életmódprogramba történt bevonása, a kezelés pedig 1×25 mg spironolactonnal és 3×100 mg CoQ10-zel bővült. Ezt követően már a harmadik napon jelentősen javuló közérzetről számolt be. Három héttel később, a hazabocsátás előtti állapotfelmérésen hatperces járástávolsága 300 méterre emelkedett, és már két emeletet képes volt megtenni. NYHA II. funkcionális állapotban került haza (47).
Következtetések
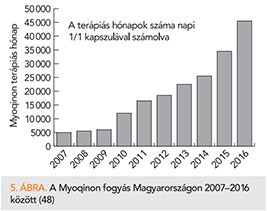
Magyarország részt vett a Q-SYMBIO-tanulmányban és az OGYI vizsgálatban alkalmazott CoQ10 készítményt gyógyszerként regisztrálta. A gyógyszerfelírási szokások módosulása a tanulmány eredményeinek közlése után figyelhető meg (5. ábra). A hazai tapasztalatok szerint a tartós, nagy dózisú CoQ10 megkezdése a guideline-okban előírt kezelés kiegészítésére bármely etiológia esetén szóba jöhet. A klinikai esetismertetések természetesen mindig sok szubjektív tényezővel színezettek, a randomizált Q-SYMBIO-tanulmány betegszáma pedig kicsi. Amennyiben az eddigi eredményeket más, megismételt, vagy nagyobb esetszámú vizsgálatok is alátámasztják, akkor a CoQ10 rendkívül értékes lesz a szívelégtelenség alapkezelésében, az indikáció osztályba sorolását pedig éppen a nagy esetszámú tanulmányok eredménye alapján lehet majd meghatározni.
Irodalom
1. Zhang Y, Aberg F, Appelkvist EL, et al. Uptake of dietary coenzyme Q supplement is limited in rats. J Nutr 1995; 125: 446–53. DOI: https://doi.org/10.1093/jn/125.3.446
2. Barshop BA, Gangoiti JA. Analysis of coenzyme Q in human blood and tissues. Mitochondrion 2007; 7(suppl): S89–S93. DOI: https://doi.org/10.1016/j.mito.2007.04.002
3. Crane FL, Hatefi Y, Lester RL, Widmer C. Isolation of a quinone from beef heart mitochondria. Biochim Biophys Acta 1957; 25: 220–1. DOI: https://doi.org/10.1016/0006-3002(57)90457-2
4. Littaru GP, Ho L, Folkers K. Deficiency of coenzyme Q10 in human heart disease. I. Int J Vitam Nutr Res 1972; 42: 291–305.
5. Mitchell P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature 1961; 191: 144–148. DOI: https://doi.org/10.1038/191144a0
6. Turunen M, Olsson J, Dallner G. Metabolism and function of coenzyme Q. Biochim Biophys Acta 2004; 1660: 171–199. DOI: https://doi.org/10.1016/j.bbamem.2003.11.012
7. Ericsson J, Dallner G. Distribution, biosynthesis, and function of mevalonate pathway lipids. Subcell Biochem 1993; 21: 229–72. DOI: https://doi.org/10.1007/978-1-4615-2912-5_11
8. Sohal RS, Forster MJ. Coenzyme Q, oxidative stress and aging. Mitochondrion 2007; 7(Suppl): S103–11. DOI: https://doi.org/10.1016/j.mito.2007.03.006
9. Bentinger M, Brismar K, Dallner G. The antioxidant role of coenzyme Q. Mitochondrion 2007; 7(Suppl): S41–50. DOI: https://doi.org/10.1016/j.mito.2007.02.006
10. Bello RI, Kagan VE, Tyurin V, et al. Regeneration of lipophilic antioxidants by NAD(P)H:quinone oxidoreductase 1. Protoplasma 2003; 221: 129–35. DOI: https://doi.org/10.1007/s00709-002-0068-x
11. Bindoli A, Valente M, Cavallini L. Inhibition of lipid peroxidation by alpha-tocopherolquinone and alpha-tocopherol-hydroquinone. Biochem Int 1985; 10: 753–61.
12. Söderberg M, Edlund C, Kristensson K, Dallner G. Lipid compositions of different regions of the human brain during aging. J Neurochem 1990; 54: 415–23. DOI: https://doi.org/10.1111/j.1471-4159.1990.tb01889.x
13. Ogasahara S, Engel AG, Frens D, Mack D. Muscle coenzyme Q deficiency in familial mitochondrial encephalomyopathy. Proc Natl Acad Sci U S A. 1989; 86: 2379–82. DOI: https://doi.org/10.1073/pnas.86.7.2379
14. Acosta MJ, Vazquez Fonseca L, Desbats MA, et al. Coenzyme Q biosynthesis in health and disease. Biochim Biophys Acta 2016; 1857: 1079–85. DOI: https://doi.org/10.1016/j.bbabio.2016.03.036
15. Potgieter M, Pretorius E, Pepper MS. Primary and secondary coenzyme Q10 deficiency: the role of therapeutic supplementation. Nutr Rev 2013; 71: 180–188. DOI: https://doi.org/10.1111/nure.12011
16. Quinzii CM, Hirano M. Primary and secondary CoQ(10) deficiencies in humans. Biofactors 2011; 37: 361–365. DOI: https://doi.org/10.1002/biof.155
17. Montini G, Malaventura C, Salviati L. Early coenzyme Q10 supplementation in primary coenzyme Q10 deficiency. N Engl J Med 2008; 358: 2849–2850. DOI: https://doi.org/10.1056/NEJMc0800582
18. Varela-López A, Giampieri F, Battino M, Quiles JL. Coenzyme Q and Its Role in the Dietary Therapy against Aging. Molecules 2016; 21: 373. doi: 10.3390/molecules21030373. DOI: https://doi.org/10.3390/molecules21030373
19. Serebruany VL, Ordonez JV, Herzog WR, et al. Dietary coenzyme Q10 supplementation alters platelet size and inhibits human vitronectin (CD51/CD61) receptor expression. J Cardiovasc Pharmacol 1997; 29: 16–22. DOI: https://doi.org/10.1097/00005344-199701000-00003
20. Jeejeebhoy F, Keith M, Freeman M, Barr A, et al. Nutritional supplementation with MyoVive repletes essential cardiac myocyte nutrients and reduces left ventricular size in patients with left ventricular dysfunction. Am Heart J 2002; 143: 1092–100. DOI: https://doi.org/10.1067/mhj.2002.121927
21. Bhagavan HN, Chopra RK. Coenzyme Q10: absorption, tissue uptake, metabolism and pharmacokinetics. Free Radic Res 2006; 40: 445–53. DOI: https://doi.org/10.1080/10715760600617843
22. Hosoe K, Kitano M, Kishida H, et al. Study on safety and bioavailability of ubiquinol (Kaneka QH) after single and 4-week multiple oral administration to healthy volunteers. Regul Toxicol Pharmacol 2007; 47: 19–28. DOI: https://doi.org/10.1016/j.yrtph.2006.07.001
23. Langsjoen PH, Langsjoen AM. The clinical use of HMG CoA-reductase inhibitors and the associated depletion of coenzyme Q10. A review of animal and human publications. Biofactors 2003; 18: 101–111. DOI: https://doi.org/10.1002/biof.5520180212
24. Rosenfeldt FL, Haas SJ, Krum H, et al. Coenzyme Q10 in the treatment of hypertension: a meta-analysis of the clinical trials. J Hum Hypertens 2007; 21: 297–306. DOI: https://doi.org/10.1038/sj.jhh.1002138
25. Ho MJ, Bellusci A, Wright JM. Blood pressure lowering efficacy of coenzyme Q10 for primary hypertension. Cochrane Database Syst Rev 2009 Oct 7; (4): CD007435. DOI: https://doi.org/10.1002/14651858.CD007435.pub2
26. Ho MJ, Li EC, Wright JM. Blood pressure lowering efficacy of coenzyme Q10 for primary hypertension. Cochrane Database Syst Rev 2016 Mar 3; 3: CD007435. doi: https://doi.org/10.1002/14651858.CD007435.pub3
27. Banach M, Serban C, Sahebkar A, et al. Lipid and Blood Pressure Meta-analysis Collaboration Group. Effects of coenzyme Q10 on statin-induced myopathy: a meta-analysis of randomized controlled trials. Mayo Clin Proc 2015; 90: 24–34. DOI: https://doi.org/10.1016/j.mayocp.2014.08.021
28. McMurray JJ, Dunselman P, Wedel H, et al. CORONA Study Group: Coenzyme Q10, rosuvastatin, and clinical outcomes in heart failure: a pre-specified substudy of CORONA (controlled rosuvastatin multinational study in heart failure). J Am Coll Cardiol 2010; 56: 1196–1204. DOI: https://doi.org/10.1016/j.jacc.2010.02.075
29. Alehagen U, Johansson P, Björnstedt M, et al. Cardiovascular mortality and N-terminal-proBNP reduced after combined selenium and coenzyme Q10 supplementation: a 5-year prospective randomized double-blind placebo-controlled trial among elderly Swedish citizens. Int J Cardiol 2013; 167: 1860–6. DOI: https://doi.org/10.1016/j.ijcard.2012.04.156
30. Alehagen U, Aaseth J, Johansson P. Reduced Cardiovascular Mortality 10 Years after Supplementation with Selenium and Coenzyme Q10 for Four Years: Follow-Up Results of a Prospective Randomized Double-Blind Placebo-Controlled Trial in Elderly Citizens. PLoS One. 2015 Dec 1; 10(12): e0141641. DOI: https://doi.org/10.1371/journal.pone.0141641
31. Sander S, Coleman CI, Patel AA, et al. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J Card Fail 2006; 12: 464–72. DOI: https://doi.org/10.1016/j.cardfail.2006.03.007
32. Fotino AD, Thompson-Paul AM, Bazzano LA. Effect of coenzyme Q10 supplementation on heart failure: a meta-analysis. Am J Clin Nutr 2013; 97: 268–275. DOI: https://doi.org/10.3945/ajcn.112.040741
33. Madmani ME, Yusuf Solaiman A, Tamr Agha K, et al. Coenzyme Q10 for heart failure. Cochrane Database Syst Rev 2014 Jun 2; 6: CD008684. DOI: https://doi.org/10.1002/14651858.CD008684.pub2
34. Mortensen SA. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end-points of “Q-symbio” – a multinational trial. Biofactors 2003; 18: 79–89.
35. Mortensen SA, Rosenfeldt F, Kumar A, et al. Q-SYMBIO Study Investigators: The effect of coenzyme Q10 on morbidity and mortality in chronic heart failure: results from Q-SYMBIO: a randomized double-blind trial. JACC Heart Fail 2014; 2: 641–649. DOI: https://doi.org/10.1016/j.jchf.2014.06.008
36. Folkers K, Vadhanavikit S, Mortensen SA. Biochemical rationale and myocardial tissue data on the effective therapy of cardiomyopathy with coenzyme Q10. Proc Natl Acad Sci U S A. 1985; 82: 901–4.
37. Singh RB, Wander GS, Rastogi A, et al. Randomized, double-blind placebo-controlled trial of coenzyme Q10 in patients with acute myocardial infarction. Cardiovasc Drugs Ther 1998; 12: 347–353. DOI: https://doi.org/10.1023/A:1007764616025
38. Seneş M, Erbay AR, Yilmaz FM, et al. Coenzyme Q10 and high-sensitivity C-reactive protein in ischemic and idiopathic dilated cardiomyopathy. Clin Chem Lab Med 2008; 46: 382–386. DOI: https://doi.org/10.1515/CCLM.2008.061
39. Sander S, Coleman CI, Patel AA, et al. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J Card Fail 2006; 12: 464–72. DOI: https://doi.org/10.1016/j.cardfail.2006.03.007
40. Molyneux SL, Florkowski CM, George PM, et al. Coenzyme Q10: an independent predictor of mortality in chronic heart failure. J Am Coll Cardiol 2008; 52: 1435–1441. DOI: https://doi.org/10.1016/j.jacc.2008.07.044
41. McMurray JJ, Packer M, Desai AS, et al. PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004. DOI: https://doi.org/10.1056/NEJMoa1409077
42. https://www.escardio.org/static_file/Escardio/Web/Congresses/Slides/Heart failure 2015/1183 (letöltve 2017. V. 16.)
43. Tomcsányi J, Tóth E. Szívelégtelenség epidemiológiája és terápiája Magyarországon a XXI. század elején Cardiologia Hungarica 2012; 42: 155–162.
44. Nagy V. Súlyos szívelégtelenségben tartós Koenzim-Q10 kezelés szükséges. Cardiologia Hungarica 2011; 41(supplementum K): K21–22.
45. Borbély A, Clemens M, Jenei Cs, et al. Szívtranszplantáció vagy abláció? Tachycardia-indukálta cardiomyopathia. Cardiologia Hungarica 2017; 47: 125–131. DOI: https://doi.org/10.26430/CHUNGARICA.2017.47.2.125
46. Kohut L. A koenzim-Q10-zel szerzett tapasztalatok szívelégtelenségben LAM 2011; 21: 553–557
47. Mohay S, Eke N, Andrássy G. A Koenzim-Q10 kedvező hatásai klinikai gyakorlati tapasztalatok alapján – esetismertetések. In Nagyvizit a kardiológián 2–4. ed. Lipták J. Budapest: Professional Publishing Hungary Kft.; 2017.
48. OEP adatbázis 2017.