Patients with chronic thromboembolic pulmonary hypertension: a long term follow-up study
█ Original article
DOI: 10.26430/CHUNGARICA.2019.49.5.338
Authors:
Mladoniczky Sára1, Balla Patrícia1, Szegedi Margit1, Takács Edit1, Piróth Zsolt1, Németh József1, Ablonczy László2, Temesvári András1, Andréka Péter1, Bálint Olga Hajnalka1
Gottsegen György Országos Kardiológiai Intézet,
1Felnőtt Kardiológiai Osztály,
2Gyermekszív Központ, Budapest
Summary
Background: Chronic thromboembolic pulmonary hypertension (CTEPH) is a thrombotic pulmonary disease associated with pulmonary vasculopathy. Pulmonary endarterectomy (surgery, PEA) is the first choice of treatment in CTEPH. Specific PAH medication is required when there is a contraindication for surgery or residual pulmonary hypertension (rPH) occurs. In the presence of PAH balloon pulmonary angioplasty (BPA) may also be recommended.
Objective: We investigated the long term outcome of our CTEPH patients.
Methods: CTEPH patients from our institution were retrospectively analyzed (data between 2003 and 2018). Baseline (clinical and right heart catheterization values), treatment and outcome data were documented. We compared outcome and mortality data in patients with and without surgery (PEA vs. non-PEA group). The clinical outcome was compared based on the following data analysis: NYHA class, 6 minutes walking distance (6MWD) and NT-proBNP.
Results: Of 29 CTEPH patients (mean age: 62±19 years, 52% male) 16 (55%) were proved to be eligible for PEA, but only 13 of them had a long term follow-up post-surgery (n=3 perioperative death). 54% of the PEA patients fully recovered (n=7) and 46% (n=6) required specific PAH treatment in the postoperative period (n=1, in combination with BPA) due to rPH. In all patients from the non-PEA group (n=13) specific PAH treatment (n=2 in combination with BPA) was initiated. Patients from PEA and non-PEA group did not differ hemodynamically. In PEA group NYHA class and NT-proBNP (p<0,001, and p=0,046), and in non-PEA group NYHA class and 6MWD (p=0,012, and 0,006) showed significant improvement at the late follow-up. We found significant difference in survival at 1, 3 and 5 year follow-up, for PEA group 100-100-100% and non-PEA group 100-85-78% (p=0,013), respectively.
Conclusions: 55% of CTEPH patients were suitable for PEA. 54% of patients who survived the surgery fully recovered, and the remaining required PAH specific therapy for rPH and had a good long term outcome. Non-PEA patients improved functionally on the long term, but had worse survival rate.
ISSUE: CARDIOLOGIA HUNGARICA | 2019 | VOLUME 49, ISSUE 5
Összefoglalás
Háttér: A krónikus tromboembóliás pulmonalis hipertónia (CTEPH) pulmonalis artériás trombózishoz társuló vaszkuláris betegség. Az elsődlegesen választandó kezelés a pulmonalis thrombendarterectomia (PEA), de ha ez kontraindikált vagy opus után reziduális pulmonalis hipertónia (rPH) marad fenn, gyógyszeres kezelést alkalmazunk, illetve lehetőség szerint ballonos pulmonalis artériás angioplasztikát (BPA) végzünk.
Cél: Az általunk kezelt CTEPH-betegek hosszú távú kimenetelét megvizsgálni.
Módszer: Intézetünkben 2003 és 2018 között diagnosztizált és kezelt betegek adatait vizsgáltuk retrospektiven. Elemeztük a diagnóziskor dokumentált klinikai és jobbszívfél-katéterezéshez köthető adatokat, a kezeléseket és a kimenetelt. Összehasonlítottuk a kimenetelt és a mortalitást annak függvényében, hogy a betegnek volt vagy nem műtéte (PEA vs. nem-PEA-csoport). A hosszú távú követés eredményeit a következő paraméterek alapján vizsgáltuk: NYHA-stádium, 6 perces járástávolság (6MWD) és NT-proBNP-szint.
Eredmények: A 29 CTEPH-betegből (átlagéletkor 62±19 év, 52% férfi) 16 (55%) volt PEA-ra alkalmas, közülük 13 beteget követtünk hosszú távon (n=3 periop exit). A PEA-betegek 54%-a (n=7) meggyógyult, a többi 6 beteg posztoperatív időszakban specifikus PAH-kezelésben (n=1, BPA-val kombinálva) részesült rPH miatt. A nem-PEA-csoport mind a 13 betege specifikus PAH gyógyszeres kezelést kapott (n=1, BPA-val kombinálva). A két csoport tagjainak kiindulási hemodinamikai paraméterei nem különböztek. Hosszú távon szignifikáns javulás volt a PEA-csoportban a NYHA-stádium és az NT-proBNP (p <0,001, és p=0,046), a nem-PEA-csoportban pedig a NYHA és a 6MWD (p=0,012 és 0,006) tekintetében. Az 1, 3, 5 éves túlélés (Kaplan–Meier-analízis) a PEA-csoportban 100-100-100% vs. a nem-PEA-csoportban 100-85-78% volt (p=0,013).
Következtetések: Az intézetünkben diagnosztizált betegek 55%-a alkalmasnak bizonyult PEA-ra. Sikeres PEA esetén 54%-uk meggyógyult, a többi specifikus PAH-kezelésre szorult rPH miatt és a hosszú távú kimenetelük kedvező volt. A nem műthető, csak gyógyszeresen kezelt CTEPH-betegek funkcionális állapota is szignifikánsan javult, de eredményeink alapján rosszabb a túlélésük.
Bevezetés
A krónikus tromboembóliás pulmonalis hipertónia (chronic thromboembolic pulmonary hypertension, CTEPH) egy, a pulmonalis artériás trombózishoz társuló vaszkuláris betegség (1), amelyben az obliteratív nagyérbetegség és a perifériás vasculopathia (kisérbetegség) változó mértékű előfordulását látjuk (2). A CTEPH meghatározó prognosztikai tényezője a kisérbetegség jelenléte, amely esetén patomechanizmusában és kórlefolyásában inkább az idiopátiás PAH-ra hasonlít (PH-klasszifikáció 4-es vs. 1-es csoportja) (3).
A vénás eredetű tromboembólus a pulmonalis artériás érrendszerben (pulmonalis embólia) általában 1 hónap alatt feloldódik, de amennyiben ez a folyamat inkomplett (befolyásoló tényezők: infekció, inflammáció, immunitás, genetika), az elasztikus artériában fibrotikus stenosisok, okklúziók alakulnak ki. Hipo-, illetve hiperperfundált területek jönnek létre, amire az artériák nyomásemelkedéssel, érfali feszülés okozta vazomediátor-aktiválással válaszolnak. A disztális érrendszerben (artériák, arteriolák) endothel-diszfunkció, vaszkuláris remodelling, és extrém esetben plexiform léziók képződnek (PAH-ra utaló eltérés) (2).
Az irodalmi adatok alapján a CTEPH incidenciája pulmonalis embólián (PE) átesett panaszos betegnél igen változó (0,4–8,8%) (4). Viszont a diagnosztizált CTEPH-ás betegeknél már jelentős a PE (74,8%), illetve a mélyvénás trombózis (MVT) (56,1%) előfordulása (5). A CTEPH gyakoriságának elemzésében fontos annak felismerése, hogy nem ritkán az akut PE esemény hátterében már ott van a krónikus tromboembóliás betegség (4).
A CTEPH felismerését megnehezíti, hogy a kezdeti tünetei atípusosak (effort dyspnoe, beszűkült terhelhetőség, mellkasi panasz). A betegség progressziója esetén jelennek meg a jobbszívfél-elégtelenség tünetei (pl. lábszárödéma) is. Nőket és férfiakat egyaránt érinthet. Az MVT rizikófaktorai (antitrombin, protein-S és -C hiány, Faktor V Leiden-mutáció) nem jellemzőek CTEPH-ra. A CTEPH rizikófaktorai között viszont a következők szerepelnek: antifoszfolipid-szindróma, emelkedett FVIII szint, nem „0-ás” vércsoport, myeloproliferatív megbetegedések, szubsztituált hypothyreosis, krónikus gyulladásos bélbetegség, krónikus osteomyelitis, ventriculo-atrialis sönt, fertőzött pacemaker, malignus tumor vagy splenectomia utáni állapot (2, 6).
A pulmonalis hipertónia folyamatos jobb kamrai terhelést jelent, amely kezelés nélkül súlyos, magas mortalitással járó szívelégtelenséghez vezethet. A diagnózistól számított első 5 évben kezelés nélkül a mortalitás akár az 50%-ot is eléri.
Az élethosszig tartó antikoaguláció mellett, elsődlegesen választandó kezelés a pulmonalis thrombendarterectomia (PEA), mivel igen alacsony a 30 napos mortalitás és jelentősen javul a betegek funkcionális állapota műtét után (2). Ennek ellenére a betegek több mint fele nem kerül műtétre, mivel disztális a trombotikus lézió (technikailag nem alkalmas PEA-ra), vagy olyan komorbiditásaik vannak, hogy elfogadhatatlan a műtéti kockázat (7). Továbbá számolni kell a PEA utáni perzisztáló vagy visszatérő (reziduális) pulmonalis hipertóniával (rPH), amely az európai centrumok legutóbbi beszámolója szerint 16,7% (7). Habár a PAH és a CTEPH a PH klasszifikációjában külön csoportot képviselnek (3), a krónikus tromboembóliás betegséghez társuló PH kialakulásában számos, az idiopátiás PAH-hoz hasonló vaszkuláris mechanizmus játszik szerepet. Ezek magyarázzák az azonos gyógyszeres kezelés hatékonyságát ebben a csoportban is. A CTEPH-betegek kezelésére törzskönyvezett PAH specifikus gyógyszer a riociguat (Rio), míg az endothelin-receptor-antagonisták (ERA), a foszfodiészteráz-5 inhibitorok (PDE-5i) és a prosztaciklinek off-label alkalmazott szerek. A gyógyszeres kezelés rPH-ban, illetve nem műthető CTEPH-ban engedélyezett (1). A nem műthető CTEPH-ra az utóbbi 15 évben egyre hatékonyabbnak bizonyul a pulmonalis ballonos angioplasztikával való kezelés (BPA) is. Az intervenció technikája mára kiforrott (ld. Japán munkacsoportok szerepe) (8), az eredmények egyre biztatóbbak (PAH megszűnése) és a szövődmények egyre kisebb arányban fordulnak elő (reperfúziós szövődmények <5%).
Célkitűzés
Az általunk kezelt CTEPH-betegek hosszú távú kimenetelét megvizsgálni, összehasonlítani a PEA, illetve nem-PEA csoport túlélését.
Betegek és módszerek
A 2003 januárja óta a Gottsegen György Országos Kardiológiai Intézetben gondozott CTEPH-betegek adatait dolgoztuk fel. Összesen 29 CTEPH-beteg került a vizsgálatba. Minden betegnél V/Q-scan és mellkas CT-angiográfia alapján igazoltuk a krónikus tromboembóliás betegséget, illetve jobbszívfél-katéterezéssel a PH-t [kritériumok: közép pulmonalis artériás nyomás (mPAP) >25 Hgmm, pulmonalis kapilláris wedge nyomás (PWC) <15 Hgmm, illetve pulmonalis vaszkuláris rezisztencia (PVR) >3 Wood egység)]. A diagnózis felállítása előtt minimum 3 hónapig a betegek terápiás szinten antikoagulálva voltak. Minden esetben történt sebészeti konzílium PEA irányában. A sebészeti konzílium és a beavatkozás Bécsben történt (Allgemeines Krankenhaus der Stadt Wien). A PEA-ra nem elfogadott betegek (disztális trombózis, súlyos komorbiditások) specifikus PAH gyógyszeres kezelésben részesültek. Ugyancsak gyógyszeres kezelés indult akkor is, ha a betegeknél rPH-t találtunk műtét után. PH esetén, amennyiben lehetőség volt rá (2017 óta), ballonos perkután angioplasztikával (BPA) egészítettük ki a gyógyszeres kezelést, amelyre ugyancsak Bécsben került sor. Reziduális PH fennállása vagy nem műtött betegek esetén 3 havonta történt követés, ilyenkor NYHA funkcionális állapotfelmérés, 6 perces járástávolság, NT-proBNP-mérés és echokardiográfia történt.
A betegeket két csoportra osztottuk, „PEA-csoport”-ra és „nem-PEA-csoport”-ra, annak függvényében, hogy átestek-e műtéten. Dokumentáltuk a demográfiai adatokat (nem és életkor), az előzményeiket, a jobbszívfél-katéterezéssel mért kiindulási hemodinamikai paramétereket (mPAP, PVR, CO). PEA-műtét után echokardiográfiai kritérium alapján döntöttünk a rPH fennállásáról (tricuspidalis regurgitáció sebessége >3,4 m/s; 2015-ös ESC/ERS PAH guideline kritériuma) (1); ha nem volt rPH „gyógyultnak” tekintettük a beteget. Kis esetszámban (5/13) állt rendelkezésünkre közvetlen műtét utáni vagy későbbi, egy éves jobbszívfél-katéterezés eredmény, így a hemodinamikai kritériumokat nem tudtuk használni a „gyógyult” állapot meghatározására.
A minimum egyéves követésben részesülő betegek követési paramétereit hasonlítottuk össze, alap vs. 1 év vs. utolsó követés. A vizsgált paraméterek az alábbiak voltak: NYHA-osztály, 6 perces járástávolság és szérum NT-proBNP.
Statisztikai analízis
Csoportok összehasonlítására végzett statisztikai számítások során kétmintás t-próbát, nem normáleloszlás esetén Mann–Whitney U-tesztet használtunk. A folytonos változókat átlag±szórás formában tüntettük fel. A p <0,05 értéket tekintettük szignifikánsnak. A túlélés vizsgálatához Kaplan–Meier-analízist alkalmaztunk. A statisztikai elemzéshez az IBM® SPSS® Statistics program 22-ik verzióját használtuk.
Eredmények
A 29 CTEPH-val diagnosztizált beteg átlagéletkora 62±17 (28–92) év volt. A nemek közel egyenlő arányban oszlottak el (15 férfi vs. 14 nő, 52% vs. 48%). A betegek 76%-a (n=22) esett át pulmonalis embólián és/vagy mély vénás trombózison. Öt beteg esetében tudunk rosszindulatú daganatos megbetegedésről, 1-1 betegnél hypothyreosis, illetve Leiden-mutáció volt ismert. A betegek 55%-át (n=16) fogadták el a sebészeti konzílium alapján PEA-műtétre, közülük 2 beteg preoperatívan, 1 beteg 24 órával a műtét után hunyt el (ez utóbbi rekurrens pulmonális embóliában). A vizsgálat alapját a PEA-csoportban a megmaradt 13 követett beteg képezi. A betegek 45%-ánál (n=13) a konzílium alapján elutasították a PEA-műtétet (nem-PEA-csoport), disztális thrombus (n=5), illetve komorbiditások (n=8) miatt.
Az 1. ábra mutatja a PEA- és a nem-PEA-csoportok kimenetelét.

A két csoport alapparaméterei az 1. táblázatban láthatóak. A csoportok között nem találtunk szignifikáns különbséget az átlagéletkor, a nemek és a tromboembóliás előzmények arányában. Hasonló volt a kiindulási NYHA-stádium is, de 6 perces járás távolságban szignifikánsan jobban teljesítettek a műtétre elfogadott betegek (p <0,05). A nem-PEA-sok rosszabb teljesítményét magyarázhatja a 61%-os komorbiditás arány. Az átlag kiindulási hemodinamikai paraméterek is hasonlóak voltak a két csoportban.

Specifikus gyógyszeres kezelésben összesen 18 beteg (13 nem-PEA-s és 6 rPH-s) részesült, 11 monoterápiában (Rio vagy PDE-5i vagy ERAs) és 7 kombinált kezelésben (ERA+PDE-5i, ERA+Rio, ERA+PC).
Egyéves és hosszú távú követés eredményei
A követés eredményeit a 2. táblázatban láthatjuk.
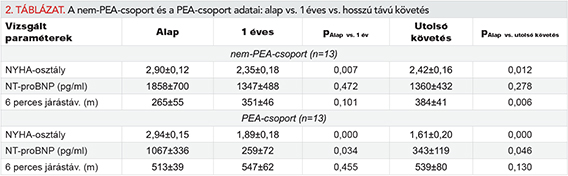
Egy év után a PEA-csoport betegeinek 54%-a (n=7) gyógyult. A többi beteg rPH miatt specifikus kezelést igényelt, ezek közül egy beteg elutasította a kezelést. Egy műtött és gyógyszeresen kezelt betegnél korai állapotromlást észleltünk, emiatt BPA-ra is sor került. A PEA-s betegek hosszú távú követése átlagosan 59±15 hónap volt. Posztoperatív időszakban a NYHA-stádium és az NT-proBNP tartósan (1 éves, illetve utolsó felmérés) szignifikáns javulást mutatott. A 6 perces járástávolság átlag alapértékben a normáltartományba esett, így ez a követés során már nem mutatott további növekedést.
A nem-PEA-csoportban minden beteg specifikus PAH-kezelésben részesült. A nem-PEA-csoportban a betegeket átlag 35±9 hónapig követtük. Egy évvel a kezelés elkezdésétől szignifikáns NYHA funkcionális állapotjavulást lehetett látni, amely perzisztált évekkel később is, sőt az utolsó követésnél a 6 perces járástávolságban is kimutatható volt a szignifikáns javulás.
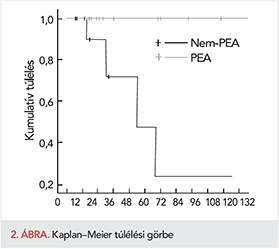
A betegek hosszú távú túlélése a 2. ábrán látható. A PEA-n átesett betegek közül senkit sem veszítettünk el a perioperatív időszakon túl. Ezzel szemben a nem-PEA-csoport betegeinek 78%-a (n=9) volt csak életben a hosszú távú követési időszak végén. Az egyik haláleset kardiorespiratórikus leállás (asystolia) miatt történt kórházi kezelés alatt (a reanimáció sikertelen volt). A másik 3 esetben ismeretlen a halál oka. A két csoport túlélése közötti különbség szignifikáns (p=0,013). Az 1, 3, 5 éves követésnél a túlélés a PEA-csoportban 100%-100%-100%, illetve a nem-PEA-csoportban 100%-85%-78% volt.
Megbeszélés
A CTEPH-ás összpopulációnk 55%-a volt alkalmas PEA-ra. Sikeres műtét után a betegek 54%-a gyógyult, a többi pedig gyógyszeres kezelést igényelt rPH miatt. A követés során jelentősen javult a funkcionális állapot mindkét csoportban, de csak a PEA csoportban javult az NT-proBNP is. Szignifikáns mortalitáskülönbség volt a hosszú távú követésnél a két csoport között, a PEA előnyére.
A saját populációnkban minden esetben ismert volt a PE, amely igen magas arányt jelent az irodalomhoz képest (75%) (3). Eseteinknél kevés más CTEPH-ra hajlamosító tényező lett dokumentálva, a leggyakrabban a malignus tumor vagy myelodysplasiás szindróma volt jelen (5/29).
A CTEPH gyakran későn kerül felismerésre, és a PH-hoz köthető folyamatos jobb kamrai terhelés magas mortalitással járó szívelégtelenséghez vezethet. A saját tapasztalatunk is azt mutatja, hogy a műtét előtt elveszített betegek (n=2), már NYHA IV. stádiumban lettek diagnosztizálva és nem kapták meg műtét előtt azt az intenzív ellátást, amelyre manapság már esély van; 2010 óta nem veszítettünk el kezeletlen beteget.
A műthetőség aránya a saját populációnkban magas volt (55%), például a spanyol PAH-regiszterben a betegeknek csak 31,2%-a volt alkalmas PEA-ra, de ez az arány náluk is nőtt, ha tercier centrumban döntöttek a kezelésről (47,9%) (9). CTEPH-ban az inoperábilitás egyik oka a komorbiditás, amely a CTEPH-betegek magas átlagéletkorából adódhat 62±17 (a legidősebb 92) év. A CTEPH-ás populáció átlagban a legidősebb a kezelt PAH-os csoportokat nézve. A spanyol regiszterben is 63,7 (a legidősebb 73) év volt (9). Azonban az inoperabilitás fő oka a disztális típusú trombotikus lézió (esetek 38,5%-a). Ebben az esetben technikailag kivitelezhetetlen a PEA.
Ha a trombózis szubszegmentális, BPA jöhet szóba, ha pedig disztális, specifikus PAH gyógyszeres kezelés. A kockázat/haszon arányt mérlegelve a betegek, amennyiben operábilisak, hosszú távon mindenképpen a PEA-val járnak a legjobban. A PEA esélyt ad a teljes gyógyulásra, amely felbecsülhetetlen javulást hozhat az életminőségükben. Vizsgálatunkban a PEA-ra került betegek 54%-a gyógyult meg, mely elmaradt a Nemzetközi CTEPH Regiszter 65%-os arányától (10). A gyógyult betegek csak antikoaguláns terápiára szorulnak a posztoperatív időszakban. A műtét után rPH igazolódott a betegek 46%-ánál, ez egy igen magas arány, ha megnézzük az európai centrumok adatközléséből született 16,7%-os arányt (10). Esetükben specifikus gyógyszeres kezelés jön szóba, mivel ennek hatására stabilizálódik az állapotuk (funkcionális stádium, NT-proBNP). Vizsgálatunkban is azt találtuk, hogy az NT-proBNP-szint változatlanul alacsony volt ebben a csoportban. Ez azért biztató, mert az NT-proBNP a jobb kamra javulását, illetve a jobb pitvar tartós tehermentesítését jelzi, mely végeredményben jelentősen befolyásolja a mortalitást (11). Badagliacca munkacsoportja egyre több adattal szolgál, azt bizonyítva, hogy a jobb kamra „gyógyulása” PAH-ban egyértelmű mortalitást javító tényező, és ezt célként kellene kitűzni, amikor PAH-os beteget kezelünk. Lang és munkatársai vizsgálata szerint a PEA perioperatív mortalitása 2% és 5% között változik (2). Saját betegeink között egy esetben volt posztoperatívan korai re-trombózis, amely halállal végződött (6,25%). A betegeink többségében viszont a halálozás hátterében kritikusan magas PVR-hez (12 WE feletti értékek) köthető jobbkamra-diszfunkció, jobbszívfél-elégtelenség áll.
A nem-PEA-csoportban senki nem gyógyult meg. A mortalitás egy évvel a kezelés elkezdése után kezdett emelkedni, 5 évnél már 22% volt. A specifikus PAH-kezeléssel elértük, hogy hosszú távon a betegek funkcionális állapota tartósan javuljon, de azt nem, hogy az NT-proBNP is szignifikánsan csökkenjen. Ha a BNP és a jobbkamra-funkció javulásának összefüggéseit irodalmi adatokkal (ezt nem vizsgáltuk) értelmezzük (11), akkor valószínűleg magyarázatot kaphatunk a rosszabb túlélési mutatókra ebben a csoportban.
A nagy központok eredményei egyértelműen kimutatták, hogy hosszú távon (5 éves adatok) a gyógyszeres kezelés mellett a legjobb túlélést a PEA és a BPA kezelésekkel érhetjük el (76%, illetve 84% és 87%)(12). Azonban nem mindegy, mikor történtek a szűrések, illetve a kezelések, hiszen ebben a vizsgálatban kimutatták, hogy az utóbbi évtizedben a jó betegszelekcióval (a léziónak megfelelő kezelés: PEA vagy BPA, illetve disztális trombózis esetén prostacyclinnel kombinált gyógyszeres terápia) a három különböző kezelési mód 5 éves túlélésben már nem tér el egymástól szignifikánsan. Ez utóbbit támasztja alá Lang és munkatársai randomizált vizsgálata is, mely kimutatta, hogy a nem műthető betegeknél treprostinil kezelés mellett igen jó túlélést lehet elérni (13). A mi betegeinknél csak két esetben használtunk prostacyclint, egy reziduális PH és egy nem műtött betegnél. A nem-PEA-csoportunk mortalitását az alacsony prostacyclin kezelési arány mellett valószínűleg a betegszelekció időpontja is befolyásolta, hiszen sok beteg akkor került a vizsgálatba, amikor a BPA még nem volt elérhető, így szűkebb kezelési lehetőségek álltak rendelkezésünkre. Emiatt, olyan esetben, ahol a gyógyszeres kezelés mellett a terápiás célokat nem érjük el, manapság már BPA irányába értékeljük újra a betegeket.
Limitációk
Vizsgálatunk fő limitáló tényezője az alacsony betegszám. Továbbá a hemodinamikai vizsgálatok ismétlésének az elmaradása, a korai és a hosszú távú követés során.
Következtetések
Összefoglalva, a saját betegpopulációnkban az operábilitás mértéke hasonló az irodalmi adatokkal, de az rPH igen magas arányban fordul elő. Fontos hangsúlyozni, hogy ennek ellenére a PEA az első választandó kezelési mód CTEPH-ben, hiszen rPH esetében is gyógyszeres kezeléssel 100%-os 5 éves túlélést találtunk. A nem műthető betegek gyógyszeres kezeléseinek eredményei elmaradnak a várttól, magasabb a mortalitás, esetükben a jövőben valószínűleg jelentős szerepet fog játszani a BPA-val való kiegészítés.
Irodalom
1. Galie N, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016; 37(1): 67–119. DOI: https://doi.org/10.1093/eurheartj/ehv317
2. Lang IM, Madani M. Update on chronic thromboembolic pulmonary hypertension. Circulation 2014; 130(6): 508–18. DOI: https://doi.org/10.1161/CIRCULATIONAHA.114.009309
3. Simonneau G, et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2013; 62(25 Suppl): D34–41. DOI: https://doi.org/10.1016/j.jacc.2013.10.029
4. Gopalan D, Delcroix M, Held M. Diagnosis of chronic thromboembolic pulmonary hypertension. Eur Respir Rev 2017; 26(143). DOI: https://doi.org/10.1183/16000617.0108-2016
5. Gall H, et al. An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan. Eur Respir Rev 2017; 26(143). DOI: https://doi.org/10.1183/16000617.0121-2016
6. 2019 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. European Heart Journal 2019. DOI: doi/10.1093/eurheartj/ehz405
7. Pepke-Zaba J, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation 2011; 124(18): 1973–81. DOI: https://doi.org/10.1161/CIRCULATIONAHA.110.015008
8. Mizoguchi H, et al. Refined balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv 2012; 5(6): 748–55.
9. Escribano-Subias P, et al. Management and outcomes in chronic thromboembolic pulmonary hypertension: From expert centers to a nationwide perspective. Int J Cardiol 2016; 203: 938–44. DOI: https://doi.org/10.1016/j.ijcard.2015.11.039
10. Jenkins D, et al. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension. Eur Respir Rev 2017; 26(143). DOI: https://doi.org/10.1183/16000617.0111-2016
11. Badagliacca R, et al. Echocardiography Combined With Cardiopulmonary Exercise Testing for the Prediction of Outcome in Idiopathic Pulmonary Arterial Hypertension. Chest 2016; 150(6): 1313–1322. DOI: https://doi.org/10.1016/j.chest.2016.07.036
12. Miwa H, et al. Long-Term Outcome of Chronic Thromboembolic Pulmonary Hypertension at a Single Japanese Pulmonary Endarterectomy Center. Circ J 2018; 82(5): 1428–1436. DOI: https://doi.org/10.1253/circj.CJ-17-1242
13. Sadushi-Kolici R, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial. Lancet Respir Med 2018. DOI: https://doi.org/10.1016/S2213-2600(18)30367-9