Chronic Thromboembolic Pulmonary Hypertension
█ Review
Authors:
Németh Nóra, Varga Albert
Szegedi Tudományegyetem, Általános Orvostudományi Kar, Családorvosi Intézet
Summary
Chronic thromboembolic pulmonary hypertension is a rare complication of pulmonary embolism. The condition is caused by incomplete resolution of the thrombotic material. The fibrotically organised thrombus not only leads to mechanical obstruction in the pulmonary vasculature, but also microvascular remodelling and vasoconstriction occurs. This, in turn, leads to a rise in pulmonary vascular resistance and pulmonary artery pressure. CTEPH markedly harms quality of life and leads to significant mortality. However, this is the only cause of pulmonary hypertension which is curable without lung transplant. Our article summarises steps of diagnostic workup and treatment options for operable and non-operable CTEPH.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, Supplement B
Összefoglalás
A krónikus tromboembóliás pulmonalis hipertónia az akut tüdőembólia ritka szövődménye. A tüdő artériáiban lévő thrombus szervül, ezáltal a mechanikus obstrukció fennmarad, ráadásul kisérbetegség és pulmonalis vazokonstrikció jön létre. Mindezek következtében a pulmonalis vaszkuláris rezisztencia, majd nyomás megemelkedik. A betegség jelentősen rontja az életminőséget, és jelentős morbiditás és mortalitás forrása. Azonban, egyedül a pulmonalis hipertónia okai közül, tüdőtranszplantáció nélkül is gyógyítható lehet. Cikkünk összefoglalja a betegség diagnosztikáját és a kezelés invazív és noninvazív lehetőségeit.
Bevezetés
A krónikus tromboembóliás pulmonalis hipertónia (Chronic Thromboembolic Pulmonary Hypertension, CTEPH) a pulmonalis embólia egy ritka szövődménye. A pulmonalis embólia lezajlása után, megfelelő antikoagulálás mellett, 3-6 hónappal az esemény után rendszerint feloldódik a vérrög. Ritkán, az irodalmi adatok alapján az esetek 0,1-9,1%-ában, a thrombus szervül (1, 2), ezért változatos kórélettani folyamatokon keresztül megnő a pulmonalis vaszkuláris rezisztencia, majd a kisvérköri nyomás is. A betegség gyakorisága 0,9-3,2 eset/év/1 millió lakos (3), tehát hazánkban kevesebb mint 50 esetre kell számítani évente. Az állapot a ritkasága miatt nem igazán van a köztudatban, ráadásul aspecifikus tünetei miatt eleve nehezen diagnosztizálható. Ennek következtében, mind a diagnózis, mind a kezelés gyakran késik. Irodalmi adatok alapján több mint egy év (medián 14,1 hónap) telik el (3) a tünetek jelentkezésétől a diagnózisig. A medián életkor 63 év, és nincs a nemek között eltérés (3).
Patomechanizmus
Többféle mechanizmust feltételeznek a CTEPH kialakulásában; úgymint a tüdő ereiben kialakult mechanikus obstrukció, vazokonstrikció és kisérbetegség.
A mechanikus obstrukciót a thrombus szervülése okozza. Ennek hátterében részben ineffektív fibrinolízis állhat. Az abnormális Aα Thr312Ala fibrinogén például gyakrabban fordul elő ilyen betegeknél (4). Ebből a molekulából olyan fibrin képződik, amelyben nagyszámú keresztkötés alakul ki az alfa-láncok között; így ellenállóbb a fibrinolízissel szemben. Egyéb thrombophiliákat, pl. lupus antikoaguláns, antifoszfolipid és antikardilopin antitestek jelenlétét is a hajlamosító tényezők között tartjuk számon (3). Ugyancsak elősegíti a thrombus szervülését a krónikus infekció és gyulladás. Az infekciós eredetre utal, hogy CTEPH betegekből eltávolított thrombusokból sok fehérvérsejtet és Staphylococcus-DNS-t mutattak ki (5), illetve a betegek vérükben emelkedett CRP-, interleukin-6-szintet találtak (6). A krónikus infekció rágcsáló modellekben csökkent makrofágaktivitáshoz vezetett, ami szintén hátráltatja a thrombus lebomlását (7, 8).
Mindezek mellett fontos szerepet játszik a mikrovaszkuláris remodelling és a vazokonstrikció is (9). Az embólia által közvetlenül nem érintett erekben kompenzatorikusan megnő az áramlás. A hiperdinamikus keringés miatt ezeken a területeken az érfalra megnövekedett nyíróerő hat, amely az endothel sérülését okozza. Ez a későbbiekben endothelproliferációhoz és patológiás vazokonstrikcióhoz vezet. Ebben a folyamatban főképp a 0,1-0,5 mm-es erek érintettek. A folyamattal kapcsolatba hozzák az interferon gamma indukálta protein 10 és az endothelin emelkedett szintjét is (10).
A betegség egyik legfontosabb következménye, hogy a kisvérkör emelkedett nyomása miatt megnő a jobb kamrai afterload. Emiatt először úgynevezett adaptív hipertrófia alakul ki: megnő a falvastagság, ezáltal (a Laplace-törvénynek megfelelően) csökken a falfeszülés. Amennyiben a folyamat progrediál, úgynevezett maladaptív hipertrófia jelentkezik: a jobbkamra kitágul, miokardiális fibrózis alakul ki, kontraktilitása pedig csökken. Ez jobb kamrai elégtelenséghez vezet. Később aztán csökken a szisztémás perfúzió, amitől viszont a jobb kamra vérellátása is romlik, ami tovább rontja a pumpafunkciót, míg végül súlyos szívelégtelenség alakul ki, amelynek a prognózisa rossz (11).
Hajlamosító tényezők
A thrombus tulajdonságaihoz köthető rizikófaktorok
Gyakoribb a CTEPH visszatérő tüdőembólia, nagy kezdeti thrombustömeg, nem provokált tüdőembólia, és fiatal életkor esetén, illetve ha magas a pulmonalis nyomás az akut szakban (12, 3).
Thrombophilia és gyulladásos típusú rizikó faktorok
Rizikót jelentenek az emelkedett VIII-as faktor, Von Willebrand-faktor, és plazminogén aktivátor inhibitor proteinszintek; az abnormális fibrinogén szerkezet, illetve különféle autoantitestek, mint antifoszfolipid- és antikardilopin-antitestek vagy lupus antikoaguláns jelenléte, továbbá a 0-tól eltérő vércsoport, és az emelkedett lipoprotein A szint is (12, 3).
Szisztémás betegség típusú rizikófaktorok
Hajlamosít, ha a beteg lépeltávolításxon esett át, pajzsmirigy-alulműködése van, vagy bármely krónikus gyulladással járó betegségben szenved, daganatos beteg, vagy pedig beültetett eszköze van: pl. hidrokefalusz kezelésére szolgáló ventrikulo-atriális sönt, centrális vénás kanül vagy pacemaker, különösképpen, ha ez az eszköz fertőzött (12, 3).
Diagnosztikus kritériumok
Szükséges bizonyítani a pulmonalis hipertónia fennállását és annak prekapilláris eredetét. Ezt akkor mondhatjuk ki, ha a jobb szívfél katéterezése során a pulmonalis artériás középnyomás (mean PAP) ≥25 Hgmm, és a pulmonalis kapilláris éknyomás (PCWP) ≤15 Hgmm (13).
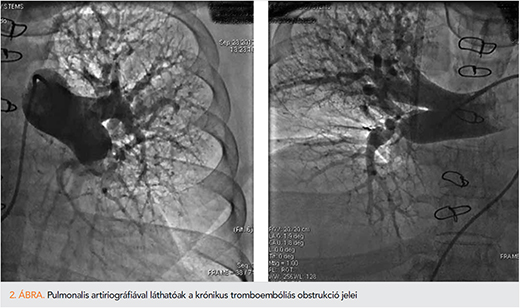
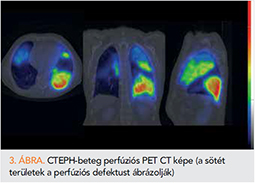
Emellett szükséges bizonyítani a tromboembóliás betegség meglétét: ventilációs-perfúziós tüdőszcintigráfiával kimutathatjuk a perfúziós kiesés meglétét, illetve a CTEPH-re specifikus radiológiai eltérések kimutathatóak valamely anatómiai képalkotó segítségével (13).
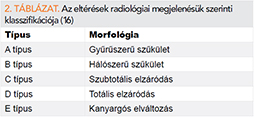
Klasszifikáció
Kaliforniai Egyetem San Diegó-i
Munkacsoport (1., 2. táblázat)

A kivizsgálás menete
A pulmonalis embólia után tünetmentesen gyógyult egyének rutinszerű szűrése nem javasolt (17). Azonban ha a gyógyulási időszak után terhelési dyspnoe jelentkezik, a kivizsgálást feltétlenül szükségesnek tartjuk. Irodalmi adatok alapján általában több mint egy év (medián 14,1 hónap) (3) telik el a tünetek jelentkezésétől a diagnózisig. Fontos figyelembe venni, hogy a CTEPH-hel diagnosztizált betegeknek csak 74,8%-ánál volt ismert (6) tüdőembólia az anamnézisben; tehát az anamnesztikus PE hiánya nem zárja ki a CTEPH lehetőségét. A CTEPH diagnózisának felállítása előtt feltétlenül szükséges 3 hónapnyi terápiás antikoagulálás, így a szubakut pulmonalis embóliát ki tudjuk zárni (13).

A javasolt kivizsgálási algoritmus (1. ábra) (17): habár a tünetek kezdetben jellegtelenek, mégis pont a részletes anamnézis és alapos fizikális vizsgálat adhat segítséget, ha gondolunk a betegségre.
A CTEPH-betegek általában terhelésre jelentkező légszomjjal, terhelési intoleranciával, fáradékonysággal, anginával fordulnak orvoshoz, illetve késői stádiumban előfordul még nagyvérköri ödémaképződés és eszméletvesztés is a tünetek között (18, 19).
Fizikális vizsgálattal a pulmonalis hipertónia fizikális jeleit és a jobbszívfél-elégtelenség tüneteit figyeljük (18, 19).
Minden esetben szükséges a mellkasröntgen, amelyen egyrészt gyanítható lehet a pulmonalis vaszkuláris betegség – úgymint érmentes tüdőterületek, aszimmetrikusan tágult artériapulmonalisok –, illetve a pulmonalis hipertónia röntgenjelei, a truncus pulmonalis tágulata, jobb pitvar vagy kamra megnagyobbodása. Azonban ezek az eltérések messze nem elég specifikusak a diagnózishoz (19).
Légzésfunkciós vizsgálat elvégzése szükséges. Egyrészt hasznos differenciáldiagnosztikai célból, a dyspnoés panaszokat magyarázó egyéb állapot kizárására. Másrészt típusos a betegségre a normál áramlások és volumenek mellett jelenlévő, csökkent CO-diffúziós kapacitás (DLCO). Esetleg jelen lehet enyhe restriktív mintázat is a tüdőparenchima hegesedése miatt. A pulmonalis hipertóniákra általánosan jellemző a hiperventiláció és az ineffektív ventiláció együttese alacsony PCO2-szinttel, ez CTEPH-ben még kifejezettebb lehet (19, 20).
EKG-n a jobbszívfél-terhelés jelei – P pulmonale, jobbszár-blokk, negatív T hullámok a mellkasi elvezetésekben, jobbra deviáló R tengely (1) – láthatóak. A negatív EKG azonban nem zárja ki a pulmonalis hipertónia jelenlétét (19).
Az echokardiográfia szerepe alapvető, általában ez a vizsgálat veti fel a betegség gyanúját. A módszerrel becsülhető a jobb kamrai szisztolés nyomás, emellett látszhatnak a pulmonalis hipertónia indirekt jelei, mint jobb kamrai és pitvari tágulat, csökkent jobb kamrai kontraktilitás, abnormális flow minta a jobb kamrai kifolyótraktusban, illetve elemezhető az intraventricularis septum mozgása is. Emellett a szív egyéb hasonló tünetekkel járó betegségei is kizárhatók, pl. billentyűelváltozások vagy a bal szívfél betegségei. Korai stádiumban ezek az eltérések hiányozhatnak. A nyugalmi echokardiográfia a pulmonalis hipertóniák 10-31%-ában negatív és csak terhelés során látszanak a patológiás elváltozások (18).
Cardiopulmonalis terheléses vizsgálat segíthet felderíteni azon eseteket, amikor a hemodinamikai paraméterek nyugalomban még normálisak, azonban a betegség fennáll (18, 21).
A ventilációs-perfúziós szcintigráfia (V/Q scan): pozitív esetben normális ventiláció mellett ék alakú perfúziós defektus látható. A negatív lelet csaknem 100% eséllyel kizárja a betegséget, míg a pozitív lelet további kivizsgálást igényel (18, 19, 23).
Anatómiai képalkotó módszer a CTEPH-re típusos elváltozások leírásában mindenképpen javasolt. A gold standard a direkt pulmonalis angiográfia, ehhez hasonlítunk minden egyéb módszert. Alkalmas a krónikus tromboembólia kimutatására, a szubszegmentális ágakban is, az elváltozások helyének feltérképezésére, megfelelő módszer az operabilitás eldöntésére, és segít a műtét tervezésében. Emellett bizonyos egyéb betegségek kizárására is hasznos, pl. pulmonalis vénák szűkületét vagy malformációját is kimutathatja.
Pulmonalis CT angiográfia megfelelően detektálja a rekanalizált vagy szervült thrombust, a bronchialis rendszer felől kialakult kollaterálisokat és mozaikszerű perfúziós mintázatot. Előnye, hogy a módszer alkalmas arra, hogy kizárja a hasonló tünetekkel járó parenchymás tüdőbetegségeket, illetve a mediastimum betegségeit. Segíthet differenciálni a tüdőerek betegségeit is, pl. a tüdőerek szarkómája, pulmonalis venookluzív betegség elkülöníthető vele a CTEPH-től. Hátránya, hogy nem annyira szenzitív a szegmentális és szubszegmentális ágak vizsgálatában (3, 12, 19).
Az MR angiográfia előnye, hogy a CT-vel ellentétben nem jár ionizáló sugárzással, viszont ugyanazon elváltozások differenciáldiagnózisára alkalmas. Hátránya, hogy időigényes, nehezebb a megszervezése, és leletezése nagyobb gyakorlatot igényel (3, 12, 19).
Az MECT (Multi energy CT) technikák több forrásból származó és/vagy különböző energiájú röntgensugarak felhasználásával készít képet. A technika előnye, hogy azt is nagyon hatékonyan megmondja, milyen elemek vannak jelen. Így aztán tud olyan képet előállítani, ami vagy csak az illető anyag-előfordulását mutatja (pl. hol van a jód, tehát hova jutott el a kontrasztanyag), vagy el tud távolítani egy elemet a képről (pl. a kalciumot). Ezáltal sokkal pontosabban képes megmutatni, milyen szövetek vannak jelen. CTEPH-ben ezáltal pontosabb, de nem jár sokkal nagyobb sugárterheléssel, mint a hagyományos CT angiográfia (3).
3D V/Q SPECT
Jobb szenzitivitása és specificitása van, mint a hagyományos ventilációs-perfúziós szcintigráfiának, mivel a különböző síkokban történő képalkotás kikerüli azt a hibát, amikor a kétdimenziós képeken a normális részek elfedik a defektust (23).
Kezelési lehetőségek
Minden beteget élethosszig kell antikoagulálni. Ez egyrészt megakadályozza az in situ thrombus képződését, másrészt a rekurráló pulmonalis embóliát (13, 18, 24). A K-vitamin-antagonisták alkalmazása javasolt, bár a korai eredmények biztatónak tűnnek az új típusú antikoagulánsokkal (25).
Operábilis betegség (Pulmonális Endarterektómia)
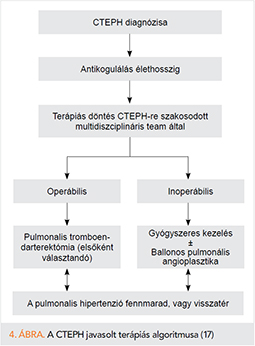
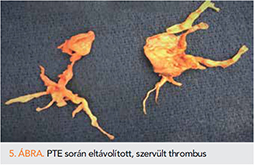
A kórkép jelenleg egyetlen ismert potenciálisan kuratív kezelési módja a műtét. A pulmonalis trombendarterektómia (PE) alkalmas arra, hogy eltávolítsa a szervült thrombustömeget, ezáltal visszaállítsa a tüdő normális vérellátását, továbbá csökkentse vagy megszüntesse a ventilációs perfúziós „mismatch”-et (4. ábra) (17).
Indikáció
Minden operábilis és vállalható rizikójú esetet meg kell operálni (17). Hagyományosan a műtét akkor volt indikált, ha a pulmonalis artéria középnyomása (mPAP) nagyobb, mint 30 Hgmm, és a pulmonalis vaszkuláris rezisztencia (PVR) nagyobb, mint 300 dyn/s/cm5, valamint a beteg funkcionális stádiuma NYHA III-IV volt. Napjainkban, a nagyobb gyakorlatnak és jobb műtéti eredményeknek köszönhetően, az indikáció köre kibővült: bizonyos centrumokban akkor is elvégzik a műtétet, ha a beteg funkcionálisan jobb állapotban van, vagy ha csak terhelésre alakul ki magas pulmonalis nyomás (3). A lézió lokalizációját tekintve minél disztálisabb a betegség, technikailag annál nehezebb a műtéti megoldás. Hagyományosan a szegmentális ágak elzáródásáig alkalmas a páciens a műtéti megoldásra. Tapasztalt, nagy esetszámmal rendelkező centrumokban a szubszegmentális ágakban elhelyezkedő trombotikus anyag eltávolítására is képesek. Centrumtól függően a betegek 60-80%-át ítélik operábilisnak. Számos tényező ugyan nem kontraindikációja a beavatkozásnak, de meglétük előre jelezheti a rosszabb kimenetelt, vagy a műtét magasabb rizikóját. Ilyen, ha előrehaladott a betegség: nagyon magas a preoperatív PVR (>1200 dyn/s/cm5), vagy ha a műtét után nem csökken legalább a felével, ha súlyos kisérbetegség van jelen, vagy ha súlyos jobbszívfél-elégtelenség alakult ki (3, 12, 19).
A műtét technikája
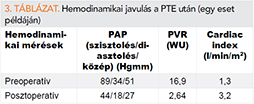
A műtétet a Kaliforniai Egyetemen fejlesztették ki. Median sternotomiát használnak a pulmonalis erek megközelítésére. Ez leginkább azért előnyös, mert ezáltal elkerülhető a pleura leválasztása, amelyben CTEPH-betegeknél vérzékeny kollaterálisok lehetnek. A műtétet extracorporalis keringés mellett végzik mély hipotermiában (Deep Hypothermic Circulatory Arrest, DHCA; a beteg testét 18-20 °C-ra hűtik (ez 30-75 percig tart a beteg testméretétől függően). A szívet és a fejet egy speciális eszközzel még ennél is jobban lehűtik, ezután megállítják a keringést. A keringésmegállást 20 percig tartják fenn, ezalatt a sebésznek el kell végeznie egyik oldalon az endarterektómiát. Az ér belsejének leválasztása az intima-media határán történik. Proximálisan kezdik el, és úgy haladnak disztál felé, egyenként a lobaris, szegmentális és szubszegmentális ágakra. A műtét egyik technikai kihívása a helyes disszekciós mélység megválasztása. (Ha túl felszínes, nem sikerül megfelelő mennyiségű trombotikus anyagot eltávolítani, és nem éri el célját a műtét. Ha túl mély, perforálódik az ér, és a beteg elvérezhet.) Amikor az egyik oldalon végeztek, újraindítják a keringést, és bezárják az eret, majd a hűtést és a keringésmegállítást megismétlik, és a másik oldalt is megoperálják. Ezt követően 75-120 perc alatt visszamelegítik a beteget. Ha szükség van más szívsebészeti beavatkozásra, azt ebben a fázisban végzik el. Ezután a beteg keringését újraindítják és bezárják a mellkast. A hemodinamikai javulás általában azonnal észlelhető. A posztoperatív szak hasonló, mint más szívsebészeti beavatkozásoknál. Eltérés, hogy enyhe hipotenzió megengedhető, illetve a lélegeztetésnél alacsony nyomásokra (Peak inspiratory pressure >30 vízcm) és magas perctérfogatra van szükség (12, 26).
Komplikációk is nagyrészt a szívműtéteknél szokásosak: stroke, vérzés, fertőzés, atelektázia, aritmia, perikardiális és pleurális folyadékgyülem, delírium. Emellett erre a műtétre jellemző szövődmény az esetek kb. 10%-ában előforduló reperfúziós tüdőödéma. Ez az állapot 72 órán belül jelentkező, súlyos hipoxiával jár, a mellkasröntgenen pedig fokális infiltrációk látszanak. Kialakulásában a reperfúzió okozta károsodások és az ennek következtében kialakult, fokozott érpermeabilitás áll. Eredmények: a 30 napos mortalitás 5% alatti a legtapasztaltabb, nagy esetszámmal dolgozó centrumokban (12, 26, 27).
Inoperábilis betegség
Pulmonalis ballon-angioplasztika
(Balloon Pulmonary Angioplasty, BPA)
Indikáció
A katéteres beavatkozás szóba jön, ha a betegség technikailag inoperábilis, ha a műtét kockázat-haszon aránya nem vállalható, vagy ha a PE nem hozta meg a várt eredményt. Ezenkívül egyes esetekben áthidaló terápiaként a műtét előtt nagyon gyenge állapotú betegeknél (12, 28).
A beavatkozás kivitelezése
A pulmonalis érrendszerben az áramlást limitáló eltéréseket ballonnal tágítják, így az ellátott tüdőterület vérellátása javul. Fontos eltérés a hasonló perkután vaszkuláris beavatkozáshoz képest, hogy itt általában egyetlen érterület kezelésétől nem, csak több terület kezelésétől együttesen várható eredmény. Egy alkalommal azonos tüdőben lévő 1-2 lebenyt kezelnek, és általában 4-6 ülés szükséges, amelyek között centrumtól függően 3-7 nap szünetet tartanak. Az aktuális célterületet a V/Q szcintigráfián látható legnagyobb kiesés alapján határozzák meg. Az egy ülésben elvégezhető tágítások számát korlátozza a sugárterhelés (max. 2 gray) és a kontrasztanyag mennyisége (400 ml) (12, 28).
Komplikációk
A leggyakoribb a reperfúziós tüdőödéma, amely 53-60%-ban előfordulhat. Gyakoribb, ha súlyos pulmonalis hipertenzió van jelen, ha első beavatkozásról van szó, ha nagy átmérőjű ágat nyitottak meg, illetve ha magas a BNP-szint, vagy fejletlen a bronchialis ágrendszer.
A másik nem ritka súlyos szövődmény a 0-7%-ban előforduló érsérülés/perforáció.
A kisebb ballonok használata, a többlépcsős beavatkozások bevezetése, az intravaszkuláris képalkotó technikák és nyomásmérés használata és a nagyobb tapasztalat mind csökkentette a szövődmények számát (12, 28).
Eredmények
A beavatkozás körüli mortalitás 0-10% között alakul az irodalmi adatok alapján. Az 1 éves túlélés 96,8%, a 3 éves pedig 94,5%. A BPA bizonyítottan javítja a pulmonalis perfúziót, a terhelhetőséget, a WHO-osztályt, a 6 perces séta teszt eredményét, és csökkenti a pulmonalis nyomást, a pulmonalis vaszkuláris rezisztenciát és a jobbkamra-terhelést (12, 28).
Gyógyszeres kezelés
A pulmonalis trombendarterektómia és ballon-angioplasztika képes a CTEPH mechanikus, fixált komponensének kezelésére. A tüdő kisereit sokféle gyógyszer célozza meg. Bár ezeket, a pulmonalis hipertóniára szabadalmaztatott szereket off-label (kivéve riociguat) sok helyen alkalmazzák CTEPH-ben, sajnos kevés tudományos bizonyíték áll rendelkezésre a hatásosságukról. A következő hatástani csoportok jönnek szóba (29):
Nirogén-oxid- (NO-) rendszeren ható szerek
A NO erős endogén vazodilatátor molekula, amelyet szintén az endothel termel. A NO aktiválja a szolubilis guanil-ciklázt, amely ciklikus GMP-t képez, ami végül az intracelluláris kalciumszint csökkenéséhez, ezáltal relaxációhoz vezet a simaizmokban. Emellett thrombocytaagregációt és simaizom-proliferációt gátló hatása is van (30).
A riociguat egy szolubilis guanil-cikláz stimulálószer, amely indirekt módon növeli az enzim érzékenységét a nitrogén-oxidra, ezáltal serkenti a cGMP képződését. A CHEST-1-vizsgálat alapján hemodinamikai és funkcionális javulást ért el inoperábilis CTEPH-es betegekben (24), amely a CHEST-2-vizsgálat alapján 2 év után is fennmaradt. Jelenleg a riociguat az egyetlen, ebben az indikációban jóváhagyott gyógyszer (31).
A foszfodiészteráz-5-gátlók (PDE-5-gátlók), például a szildenafil, a cGMP lebomlását akadályozzák meg. CTEPH-betegek körében nagyon kevés adat áll rendelkezésre a hatásosságáról (32).
Endothelinreceptor-antagonisták (ERA)
Az endothelin-1 egy erős vazokonstriktor, amelyet az endothelium termel, és az erek simaizmának proliferációjához vezet, amelynek fontos szerepe van a kisérbetegség kialakulásában. Az endothelinreceptor-blokkolók éppen ezt a hatást akadályozzák meg. CTEPH-ben a cikk írásáig a macitentan és a bosentan hatóanyagokat is vizsgálták. A szerek hemodinamikai javulást hoztak a MERIT- (33) és a BENEFiT- (34) vizsgálatok szerint, de tartósan nem javították a terhelhetőséget. A bosentant eredményesen használták áthidaló terápiának a műtét előtt (35).
Prosztaciklinek
A prosztaciklineket az endothelsejtek termelik. Potens vazodilatátor molekulák, amelyek gátolják a thrombocytaaggregációt, és a simaizom-proliferációt is. Az intravénás prosztaciklin hatékonynak tűnt a közvetlen posztoperatív szakban.
A szubkután treprostinil a CTREPH-vizsgálat alapján javítja a hemodinamikai paramétereket, és a terhelhetőséget is (36).
Fontos megjegyezni azonban, hogy a pulmonalis hipertónia gyógyszeres kezelése csak a tüneteket, nem pedig a túlélést javítja, tehát nem késleltetheti a műtétet operábilis betegek esetén (29).
Emellett természetesen a szupportív terápia mint antikoaguláns-kezelés, diuretikumok, oxigénterápia is szükségesek a szívelégtelenség és a hipoxia tüneti kezelésére (29).
Kardiális rehabilitáció
A gondos rehabilitáció műtét vagy katéteres tágítás után javítja a csúcs-oxigénfelvételt, az elért maximális terhelési szintet és a szubjektív életminőséget (37).
Prognózis
Habár a CTEPH a pulmonalis hipertónia egyetlen gyógyítható formája, adekvát kezelés nélkül a kilátások igen borúsak. Az 5 éves túlélés kezelés nélkül mindössze 30% az olyan betegeknél, akiknél a pulmonalis artériás középnyomás (mPAP) >40 Hgmm, és alig 10%, ha az mPAP >50 Hgmm (29). Ezzel szemben pulmonalis trombendarterektómiát követően az 5 éves túlélés 90% körüli (26, 29). Míg az inoperábilis csoportban megfelelő kezelés mellett 70% körül van (26, 29).
Összefoglalás
Az elmúlt évtizedben jelentős előrelépés történt a CTEPH diagnosztikája és kezelése tekintetében. Új noninvazív módszerek lassan utolérik a direkt angiográfia hatékonyságát a betegség súlyosságának vizsgálatában és a kezelés tervezésében. Kezelés szempontjából továbbra is a pulmonalis trombendarterektómia az egyetlen bizonyítottan kuratív módszer. A sebészeti technika fejlődése egyrészt jelentősen javította a rövid és hosszú távú túlélést, másrészt lehetővé teszi egyre disztálisabb betegség gyógyítását, ezáltal kitágította az indikáció körét. A növekvő tapasztalat biztonságosabbá és hatékonyabbá tette a pulmonalis ballon-angioplasztikát is. Indikációja egyelőre csak az inoperábilis betegségben van, de felmerül, hogy a továbbiakban lesz olyan, egyébként operábilis betegcsoport, amelynek ez a megoldás előnyösebb lesz, mint a műtét. Azzal, hogy a riociguat hazánkban is elérhető, és az endothelinreceptor-antagonistákkal készült vizsgálatok biztató eredményeket hoztak, a terápiás repertoár tovább bővült.
Irodalom
1. Marti D, G.V., Escobar C, et al. Incidence of symptomatic and asymptomatic chronic thromboembolic pulmonary hypertension. Arch Bronconeumol, 2010.
2. Gall, H., et al. An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan. Eur Respir Rev, 2017. 26(143).
3. Ranka, S., et al. Chronic Thromboembolic Pulmonary Hypertension-Management Strategies and Outcomes. J Cardiothorac Vasc Anesth, 2019.
4. Carter, A.M., et al. Alpha-fibrinogen Thr312Ala polymorphism and venous thromboembolism. Blood, 2000; 96(3): 1177–9.
5. Bonderman, D., et al. Role for staphylococci in misguided thrombus resolution of chronic thromboembolic pulmonary hypertension. Arterioscler Thromb Vasc Biol, 2008; 28(4): 678–84.
6. Pepke-Zaba, J., et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation, 2011; 124(18): 1973–81.
7. Fedullo, P., et al. Chronic thromboembolic pulmonary hypertension. Am J Respir Crit Care Med, 2011; 183(12): 1605–13.
8. Lang, I.M., P. Dorfmuller, and A. Vonk Noordegraaf, The Pathobiology of Chronic Thromboembolic Pulmonary Hypertension. Ann Am Thorac Soc, 2016; 13(Suppl 3): S215–21.
9. Alias, S., et al. Defective angiogenesis delays thrombus resolution: a potential pathogenetic mechanism underlying chronic thromboembolic pulmonary hypertension. Arterioscler Thromb Vasc Biol, 2014; 34(4): 810–819.
10. Quarck, R., et al. Contribution of inflammation and impaired angiogenesis to the pathobiology of chronic thromboembolic pulmonary hypertension. Eur Respir J, 2015; 46(2): 431–43.
11. Vonk Noordegraaf, A., et al. Pathophysiology of the right ventricle and of the pulmonary circulation in pulmonary hypertension: an update. Eur Respir J, 2019; 53(1).
12. Mahmud, E., et al. Chronic Thromboembolic Pulmonary Hypertension: Evolving Therapeutic Approaches for Operable and Inoperable Disease. J Am Coll Cardiol, 2018; 71(21): 2468–2486.
13. Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European
14. Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J, 2016; 37(1): 67–119.
15. Madani M, et al. Pulmonary endarterectomy. Patient selection, technical challenges, and outcomes. Ann Am Thorac Soc 2016; 13(Suppl. 3): S240–S247
16. Kawakami, T., et al. Novel Angiographic Classification of Each Vascular Lesion in Chronic Thromboembolic Pulmonary Hypertension Based on Selective Angiogram and Results of Balloon Pulmonary Angioplasty. Circ Cardiovasc Interv, 2016; 9(10).
17. Pepke-Zaba, J., M.M. Hoeper, and M. Humbert, Chronic thromboembolic pulmonary hypertension: advances from bench to patient management. Eur Respir J, 2013; 41(1): 8–9.
18. Wilkens, H., et al. Chronic thromboembolic pulmonary hypertension (CTEPH): Updated Recommendations from the Cologne Consensus Conference 2018. Int J Cardiol, 2018; 272S: 69–78.
19. Kim, N.H., et al. Chronic thromboembolic pulmonary hypertension. Eur Respir J, 2019; 53(1).
20. McCabe, C., et al. Inefficient exercise gas exchange identifies pulmonary hypertension in chronic thromboembolic obstruction following pulmonary embolism. Thromb Res, 2013; 132(6): 659–65.
21. Held, M., et al. Cardiopulmonary exercise testing to detect chronic thromboembolic pulmonary hypertension in patients with normal echocardiography. Respiration, 2014. 87(5): p. 379-87.
22. Tunariu, N., et al. Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension. J Nucl Med, 2007; 48(5): 680–4.
23. Gutte, H., et al. [Combined ventilation/perfusion SPECT/CT is best for diagnosing pulmonary embolism]. Ugeskr Laeger, 2012; 174(6): 334–6.
24. Ridker, P.M., et al. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism. N Engl J Med, 2003; 348(15): 1425–34.
25. Gavilanes-Oleas, F.A., et al. Use of direct oral anticoagulants for chronic thromboembolic pulmonary hypertension. Clinics (Sao Paulo), 2018; 73: e216.
26. Jenkins, D., et al. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension. Eur Respir Rev, 2017; 26(143).
27. Taboada, D., et al. Outcome of pulmonary endarterectomy in symptomatic chronic thromboembolic disease. Eur Respir J, 2014; 44(6): 1635–45.
28. Mahmud, E., et al. Balloon Pulmonary Angioplasty for Chronic Thromboembolic Pulmonary Hypertension. Interv Cardiol Clin, 2018; 7(1): 103–117.
29. Pepke-Zaba, J., H.A. Ghofrani, M.M. Hoeper. Medical management of chronic thromboembolic pulmonary hypertension. Eur Respir Rev, 2017; 26(143).
30. inh NO
31. Kim, N.H., et al. Haemodynamic effects of riociguat in inoperable/recurrent chronic thromboembolic pulmonary hypertension. Heart, 2017; 103(8): 599–606.
32. Suntharalingam, J., et al. Long-term use of sildenafil in inoperable chronic thromboembolic pulmonary hypertension. Chest, 2008; 134(2): 229–236.
33. Ghofrani, H.A., et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study. Lancet Respir Med, 2017; 5(10): 785–794.
34. Jais, X., et al. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension: BENEFiT (Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension), a randomized, placebo-controlled trial. J Am Coll Cardiol, 2008; 52(25): 21–27.
35. Reesink, H.J., et al. Bosentan as a bridge to pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension. J Thorac Cardiovasc Surg, 2010; 139(1): 85–91.
36. Sadushi-Kolici, R., et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial. Lancet Respir Med, 2019; 7(3): 239–248.
37. Fukui, S., et al. Efficacy of cardiac rehabilitation after balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension. Heart, 2016; 102(17): 1403–9.
38. Sugimura, K., et al. Percutaneous transluminal pulmonary angioplasty markedly improves pulmonary hemodynamics and long-term prognosis in patients with chronic thromboembolic pulmonary hypertension. Circ J, 2012; 76(2): 485–8.