Recommendations for the diagnosis and treatment of chronic heart failure according to the new ESC guideline published in 2021.
█ Review
DOI: 10.26430/CHUNGARICA.2022.52.2.112
Authors:
Majoros Zsuzsanna, Kiss Róbert Gábor, Pál Tamás
Magyar Honvédség Egészségügyi Központ – Honvédkórház, Kardiológiai Osztály, Budapest
Levelezési cím:
E-mail: robertgaborkiss@gmail.com
Summary
The European Society of Cardiology published its new guideline on the diagnosis and treatment of acute and chronic heart failure (HF) in 2021 (1). In the following, we will summarise the main messages of the new recommendation on the terminology, diagnostic criteria, drug and device based treatment of chronic heart failure, with particular reference to the changes and novelties compared to the previous guideline (2).
ISSUE: CARDIOLOGIA HUNGARICA | 2022 | VOLUME 52, ISSUE 2
Összefoglalás
Az Európai Kardiológus Társaság 2021-ben publikálta új irányelvét az akut és krónikus szívelégtelenség (heart failure – HF) diagnosztikájával és kezelésével kapcsolatban (1). Az alábbiakban igyekszünk összefoglalni az új ajánlás krónikus szívelégtelenség terminológiájára, diagnosztikus kritériumaira, gyógyszeres és eszközös kezelésére vonatkozó legfontosabb üzeneteit, különös tekintettel az előző irányelvhez (2) képest megjelenő változásokra, újdonságokra.
A szívelégtelenség definíciója, típusai (1. táblázat)

A szívelégtelenség egy jellegzetes panaszokkal és tünetekkel járó klinikai szindróma, amelyet a szív strukturális és/vagy funkcionális rendellenességei okoznak, amelyek emelkedett intrakardiális nyomást és/vagy elégtelen perctérfogatot eredményeznek nyugalomban és/vagy terhelés közben.
A szívelégtelenséget hagyományosan a bal kamrai ejekciós frakció (LVEF) értéke alapján oszthatjuk fel különböző fenotípusokra.
A nevezéktan a ≤40% és a ≥50% ejekciós frakciójú betegek csoportjában az előző irányelvhez képest változatlan maradt.
40% vagy az alatti LVEF esetén csökkent ejekciós frakciójú szívelégtelenségről (heart failure with reduced ejection fraction – HFrEF) beszélünk. Ebben az esetben a kontraktilitás zavara az elsődleges.
Amennyiben az LVEF 50% vagy a feletti, megtartott ejekciós frakciójú szívelégtelenségről (heart failure with preserved ejection fraction – HFpEF) beszélhetünk. Ilyenkor a bal kamra relaxációjának zavara dominál. Ebben az esetben a diagnózis felállításához a típusos panaszokon (pl. légszomj) és tüneteken (pl. pangásos szörtyzörejek, perifériás ödéma) túl szükség van a bal kamrai diasztolés diszfunkcióra és/vagy emelkedett bal kamrai töltőnyomásra utaló strukturális és/vagy funkcionális rendellenességek, így az emelkedett natriuretikus peptidszintek igazolására is.
A két csoport közötti „szürke zónába” tartozó, 41 és 49% közötti ejekciós frakcióval bíró szívelégtelen populációt a korábbi ajánlás közepes ejekciós frakciójú szívelégtelenség („heart failure with mid-range ejection fraction” – HFmrEF) névvel illette. Bár ez továbbra is egy meglehetősen heterogén betegcsoportot jelöl, a randomizált, kontrollált tanulmányok retrospektív elemzései alapján ezek a betegek szintén profitálhatnak a HFrEF-ben bevált kezelési lehetőségekből. A vélhetően hasonló patofiziológiára és hasonló kezelési stratégiára utalva jelen ajánlás bevezette az enyhén csökkent ejekciós frakciójú szívelégtelenség („heart failure with mildly reduced ejection fraction” – HFmrEF) fogalmát, megtartva ezzel a korábbi angol rövidítést.
A tünetek/panaszok időbeli fennállása, kialakulásának dinamikája alapján pedig megkülönböztethetünk akut (acute heart failure – AHF) és krónikus szívelégtelenséget (chronic heart failure – CHF). A terjedelmi korlátok miatt jelen közlemény csak a krónikus, stabil szívelégtelenséggel kapcsolatos ajánlásokat tárgyalja.
A krónikus szívelégtelenség diagnosztikája
A krónikus szívelégtelenség (CHF) diagnózisának felállításához a szívelégtelenségre jellemző tünetek és/vagy panaszok, valamint a szívműködési zavar objektív bizonyítékai szükségesek.
Szívelégtelenség gyanúja esetén kezdeti diagnosztikus tesztként a natriuretikus peptidek plazmakoncentrációjának meghatározása javasolt a diagnózis kizárásának céljából. Ha a BNP-szint kisebb, mint 35 pg/ml, vagy az NTproBNP-szint alacsonyabb, mint 125 pg/ml, abban az esetben a szívelégtelenség fennállásának alacsony valószínűsége miatt a szívelégtelenség diagnózisa elvethető. Ha a natriuretikus peptidek szintje a fenti értékekkel egyenlő, vagy annál magasabb úgy echokardiográfia elvégzése javasolt, részben a szívelégtelenség diagnózisának megerősítése, részben a szívelégtelenség típusának (HFrEF, HFmrEF, HFpEF) megállapítása céljából. Ha a natriuretikus peptidszint-meghatározás nem elérhető, akkor minden olyan beteg esetében, akinél a rizikófaktorok, az anamnézis, a fizikális vizsgálat és az EKG értékelése alapján a szívelégtelenség felmerül, echokardiográfia elvégzése szükséges.
Amennyiben a fenti vizsgálati algoritmust követve a szívelégtelenség diagnózisa bizonyítást nyert, nagyon fontos az etiológia meghatározása és a társbetegségek azonosítása, hiszen a szívelégtelenség csak ezek ismeretében kezelhető megfelelően.
Meg kell jegyezni, hogy a magas natriuretikus peptidszinteknek számos kardiovaszkuláris és nem kardiovaszkuláris oka lehet, amelyek csökkenthetik diagnosztikus pontosságukat. Ezek közé tartozik a pitvarfibrilláció, az idősebb életkor, valamint az akut vagy krónikus veseelégtelenség. Ezzel ellentétben a natriuretikus peptidszintek aránytalanul alacsonyak lehetnek elhízott betegekben.
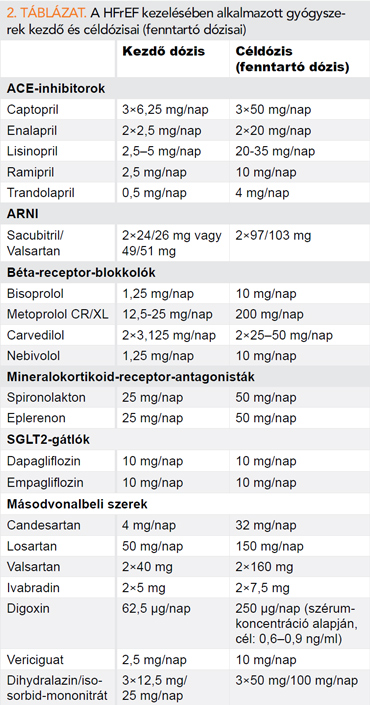
A csökkent ejekciós frakciójú szívelégtelenség (HFrEF) gyógyszeres kezelése (1. ábra, 2. táblázat)

A gyógyszeres terápia a HFrEF kezelésének alapköve.
A HFrEF-ben szenvedő betegek kezelésének három fő célja van:
- a mortalitás csökkentése,
- a súlyosbodó szívelégtelenség miatti visszatérő kórházi kezelések megelőzése, valamint
- a klinikai állapot, a funkcionális kapacitás és az életminőség (QOL) javítása.
A HFrEF gyógyszeres kezelésében az új ajánlás megkülönböztet:
- minden HFrEF-beteg számára javasolt és
- szelektált HFrEF-betegpopuláció számára javasolt, megfontolandó vagy megfontolható kezelési lehetőségeket.
Minden beteg számára javasolt kezelési lehetőségek HFrEF-ben
A minden HFrEF-beteg számára javasolt, úgynevezett elsővonalbeli szerek közé sorolja az ajánlás a renin-angiotenzin rendszert (RAS) gátló vegyületek közül az ACE-inhibitorokat és az angiotenzinreceptor-gátló, neprilizin-inhibitor (ARNI) vegyületek közé tartozó sacubitril/valsartant, a béta-receptor-blokkolókat, a mineralokortikoid-receptor-antagonistákat (MRA), valamint újdonságként a nátrium-glükóz-kotranszporter (SGLT2) gátlók csoportjába tartozó dapagliflozint és empagliflozint. Ezeket a gyógyszereket, amelyek a HFrEF kezelésének alappilléreit jelentik kontraindikáció vagy intolerancia hiányában minden tünetes HFrEF-betegnek kapnia kell (I. osztályú ajánlás). Megszűnt az ajánlásban a korábbi hierarchikus felépítés, ezen készítmények együttes mihamarabbi alkalmazására és feltitrálására kell törekedni.
Renin-angitenzin (RAS) gátlók
Angiotenzinkonvertáz-enzim-gátlók (ACEi-k)
Az ACEi-k összmortalitást csökkentő hatását HFrEF-ben a CONSENSUS (3) és a SOLVD Treatment (4) vizsgálatok bizonyították. A HFrEF valamennyi súlyosságú betegcsoportjában (NYHA II–IV.) megfigyelhető összmortalitást csökkentő hatás miatt az ACEi-ket az európai szívelégtelenség irányelv véleménye szerint minden HFrEF-beteg esetében alkalmazni kell (A-típusú evidencián alapuló I. osztályú ajánlás). Javasolt a nagy, multicentrikus, kontrollált, randomizált vizsgálatokban alkalmazott ACEi-ket preferálni.
Angiotenzinreceptor-blokkoló/neprilizin-inhibitor (ARNI) vegyületek
Az ARNI-vegyületek első tagjának, az LCZ696 nevű vegyületnek (sacubitril/valsartan) az enalaprilhoz képest megfigyelhető kedvező morbiditási, mortalitási hatását a PARADIGM HF-vizsgálat (5) bizonyította. A vizsgálat eredményei alapján az európai ajánlás minden ambuláns HFrEF-beteg esetén javasolja az ACE-gátló/ARB ARNI-ra történő cseréjét, aki az optimális kezelés ellenére panaszos marad (B-típusú evidencián alapuló, I. osztályú ajánlás). Az ACEi-ról ARNI-ra történő váltás esetén fontos, hogy az utolsó ACEi-dózis és az első sacubitril-valsartan dózis között legalább 36 órának el kell telnie, az angioödéma fokozott veszélye miatt.
Az előző szívelégtelenség irányelv megjelenése után publikált PIONEER-HF (6), TITRATION (7) és TRANSITION (8) vizsgálatok alapján a sacubitril/valsartan hospitalizációra szoruló, sok esetben de novo és ACEi/ARB-naiv HFrEF-betegek esetén is biztonsággal alkalmazható. Az új ajánlás emiatt megfontolhatónak tartja a sacubitril/valsartan bevezetését ACEi-naiv (pl. de novo) betegek esetén is (B-típusú evidencián alapuló, IIb osztályú ajánlás).
Béta-receptor-blokkolók (BB)
A BB-k összmortalitást csökkentő hatása HFrEF-ben a CIBIS II (9), a MERIT HF (10), US Carvedilol (11), a COPERNICUS (12) és a SENIORS (13) vizsgálatok alapján a bisoprolol, a metoprolol-succinát CR/XL, a carvedilol és a nebivolol vonatkozásában igazolódott. A HFrEF valamennyi súlyosságú betegcsoportjában (NYHA II–IV.) megfigyelhető összmortalitást csökkentő hatás miatt az BB-ket a jelenleg aktuális európai szívelégtelenség-irányelv véleménye szerint minden HFrEF-beteg esetében alkalmazni kell (A-típusú evidencián alapuló I. osztályú ajánlás). A BB-k bevezetése csak stabil, euvolaemiás betegek esetében javasolt. A BB-k alkalmazása során ragaszkodni kell a nagy mortalitási vizsgálatokban használt BB-khez és törekedni kell az azokban szereplő céldózisok elérésére.
Mineralkortikoid-receptor-antagonisták (MRA)
Az MRA-k (spironolakton vagy eplerenon) összmortalitást csökkentő hatását szívelégtelenségben a RALES- (14), az EMPHASIS- (15) és az EPHESUS- (16) vizsgálat igazolta. Alkalmazásuk az ACE-gátlók/ARNI-k és BB-k mellett minden tünetes HFrEF-beteg számára javasolt (A-típusú evidencián alapuló I. osztályú ajánlás).
Nátrium-glükóz-kotranszporter-2 (SGLT2) gátlók
Az új ajánlás egyik fő újdonsága HFrEF-ben az SGLT2-gátlók megjelenése volt, amely azt eredményezte, hogy az eddig három alappilléren nyugvó gyógyszeres terápia kiegészülve az SGLT2-gátlókkal, négy alappillérűvé vált. Az SGLT2-gátlók HFrEF-ben történő alkalmazását két nagy betegszámú, randomizált vizsgálat eredményeire alapozzuk. A DAPA-HF (17) és EMPEROR REDUCED (18) vizsgálatokban a dapagliflozin és empagliflozin az ACE-I/ARNI/béta-blokkoló/MRA-terápiához hozzáadva csökkentette a kardiovaszkuláris halálozás és a szívelégtelenség súlyosbodásának kockázatát HFrEF-ben szenvedő betegeknél 2-es típusú diabétesz fennállásától függetlenül. Hacsak nem ellenjavallt vagy nem tolerálható, a dapagliflozin vagy az empagliflozin ajánlott minden HFrEF-betegnek, függetlenül attól, hogy cukorbetegek vagy sem (A-típusú evidencián alapuló, I. osztályú ajánlás).
Fontos gyakorlati újdonsága az irányelvnek, hogy a stratégiai gyógyszerekkel kapcsolatban eddig javasolt lépcsőzetes bevezetés és titrálás elvét felváltotta ezen gyógyszerek minél előbb, akár egyszerre történő bevezetésének és az eddigieknél gyorsabb, egymással párhuzamos titrálásának alapelve, természetesen az arra alkalmas betegek esetén. Sokszor a titrálást a hipotonizáló hatás akadályozza, vagy lassítja. Ezért a kevésbé hipotonizáló MRA- és SGLT2-csoport tagjainak korai alkalmazása rövidítheti a kórházi tartózkodást, különösen, ha az ACEi vagy ARNI titrálás a hipotonizáló hatás miatt nehézkes. A négy gyógyszercsoport beállításának sorrendjét illetően a személyre szabott kezelés „művészete” az új ajánlás fényében lehetővé válik. Az Európai Szívelégtelenség Társaság (Heart Failure Association, HFA) 2021-ben dokumentált új konszenzus dokumentuma (19) a stratégiai gyógyszerek gyakorlati alkalmazásában kíván segítséget nyújtani. A gyógyszerek bevezetését és titrálását befolyásoló bizonyos paraméterek (vérnyomás: <90/60 Hgmm; >90/60 Hgmm; >140/90 Hgmm és szívfrekvencia: <60/perc; 60-70/perc; >70/perc) és társbetegségek (pitvarfibrilláció: igen/nem és veseelégtelenség/hyperkalaemia: igen/nem), valamint a folyadékretenció jelenléte (igen/nem) alapján betegprofilokat határoztak meg, ajánlásokat téve a preferálandó titrálási sorrendre.
Szelektált HFrEF-betegpopuláció számára javasolt, megfontolandó vagy megfontolható kezelési lehetőségek
Azoknál a betegeknél, amelyeknél az elsővonalbeli szerek nem elegendők, azaz panaszosak maradnak, jönnek szóba az úgynevezett másodvonalbeli szerek, amelyek közé hat gyógyszercsoportot sorol az új irányelv.
Diuretikumok
Minden olyan HFrEF-betegnek, akinek folyadékretenciója van vagy korábban folyadékretenciója volt javasolt a diuretikum alkalmazása a folyadékretenció megszüntetésének, illetve a folyadékretenció ismételt megjelenésének megakadályozása céljából (C-típusú evidencián alapuló I. osztályú ajánlás). A diuretikumokat a terápiás cél eléréséhez szükséges legkisebb dózisban javasolt alkalmazni. Amennyiben a beteg diuretikumigénye szükségessé teszi, a diuretikumrezisztencia elkerülése céljából érdemes a kacs- és a tiaziddiuretikumokat kombinációban alkalmazni (szekvenciális nefronblokád).
Angiotenzinreceptor-blokkolók
Az ARB-k alkalmazását csak abban az esetben javasolja az irányelv, amennyiben a beteg az ACEi-re vagy ARNI-ra köhögés miatt intoleráns (B-típusú evidencián alapuló I. osztályú ajánlás).
If-csatorna-blokkoló
Az ivabradin alkalmazását HFrEF-ben a SHIFT-vizsgálat (20) támasztja alá. Azon betegeknél kell megfontolni a gyógyszer alkalmazását, akik az optimális gyógyszeres kezelés (optimal medical treatment – OMT) ellenére panaszosak maradnak, bal kamrai ejekciós frakciójuk 35% alatti, szívfrekvenciájuk 70/min feletti és sinusritmusban (s.r.) vannak. A betegek a tolerált maximális dózisban kell, hogy részesüljenek BB-kezelésben (B-típusú evidencián alapuló IIa osztályú ajánlás). Szintén meg kell fontolni a szer alkalmazását, amennyiben az előbb részletezett feltételek (HR ≥70/min, EF: ≤35%, s.r.) teljesülnek és a beteg intolerancia vagy kontraindikáció miatt nem részesülhet BB-kezelésben (C-típusú evidencián alapuló IIa osztályú ajánlás).
Direkt vazodilatátor-kombináció (hidralazin és nitrát)
Két klinikai szcenárióban javasolja az új ajánlás a direkt vazodilatátor-kombináció alkalmazását.
Meg lehet fontolni a direkt vazodilatátor-kombináció alkalmazását azon tünetes HFrEF-bgetegek esetében, akik nem tolerálják sem az ACEi-t, sem az ARB-t, sem pedig az ARNI-t (B-típusú evidencián alapuló IIb osztályú ajánlás).
Meg kell továbbá fontolni a kezelés direkt vazodilatátorokkal történő kiegészítését olyan önmagukat feketének valló betegek esetén, akik az optimális kezelés ellenére súlyosan panaszosak maradnak (NYHA III–IV.), amennyiben az EF ≤35% vagy az EF ≤45% és jelentős bal kamrai dilatáció áll fenn (B-típusú evidencián alapuló IIa osztályú ajánlás). Ennek az alkalmazásnak a tudományos hátterét az A-HEFT (21) vizsgálat teremtette meg.
Digoxin
Minden olyan betegnél meg lehet fontolni a digoxin alkalmazását, aki az optimális gyógyszeres kezelés ellenére panaszos marad és sinusritmusban van (A-típusú evidencián alapuló IIb osztályú ajánlás). Erre az indikációra DIG-vizsgálat (22) teremtett evidenciát.
Bár ebben az indikációban kontrollált, randomizált vizsgálatból származó evidenciák nem állnak rendelkezésünkre, gyakorlati szempontból fontos, hogy magas kamrafrekvenciájú pitvarfibrilláció és tünetes (dekompenzált) szívelégtelenség esetén, amikor egyéb (pl. béta-blokkoló) kezelés nem alkalmazható, hasznos lehet a digoxin alkalmazása frekvenciakontroll céljából.
Több metaanalízis elemezte a közelmúltban a digoxin mortalitásra gyakorolt hatását mind sinusritmusban, mind pedig pitvarfibrillációban, amelyek felhívják a figyelmünket arra, hogy bánjunk rendkívül óvatosan a készítmény alkalmazásával (23). Fontos kiemelni, hogy a digoxin esetén a terápiás ablak nagyon kicsi, emiatt a szérumkoncentráció rendszeres ellenőrzése javasolt (cél: 0,6-0,9 ng/ml).
A digitoxinnal kapcsolatos eredményeket HFrEF és sinusritmus esetén a jelenleg is zajló DIGIT-HF-vizsgálat (24) fogja elemezni.
Szolubilis guanilát-cikláz-stimulátor
A dekompenzált HFrEF-beteget körében végzett VICTORIA-vizsgálatban (25) a szolubilis guanilát-cikláz-stimulátor vericiguat placebóval összehasonlítva szignifikánsan csökkentette a kardiovaszkuláris mortalitás és szívelégtelenség miatti hospitalizáció primer kompozit végpontját. Az új ajánlás alapján meg lehet fontolni a vericiguat alkalmazását NYHA II–IV. stádiumban lévő HFrEF-betegekben, akiknek ACE-I (vagy ARNI), béta-blokkoló és MRA-terápia mellett rosszabbodik a szívelégtelenségük (B-szintű evidencián alapuló IIb osztályú ajánlás).
Az új ajánlásba nem került bele, azonban érdemes megemlíteni egy másik új hatóanyagot is, a kardiális miozinaktivátor omecamtiv-mecarbilt, amelynek hatékonyságát és biztonságosságát HFrEF-ben a GALACTIC-HF-vizsgálat (26) elemezte. A vizsgálat elsődleges végpontja az első szívelégtelenség miatti esemény és a kardiovaszkularis mortalitás kompozit végpontja volt, amelyben a készítmény 8%-os rizikócsökkenést eredményezett. A vizsgálat nem igazolta ugyanakkor a készítmény kardiovaszkularis mortalitást csökkentő hatását. Bár egyelőre nem része a HFrEF-ben javasolt gyógyszeres kezelésnek, a jövőben talán meg lehet majd fontolni a HFrEF-terápia omecamtiv-mecarbillal történő kiegészítését a szívelégtelenség miatti hospitalizáció csökkentése céljából.
Az enyhén csökkent (HFmrEF) és a megtartott ejekciós frakciójú szívelégtelenség (HFpEF) gyógyszeres kezelése
A HFmrEF gyógyszeres kezelése
A HFmrEF-ben szenvedő betegek klinikai jellemzői jobban hasonlítanak a HFrEF-hez, mint a HFpEF-hez. Bár nem rendelkezünk olyan jelentős prospektív, randomizált vizsgálatokkal, amelyeket kizárólag HFmrEF-ben szenvedő betegeken végeztek, számos vizsgálat alcsoport-analízise vizsgálta ezt a betegcsoportot.
A perindoprillel végzett, neutrális eredménnyel zárult PEP-CHF-vizsgálatba (31) 40% feletti ejekciós frakciójú (vagyis a HFmrEF és HFpEF kategóriába tartozó) betegek kerültek bevonásra, nem rendelkezünk azonban ejekciós frakció szerinti alcsoportadatokkal.
A 40% feletti ejekciós frakciójú betegek körében candesartannal végzett CHARM-PRESERVED-vizsgálat (32) retrospektív analízise szerint a szer csökkentette a szívelégtelenség miatti hospitalizációt a HFmrEF-betegek alcsoportjában.
A nagy béta-blokkoló-vizsgálatok IPD metaanalízise a kardiovaszuláris és az öszmortalitás 50%-os csökkenését igazolta a sinusritmusban lévő betegek (HFrEF és HFmrEF) körében.
Fontos gyakorlati megfontolás lehet a szerek alkalmazása kapcsán, hogy sok HFmrEF-ben szenvedő betegnek az ACEi/ARB, béta-blokkoló kezelés egyéb okból is (pl. hipertónia, angina, koronáriabetegség, korábbi miokardiális infarktus, pitvarfibrilláció) indikált.
A ≥45% ejekciós frakciójú betegek körében végzett, neutrális eredménnyel zárult TOPCAT-vizsgálat (27) retrospektív analízise során azt találták, hogy a spironolakton szignifikánsan csökkentette a primer kompozit végpontként meghatározott kardiovaszkuláris mortalitás, szívelégtelenség miatti hospitalizáció és abortált szívhalál gyakoriságát a <55%-os EF-fel bíró betegek alcsoportjában (28).
A szintén ≥45% EF-fel bíró betegek körében végzett PARAGON-vizsgálat (29) utólagos elemzése során azt találták, hogy a sacubitril/valsartant valsartannal összehasonlítva 22%-kal csökkentette a kardiovaszkuláris mortalitás és szívelégtelenség miatti hospitalizáció kompozit végpontját az 57% vagy az alatti ejekciós frakciójú betegek esetén (a vizsgálat a teljes populáció vonatkozásában neutrális eredménnyel zárult) (30).
Mindezen gyakorlati megfontolások és vizsgálati eredmények alapján a szívelégtelenség miatti hospitalizáció és halálozás csökkentése céljából meg lehet fontolni a HFmrEF-betegek ACE-inhibitorral, ARB-vel, béta-receptor-blokkolóval, MRA-val és ARNI-val történő kezelését (C-típusú evidencián alapuló IIb osztályú ajánlás).
A HFpEF gyógyszeres kezelése
Az új ajánlás megjelenéséig a HFpEF-ben végzett nagy kontrollált, randomizált vizsgálatok egyikében sem sikerült a primer végpont vonatkozásában szignifikáns rizikócsökkenést igazolni. Ilyen vizsgálatok voltak a PEP-CHF (31) (perindopril), a CHARM-Preserved (32) (candesartan), az I-PRESERVE (33) (irbesartan), a TOPCAT (27) (spironolakton), a DIG-PRESERVED (34) (digoxin) és a PARAGON-HF (29) (sacubitril/valsartan).
A betegségmódosító terápiákra vonatkozó ajánlások hiányában a kezelésnek a pangásos tünetek diuretikumokkal történő csökkentését kell céloznia (C-típusú evidencián alapuló I. osztályú ajánlás).
Fontos HFpEF esetében a háttérben álló kockázati tényezők, az etiológia és a társbetegségek azonosítása és kezelése (C-típusú evidencián alapuló I. osztályú ajánlás). A HFpEF néhány speciális fenotípusának célzott kezelése jobb kimenetelhez vezet, ezért ezek felismerése kiemelt jelentőséggel bír (pl. amyloidosis, HCM, Fabry-kór).
Meg kell jegyezni, hogy az amerikai Élelmiszer-biztonsági és Gyógyszerügyi Hatóság (FDA) jóváhagyta a sacubitril/valsartan és a spironolakton alkalmazását valamennyi szívelégtelen beteg esetében a bal kamrai ejekciós frakció értékétől függetlenül. Az SGLT2-gátlókkal pedig az ajánlás készítésével egy időben voltak folyamatban vizsgálatok.
Bár az SGLT2-gátló empagliflozinnal folytatott vizsgálat eredményeit az új európai ajánlással egy időben publikálták, így értelemszerűen nem kerülhetett be a 2021-es európai szívelégtelenség irányelvbe, meg kell említeni a HFpEF kezelésében mérföldkőnek tekinthető EMPEROR Preserved-vizsgálatot (35), amely HFpEF-ben (és az EF-tartomány alapján HFmrEF-ben is) elsőként szignifikáns rizikócsökkenést igazolt a kardiovaszkuláris halálozás és szívelégtelenség miatti hospitalizáció kompozit végpontja vonatkozásában az empagliflozinnal kezelt betegek körében.
Egy másik SGLT2-gátlóval, a dapagliflozinnal kapcsolatos eredményeket HFpEF-betegek vonatkozásában a jelenleg is zajló DELIVER-vizsgálat (36) fogja elemezni.
Fontos továbbá megjegyezni, hogy a HFmrEF és HFpEF kategóriába tartozhatnak azok a HFrEF-betegek is, akik az optimális kezelés hatására javulást mutattak (ezeket a betegeket a szívelégtelenség univerzális definícióját és felosztását tárgyaló, 2021-ben publikált konszenzus dokumentum (37) 4. kategóriaként „heart failure with improved EF”, HFimpEF névvel illeti). A TRED-HF-vizsgálat (38) eredményei alapján a gyógyszeres kezelés felfüggesztése a normalizálódó ejekciós frakciót mutató betegek esetében újból a szívelégtelenség progressziójához vezet. Ezen betegek esetében tehát a korábban bevezetett neurohormonális antagonista kezelés élethosszan keresztül történő fenntartása szükséges.
A szívelégtelenség miatt hospitalizációra került betegekkel kapcsolatos ajánlások
Külön fejezetet szentel az új ajánlás a szívelégtelenség miatt hospitalizációra került betegek kezelésével kapcsolatban, amelynek fontos gyakorlati tanácsait érdemes megszívlelni.
- Hazabocsátás előtt javasolt a folyadékretenció-mentes állapot elérése, a stabil per os gyógyszeres kezelés melletti euvolaemiára törekvés.
- Javasolt a fentiekben részletezett stratégiai gyógyszerek bevezetése még a kórházi kezelés időszaka alatt.
- Az elbocsátást követő 1-2 héten belül javasolt a betegek ambuláns kontrollvizsgálata a folyadékstátusz megítélése, a bevezetett gyógyszeres kezelésre adott válasz (tolerancia) ellenőrzése és a gyógyszerdózisok lehetőség szerinti további titrálása céljából.
A krónikus szívelégtelenség eszközös kezelése (ICD és CRT)
A beültethető kardioverter-defibrillátorokkal (ICD) kapcsolatos ajánlások
A beültethető kardioverter-defibrillátorok (ICD) hatékonyak az életet veszélyeztető kamrai aritmiák kezelésében és hagyományos transzvénás rendszer esetén a bradycardia megelőzésében is.
A hirtelen szívhalál szekunder prevenciója
Változatlan az ajánlás a szekunder prevenciós indikáció vonatkozásában. Minden hemodinamikai instabilitással járó kamrai ritmuszavart (VT/VF) túlélő, jó funkcionális állapot mellett egy évnél hosszabb életkilátással bíró beteg esetén ICD-implantáció javasolt szekunder prevenciós céllal, amennyiben a ritmuszavar hátterében kizárhatók a reverzibilis okok és nem a miokardiális infarktust követő 48 órán belül lépett fel (A-típusú evidencián alapuló, I. osztályú ajánlás).
A hirtelen szívhalál primer prevenciója
HFrEF-ben a primer prevenciós ICD-k hatékonyságát elemző vizsgálatok közül a MADIT II (39) és az SCD-HeFT (40) emelendő ki. A MADIT II-vizsgálat 30% alatti bal kamrai ejekciós frakciójú posztinfarktusos betegekben igazolta az ICD-alkalmazás összmortalitást csökkentő hatását. Az SCD-HeFT-vizsgálat szintén összmortalitás-csökkenést igazolt az ICD-alkalmazást illetően egy LVEF ≤35%, NYHA II–III, részben iszkémiás, részben noniszkémiás betegcsoportban. Az etiológia szerinti alapcsoport-analízis azonban csak az iszkémiás alcsoportban mutatott statisztikailag szignifikáns összmortalitás-csökkenést.
Nem változott a primer prevenciós indikáció az iszkémiás betegcsoportban, ahol az ajánlás evidenciával egyértelműen alátámasztott. A hirtelen szívhalál primer prevenciója céljából ICD-implantáció javasolt azon tünetes (NYHA II–III. funkcionális stádium), iszkémiás etiológiájú, legalább három hónapos optimalizált gyógyszeres kezelés (OMT) ellenére 35% alatti bal kamrai ejekciós frakciójú (LVEF) betegek esetében, akiknél a várható túlélés jó funkcionális állapot mellett az egy évet meghaladja (A-típusú evidencián alapuló, I. osztályú ajánlás).
A non-iszkémiás etiológiájú betegek esetében továbbra sincs igazán meggyőző evidencia. Nem sokkal az előző ajánlás megjelenése után, 2016-ban publikálták a DANISH-vizsgálatot (41), ami LVEF ≤35%, NYHA II–IV., NTproBNP >200 pg/ml, nem iszkémiás etiológiájú HFrEF-ben szenvedő betegcsoportban az ICD-alkalmazás kapcsán nem igazolt összmortalitás-csökkenést. Csupán a hirtelen halál vonatkozásában volt megfigyelhető szignifikáns rizikócsökkenés, ami a változatlan arányú összmortalitással és kardiovaszkuláris mortalitással együtt, a halál módjának megváltozására utal, azaz felveti a lehetőségét annak, hogy ezek a betegek nem hirtelen, hanem pl. progresszív szívelégtelenségben halnak meg. Az összmortalitást tekintve csak a betegek 70 évnél fiatalabb alcsoportjában volt szignifikáns rizikócsökkenés kimutatható. A DANISH-vizsgálat eredményei alapján az új irányelv az előzőnél gyengébb ajánlást fogalmaz meg a non-iszkémiás etiológiájú betegek primer prevenciós ICD-beültetésére vonatkozóan. A hirtelen halálozás és a teljes halálozás kockázatának csökkentése érdekében meg kell fontolni az ICD alkalmazását azon tünetes (NYHA II–III. stádiumú), nem-iszkémiás etiológiájú szívelégtelen betegek esetén, akiknél ≥3 hónapos OMT ellenére az LVEF ≤35%-os, feltéve, hogy a beteg várhatóan 1 évnél tovább él még jó funkcionális állapotban (A-típusú evidencián alapuló, IIa osztályú ajánlás). Mivel azonban a non-iszkémiás betegcsoport a hirtelen szívhalál-rizikó vonatkozásában meglehetősen heterogén (pl. a lamin gén mutációi és a kardiális sarcoidosis magasabb SCD rizikóval jár), a pontosabb rizikóstratifikáció szempontjából hasznos lehet egyéb modalitások (pl. szív MR, genetikai vizsgálat) alkalmazása.
Refrakter szívelégtelenség tüneteit mutató, adekvát gyógyszeres kezelés ellenére NYHA IV. funkcionális osztályban lévő, reszinkronizációs kezelésre, mechanikus keringéstámogató kezelésre és szívtranszplantációra nem alkalmas betegek esetén az ICD-beültetés továbbra is ellenjavallt (mivel ebben a betegcsoportban nincs összmortalitást csökkentő hatása csupán a halál módját shifteli a hirtelen halál felől a progresszív szívelégtelenség irányába). Ugyancsak ellenjavallt az ICD-beültetés primer prevenciós indikációval a miokardiális infarktust követő 40 napon belül.
Újdonság az irányelvben a subcutan ICD-kre vonatkozó ajánlás, amelyek alkalmazása elsősorban vénás behatolási út hiányában vagy egy korábbi rendszer infekció miatti eltávolítása után jön szóba. Fontos a megfelelő betegszelekció, a készülékek ugyanis nem védenek a bradycardia ellen és nem képesek sem antitachycardia ingerlésre, sem pedig reszinkronizációs kezelésre. A hagyományos transzvénás rendszerekkel összehasonlítva hatékonyságukban és a procedurális szövődmények vonatkozásában nem különböznek lényegesen, a kezdeti tapasztalatok azonban nagyobb arányban számoltak be indokolatlan (inappropriate) sokkokról.
Változatlan az irányelvben a külső (viselhető) ICD-kre vonatkozó ajánlás. Megfontolható külső (viselhető) ICD alkalmazása olyan, szívelégtelenségben szenvedő betegekben, akiknél korlátozott ideig áll fenn a hirtelen szívhalál kockázata, vagy áthidaló (bridge) megoldásként a készülék beültetéséig (C-típusú evidencián alapuló IIb osztályú ajánlás).
A kardiális reszinkronizációs terápiára (CRT) vonatkozó ajánlások
A biventrikuláris pacemaker beültetése által megvalósuló kardiális reszinkronizációs kezelés (CRT) megfelelően szelektált betegek esetén fokozza a szív teljesítményét, mérsékli a panaszokat, javítja az életminőséget, valamint csökkenti a morbiditást és a mortalitást. Sok olyan betegben is érvényesülhetnek a CRT általi mortalitásbeli előnyök, akik a tünetek vagy a bal kamra funkciója szempontjából non-reszpondernek tűnnek. A CRT-re adott kedvező válasz szempontjából egyebek mellett a QRS-szélesség és a morfológia meghatározó. Számos vizsgálat mutatta, hogy a bal Tawara-szár-blokk (LBBB) morfológiájú QRS-sel rendelkező betegek nagyobb valószínűséggel reagálnak kedvezően a CRT-re, míg a non-LBBB-csoportban a CRT-re adott válasz kevésbé biztos.
Az ajánlás értelmében minden 150 ms-nál szélesebb QRS-ű, LBBB QRS-morfológiát mutató, OMT ellenére LVEF ≤35%, tünetes, sinusritmusban lévő beteg esetén CRT javasolt (A-típusú evidencián alapuló I. osztályú ajánlás).
130–149 ms közötti QRS-szélesség esetén az LBBB QRS-morfológiát mutató, optimális gyógyszeres kezelés ellenére LVEF ≤35%, tünetes, sinusritmusban lévő beteg esetén a CRT alkalmazása megfontolandó (B-típusú evidencián alapuló IIa osztályú ajánlás).
Tünetes, optimális gyógyszeres kezelés ellenére LVEF ≤35%, sinusritmusban lévő betegek esetén nem LBBB morfológiájú QRS mellett is meg kell fontolni a CRT alkalmazását, amennyiben, QRS ≥150 ms (B-típusú evidencián alapuló IIa osztályú ajánlás).
Meg lehet fontolni a CRT alkalmazását nem LBBB morfológiájú QRS mellett 130–149 ms közötti QRS-szélesség esetén (B-típusú evidencián alapuló IIb osztályú ajánlás).
Annak fényében, hogy pitvarfibrilláló betegekben milyen csekély mennyiségű bizonyíték áll rendelkezésre a CRT hatékonyságával kapcsolatban, kiválasztott betegekben fontolandó meg az alkalmazása (különösen azok esetében, akiknél a QRS szélessége ≥150 ms), célként a minél magasabb biventrikuláris ingerlési arányt kitűzve.
A BLOCK HF-vizsgálat (42) eredményei alapján magas fokú AV-blokk miatt konvencionális pacemaker-indikációval bíró, HFrEF-betegek esetén CRT javasolt a jobb kamrai ingerlés helyett, és ez a pitvarfibrilláló betegekre is vonatkozik (A-típusú evidencián alapuló I. osztályú ajánlás).
Meg kell fontolni a CRT-re történő „upgrade”-et <35%-os LVEF esetén azon betegekben, akik hagyományos pacemaker- vagy ICD-beültetésen estek át, magas a jobb kamra ingerlési arányuk és szívelégtelenségük a későbbiekben OMT ellenére progrediál (B-típusú evidencián alapuló IIa osztályú ajánlás). Jelenleg is zajlik a BUDAPEST CRT-vizsgálat (43), amely további fontos evidenciákat szolgáltathat ebben a vonatkozásban.
Az ECHO-CRT-vizsgálat (44) eredményeinek ismeretében 130 ms alatti QRS-szélesség esetén CRT alkalmazása nem javasolt.
Az új ajánlás részletesen foglalkozik még a szívelégtelenségben alkalmazható képalkotó és egyéb diagnosztikus módszerekkel, a legfontosabb társbetegségek (pitvarfibrilláció, iszkémiás szívbetegség, vashiány, billentyűbetegségek), valamint a kardiális amyloidosis diagnosztikájával és kezelésével, az előrehaladott és akut szívelégtelenséggel. Mindezek részletes áttekintése azonban jelentősen meghaladná e közlemény kereteit.
Következtetések
Összefoglalva az új szívelégtelenség ESC-ajánlás leg-fontosabb újdonságait, a HFrEF gyógyszeres kezelésé-ben új gyógyszercsoportként megjelentek az SGLT2-gát-lók, valamint a vericiguat. Bölcs újdonság, hogy a négy alapszert (ACEi/ARNI, MRA, BB, SGLT2-inhibitor) egyenrangú, elsőként alkalmazható módon kezeli, lehe-tővé téve a gyógyítás művészetének művelését, a keze-lés személyre szabásának útján. Noha az ajánlás még nem tartalmazza, hiszen kihirdetését 20 perccel követte az első sikeres HFpEF, SGLT2-gátló vizsgálat eredmé-nyeinek megismerése, annak eredményeit értelemsze-rűen inkorporálhatjuk gondolkodásunkba. Különösen azért, mert az időközben megjelent, akut szívelégtelen-ségben végzett EMPULSE-vizsgálat (45) tovább erősíti az SGLT2-inhibíció polgárjogait a szívelégtelenség ke-zelésének teljes spektrumában.
Fontos újdonság továbbá, hogy a „közepes ejekciós frakciójú szívelégtelenség” kifejezés módosításra került az „enyhén csökkent ejekciós frakciójú szívelégtelen-ség” terminusra, továbbá megjelentek ezen alcsoport gyógyszeres kezelésére vonatkozó ajánlások, valamint módosult a primer prevenciós ICD-beültetés indikációja a noniszkémiás betegcsoportban.
Köszönetnyilvánítás
Szerzők köszönetet mondanak dr. Nyolczas Noéminek és dr. Muk Balázsnak a közlemény gondos átnézéséért.
Nyilatkozat
A szerzők kijelentik, hogy az összefoglaló közlemény megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
IRODALOM
1. McDonagh TA, Metra M, Adamo M, et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021 Sep 21; 42(36): 3599–3726. Erratum in: Eur Heart J 2021 Oct 14; PMID: 34447992. https://doi.org/10.1093/eurheartj/ehab368
2. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016 Aug; 18(8): 891–975. Epub 2016 May 20. PMID: 27207191. https://doi.org/10.1002/ejhf.592
3. CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Eng J Med 1987; 316: 1429–35. https://doi.org/10.1056/NEJM198706043162301
4. SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fraction and congestive heart failure. N Eng J Med 1991; 325: 293–302. https://doi.org/10.1056/NEJM199108013250501
5. McMurray JJV, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Eng J Med 2014; 371: 993–1004. https://doi.org/10.1056/NEJMoa1409077
6. Velazquez EJ, Morrow DA, DeVore AD, et al. PIONEER-HF Investigators. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med 2019; 380: 539–548. https://doi.org/10.1056/NEJMoa1812851
7. Senni M, McMurray JJ, Wachter R, et al, Initiating sacubitril/valsartan (LCZ696) in heart failure: results of TITRATION, a double-blind, randomized comparison of two uptitration regimens. Eur J Heart Fail 2016 Sep; 18(9): 1193–202. Epub 2016 May 12. PMID: 27170530; PMCID: PMC5084812. https://doi.org/10.1002/ejhf.548
8. Wachter R, Senni M, Belohlavek J, et al. TRANSITION Investigators. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019; 21: 998–1007. https://doi.org/10.1002/ejhf.1498
9. CIBIS II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS II): a randomised trial. Lancet 1999; 353: 9–13.
10. MERIT HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT–HF). Lancet 1999; 353: 2001–07.
11. Packer M, Bristow MR, Cohn JN, et al. The Effect Of Carvedilol on Morbidity and Mortality in Patients With Chronic Heart Failure. N Eng J Med 1996; 334: 1349–55. https://doi.org/10.1056/NEJM199605233342101
12. M Packer, A Coats, M Fowler, et al. the Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Eng J Med 2001; 344: 1651–8. https://doi.org/10.1056/NEJM200105313442201
13. Flather MD, Shibata MC, Coats AJS et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26: 215–225. https://doi.org/10.1093/eurheartj/ehi115
14. Pitt B, et al. The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure. N Engl J Med 1999: 341: 709–17. https://doi.org/10.1056/NEJM199909023411001
15. Zannad F, McMurray JJV, Krum H, et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Eng J Med 2011; 364: 11–21. https://doi.org/10.1056/NEJMoa1009492
16. Pitt B, Remme W, Zannad F, et al. Eplerenon, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction. N Eng J Med 2003; 348: 1309–21. https://doi.org/10.1056/NEJMoa030207
17. McMurray JJV, Solomon SD, Inzucchi SE, et al. DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995–2008. https://doi.org/10.1056/NEJMoa1911303
18. Packer M, Anker SD, Butler J, et al. EMPEROR Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020; 383: 1413–1424. https://doi.org/10.1056/NEJMoa2022190
19. Rosano GMC, Moura B, Metra M, et al. Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2021 Jun; 23(6): 872–881. Epub 2021 May 20. PMID: 33932268. https://doi.org/10.1002/ejhf.2206
20. Swedberg K, Komajda M, Böhm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010; 376: 875–85. https://doi.org/10.1016/S0140-6736(10)61198-1
21. Taylor AL, Ziesche S, Yancy C, et al. for the African-American Heart Failure Trial Investigators. Combination of Isosorbide Dinitrate and Hydralazine in Blacks with Heart Failure. N Engl J Med 2004; 351: 2049–57. https://doi.org/10.1056/NEJMoa042934
22. The Digitalis Investigator Group. The Effect of Digoxin on Mortality and Morbidity in Patients with Heart Failure. N Engl J Med 1997; 336: 525–33. https://doi.org/10.1056/NEJM199702203360801
23. Vamos M, Erath JW, Hohnloser SH. Digoxin-associated mortality: a systematic review and meta-analysis of the literature. Eur Heart J 2015; 36: 1831–1838. https://doi.org/10.1093/eurheartj/ehv143
24. Bavendiek U, Berliner D, Davila LA, et al. DIGIT-HF Investigators and Committees. Rationale and design of the DIGIT-HF trial (DIGitoxin to Improve ouTcomes in patients with advanced chronic Heart Failure): a randomized, double-blind, placebo-controlled study. Eur J Heart Fail 2019; 21: 676–684. https://doi.org/10.1002/ejhf.1452
25. Armstrong PW, Pieske B, Anstrom KJ, et al. VICTORIA Study Group. Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020; 382: 1883–1893. https://doi.org/10.1056/NEJMoa1915928
26. Teerlink JR, Diaz R, Felker GM, et al.; GALACTIC-HF Investigators. Cardiac myosin activation with omecamtiv mecarbil in systolic heart failure. N Engl J Med 2021; 384: 105–116. https://doi.org/10.1056/NEJMoa2025797
27. Pitt B, Pfeffer MA, Assmann SF, et al. TOPCAT Investigators. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 370: 1383–1392. https://doi.org/10.1056/NEJMoa1313731.
28. Solomon SD, Claggett B, Lewis EF, et al. TOPCAT Investigators. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J 2016 Feb 1; 37(5): 455–62. Epub 2015 Sep 15. PMID: 26374849; PMCID: PMC4751235. https://doi.org/10.1093/eurheartj/ehv464.
29. Solomon SD, McMurray JJV, Anand IS, et al. PARAGON-HF Investigators and Committees. Angiotensin-neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019; 381: 1609–1620. https://doi.org/10.1056/NEJMoa1908655
30. Solomon SD, Vaduganathan M, L Claggett B, et al. Sacubitril/Valsartan Across the Spectrum of Ejection Fraction in Heart Failure. Circulation 2020 Feb 4; 141(5): 352–361. Epub 2019 Nov 17. PMID: 31736342. https://doi.org/10.1161/CIRCULATIONAHA.119.044586
31. Cleland JG, Tendera M, Adamus J, et al. PEP-CHF Investigators. The perindopril in elderly people with chronic heart failure (PEPCHF) study. Eur Heart J 2006; 27: 2338–2345. https://doi.org/10.1093/eurheartj/ehl250
32. Yusuf S, Pfeffer MA, Swedberg K, et al CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved trial. Lancet 2003; 362: 777–781. https://doi.org/10.1016/S0140-6736(03)14285-7
33. Massie BM, Carson PE, McMurray JJ, et al. I-PRESERVE Investigators. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359: 2456–2467. https://doi.org/10.1056/NEJMoa0805450
34. Ahmed A, Rich MW, Fleg JL, et al. Effects of digoxin on morbidity and mortality in diastolic heart failure: the Ancillary Digitalis Investigation Group trial. Circulation 2006; 114: 397–403. https://doi.org/10.1161/CIRCULATIONAHA.106.628347
35. Anker SD, Butler J, Filippatos G, et al., EMPEROR-Preserved Trial Investigators. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14; 385(16): 1451–1461. Epub 2021 Aug 27. PMID: 34449189 https://doi.org/10.1056/NEJMoa2107038
36. Solomon SD, Boer RA, DeMets D, et al. Dapagliflozin in heart failure with preserved and mildly reduced ejection fraction: rationale and design of the DELIVER trial. Eur J Heart Fail 2021; 23(7): 1217–1225. https://doi.org/10.1002/ejhf.2249
37. Bozkurt B, Coats AJS, Tsutsui H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association. Eur J Heart Fail 2021; 23: 352–380. https://doi.org/10.1002/ejhf.2115
38. Halliday BP, Wassall R, Lota AS, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet 2019; 393: 61–73. https://doi.org/10.1016/S0140-6736(18)32484-X
39. Moss AJ, Zareba W, Hall WJ et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Eng J Med 2002; 346: 877–83. https://doi.org/10.1056/NEJMoa013474
40. Brady GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Eng J Med 2005; 352: 225–237. https://doi.org/10.1056/NEJMoa043399
41. Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med 2016; 375: 1221–30. https://doi.org/10.1056/NEJMoa1608029
42. Curtis AB, Worley SJ, Adamson PB, et al. Biventricular Pacing for Atrioventricular Block and Systolic Dysfunction. N Eng J Med 2013; 368: 1585–93. https://doi.org/10.1056/NEJMoa1210356
43. Merkely B, Kosztin A, Roka A, et al. Rationale and design of the BUDAPEST-CRT upgrade study: a prospective, randomized, multicentre clinical trial. Europace 2016 Oct 6. [Epub ahead of print] https://doi.org/10.1093/europace/euw193.
44. Ruschitzka F, Abraham WT, Singh JP, et al. Cardiac-Resynchronization Therapy in Heart Failure with a Narrow QRS Complex. N Eng J Med 2013; 369: 1395–405. https://doi.org/10.1056/NEJMoa1306687
45. Voors AA, Angermann CE, Teerlink JR, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022; 28: 568–574. https://doi.org/10.1038/s41591-021-01659-1