Subclinical atrial fibrillation and anticoagulant therapy: What do we know in 2022?
█ Review
DOI: 10.26430/CHUNGARICA.2022.52.3.234
Authors:
Vámos Máté1, Kupó Péter2, Miklós Márton1, Benák Attila1, Zsigmond-Előd János1, Gellér László3, Nagy Klaudia Vivien3, Sághy László1, Pap Róbert1
1Szegedi Tudományegyetem, Belgyógyászati Klinika, Szeged
2Pécsi Tudományegyetem, Szívgyógyászati Klinika, Pécs
3Semmelweis Egyetem, Városmajori Szív- és Érgyógyászati Klinika, Budapest
Levelezési cím:
Dr. Vámos Máté PhD, med. habil.
Szegedi Tudományegyetem, Belgyógyászati Klinika, Elektrofiziológia Részleg, 6725 Szeged, Semmelweis u. 8.
E-mail: vamos.mate@gmail.com; vamos.mate@med.u-szeged.hu
Summary
This review focuses on the risk-benefit ratio of anticoagulant therapy in subclinical atrial fibrillation (SCAF) detected by implantable cardiac electronic devices. To the best of our knowledge, we have to count on the increase of stroke risk after the detection of SCAF episodes lasting ≥5-6 minutes. Although the absolute risk is lower compared to that one observed in clinical atrial fibrillation (AF), the risk increases gradually with SCAF burden. The temporal relationship between atrial arrhythmias and stroke events is not always consistent, suggesting that SCAF/AF is also a risk marker and not always the direct cause of stroke. Several studies have been conducted in SCAF and/or stroke of unknown origin to investigate the role of intensive monitoring and anticoagulant treatment strategies, reporting contradictory results at more endpoints. Based on the available evidence and current recommendations, the decision to introduce anticoagulation in these patients should be based on an individual and dynamic evaluation of the thromboembolic risk and the length/frequency of SCAF events.
ISSUE: CARDIOLOGIA HUNGARICA | 2022 | VOLUME 52, ISSUE 3
Összefoglalás
Jelen áttekintő közlemény a beültethető kardiológiai eszközökkel detektált szubklinikus pitvarfibrilláció (SCAF) esetében szóba jövő antikoaguláns kezelés kockázat-haszon viszonyára fókuszál. Mai tudásunk szerint az 5-6 percet meghaladó SCAF-epizódokat követően kell számolnunk a stroke kockázatának fokozódásával. Bár az abszolút kockázat alacsonyabb a manifeszt, klinikai pitvarfibrillációban (AF) megfigyelthez képest, a rizikó fokozatosan emelkedik, arányosan a SCAF-események hosszával/gyakoriságával. A pitvari ritmuszavarok és a stroke-események időbeli összefüggése ugyanakkor nem mindig konzekvens, amely alapján a SCAF/AF kardiovaszkuláris kockázati markernek és nem mindig a stroke közvetlen okának tekinthető. Több tanulmány is készült a SCAF, illetve ismeretlen eredetű stroke esetén alkalmazott intenzív monitorozás és antikoaguláns kezelési stratégiák vizsgálatára, amelyek eredményei több ponton ellentmondásosak. A rendelkezésre álló adatok és az aktuális ajánlások tükrében a trombembóliás rizikó és a SCAF-események hosszának/gyakoriságának individuális és dinamikus mérlegelése alapján kell döntenünk az antikoaguláció bevezetéséről ezen betegek esetében.
Bevezetés
A pitvarfibrilláció (AF) kezelésére vonatkozó, 2020-ban megjelent európai ajánlás a korábbiaknál nagyobb hangsúlyt fektetett a pontos definíciók és egységes nómenklatúra alkalmazására (1, 2). Ennek szükségességét részben az egyre bővülő, EKG-t rögzítő technikák megjelenése vonta maga után. Ez alapján elkülönítjük a testfelszíni EKG-val igazolt (tünetes vagy tünetmentes) klinikai AF-et és az úgynevezett szubklinikus pitvarfibrillációt (subclinical atrial fibrillation, SCAF). Ez utóbbi esetében csak beültethető kardiológiai eszközzel (pacemaker, beültethető defibrillátor [ICD], beültethető loop recorder [ILR]) regisztrálható tartós (>30 sec), magas pitvari frekvenciával járó esemény (atrial high rate episode, AHRE) és nem áll rendelkezésre AF-et igazoló testfelszíni EKG-regisztrátum. A SCAF-események tehát tünetmentesek és általában mellékleletként kerülnek leírásra a pacemaker/ICD-lekérdezések során. A beültethető eszköz által nyújtott folyamatos EKG-monitorozás lehetővé teszi a SCAF-események hosszának és gyakoriságának (az ún. burden-nek) a pontos megállapítását. Jelen összefoglaló közlemény a SCAF esetében alkalmazott antikoaguláns kezelés, több szempontból a mai napig nem teljesen tisztázott kérdéskörére, annak kockázat-haszon viszonyára fókuszál.
Stroke-rizikó és SCAF
A 2012-ben publikált ASSERT-vizsgálat (n=2580) az egyik legismertebb tanulmány, amely pacemakerrel és ICD-vel élő betegek esetén igazolta, hogy már egy rövid (>6 min) SCAF-epizódot követően is jelentősen emelkedik a későbbi, klinikailag manifeszt AF kockázata, ami az átlag 2,5 éves utánkövetés során a betegek 15,7%-ánál igazolódott. Mindezen túl a SCAF jelenléte 2,5-szeres stroke-rizikóval párosult, amely függetlennek bizonyult egyéb stroke-rizikófaktoroktól, sőt a klinikailag manifeszt AF megjelenésétől is (3). A tanulmány egy későbbi analízise a SCAF-hosszúság és a stroke-rizikó összefüggését vizsgálta 24 órát meghaladó, 6 órától 24 óráig fennálló és 6 perctől 6 óráig tartó SCAF-alcsoportokban (4). Ebben a post-hoc analízisben csak a 24 órát meghaladó SCAF-események mutattak szignifikáns összefüggést a stroke-eseményekkel, jóllehet a betegcsoportok a SCAF-hosszúság és a stroke közötti összefüggés vizsgálatára nem rendelkeztek megfelelő statisztikai erővel. A prospektív, szintén obszervációs TRENDS-vizsgálatban, csak az 5,5 órát elérő vagy meghaladó SCAF-események párosultak gyakoribb trombembóliás eseményekkel, az ennél rövidebb eseményű betegek rizikója azonos volt azokkal a pacemakerrel vagy ICD-vel élő betegekével, akiknél egyáltalán nem észleltek SCAF-eseményeket (5). Ennek ellenére jogosan feltételezhető a SCAF-események hossza és a stroke-rizikó közötti kapcsolat, hiszen jól ismert tény, hogy a stroke-rizikó fokozatosan emelkedik a pitvarfibrilláció progresszióját tükröző paroxizmális, perzisztens, majd permanens formák kialakulásával (6). Bár a SCAF- és a stroke-rizikó kapcsolatát az ASSERT-vizsgálat előtt és azt követően is számos tanulmány vizsgálta, ezek összehasonlítása nehézségekkel jár az azokban alkalmazott különböző statisztikai és detekciós módszerek, az eltérő stroke-rizikójú betegpopulációk és az eltérő végpontdefiníciók miatt. Ezen limitációk tudomásul vétele mellett is, a dr. Steinberg és dr. Piccini nyomán szerkesztett összefoglaló ábra jól szemlélteti, hogy a SCAF-események hosszának növekedésével a stroke-események folyamatosan emelkedő kockázatával kell számolnunk (1. ábra) (7).
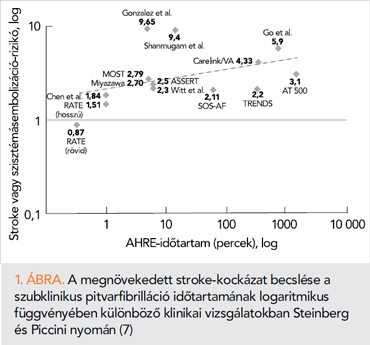
Ellentmondás a stroke-események és a SCAF időbeliségében
Szintén beültethető kardiológiai eszközzel élő betegek körében megfigyelt jelenség, hogy a pitvari ritmuszavarok és stroke-események időben nem mindig egymást követően jelentkeznek. A már említett ASSERT-vizsgálatban például az 51 stroke-ot vagy szisztémás embóliás eseményt elszenvedett beteg közül 26 esetben detektáltak SCAF-ot, jóllehet a SCAF-esemény csak 18 betegnél (35%) jelentkezett a trombembólia előtt, amelyből csak 4 betegnél (8%) került regisztrálásra a stroke-ot megelőző 30 napban és csak 1 betegnél zajlott pitvari ritmuszavar az agyi esemény pillanatában (8). Újabb vizsgálatok alapján viszont a stroke-rizikó egyértelműen nő a több órát tartó (≥5,5 h) SCAF-epizódot követő 5 napban (9).
Mindezek alapján valószínűleg összetett kölcsönhatás áll fent a stroke hagyományos kockázati tényezői és az AF/SCAF kialakulása/időtartama, valamint a stroke előfordulása között, az AF pedig így kockázati markernek és nem mindig a stroke közvetlen okának tekinthető (10).
Antikoaguláns kezelés és SCAF
Az eddigiek alapján tehát, ami biztosan megállapítható:
- Az iszkémiás stroke relatív rizikója az AF minden formájában, beleértve a SCAF-ot is, emelkedett.
- Az abszolút rizikó fokozatosan emelkedik az AF-burden növekedésével.
- SCAF esetén mind az abszolút, mind a relatív stroke-rizikó alacsonyabb, mint klinikailag manifeszt AF-ben.
A jelenlegi ajánlások szerint a klinikailag igazolt AF minden formájában indikált az antikoaguláns kezelés, amennyiben emelkedett a trombembóliás rizikó (CHA2DS2-VASc score) (1). Az orális antikoagulánsok (OAC), és ezen belül is főleg a nem K-vitamin-antagonista típusú OAC-ok (NOAC) hatásossága sokszorosan bizonyított AF-ben, jóllehet emelik a vérzéses rizikót is. Kérdés tehát, hogy hasonló hatást (kockázat/haszon, költséghatékonyság) várhatunk-e az antikoaguláns kezeléstől SCAF esetén is? Ezt a kérdést vizsgálta, illetve vizsgálja néhány intervenciós vizsgálat, amelyeket a következőkben tekintünk át.
Az IMPACT-vizsgálatban a „pill-in-pocket” típusú OAC-kezelés koncepcióját vizsgálták: 2718 kétüregű vagy biventricularis defibrillátorral élő beteget randomizáltak távoli utánkövetés alapján irányított antikoaguláns kezelés megkezdésére és leállítására, vagy hagyományos ambuláns kontroll során, standard klinikai kritériumok szerint indított antikoagulációra (11). A távoli utánkövetéssel megfigyelt csoportban 1-es vagy 2-es CHADS2 pontszám és 48 órát meghaladó ritmuszavar valamint 3-as vagy 4-es CHADS2 score és 24 órát meghaladó AF esetén OAC-terápiát indítottak, 30 napos, illetve 50 napos ritmuszavar-menetesség esetén pedig leállították azt. A vizsgálatot 2 éves medián utánkövetés után leállították, mivel nem sikerült igazolni a beültethető kardiológiai eszköz detekciója alapján indított és leállított OAC-kezelés klinikai előnyét az ambuláns utánkövetés és hagyományos rizikóstratifikáció alapú antikoagulálással szemben a stroke, a szisztémás embólia és a súlyos vérzés összetett elsődleges végpontján.
A CRYSTAL AF- és a NAVIGATE ESUS-vizsgálatok az ismeretlen eredetű stroke-ot elszenvedett betegek (Embolic Stroke of Undetermined Source, ESUS) kérdéskörét vizsgálták. A CRYSTAL AF-tanulmányban 441 ismeretlen eredetű stroke-ot elszenvedett betegnél azt vizsgálták, hogy az ILR-rel végzett hosszú távú monitorozás hatékonyabb-e, mint a hagyományos ambuláns követés ezen betegek pitvarfibrillációjának kimutatására (12). Az 1 éves utánkövetés során az ILR-rel követett betegcsoportban 12,4%-ban, míg a kontrollcsoportban 2%-ban igazolódott AF (p<0,001) és ennek megfelelően antikoaguláns kezelést is gyakrabban indítottak az ILR-csoportban (14,7 vs. 6,0%, p=0,007). A NAVIGATE-ESUS-vizsgálói egy lépéssel tovább mentek: feltételezték, hogy mivel az ESUS esetében nagy számban igazolódik később AF, további monitorozási kísérlet nélkül rivaroxaban (1×15 mg) vagy aszpirin (1×100 mg) szedésére randomizáltak 7213 beteget. A vizsgálatot végül az átlagos 11 hónapos utánkövetést követően, idő előtt leállították, mert a stroke kockázatát illetően nem mutatkozott előny a rivaroxabancsoportban, azonban a NOAC-kezelés szignifikánsan emelte a vérzéses események gyakoriságát (13).
A CRYSTAL AF-vizsgálatban az ILR alkalmazásával megfigyelt kedvező eredmények hívták életre a közelmúltban publikált LOOP-vizsgálatot, amelyben emelkedett rizikójú, de stroke-ot korábban nem elszenvedett betegeket (életkor: 70–90 év + legalább 1 további stroke-rizikófaktor) randomizáltak ILR-beültetésre vagy hagyományos utánkövetésre, 6 percet meghaladó SCAF/AF detekciója esetén pedig protokoll szerint OAC-terápiát indítottak (14). A 64,5 hónapos medián utánkövetés során az ILR-csoportban gyakrabban diagnosztizáltak SCAF/AF-et (32% vs. 12%, p<0,01), gyakrabban indult OAC-kezelés (30% vs. 13%, p=0,007), de a stroke/szisztémás embólia kombinált végpontjában nem mutatkozott statisztikailag szignifikáns különbség (4,5% vs. 5,6%). Megemlítendő, hogy a stroke-eseményig eltelt idő görbéi az első 2-3 évben átfedték egymást, majd a 3. évtől a kontrollcsoportban magasabb eseményráta volt megfigyelhető. Ez alapján valószínűsíthető, hogy az ILR-vezérelt OAC-terápia haszna hosszabb távon már kimutatható lehet. A vizsgálat azt is kimutatta, hogy aktív szűrés nélkül is gyakori az AF diagnózisa, így antikoagulációt is gyakran indítanak ebben a betegcsoportban. Az is felmerült, hogy a mindössze 6 perces detekciós küszöb túl alacsony volt, így olyan résztvevők is részesültek antikoaguláns kezelésben, akik nem voltak kitéve az AF-fel összefüggő stroke kockázatának.
A LOOP-vizsgálat negatív eredményéhez képest némileg ellentmondásos eredmény született a szintén 2021-ben publikált STROKESTOP-vizsgálatban, amely a primer prevenciós intenzív AF-monitorozás és ez alapján indított OAC-kezelés koncepcióját vizsgálta magas kockázatú betegeken (életkor: 75–76 év), 2 hétig tartó, napi 2× végzett ambuláns, 1 csatornás EKG alkalmazásával (15). Az összesen 27 975 fő részvételével végzett, randomizált vizsgálatban egy 30 másodperces vagy legalább két 10–29 sec tartamú AF-esemény esetén indítottak OAC-ot. A 6,9 éves mediánkövetés után mérsékelt, de szignifikáns nettó klinikai előny (kombinált elsődleges végpont: stroke, szisztémás embólia, súlyos vérzés, összmortalitás) mutatkozott az intenzíven monitorozott csoportban (HR=0,96; 95% CI: 0,92–1,00; p=0,045).
SCAF-fal kapcsolatos jelenleg zajló klinikai vizsgálatok
A közelmúltban végzett vizsgálatok ellentmondásos eredményei alapján látható, hogy továbbra is vannak nyitott kérdések a SCAF esetén szóba jövő antikoaguláció kockázat-haszon arányával kapcsolatban. Ebből a szempontból két, jelenleg zajló randomizált vizsgálat eredményei kiemelten fontosnak tűnnek.
Az ARTESiA-vizsgálatba (Apixaban for the Reduction of Thrombo-Embolism in Device-Detected Sub-Clinical Atrial Fibrillation, ClinicalTrials.gov. NCT01938248) pacemakerrel/ICD-vel/ILR-rel élő betegeket vontak be, akiknél minimum 6 perc, maximum 24 óra hosszúságú SCAF került regisztrálásra és emelkedett stroke-rizikóval rendelkeztek (korábbi stroke, ≥75 éves életkor vagy halmozottan fennálló rizikófaktorok). A betegeket ezután aszpirin- vagy apixabankezelésre randomizálták. A vizsgálat bevonási szakasza, amelyben 4 magyar centrum is aktívan részt vett, már lezárult, az első eredmények leghamarabb 2023 második felében várhatók.
Az előzőhöz hasonló NOAH-vizsgálat (Non-vitamin K Antagonist Oral Anticoagulants in Patients With Atrial High Rate Episodes, ClinicalTrials.gov. NCT02618577) is a beültethető kardiológiai eszközzel élő betegeknél detektált SCAF és emelkedett stroke-rizikó esetén alkalmazott OAC-kezelés, ez esetben edoxaban vs. aszpirin, koncepcióját vizsgálja. Ezen vizsgálat még bevonási szakaszban van, várhatóan 2022 harmadik negyedévében zárul le a betegbeválasztás. A vizsgálatba azok a 65 évet betöltött betegek vonhatók be, akik emelkedett stroke-rizikóval rendelkeznek. A NOAH-vizsgálatba azonban azon betegek is bevonhatók, akik az életkor mellett csak egy további stroke rizikófaktorral rendelkeznek (CHA2DS2-VASc score ≥2). A készülékben minimum 6 perces SCAF-epizód detekciója szükséges, azonban a 24 órát meghaladó SCAF-epizóddal rendelkező betegek is bevonhatók. További különbség a két vizsgálat között, hogy míg az ARTESiA-vizsgálat az apixaban 5 mg vagy 2,5 mg-os (életkor, vesefunkció és testsúly alapján) dózisának hatékonyságát aszpirin 81 mg-mal szemben vizsgálja, a NOAH-vizsgálat az edoxaban 60 mg vagy 30 mg-os dózisát hasonlítja össze placebóval, vagy 100 mg-os aszpirinnel (TAGG-kezelés szükségessége esetén) a stroke, illetve a szisztémás embolizáció megelőzésének tekintetében.
Reményeink szerint az ARTESiA- és a NOAH-vizsgálatok eredményeinek ismeretében választ kapunk arra a jelenleg még nyitott kérdésre, hogy a beültetett eszközök által detektált SCAF-események mellett, mely esetekben szükséges OAC-kezelés indítása.
Következtetések
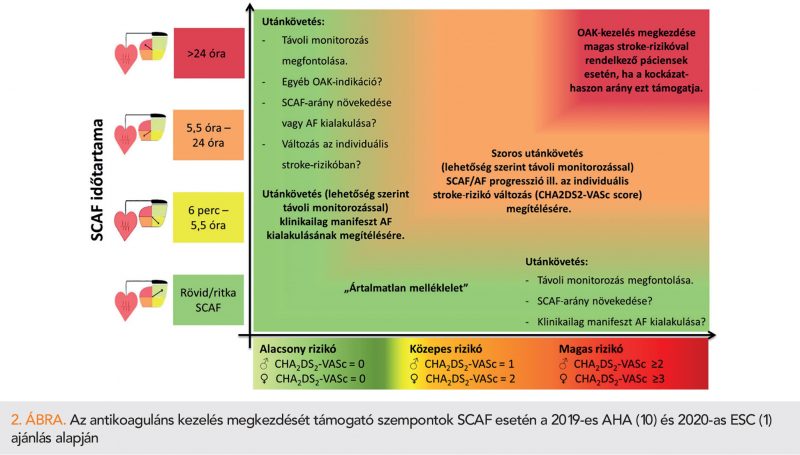
A tünetmentes, kardiológiai eszközzel detektált, 24 órát nem meghaladó szubklinikus pirtvarfibrilláció esetén felmerülő antikoaguláció indikációja a jelenlegi ismereteink alapján nem egyértelmű. Az alacsony kockázatú és/vagy rövid, ritkán előforduló pitvari ritmuszavarban szenvedő betegek valószínűleg nem igényelnek véralvadásgátló kezelést. A fent részletezett, zajló klinikai vizsgálatok eredményeinek megérkezéséig, a trombembóliás rizikó növekedésével és a SCAF-események hosszának/gyakoriságának emelkedésével arányosan, individuálisan kell mérlegelnünk az antikoaguláció bevezetését, mint ahogyan ezt a jelenleg hatályos európai (1) és amerikai (10) ajánlások is javasolják (2. ábra). Fontos hangsúlyozni azt is, hogy az SCAF-terhelés nem statikus, dinamikusan változhat, ezért ezen betegek szoros, lehetőség szerint távoli utánkövetése javasolt, hogy az AF-események progressziója esetén időben el lehessen kezdeni az antikoaguláns kezelést.
Nyilatkozat
A szerzők kijelenti, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
IRODALOM
1. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42: 373–498. https://doi.org/10.1093/eurheartj/ehaa612
2. Salló Z, Kupó P, Szegedi N, et al. Összefoglaló az ESC 2020-as pitvarfibrilláló betegek ellátására vonatkozó irányelveiről. Cardiologia Hungarica 2021; 51: 177–82. https://doi.org/10.26430/CHUNGARICA.2021.51.3.177
3. Healey JS, Connolly SJ, Gold MR, et al. Subclinical atrial fibrillation and the risk of stroke (published correction appears in N Engl J Med 2016 Mar 10; 374: 998.) N Engl J Med 2012; 366(2): 120–129. https://doi.org/10.1056/NEJMoa1105575
4. Van Gelder IC, Healey JS, Crijns HJGM, et al. Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. Eur Heart J 2017; 38: 1339–1344. https://doi.org/10.1093/eurheartj/ehx042
5. Glotzer TV, Daoud EG, Wyse DG, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol 2009; 2(5): 474–480. https://doi.org/10.1161/CIRCEP.109.849638
6. Hohnloser SH, Vamos M. Not All Types of Atrial Fibrillation Carry the Same Stroke Risk, but Most Benefit From Oral Anticoagulation. Circ Arrhythm Electrophysiol 2017; 10: e004847. https://doi.org/10.1161/CIRCEP.116.004847
7. Steinberg BA, Piccini JP. When Low-Risk Atrial Fibrillation Is Not So Low Risk: Beast of Burden. JAMA Cardiol 2018; 3: 558–560. https://doi.org/10.1001/jamacardio.2018.1205
8. Brambatti M, Connolly SJ, Gold MR, et al. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation 2014; 129(21): 2094–2099. https://doi.org/10.1161/CIRCULATIONAHA.113.007825
9. Singer DE, Ziegler PD, Koehler JL, Sarkar S, Passman RS. Temporal Association Between Episodes of Atrial Fibrillation and Risk of Ischemic Stroke. JAMA Cardiol 2021; 6(12): 1364–1369. https://doi.org/10.1001/jamacardio.2021.3702
10. Noseworthy PA, Kaufman ES, Chen LY, et al. Subclinical and Device-Detected Atrial Fibrillation: Pondering the Knowledge Gap: A Scientific Statement From the American Heart Association. Circulation 2019; 140(25): e944–e963. https://doi.org/10.1161/CIR.0000000000000740
11. Martin DT, Bersohn MM, Waldo AL, et al. Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices. Eur Heart J 2015; 36(26): 1660–1668. https://doi.org/10.1093/eurheartj/ehv115
12. Sanna T, Diener HC, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370(26): 2478–2486. https://doi.org/10.1056/NEJMoa1313600
13. Hart RG, Sharma M, Mundl H, et al. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med 2018; 378(23): 2191–2201. https://doi.org/10.1056/NEJMoa1802686
14. Svendsen JH, Diederichsen SZ, Højberg S, et al. Implantable loop recorder detection of atrial fibrillation to prevent stroke (The LOOP Study): a randomised controlled trial (published correction appears in Lancet 2021 Oct 23; 398(10310): 1486). Lancet 2021; 398(10310): 1507–1516. https://doi.org/10.1016/S0140-6736(21)01698-6
15. Svennberg E, Friberg L, Frykman V, Al-Khalili F, Engdahl J, Rosenqvist M. Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. Lancet 2021; 398(10310): 1498–1506. https://doi.org/10.1016/S0140-6736(21)01637-8