Tricuspidal regurgitation: new possibilities for imaging
█ Review
DOI: 10.26430/CHUNGARICA.2018.48.1.69
Authors:
Jenei Csaba1, Denisa Muraru2, Csanádi Zoltán1, Édes István1, Luigi P. Badano2
1Debreceni Egyetem, Általános Orvostudományi Kar, Kardiológiai Tanszék, Debrecen
2Department of Cardiac, Thoracic and Vascular Sciences, University of Padua, School of Medicine, Padua, Italy
Summary
The traditional concept, that tricuspid regurgitation (TR) is less important than left-sided valvular diseases had persisted until recently, when studies identified TR as a progressive entity associated with a poor survival. As the tricuspid valve apparatus has a complex spatial structure, three-dimensional imaging may help to assess the severity and to evaluate the consequences of TR. Corrective treatment of TR is tricuspid valve surgery, however current guidelines do not provide exact recommendations either for the proper patient selection or for the optimal timing of the surgical intervention due to the lack of sufficient data from randomized controlled trials.
ISSUE: CARDIOLOGIA HUNGARICA | 2018 | VOLUME 48, ISSUE 1
Összefoglalás
A tricuspidalis rendszert érintő elváltozásoknak korábban kisebb jelentőséget tulajdonítottak. A figyelem középpontjába akkor kerültek, amikor megjelentek azok a tanulmányok, amelyek a tricuspidalis regurgitáció (TR) progresszív voltát és hosszú távú túlélésre kifejtett kedvezőtlen hatásukat hangsúlyozták. A tricupidalis apparátus komplex geometriája miatt a háromdimenziós képalkotó technikák segítséget nyújthatnak a TR súlyosságának pontos megítélésében és következményeinek értékelésében. A TR hatékony kezelését a műtéti korrekciók jelentik, azonban randomizált vizsgálatok hiányában a jelenlegi ajánlás nem ad megfelelő támpontot az alkalmas betegek kiválasztásához és az intervenció optimális idejének megválasztásához.
Bevezetés
A tricuspidalis regurgitáció gyakori echokardiográfiás lelet, amely a normál populáció 80-90%-ban is jelen lehet (1), többségében enyhe formában. A tricuspidalis regurgitáció nagyrészt (80%-ban) ún. szekunder vagy funkcionális TR (FTR), amely a tricuspidalis anulus dilatációja és/vagy a billentyű vongálódása miatt jön létre, míg a primer (organikus) forma a billentyűapparátus hibáira vezethető vissza. A súlyos TR arányát 1,2%-ban határozták meg egy több mint 60 000 echokardiográfiás felvételt elemző adatbázis alapján (2). Populációs adatok szerint hozzávetőlegesen 1,6 millió ember él mérsékelten súlyos, vagy súlyos TR-rel az Egyesült Államokban (3).
Hosszú ideig a TR-t jóindulatúnak tartották, ha nem társult hozzá pulmonalis hipertenzió, bal- vagy jobbkamra-diszfunkció. Igazán figyelmet csak olyan tanulmányok megjelenése után kapott, amelyek rávilágítottak arra, hogy már a mérsékelten súlyos TR is rosszabb túlélést eredményez (4). A szerzők rosszabb prognózist észleltek abban az esetben is, amikor a TR nem kapcsolódott pulmonalis hipertenzióhoz, vagy kamra-diszfunkcióhoz. Az is világossá vált, hogy jelentős romlás észlelhető a TR súlyosságában, ha a mitralis billentyűműtéttel egy időben nem kerül megoldásra (5). Ezzel az ismerettel párhuzamosan a tricuspidalis billentyűt érintő műtétek száma növekedett: egy 10 éves periódust átölelő időszakban az Egyesült Államokban több, mint duplájára emelkedett ezen műtétek száma (6) és a tricuspidalis anuloplasztika előtérbe kerülésével csökkent a mortalitás. Randomizált vizsgálatok hiányában a jelenlegi ajánlás nem ad elegendő támpontot a megfelelő betegszelekcióhoz, és az intervenció optimális idejének kiválasztásához (7).
Tricuspidalis billentyűapparátus funkcionális anatómiája

A négy billentyű közül a tricuspidalis orificiuma a legnagyobb, és a mitralis billentyűhöz képest a kamra csúcsához közelebb helyezkedik el (8). Általánosságban 3 vitorlát tartalmazó billentyűkomplexként gondolunk rá, holott postmortem vizsgálatok alapján ez az esetek csak kicsit több mint 50%-ában igaz, a változatok a 2-től az akár 6 vitorláig is terjednek (9, 10). A félkör alakú anterior a legnagyobb vitorla, míg a szeptális a legkisebb. A szeptális vitorla az interventrikuláris szeptum felett ered, jellegzetesen £10 mm-rel a csúcshoz közelebb, mint a mitralis anterior vitorla szeptális eredése. A poszterior gyakran több kisebb vitorlarészből (scallop) áll (1. ábra). A normál tricuspidalis anulus ellipszoid alakú, és nem síkbeli struktúra. Az anteroszeptális része a pitvar felé, míg a poszteroszeptális része a kamra felé van közelebb. A vitorla tartóapparátusa is eltér a mitralis billentyűétől, mert míg a mitralis billentyű esetében a vitorlákhoz mindkét papilláris izomtól húzódnak ínhúrok, addig a tricuspidalis apparátusban eleve több, kisebb méretű papilláris izom található, amelyektől csak a hozzá tartozó vitorlához húzódik ínhúr, valamint a vitorlától húzódó ínhúr közvetlenül is csatlakozhat a jobb kamra endocardiumához (2. ábra). A tartóapparátus különbözősége járul hozzá ahhoz, hogy a jobb kamra tágulása, illetve a szisztolés funkciócsökkenés hatása direkten áttevődik a tricuspidalis anulusra, befolyásolva ezzel a megfelelő vitorlazáródást.

A tricuspidalis anulus igen dinamikus struktúra, amelynek mérete jelentősen változik a szívciklus során. A legkisebb méretét a közép- és végszisztolés helyzetben éri el, míg legnagyobb méretét a késő diasztolé során. Az ellipszoid alakja is sokkal köralakúbbá válik a szisztolé alatt. A normális tricuspidalis anulus területe 8,6±2 cm2 végdiasztolés helyzetben, míg a legnagyobb átmérője 36±4 mm, a legkisebb átmérője pedig 30±4 mm, ahol a köralakúsági mutatója 0,83. A tricuspidalis anulus felszínváltozásának mértéke 35±10% a szívciklus alatt (11). A normálpopulációs vizsgálat szerint az anulus mérete szorosan összefügg mind a jobb pitvari, mind pedig a jobb kamrai volumenekkel, amelyek alapján feltételezhető, hogy mindkét szívüreg méretváltozásai hozzájárulnak a tricuspidalis anulus méretének változásához. A TR súlyosságának növekedése mellett a tricuspidalis anulus dilatációja is észlelhető, amely a leginkább az anterior vitorla felé, a jobb kamra szabad fala irányában következik be. Ezzel párhuzamosan az anulus laposabbá válik, és alakja a normálisan ellipszoid formához képest sokkal inkább körre kezd hasonlítani (12–16).
Etiológia és patofiziológia
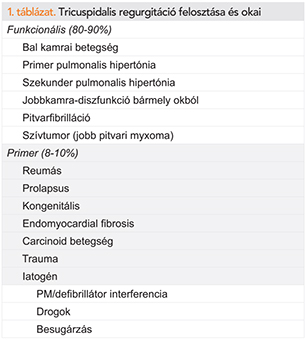
A TR csak mintegy 8-10%-ban primer (organikus), azaz a billentyű strukturális eltérésére vezethető vissza (1. táblázat). A primer TR hátterében világszerte a reumás láz a leggyakoribb ok, amely a restriktívvé váló vitorlák miatt okoz TR-t. Veleszületett defektus, endocarditis, endomiokardiális fibrózis, tompa mellkasi trauma és iatrogen okok (pacemaker-drót okozta TR, besugárzás, iv. droghasználat és bizonyos gyógyszerek hatása) is okozhatnak primer TR-t. A carcinoid szindróma is gyakran jelenik meg primer TR formájában.
A szekunder, funkcionális TR nagyságrendekkel gyakoribb, a TR-esetek közel 80-90%-át teszi ki. A billentyűzáródás elégtelenségének alapját a jobb kamrai remodelling kiváltotta vitorla vongálódás és a tricuspidalis anulus tágulása adja (17). A hátterében a leggyakoribb ok a jobb kamrai nyomásterhelés, amelyet kiválthat a bal szívfél betegsége, primer vagy szekunder pulmonalis hipertónia. Kiválthatja a jobb kamrai volumenterhelés vagy a jobb kamrai szívizombetegség, amely döntően a jobb kamra dilatációján keresztül, valamint a pitvarfibrilláció, amely pedig elsősorban a pitvari méretek növekedése révén járul hozzá a regurgitáció súlyosbodásához. A TR önmagában is tovább emeli a jobb kamra diasztolés nyomását, ezen keresztül gyorsítva a jobb kamrai dilatációt. A TR kialakítva egy kóros kört, öngerjesztővé válik (13). A folyamat a jobb kamrai diasztolés nyomásemelkedés révén a bal szívfélre is kihat: a kamrai szeptum a bal kamra irányába nyomódva a bal kamra diasztolés telődését rontja és emeli a bal kamrai diasztolés nyomást, illetve ezen keresztül a pulmonalis artériás nyomást.
A jobb kamra és a TR kapcsolata igen komplex, és a jobb kamrai funkcióromlás prognosztikai jelentősége magát a TR súlyosságát is felülmúlja. A balszívfél-műtétet követően maga a jobb kamrai funkciócsökkenés a túlélés erős prediktora (18).
A tricuspidalis regurgitáció vizsgálata
A TR sokáig klinikailag tünetmentes, gyakran a jelenlévő tünetek a balszívfél-betegségre vezethetők vissza. A perifériás ödéma inkább előrehaladott állapotban válik nyilvánvalóvá.
A TR értékelésében meghatározó szerepe van a 2D transztorakális echokardiográfiának (TTE). A tricuspidalis apparátus komplexitása miatt a vizsgálata számos kihívást tartogat. A billentyűk megjelenítésére, illetve morfológiai elemzésére az alábbi három 2D-s TTE-metszetet használjuk:
- a parasternalis hossztengelyi nézetből módosított jobb kamrai beáramlási kép,
- parasternalis rövidtengelyi metszet az aortabillentyű síkjában,
- csúcsi négyüregű felvétel (3. ábra). Amennyiben nem megfelelő a képminőség a TTE felvételekhez, használható a TEE is a tricuspidalis billentyű vizualizálásához.

TEE során a közép-oesophagealis metszet 0°-os, és az 50-70°-os jobb kamrai beáramlási-kiáramlási nézetét, a módosított bicavalis felvételt és a transzgasztrikus metszetet használhatjuk. Nehezíti a vizsgálatot az, hogy TEE során a tricuspidalis billentyű az anterior elhelyezkedése miatt a távoli mezőben található, valamint a gyorsan mozgó, vékonyabb tricuspidalis vitorlákat (jellemzően a szeptálist) az aorta anulus kiárnyékolhatja főként, ha ez utóbbiban meszesedés is jelen van. A 2D technika fontos korlátja, hogy csak nagyon ritkán nyújt lehetőséget arra, hogy a tricuspidalis billentyű vitorlái egyszerre vizsgálhatóak legyenek (4. ábra). A háromdimenziós (3D) echónak megvan az az egyedülálló képessége, hogy a tricuspidalis billentyűt és az anulust képes szemből, a sebészi nézetnek megfelelően működése közben mutatni (5. ábra) (13, 19, 20). Emiatt a vitorlahibák azonosításával a 3D echónak kitüntetett szerepe van a primer TR diagnosztikájában.

A jelenlegi ajánlás a TR többparaméteres, összefoglaló értékelését javasolja (21). Az ajánlásban szereplő paraméterek a mitralis regurgitációban használatosakhoz hasonlóak, azonban kevésbé validáltak a TR-re, mint a mitralis elégtelenségre. Általánosságban elmondható, hogy nincs olyan paraméter, amely önmagában képes lenne a TR súlyosságát leírni, így a súlyosság megítélésének az egyes paraméterek és a TR következményeinek együttes értékelésén kell alapulnia.

A TR tényét könnyen bizonyíthatjuk a színes Doppler használatával, amelyhez javasolt valamennyi, a tricuspidalis billentyű vizualizálására alkalmas nézet használata. Azonban az enyhénél súlyosabb esetekben a színes Doppler – számos technikai és hemodinamikai ok miatt – hibás értékelést eredményezhet (22), így önmagában nem javasolt a TR súlyosságának meghatározására (21). A vena contracta (VC) szélesség és a konvergáló áramlás értékelésén alapuló proximális azonos sebességek felszínének (PISA) mérése adja a TR sokkal kvantitatívabb megközelítését.

Vena contracta a billentyűt elhagyó regurgitáló áramlás legkeskenyebb részének átmérője, amely arányos a regurgitáló orificium területével. A méréshez – a kinagyított felvételen – a vizsgálófej optimális pozíciójával állítjuk be a megfelelő színes Doppler alakzatot (Nyquist limit: 40-70 cm/s) a csúcsi négyüregű nézet felhasználásával. A súlyos TR-t a VC ≥7 mm jelzi (21), míg a 6 mm alatti értékek nem alkalmasak a közepesen súlyos vagy az enyhe TR elkülönítésére (23). Elsősorban funkcionális TR mellett a billentyűt elhagyó regurgitáló áramlás keresztmetszeti képe igen szabálytalan (13) (6. ábra), így a 2D alapú VC-mérés gyakran alulbecsli a TR súlyosságát. Ez a tény részben magyarázza, hogy a VC gyenge korrelációt mutat a színes Dopplerrel kombinált 3D echo planimetriás vena contracta terület (VCA) mérésével. A metodika ugyan még további validálást igényel, de az eddigi ismeretek alapján a súlyos TR-t a VCA>0,57 cm2 mutathatja (24, 25).
A TR súlyosságának megítéléshez kvantitatív megközelítést a konvergáló áramláson alapuló mérések (PISA rádiusz, effektív regurgitáló orificum terület [EROA], regurgitáló volumen) biztosítanak. A méréshez a jobb kamrára fókuszált csúcsi négyüregi nézetet, illetve a parasternalis metszeteket használjuk. A tricuspidalis billentyűre fókuszált, nagyított képen a színes Doppler-skála alapvonalát eltoljuk általában a regurgitáló áramlás csúcssebességének 10-20%-ával (Nyquist limit 15-40 cm/s). A PISA sugarát a szisztolé közepén mérjük. A 9 mm-nél nagyobb PISA rádiusz (28 cm/s-os Nyquist limit mellett) megfelel a EROA≥40 mm2, illetve a regurgitáló volumen ≥45 ml-nek, amely értékek a súlyos TR meghatározói. TR osztályozására a PISA-metódust felhasználva is csak a PISA rádiuszmérésnél van lehetőségünk: 5 mm-nél kisebb esetben enyhe, a köztes értékek közepesen súlyos TR-t, a 9 mm-nél nagyobb értékek súlyos regurgitációt valószínűsítenek.

A PISA-metodika esetében is a technikai limitációk hasonlóak, mint a vena contractánál: a PISA-felszín is a legritkább esetekben szabályos félgömbfelszín (7. ábra), így ezzel a módszerrel is kb. az esetek 30%-ában alulbecsüljük a TR súlyosságát (26). Ígéretes megoldást jelenthet a 3D színes Doppler alapú 3D PISA-metódus, mert kiküszöböli a nem gömbfelszínű PISA és a sokszor szabálytalan alakú EROA miatti hibalehetőséget (27).
A TR értékelését segíti még a regurgitáció folyamatos hullámú (CW) Doppler görbe alakjának, a tricuspidalis beáramlási görbe E-hullám sebességének és a vena hepaticában lévő áramlásnak a vizsgálata. A súlyos TR együtt jár a jobb kamrai és a jobb pitvari dimenziók növekedésével is. A jobb kamra dilatációja nem specifikus csak a tricuspidalis regurgitációra, de hiányában a TR valószínűleg enyhe fokú.
A jobb kamrai paraméterek a TR súlyosságával párhuzamosan változnak (28), de a változások mértéke függ a jobb kamrai terheléstől, és így nem tükrözik hűen a valós jobb kamrai kontraktilitást (29). A jobb kamra jellegzetes térbeli alakja miatt az analízis „gold standard-ja” az cMRI, de ehhez hasonló pontosságot érhetünk el 3DE-vel történő elemzéssel is (30). A klinikai gyakorlatban jelenleg a jobb kamrai méretek megítélésére a 2DE során mért jobb kamrai átmérők a legelterjedtebbek. Jobb kamrai dilatációt jelöl, ha a csúcsi 4 üregű, jobb kamrára fókuszált nézeten a jobb kamra bazális átmérője (RVd1) >42 mm, a középső átmérője (RVd2) >33 mm, míg a hossztengelyi mérete >86 mm.
A tricuspidalis anulus is fontos szerepet játszik a tricuspidalis elégtelenség kialakulásában. Ismert, hogy az anuláris dilatáció egyenesen arányos a regurgitáló volumennel (16), továbbá a TR sebészi kezelésében az anulus dilatációjának hangsúlyosabb szerepe van, mint pusztán a TR súlyosság meghatározásának. Azonban a komplex geometriájú, igen dinamikus tricuspidalis anulus mérése komoly kihívást jelent a hagyományos kétdimenziós technikával, amely gyakran alulbecsüli a valós méretet. A 3DE segítségével pontosabb mérésekre van lehetőség, azonban arra nincs adat, hogy a szívciklus alatt jelentős változást mutató struktúra melyik mérete lesz a legfontosabb a kezelés kiválasztásában, illetve a rizikó és a prognózis meghatározásában (11, 31, 32).
A TR súlyosság meghatározásának többparaméteres, az ajánlásban megfogalmazott értékelése alapján a TR akkor súlyos, ha a regurgitáló áramlás folyamatos hullámú Doppler (CW) képe háromszög alakú korai csúccsal, a tricuspidalis beáramlási görbe E-hullámának sebessége >1 m/s, VC >7 mm, PISA rádiusz >9 mm, EROA ≥40 mm2, a regurgitáló volumen ≥45 ml, v. hepaticában szisztoles reverz irányú áramlás látható. Ezeken kívül a súlyos TR-re utaló indirekt jel a paradox kamrai szeptummozgás, a pitvari szeptum bal pitvar felé történő kiboltosulása, illetve a jobb kamra és a jobb pitvar dilatációja.
Fontos megjegyezni, hogy a TR súlyossága nagyban függ a jobb kamrai elő- és utóterheléstől, illetve a jobb kamra szisztolés funkciójától. Szükséges emiatt az optimalizált gyógyszeres (pl. diuretikus) kezelés beállítását követően a mérések megismétlése. Mivel a TR súlyosságát befolyásolja a jobb kamrai terhelés, így az altatott betegen végzett intraoperatív TEE alulbecsülheti a súlyosságot, ezért az intraoperatív TEE nem javasolt a sebészi intervenció szükségességének megítélésére (33). A TR-t meghatározó paraméterek a légzéssel szinkron is változnak: légzés hatására mind az EROA, mind a regurgitáló volumen változik. Belégzéssel a regurgitációs orificium nő, a regurgitáció gradiense csökken, amelyek együttesen nagyobb térfogatú visszaáramló vérmennyiséget eredményeznek (34). A légzéssel összefüggő változások miatt javasolt a több szívciklus során mért értékek átlagolása.
Amennyiben az echokardiográfia technikai okok miatt nem kivitelezhető, akkor alternatív vizsgálóeljárásként elsősorban az cMRI a megfelelő választás (35). Ezzel a vizsgálattal megállapítható a TR súlyossága, mérhető a tricuspidalis anulus mérete, a jobb pitvari volumenek, és karakterizálhatóak a jobb kamrai volumenek és funkció. A CT szintén alkalmas módszer a regurgitációt kialakító mechanizmusok azonosítására (jobb kamra, tricuspidalis anulus), de a vékony vitorlák vizualizálására és a transzvalvuláris áramlás mérésére nem használható. Jobbszívfél-katéterezés akkor válhat indokolttá, ha echokardiogáfiás módszerrel a pulmonalis nyomás nem határozható meg.
Kezelés
A TR kezelése a műtéti korrekciókon alapul elsősorban, a gyógyszeres kezelés csupán a tünetek enyhítését tudja biztosítani. A súlyos TR sokáig tünetmentes tud maradni még a kialakuló jobb kamrai dilatáció és a következményes jobb kamrai szisztolés diszfunkció ellenére is, amely utóbbi a magasabb műtéti kockázat egyik meghatározó tényezője. A betegség klinikai képének ezen sajátossága miatt a sebészi megoldás optimális idejének megválasztása továbbra sem egyértelmű.

A jelenlegi ajánlások alapján (36) a sebészi intervenció javasolt a tüneteket okozó súlyos primer regurgitáció esetében, ha balszívfél-betegség miatt műtétet terveznek, vagy ha jobb kamrai funkcióromlás még nem alakult ki (I. osztályú ajánlás). Tünetmentes betegeknél a sebészi megoldás megfontolandó akkor, ha jobb kamrai dilatáció vagy szisztolés funkcióromlás észlelhető (IIa osztályú ajánlás) (8. ábra). Funkcionális TR mellett a műtéti megoldás a panaszoktól függetlenül javasolt, ha a regurgitáció súlyos és a bal szívfél betegsége miatt eleve indokolt a műtét (I. osztályú ajánlás). Ezt támasztják alá azok a megfigyelések, amelyek bizonyították, hogy a balszívfél-műtéteihez társuló tricuspidalis plasztika nem emeli jelentősen a perioperatív mortalitást és morbiditást (37, 38), de a TR progresszióját csökkentve javítja az eseménymentes túlélést (39, 40). Ezzel szemben, ha a mitralis billentyűműtéttel egy időben nem került megoldásra a TR, akkor jelentős progressziót észleltek a regurgitáció súlyosságában az utánkövetés kapcsán (5). Így IIa osztályú ajánlásként szerepel a tricuspidalis anuloplasztika elvégzése a balszívfél-műtétével egyidejűleg – függetlenül a regurgitáció súlyosságától, ha jelentős a tricuspidalis anulus dilatációja (≥40 mm, vagy 21 mm/m2) (7, 41) (8. ábra). Szintén ajánlott (II.a) a korai műtét a balszívfél-műtétet követően kialakult súlyos TR miatt tünetes betegeknél, vagy tünetmentes állapotban, ha progresszív jobb kamrai dilatáció/diszfunkció figyelhető meg, de még nincs súlyos jobb vagy bal kamrai funkcióromlás és súlyos pulmonalis vaszkuláris betegség/hipertenzió (8. ábra).
A sebészi technikákat tekintve a tricuspidalis anuloplasztika az elsőként ajánlott, alacsony rizikójú beavatkozás, hiszen a billentyűmegtartó műtétekhez képest a műbillentyű-beültetés magasabb kockázatú beavatkozásnak számít (10 éves túlélés csupán 30-50%). Amennyiben mégis műbillentyű-beültetés szükséges, az adatok alapján a biológiai típust érdemes preferálni a mechanikussal szemben (6, 38, 42, 43). A sebészi rizikót növeli a jobb kamrai dilatáció/diszfunkció, illetve a vitorlahibát kiváltó etiológia az organikus TR esetében. Ugyanakkor éppen a primer (organikus) TR diagnózisának felállításakor érhető leginkább tetten a 2D echokardiográfia technikai korlátai. Szintén a technikai korlátok az okai annak, hogy a 2D echokardiográfia nem tud elegendően pontos és részletes adatokat biztosítani a tricuspidalis anulus valós méreteiről a sebészi intervenció tervezéséhez (pl. méretválasztás), amely az intervenció típusától függetlenül a műtét sikerességét befolyásolja.
A TR-intervenciók közül a legnagyobb kockázattal a korábbi szívműtétet követően kialakult TR miatt végzett műtét jár. Ebben az esetben a korai perioperatív mortalitás elérheti a 30%-ot is, és a hosszú távú eredmények sem túlságosan biztatóak (44, 45), amelynek leggyakoribb oka az előrehaladott (és gyakran már irreverzibilis) jobb kamrai funkcióromlás.
A TR típusától függetlenül igaz az a tény, hogy a súlyos TR sokáig tünetmentes tud maradni, illetve a tünetek jól reagálnak a diuretikus kezelésre, így sok esetben a műtétre már csak akkor kerül sor, amikor a jobb kamrai diszfunkció már előrehaladott stádiumban van, ami jelentősen emeli a műtét kockázatát. Valószínűleg ez a tény járul hozzá leginkább ahhoz, hogy TR műtéti megítélése hazánkban jelenleg igen ellentmondásos.
A magas műtéti rizikójú betegeknek nyújthatnak terápiás lehetőséget a perkután alkalmazható katéteres tricuspidalis intervenciós eszközök, módszerek. Az erre a célra fejlesztett eszközök többsége még a korai klinikai vizsgálati fázisban van, így kellő tapasztalat még nem áll rendelkezésre. Az eddigi adatok alapján feltételezhető, hogy azok a magas sebészi kockázatú betegek profitálhatnak a beavatkozásból leginkább, akiknek egyszerre van jelen katéteres intervencióra alkalmas súlyos funkcionális mitralis és tricuspidalis regurgitációja, vagy akiknél a bal szívfél betegsége miatt végzett műtétet követően alakult ki és progrediált a súlyos TR (46, 47).
Következtetések
A TR gyakori echokardiográfiás lelet, amelynek döntő részét a funkcionális regurgitáció adja. A TR klinikailag sokáig tünetmentes, ugyanakkor már a közepesen súlyos stádium is rosszabb túlélé st eredményez. A TR súlyosságának megítélésében és a következmények értékelésében kiemelt szerepe van a 2D echokardiográfiának. Fontos hangsúlyozni, hogy az egyes paramétereket ne önállóan, hanem összefüggéseikben értelmezzük, mert önmagában egyik paraméter sem alkalmas a TR súlyosságának pontos leírására. Ismernünk kell azonban a vizsgálómódszerek korlátait, hogy helyesen értelmezzük például az egyes mérések változó eredményeit (pl. volumenstátusz hatása). A tricupidalis apparátus komplex térbeli alakja miatt a meghatározás pontosságát növelik azok a vizsgálóeljárások, melyek térbeli információt is képesek biztosítani (pl. 3DE, cMRI), ezen módszerek a sebészi intervenció tervezését is segíthetik. A TR kezelése alapvetően a sebészi megoldáson alapul, ezek közül a billentyűmegtartó műtéti megoldások a kedvezőbbek. A TR jelentős hányadát adó funkcionális TR esetében a bal szívfél betegsége miatt indikált műtéttel egy időben végzett tricuspidalis anuloplasztika jár a legalacsonyabb kockázattal. A műtéti rizikót jelentősen növeli a jobb kamra funkcióromlása, amellyel akkor szembesülünk, ha beteg későn, előrehaladott stádiumba kerül referálásra. A jövőben a katéteres tricuspidalis intervenciós módszerek a nagy műtéti kockázatú betegeknek nyújthatnak megoldást.
Irodalom
1. Singh JP, et al. Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study). Am J Cardiol 1999; 83(6): 897–902. doi: https://doi.org/10.1016/S0002-9149(98)01064-9
2. Ong K, Yu G, Jue J. Prevalence and spectrum of conditions associated with severe tricuspid regurgitation. Echocardiography 2014; 31(5): 558–62. doi: https://doi.org/10.1111/echo.12420
3. Taramasso M, et al. The growing clinical importance of secondary tricuspid regurgitation. J Am Coll Cardiol 2012; 59(8): 703–10. doi: https://doi.org/10.1016/j.jacc.2011.09.069
4. Nath J, Foster E, Heidenreich PA. Impact of tricuspid regurgitation on long-term survival. J Am Coll Cardiol 2004; 43(3): 405–9. doi: https://doi.org/10.1016/j.jacc.2003.09.036
5. Kim JB, et al. Mild-to-moderate functional tricuspid regurgitation in patients undergoing valve replacement for rheumatic mitral disease: the influence of tricuspid valve repair on clinical and echocardiographic outcomes. Heart 2012; 98(1): 24–30. doi: https://doi.org/10.1136/heartjnl-2011-300403
6. Vassileva CM, et al. Tricuspid valve surgery: the past 10 years from the Nationwide Inpatient Sample (NIS) database. J Thorac Cardiovasc Surg 2012; 143(5): 1043–9. doi: https://doi.org/10.1016/j.jtcvs.2011.07.004
7. Vahanian A, et al. Guidelines on the management of valvular heart disease (version 2012). European Heart Journal 2012; 33: 2451–2496.
8. Rogers JH, Bolling SF. The tricuspid valve: current perspective and evolving management of tricuspid regurgitation. Circulation 2009; 119(20): 2718–25. doi: https://doi.org/10.1161/CIRCULATIONAHA.108.842773
9. Mishra P, Mishra A, Pouranam V. Variations in the number and morphology of cusps of the tricuspid valve: a cadaveric study. Int J Biomed Res 2016; 7(01): 039–43. doi: https://doi.org/10.7439/ijbr
10. Sutton JP, 3rd, et al. Is the morphologically right atrioventricular valve tricuspid? J Heart Valve Dis 1995; 4(6): 571–5.
11. Addetia K, et al. 3-Dimensional Echocardiographic Analysis of the Tricuspid Annulus Provides New Insights Into Tricuspid Valve Geometry and Dynamics. JACC Cardiovasc Imaging 2017. doi: https://doi.org/10.1016/j.jcmg.2017.08.022
12. Dreyfus GD, et al. Functional tricuspid regurgitation: a need to revise our understanding. J Am Coll Cardiol 2015; 65(21): 2331–6. doi: https://doi.org/10.1016/j.jacc.2015.04.011.
13. Badano LP, Muraru D, Enriquez-Sarano M. Assessment of functional tricuspid regurgitation. Eur Heart J 2013; 34(25): 1875–85. doi: https://doi.org/10.1093/eurheartj/ehs474
14. Ton-Nu TT, et al. Geometric determinants of functional tricuspid regurgitation: insights from 3-dimensional echocardiography. Circulation 2006; 114(2): 143–9. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.611889
15. Fukuda S, et al. Three-dimensional geometry of the tricuspid annulus in healthy subjects and in patients with functional tricuspid regurgitation: a real-time, 3-dimensional echocardiographic study. Circulation 2006; 114(Suppl 1): I492–8. doi: https://doi.org/10.1161/CIRCULATIONAHA.105.000257
16. Hai T, et al. Changes in Tricuspid Annular Geometry in Patients with Functional Tricuspid Regurgitation. J Cardiothorac Vasc Anesth 2017; 31(6): 2106–2114. doi: https://doi.org/10.1053/j.jvca.2017.06.032
17. Topilsky Y, et al. Clinical context and mechanism of functional tricuspid regurgitation in patients with and without pulmonary hypertension. Circ Cardiovasc Imaging 2012; 5(3): 314–23. doi: https://doi.org/10.1161/CIRCIMAGING.111.967919
18. Kammerlander AA, et al. Right ventricular dysfunction, but not tricuspid regurgitation, is associated with outcome late after left heart valve procedure. J Am Coll Cardiol 2014; 64(24): 2633–2642. doi: https://doi.org/10.1016/j.jacc.2014.09.062.
19. Badano LP, et al. Evaluation of the tricuspid valve morphology and function by transthoracic real-time three-dimensional echocardiography. Eur J Echocardiogr 2009; 10(4): 477–84. doi: https://doi.org/10.1093/ejechocard/jep044
20. Muraru D, et al. Evaluation of tricuspid valve morphology and function by transthoracic three-dimensional echocardiography. Curr Cardiol Rep 2011; 13(3): 242–9. doi: https://doi.org/10.1007/s11886-011-0176-3.
21. Lancellotti P, et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: An executive summary from the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging 2013; 14: 611–644. doi: https://doi.org/10.1093/ehjci/jet105
22. Gonzalez-Vilchez F, et al. Assessment of tricuspid regurgitation by Doppler color flow imaging: angiographic correlation. Int J Cardiol 1994; 44(3): 275–83. doi: https://doi.org/10.1016/0167-5273(94)90292-5
23. Tribouilloy CM, et al. Quantification of tricuspid regurgitation by measuring the width of the vena contracta with Doppler color flow imaging: a clinical study. J Am Coll Cardiol 2000; 36(2): 472–8. doi: https://doi.org/10.1016/S0735-1097(00)00762-2
24. Chen TE, et al. Three-dimensional color Doppler echocardiographic quantification of tricuspid regurgitation orifice area: comparison with conventional two-dimensional measures. J Am Soc Echocardiogr 2013; 26(10): 1143–52. doi: https://doi.org/10.1016/j.echo.2013.07.020
25. Song JM, et al. The vena contracta in functional tricuspid regurgitation: a real-time three-dimensional color Doppler echocardiography study. J Am Soc Echocardiogr 2011; 24(6): 663–70. doi: https://doi.org/10.1016/j.echo.2011.01.005
26. Mascherbauer J, Maurer GT. The forgotten valve: lessons to be learned in tricuspid regurgitation. Eur Heart J 2010; 31(23): 2841–3. doi: https://doi.org/10.1093/eurheartj/ehq303
27. de Agustin JA, et al. Proximal isovelocity surface area by single-beat three-dimensional color Doppler echocardiography applied for tricuspid regurgitation quantification. J Am Soc Echocardiogr 2013; 26(9): 1063–72. doi: https://doi.org/10.1016/j.echo.2013.06.006
28. Hsiao SH, et al. Severe tricuspid regurgitation shows significant impact in the relationship among peak systolic tricuspid annular velocity, tricuspid annular plane systolic excursion, and right ventricular ejection fraction. J Am Soc Echocardiogr 2006; 19(7): 902–10. doi: https://doi.org/10.1016/j.echo.2006.01.014
29. Selton-Suty C, Juilliere Y. Non-invasive investigations of the right heart: how and why? Arch Cardiovasc Dis 2009; 102(3): 219–32. doi: https://doi.org/10.1016/j.acvd.2008.12.010
30. Muraru D, et al. New speckle-tracking algorithm for right ventricular volume analysis from three-dimensional echocardiographic data sets: validation with cardiac magnetic resonance and comparison with the previous analysis tool. Eur Heart J Cardiovasc Imaging, 2016; 17(11): 1279–1289. doi: https://doi.org/10.1093/ehjci/jev309
31. Miglioranza MH, et al. Dynamic changes in tricuspid annular diameter measurement in relation to the echocardiographic view and timing during the cardiac cycle. J Am Soc Echocardiogr 2015; 28(2): 226–35. doi: https://doi.org/10.1016/j.echo.2014.09.017
32. Muraru D, Surkova E, Badano LP. Revisit of Functional Tricuspid Regurgitation; Current Trends in the Diagnosis and Management. Korean Circ J 2016; 46(4): 443–55. doi: https://doi.org/10.4070/kcj.2016.46.4.443
33. Bajzer CT, et al. Tricuspid valve surgery and intraoperative echocardiography: factors affecting survival, clinical outcome, and echocardiographic success. J Am Coll Cardiol 1998; 32(4): 1023–31. doi: https://doi.org/10.1016/S0735-1097(98)00355-6
34. Topilsky Y, et al. Pathophysiology of tricuspid regurgitation: quantitative Doppler echocardiographic assessment of respiratory dependence. Circulation 2010; 122(15): 1505–13. doi: https://doi.org/10.1161/CIRCULATIONAHA.110.941310
35. Kim HK, et al. Assessment of hemodynamic effects of surgical correction for severe functional tricuspid regurgitation: cardiac magnetic resonance imaging study. Eur Heart J, 2010; 31(12): 1520–8. doi: https://doi.org/10.1093/eurheartj/ehq063
36. Falk V, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg 2017; 52(4): 616–664. doi: https://doi.org/10.1093/ejcts/ezx324
37. Zhu TY, Wang JG, Meng X. Does concomitant tricuspid annuloplasty increase perioperative mortality and morbidity when correcting left-sided valve disease? Interact Cardiovasc Thorac Surg 2015; 20(1): 114–8. doi: https://doi.org/10.1093/icvts/ivu326
38. Verdonk C, et al. Is tricuspid annuloplasty increasing surgical mortality and morbidity during mitral valve replacement? A single-centre experience. Arch Cardiovasc Dis 2017. doi: https://doi.org/10.1016/j.acvd.2017.08.006
39. Pagnesi M, et al. Tricuspid annuloplasty versus a conservative approach in patients with functional tricuspid regurgitation undergoing left-sided heart valve surgery: A study-level meta-analysis. Int J Cardiol 2017; 240: 138–144. doi: https://doi.org/10.1016/j.ijcard.2017.05.014
40. Desai RR, et al. Tricuspid regurgitation and right ventricular function after mitral valve surgery with or without concomitant tricuspid valve procedure. J Thorac Cardiovasc Surg 2013; 146(5): 1126–1132 e10. doi: https://doi.org/10.1016/j.jtcvs.2012.08.061
41. Nishimura RA, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63(22): e57–185.
42. Chang BC, et al. Long-term clinical results of tricuspid valve replacement. Ann Thorac Surg 2006; 81(4): 1317–23. discussion 1323–4.
43. Navia JL, et al. Surgical management of secondary tricuspid valve regurgitation: annulus, commissure, or leaflet procedure? J Thorac Cardiovasc Surg 2010; 139(6): 1473–1482 e5.
44. McCarthy PM, et al. Tricuspid valve repair: durability and risk factors for failure. J Thorac Cardiovasc Surg 2004; 127(3): 674–85.
45. Chan DT, et al. Late tricuspid surgery: predicting outcome with computed tomography. Asian Cardiovasc Thorac Ann 2011; 19(2): 128–32.
46. Ohno Y, et al. Association of tricuspid regurgitation with clinical and echocardiographic outcomes after percutaneous mitral valve repair with the MitraClip System: 30-day and 12-month follow-up from the GRASP Registry. Eur Heart J Cardiovasc Imaging 2014; 15(11): 1246–55.
47. Buzzatti N, et al. Long-term outcomes of tricuspid valve replacement after previous left-side heart surgery. Eur J Cardiothorac Surg 2014; 46(4): 713–9; discussion 719.