How does eplerenone work?
█ Review
DOI: 10.26430/CHUNGARICA.2018.48.6.410
Authors:
Moser György
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet, Kardiológiai Osztály Szolnok
Summary
It is a key issue to understand in common clinical practice why it is important to block the activated renin-angiotensin-aldosterone system at two different points of action. The author analyzes in detail the escape mechanisms, and on the other hand, the interdependence within the renin-angiotensin-aldosterone system and amongst the components of the whole neuroendocrine activation, that justifies the approach mentioned above. A significant part of this analysis is to describe the advantages of using eplerenone over its „precursor”, spironolactone, and how these advantages hold for the extension of treatment with mineralocorticoid receptor antagonists. The major problems going forward are to determine the mechanism of the remodeling effect of eplerenone, the components involved, and the time course of this process. Knowing the dynamics of remodeling, we should, by being able to optimize the time of initiation of eplerenone therapy, to best utilize the potential of this therapy.
ISSUE: CARDIOLOGIA HUNGARICA | 2018 | VOLUME 48, ISSUE 6
Összefoglalás
A klinikai gyakorlatban kulcsfontosságú kérdés, hogy miért van szükség az aktivált renin–angiotenzin–aldoszteron-rendszer két elkülönült támadásponton történő blokádjára. A szerző részletesen taglalja egyfelől az escape mechanizmusokat, másrészt azokat a renin–angiotenzin–aldoszteron-rendszeren belüli, és a neuroendokrin aktiváció összetevői közt fellelhető interdependenciát, amelyek a fenti megközelítést indokolttá teszik. Kiemelt helyet kap annak elemzése, hogy az eplerenon milyen előnyöket tud felmutatni „elődjével”, a spironolaktonnal szemben, s azok mennyiben szolgálhatják a mineralokortikoid-receptor-antagonista terápia kiterjesztését. Súlyponti probléma az eplerenon antiremodelling hatásának mechanizmusa, komponensei és időfaktora, s az utóbbi ismeretében e terápia optimális időpontjában történő iniciálásában rejlő (még) kihasználatlan lehetőségek.
Bevezetés
A mineralokortikoid-receptorok (MR) blokádja csökkenti szívelégtelenségben a hirtelen halál és a szívelégtelenség progressziójából adódó mortalitást, valamint a szívelégtelenség miatt történő hospitalizációk számát, angiotenzin konvertáz enzim (ACE) gátló kezelésben már részesülő, bal kamrai (BK) szisztolés diszfunkcióban szenvedő betegeken. Habár az aldoszteron kardiális hatása, élettani homeosztatikus szerepe nem tekinthető minden részletében tisztázottnak, retrospektíve a fentiek a maladaptáció bizonyítékának tekinthetők. E terápia igényes vezetéséhez azonban ismernünk kell a rendelkezésre álló gyógyszereket az adekvát differenciálterápiás döntésekhez, tisztában kell lenni kedvező hatásuk farmakodinamikájával és a potenciális mellékhatások minéműségével, mechanizmusával, elkerülésük és kivédésük lehetőségeivel.
Az aldoszteronról általában
Az aldoszteron fiziológiás állapotban a legfontosabb mineralokortikoid. Az aldoszteron a mineralokortikoid-receptoroknak azonban nem egyetlen ligandja. Az életkor előrehaladtával az aldoszteronszint csökken, a kortizolszint viszont emelkedik, amely az MR-ekhez potens agonistaként kötődik. (Oka, hogy az életkorral a 11β-hidroxi-kortikoszteron dehidrogenáz-2 enzim aktivitása csökken, amely a kortizolt kortizonná alakítja, amely utóbbi viszont nem aktiválja az MR-t) (1). Az életkorral az MR-receptorok expressziója is fokozódik. Mindezt összevetve, az idősödő betegeken az MR-eken a kortizol által mediált jelátvitel fontosabb szerephez jut. Az aldoszteron a mellékvese-kéregben termelődik, de az aldoszteronszintézis enzimjei expresszálódnak a vaszkulatúrában is, ott is szintetizálódik. Fiziológiásan a szívben nem igazolt az aldoszterontermelés, de nem zárható ki, hogy bizonyos patológiás állapotokban (szívinfarktus, szívelégtelenség) létrejöhet. Fő hatása az epiteliális elektrolittranszport szabályozása elsősorban a vesében, de más szövetekben is, mint pl. a nyálmirigyekben, vastagbélben (2). Az aldoszteron epiteliális – főként a renális tubuláris (transz)epiteliális-ionáramlásra gyakorolt hatása primer hiperaldoszteronizmusban a legszembetűnőbb: hypokalaemiás, hypochloraemiás alkalózis, emelkedett szérum Na+-szinttel. A plazma Ca2+ és Mg2+-szintje is a K+-nál azonos irányban változik. A nyomelemek közül kiemelendő, hogy a Li+ is K+-analógnak tekinthető a renin–angiotenzin–aldoszteron-rendszer (RAAS) aktivitásának változása során. Hiperaldoszteronizmusban a balkamra-hipertrófia és a stroke veszélye nagyobb, mint azonos mértékű esszenciális hipertónia esetén. Számos vizsgálat igazolta az aldoszteron hatására létrejött súlyos inflammatorikus léziókat a koronáriákban, monocita/makrofág infiltrációval, következményes iszkémiával, nekrózissal (3). Az aldoszteron ex vivo vizsgálat szerint két módon fejti ki hatását:
- Az MR-ekhez kötődve, génaktiváció útján, ez a „hagyományosan ismert”, lassan kifejődő hatás.
- Az „alternatív” út is plazmamembrán receptorokat aktivál, e hatás gyorsan kifejlődik, nem involvál génexpressziót, biológiai hatásnak, nongenom hatásnak is nevezik. Erre utal az aldoszteronnak az eritrocitákban a Na+-ioncserére kifejtett hatása – minthogy ismert tény, hogy a vörösvértestek nem tartalmaznak DNS-t. A vaszkuláris simaizomsejtekben perceken belül fokozza a Na+-beáramlást a Na+ – H+-ioncsere fokozása útján. E folyamat dinamikája túl gyors ahhoz, hogy a hátterében génaktiváció állhatna (2). A spironolaktonról tudjuk, hogy az aldoszteron ezen utóbbi hatásait nem blokkolja (4).
Az aldoszteron toxikus hatásai három fő csoportba oszthatók (lehetséges, hogy az első hatás a primer, a második és a harmadik annak következménye): - specifikus aldoszteron vaszkulopátia: az aldoszteron endothel-diszfunkciót okoz. Hátterében valószínűleg a szuperoxid-termelés következtében csökkenő NO-szint áll. (Az aldoszteron és az angiotenzin-II egyaránt lebontja az NO-t.) Az aldoszteron-blokád az endotheliális NO-aktivitást akár 94%-kal emeli (5), míg az ACE-gátlók, illetve a statinok csak ≈25-35%-kal javítják az endothel-diszfunkciót. Az endothel-diszfunkció javítása csökkenti az elkövetkező kardiovaszkuláris (CV) események számát (4). A HOPE-vizsgálat a statinok és ACE-gátlók, a RALES-study a spironolakton vonatkozásában igazolta a fentieket. Az aldoszteron csökkenti a vaszkuláris compliance-t, s emeli a plazminogén aktivátor inhibitor-1 szintjét is, fokozva a trombogenitást. Az MR-antagonisták emelik a szervezet K+ és Mg2+-tartalmát. A K+ szérum szintjének emelkedése önmagában endothel-hiperpolarizáló faktornak tekinthető, amely ezáltal endothel dependens vazodilatációt okoz. Az orális Mg adás anginás betegeken csökkenti az endothel-diszfunkciót, de nem tisztázott, hogy e hatás involválja-e az NO-t.
- Aldoszteron indukálta miokardiális fibrózis: az aldoszteron emeli a III. típusú prokollagén aminoterminális peptid (PIIINP) szintjét, amely a kollagén turnover indikátora, a szintézist és degradációt egyaránt fémjelzi (6, 7). Az is ismert, hogy a fibroblasztokon az MR-en kívül angiotenzin-II-receptor is van, amelyeket az aldoszteron upregulál, indirekt módon elősegítve a fibrózist. Az aldoszteron fibrózist és hipertrófiát a non epitheliális szövetekben fokozza (8). A szívben a perivaszkuláris és intersticiális fibrózis az elektromos remodelling, elektromos inhomogenitás (aritmogenitás) patofiziológiai alapját képezheti. A strukturális váz merevebbé válása a diasztolés funkciót (a szív passzív elaszticitását) kedvezőtlenül befolyásolja. A perivaszkuláris fibrózis a perfúziót is kedvezőtlenül befolyásolhatja, azáltal a szív aktív relaxációját is károsíthatja.
- Az aldoszteron hatása a vegetatív idegrendszerre: a spironolaktonról igazolták, hogy a szív adrenerg aktivitását csökkenti, s a vagustónus kardiális hatását fokozza (9).
A fenti effektus szoros kapcsolatban áll az MR-antagonisták mortalitáscsökkentő hatásával (4). Az aldoszteron csökkenti a baroreflex szenzitivitást és a szívfrekvencia-variabilitást. Arra is van irodalmi adatunk, hogy 200 mg iv. adott kanrenoát (a spironolakton fő aktív metabolitja) akutan javítja a vagus kontrollt (10). Az NO kulcsfontosságú regulátor az autonóm idegrendszerben (5, 11, 12). Minthogy az aldoszteron vaszkulopátia karakterisztikus vonása az NO-deficit, a vegetatív idegrendszer modulációjára is kézenfekvő magyarázattal (összekötő kapoccsal) szolgálhat az NO-szint változása.
Termeli vagy extrahálja a szív az aldoszteront?
Több évtizede ismert, hogy a szívben az aldoszteronszint meghaladja a szérum aldoszteronszintet. Ennek hátterében az intrakardiális szintézisét valószínűsítették, ugyanazon stimulusok hatására, amelyek a mellékvese aldoszteron-termelését is provokálják (13). A fenti kérdés eldöntése intenzív kutatás tárgya, s számos experimentális adat áll már rendelkezésünkre. Az aldoszteron a szívben extrahálódik és koncentrálódik nemcsak szívelégtelenségben, hanem, ha kisebb mértékben, de fiziológiásan is. Ezidáig a szívben az aldoszteron-termelés enzimjeinek expresszióját igazolni nem tudták humán vonatkozásban (2). Kulcsfontosságú problémakör a szív aldoszteron-akkumulációjánák változása patológiás körülmények közt (mint pl. kongesztív szívelégtelenség, szívinfarktus), illetve a szív aldoszteron-extrakciója és a ventrikuláris remodelling kapcsolata. Szintén lényegi kérdés (s az előbbitől nem választható el) a szív aldoszteron-extrakciójának prognosztikus jelentősége. Először a transzkardiális aldoszteron grádiens (vagy extrakció) fogalmát kell definiálni, ami nem más, mint az aortagyök- és a sinus coronarius szérum aldoszteronszintjének különbsége, aránya. Nagyságrendileg ezt kongesztív szívelégtelenségben kb. 20%-nak találták (14), s pozitív korrelációt mutat a bal kamrai végszisztolés volumenindex (LVESVI) értékével. Érdemes Tsutamoto és munkatársai vizsgálatának esszenciáját itt áttekinteni (15). Első miokardiális infarktust elszenvedett, revaszkularizált, enalaprillal kezelt betegeken mérték a szérum aldoszteronszintet az aortagyökben, illetve a sinus coronariusban, az akut szakban, illetve egy hónap elteltével. Meghatározták a plazma PIIINP-szinteket is. Az akut fázisban a szérum aldoszteronszint lényegesen alacsonyabb volt a sinus coronariusban, mint az aortagyökben. A szív tehát az aldoszteront akkumulálta (de az még önmagában nem zárja ki, hogy a szív is termel aldoszteront). Az akut szakban nem volt szignifikáns különbség a bal kamrai ejekciós frakció (LVEF), a bal kamrai végdiasztolés volumenindex (LVEDVI) és az LVESVI vonatkozásában a magas, illetve az alacsony transzkardiális aldoszteron-extrakciót mutató csoport betegein. Egy hónap elteltével viszont az előbbi betegpopulációban az LVEF-et szignifikánsan alacsonyabbnak találták, az LVEDV és az LVESVI szignifikánsan magasabb volt. Bár az előbbiekkel összefügg, mégis érdemes kiemelni, hogy a magas kardiális aldoszteron-extrakciót mutató betegeknél az LVEDVI abszolút változása szignifikánsan nagyobb volt. Az akut szakban ugyanakkor a magas transzkardiális aldoszteron-extrakcióval jellemzett betegeken az arteria pulmonalis középnyomás, a PCWP és a jobb pitvari középnyomás magasabb volt, egy hónap elteltével viszont már számottevő különbség a fenti hemodinamikai paraméterek terén nem mutatkozott. A magasabb aldoszteron-extrakció az első hónap végén is megmaradt, de csökkent mértékben. Korábbi adatokkal egybevetve, tudjuk, hogy a szív fokozott aldoszteron-extrakciója a szívinfarktus krónikus stádiumában is megmarad (15). Az első hónap végére a magas transzkardiális aldoszteron extrakcióval jellemzett betegeken a sinus coronarius PIIINP-szintje szignifikánsan megemelkedett, míg az akut szakban a két csoport között különbség e tekintetben nem volt észlelhető. (Ezen megfigyelés arra enged következtetni, hogy a szív által extrahált aldoszteron az MR-ek által mediáltan fokozza a szív kollagén szintézisét, a fibrózis létrejöttét a szívben.) Az akut szak transzkardiális aldoszteron gradiense és az egy hónap elteltével mért sinus coronarius PIIINP-szint között szignifikáns pozitív korrelációt igazoltak (tehát ez utóbbi biomarker az LVEDVI változása azonos trendet mutat). Mindez arra utal, hogy a miokardiális aldoszteronextrakció a posztinfarktusos BK-i remodellingnek alapvető modulátora (függetlenül az infarktus méretétől), a hemodinamiai tényezőkkel szoros összefüggésben. Humán szívben az MR-ek a cardiomyocytákban, a fibroblasztokban és az endothelsejtekben expresszálódnak. A BK-i remodelling, amelyet mechanikai, neurohormonális és terápiás tényezők modifikálnak (16, 17), szívinfarktus után a morbiditás és a mortalitás fontos prediktora (18). Több szerző is publikálta, hogy a szérum aldoszteronszint emelkedése szoros kapcsolatban áll a bal kamrai remodellinggel és a hosszú távú prognózissal (19, 20). Tsutamoto fent részletezett vizsgálatában a teljes betegpopuláción globálisan is emelkedett szérum aldoszteronszintet találtak, és az aortagyök emelkedett szérum aldoszteronszintje pozitívan korrelált a szív aldoszteron-extrakciójával (15). Ez arra utal, hogy önmagában a plazma aldoszteronszintjének mérésével a BK-i remodelling egy alapvető promoterére tudunk következtetni. A klinikumra vonatkozó üzenet: a fenti vizsgálat eredménye (is) érveket jelent AMI-ban a posztinfarktusos remodelling prevenciójára, az MR-antagonista és ACE-gátló kezelés mielőbbi elkezdése mellet, hiszen az infarceált régió expanziója már az első héten zajlik. Arra is vannak adataink, hogy a plazma aldoszteronszint csökkentése a szívinfarktus akut szakában hatékony a posztinfarktusos bal kamrai remodelling megelőzésére (21). Modena és munkatársai vizsgálata alapján az ACE-gátló és aldoszteronreceptor-antagonista együttes adása 9 nappal az AMI kezdete után – szemben az önmagában adott ACE-gátlóval – alkalmas volt a BK-i remodelling megelőzésére (22).
Escape mechanizmusok a RAAS effektor hormonjai esetén

A klinikum további taglalása előtt érdemes feleleveníteni néhány patomechanizmust, amelyek érvet jelentenek a több támadáspontú RAAS-blokád mellett.
Ha egy stadionba tömeg halad be a kapukon, s egy kaput bezárunk, csökken a közönség beáramlása. A nép azonban hamarosan a többi bejáratokhoz csoportosul, s a bejutás üteme akár meghaladhatja a korábbit. Ez az escape jelenség lényege, használatos a breakthrough (áttörés), illetve a szintézis reaktiváció kifejezés is. Az ACE-gátló kezelés során jól ismert az angiotenzin-II escape, illetve aldoszteron escape fogalma. (Az utóbbi ARB-kezelés esetén is létrejöhet.) Lényege, hogy egy reakcióút lezárásakor a szubsztrátkínálat egy másik katalitikus rendszer elé torlódik, annak upregulatióját eredményezve. A háttérben részben a több potenciális angiotenzin-II, illetve aldoszteron-képződési út áll, de inszufficiens ACE-gátló dózis is releváns tényező lehet (a kaput nem csukjuk be, csak „behajtjuk”, s a feltorlódott tömeg az ajtót benyomja). Az ACE gátlása az angiotenzin-I felhalmozódását eredményezi, amelynek folytán enzimindukció következhet be, felülírva az inszufficiens gátlást. Más tehát formális, és a potens ACE-gátlás esetén az escape mechanizmusa. Az alternatív reakcióutak több lehetőségét tekintve (1., 2. ábra) nem meglepő, hogy az aldoszteron escape lényegesen gyakoribb, mint az angiotenzin-II escape. A 2. ábrából az is látható, hogy az angiotenzin-II (az ábrán A II) escape egyben komponense az aldoszteron escape-nek is. Fontos azonban, hogy nem minden kapu azonos áteresztő képességű. Kiemelendő az ACTH, mint potens stimuláns, s a hypokalaemia aldoszteron-termelést szupprimáló hatása, amelyre az aldoszteron-szekréció rendkívül szenzitíven reagál.

MacFadyen és munkatársai ACE-inhibitorral kezelt kongesztív szívelégtelen végzett vizsgálatában a betegek 15%-ában igazoltak angiotenzin-II reaktivációt, míg az aldoszteron-szuppressziót a betegek 38%-ában találták inszufficiensnek (23). Az ACE-gátlók, illetve az ARB-k adása tehát nem tekinthető a szekunder hiperaldoszteronizmus megbízható prevenciójának. ACE-gát-lókkal hosszú távon nagyságrendileg mintegy 20%-os aldoszteronszint-csökkenés érhető el.
Összefüggések, visszacsatolások a neuroendokrin rendszer elemei között, illetve a RAAS-on belül
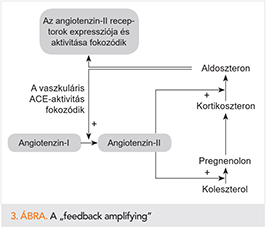
RAAS önmagában sem egy lineáris folyamatábraként illusztrálható, s a neuroendokrin rendszer többi összetevője (szimpatoadrenális aktiváció stb.) sem párhuzamosan zajló folyamatok. A RAAS-on belül többszörös, pozitív bidirekcionális visszacsatolások működnek (feedback amplifying) (3. ábra), amelyek a neuroendokrin rendszer egészével összefonódva egymást kölcsönösen erősítő rendszert képeznek (reciprocal reinforcement) (4. ábra).

Az escape mechanizmusokat és RAAS két effektor hormonjának (angiotenzin-II és aldoszteron) szövevényes kölcsönhatásait áttekintve érthetővé válik, hogy az aktivált RAAS potens blokádja csak mindkét út együttes gátlásával lehet hatékony. Hasonlítható a helyzet ahhoz, mint amikor egy makramé hálózatát akarjuk meggyengíteni: a fonalat több helyen kell átvágni.
Az eplerenon terápia előzményeiről
A RALES-vizsgálat mérföldkő a spironolakton kedvező hatásának bizonyításában kongesztív szívelégtelenségben. A <35% BK-i ejekciós frakciójú, NYHA III–IV. stádiumban levő betegeken a standard terápiához adott napi 25 mg spironolakton (amely napi 50 mg-ig feltitrálható volt), a mortalitást 30%-kal csökkentette, s a hospitalizáció vonatkozásában is kedvező hatású volt (24). Kevésbé ismert, hogy a spironolakton csoportban a digitalizált betegeken a mortalitási haszon kétszeres volt. Ennek hátterében két mechanizmus is szóba jön. Egyrészt a „magas normális” szérum K+-szint a digitálisszal összefüggésbe hozható, hiperdinam ritmuszavarok létrejöttét csökkenti. Másrészt, a digitálisztról ismert „saját” vazokonstriktor hatása (amelyet antagonizálhat a pumpafunkció javulása folytán a szimpatikotónia mérséklődéséből eredő vazokonstrikció csökkenése), de az MR-antagonizmus vazodilatátor hatása is egy összetevő lehet. Az RALES egy alvizsgálata arra is fényt derített, hogy a spironolakton a legnagyobb abszolút benefitet azokon a betegen nyújtotta, akiknél a vesefunkció beszűkült volt (eGFR ≤30 ml/perc/1,73 m2) (25). Ez érthető is, hiszen nagyobb mélységből nagyobbat lehet emelni, súlyosabban betegpopulációban nagyobb tere van a javulásnak. A RAAS blokkolása egyértelműen kedvező hatást hoz kongesztív szívelégtelenségben. A tradicionális szemlélet szerint a fő „culprit” effektor az angiotenzin-II. Ma már egyértelmű, hogy az aldoszteron hatása az előbbihez addicionálódik. ACE-gátló kezeléskor eleve magasabb lehet a reziduális aldoszterontermelés, a RAAS-tól különböző triggerek hatására (4). A spironolaktonról már korábban tudtuk, hogy csak azokon a betegeken hoz szignifikáns javulást, akiknek a fokozott aldoszteronhatásra utaló PIIINP-szintje az átlagnál magasabb. A PIIINP szintjének emelkedése a hospitalizáció és mortalitás fokozott rizikójával társul, s e peptid szérumszintjét a spironolakton csökkenti (26). Az aldoszteron, illetve hatásának spironolakton általi blokádja befolyásolja a szív elektrofiziológiáját. A spironolakton csökkenti a QT-diszperziót, amely legalább részben a delayed rectifier K+-áramlásának gyors komponensére kifejtett hatás által mediált (27). Ez utóbbi is komponense lehet antiaritmiás hatásának az ionháztartásra kifejtett effektus mellett.
Az eplerenonról
Az eplerenon – szemben a spironolaktonnal – olyan szelektív MR-blokkoló, amely a glükokortikoid-, a progeszteron-, illetve az androgénreceptorokhoz nem kötődik. Sarkítottan: az eplerenon egy olyan spironolakton, amely annak előnyeit megtartva, férfi betegeknek is adható anélkül, hogy aspecifikus MR gátlásából fakadó mellékhatásaival érdemben számolnunk kellene. Fogalmazhatunk úgy is, hogy a RALES-study pozitív eredményeit az eplerenon terápiára extrapolálhatjuk. Az említett mellékhatásokat (kiemelendő a gynecomastia és az erektilis diszfunkció) a betegek gyakran intolerábilisnak ítélik, nemegyszer a gyógyszert önkényesen elhagyják. A súlyponti eplerenonnal vezetett vizsgálatok: az EPHESUS- és az EMPHASIS-HF-study. Az EPHESUS-tanulmányban (28) 3-14 napja lezajlott AMI után ˂40% ejekciós frakció és szívelégtelenség klinikai tünetei mellett a betegek napi 25 mg eplerenont kaptak (vs. placebo), amelyet 4 hét múlva 50 mg-ra emeltek. (Diabéteszben szenvedő betegeken, a primeren magas rizikó miatt nem volt beválasztási kritérium, hogy a károsodott szisztolés funkció klinikailag szimptomatikus legyen.) A ≥220 µmol/l szérum kreatininszint kizárási kritérium volt. 5,5 mmol/l szérum K+-szint felett dózisredukcióra, vagy a gyógyszer elhagyására került sor. Az eplerenont szedők alcsoportjában csökkent az összmortalitás, a CV-mortalitás, és a CV-események miatti hospitalizációk gyakorisága. Kiemelendő, hogy a CV-mortalitás csökkentésében hatalmas szerepe volt a hirtelen halál megelőzésének, amely 21%-kal csökkent. Az eplerenon szelektivitása megvalósította a gyakorlatban az elvárásokat, a gynecomastia és az impotencia előfordulásában nem volt különbség a placebocsoporthoz viszonyítva, ez szembetűnő különbség a RALES-tanulmányban tapasztaltakhoz képest. Egy év elteltével az eplerenonnal kezelt betegeken átlag 5,3 µmol/l szérum kreatininszint-emelkedést észleltek (vs. 1,8 µmol/l placebocsoport), és 0,3 mmol/l szérum K+-szint-emelkedést (vs. 0,2 mmol/l placebocsoport). A súlyos hyperkalaemia (≥6,0 mmol/l Se K+) az eplerenon csoportban a betegek 5,5%-ában fordult elő (vs. 3,9% placebocsoport). Kiemelendő viszont, hogy a hypokalaemia (˂3,5 mmol/l Se K+) kockázatát az eplereonon felére csökkentette a placebocsoportbelihez képest! A vizsgálat tehát sikeres volt. A háttérben álló mechanizmusok részesedésének aránya a kedvező hatásban viszont nem tisztázott. Több évtizede ismerjük az MR-antagonisták hatását a folyadék- és elektrolitháztartásra, de lehet, hogy azok extrarenális hatásai még fontosabbak, mint: antiremodelling hatás, vaszkuláris inflammáció-, intersticiális fibrózis gátlása, oxidatív stessz-, endothel-diszfunkció csökkentése, trombocitaaggregáció gátlása (29, 30). A noradrenalin reuptake javítása, a szívfrekvencia-variabilitás fokozása (31) és még számos pozitív nonrenális hatást rejthet a pozitív eredő hatás. Az EMPHASIS-HF-vizsgálatban NYHA II osztályba sorolt, szimptomatikus betegek kaptak eplerenont (vs. placebo), napi 25 mg kezdő dózisban (32). 30–49 ml/perc/1,73 m2 GFR mellett az induló dózis másnaponta 25 mg volt. 4 hét elteltével a napi 25 mg dózist 50 mg-ra, a másnaponta 25 mg dózist napi 25 mg-ra emelték, hacsak a Se K+-szint nem haladta meg az 5 mmol/l-t. A 4 hetente elvégzett Se ionkontroll során az 5-5,9 mmol/l Se K+-szint esetén az eplerenon dózisát csökkentették, ≥6 mmol/l Se K+-szintnél adását felfüggesztették. A vizsgálatban igazolt mortalitási és morbiditási haszon az eplerenon terápiás értékét az enyhén szimptomatikus, mérsékelt fokú és súlyos BK-i szisztolés diszfunkciós betegekre kiterjesztette. A trend alapján valószínű, hogy a fenti kedvező hatás tünetmentes betegekre is extrapolálható. A betegpopuláció 85%-a már a randomizációkor részesült β-blokkoló kezelésben (ez az arány a RALES-vizsgálatban csak 10% volt). A Se K+-szintre és vesefunkcióra kifejtett mellékhatások emlékeztetnek az EPHESUS-vizsgálatban észleltekre. (A hyperkalaemia veszélyének minimalizálására a ≥5 mmol/l Se K+-szint és a ≤30 ml/perc/1,73 m2 GFR kizárási kritérium volt.) A vizsgálat végén ≥6 mmol/l az eplerenon alcsoportban a betegek 2,5%-ában fordult elő (vs. 1,9% placebocsoport). A mérsékelt fokú Se K+-szint emelkedésében (≤5,5 mmol/l) nagyobb volt a különbség (11,8 vs. 7,2%) (8).
Korábban felvetették annak lehetőségét, hogy diabetes mellitusban a hyporeninaemiás hipoaldoszteronizmus egy lehetséges összetevője annak, hogy e betegek vulnerábilisabbak veseelégtelenség, illetve hyperkalaemia kialakulása iránt (33). Minthogy a diabéteszes betegek esetén a fenti mellékhatásokat nem találták gyakoribbnak, e vizsgálat az előbbi hipotézist nem támasztotta alá. A ≤3,5 mmol/ Se K+-szint az eplerenonnal kezelt betegek közt 7,5%-ban, a placebocsoportban 11%-ban fordult elő. A ≤4 mmol/l Se K+-szint az eplerenon csoportban 38,8% gyakoriságú volt (vs. 48,4% placebocsoport). Irodalmi adataink vannak arra, hogy a ≤4 mmol/l Se K+-szint szisztolés szívelégtelenségben szenvedő betegeken a mortalitás emelkedésével társul (34). Az eplereonon tehát e vizsgálatban is bizonyította protekív hatását a hypokalaemia veszélyével szemben. Az átlagos Se kreatinin változásáról a vizsgálat első hónapjának elteltével vannak adataink: 13,3±30,9 μmol/l emelkedés az eplerenon csoportban, a placebót szedőknél 6,2±25,6 μmol/l. (A RALES-vizsgálatban az első évben a Se K+-szint emelkedése a spironolakton csoportban átlag 0,3 mmol/l, a Se kreatininszint 4-9 μmol/l-rel emelkedett, a placebocsoportban egyik paraméter vonatkozásában sem volt érdemi változás.) Érdemes a szérum K+-szint emelkedése, vagy veszélyes hyperkalaemia problémaköréhez rövid kitérőt tenni.
- A hypernatraemia (illetve a normál range felső tartományában levő szérum nátriumszint és hypokalaemia együttes fennállása az aldoszteron-antagonista indikációja és biztonsága mellett egyaránt érvet jelent.
- A „magas normális” szérum K+-szint (4,5-5 mmol/l) mind a hyperdinam ritmuszavarokkal szemben, mind az antiaritmiás gyógyszerek proaritmiás hatásával szemben protektív hatásúnak tekinthető.
- A diéta mellett a „K-vesztő diuretikumok” és az ioncserélő gyanták a hyperkalaemia megelőzésében a mozgásteret kiterjesztik.
Számos részlet elemzése után, esszencia a klinikai gyakorlat számára: I. A szintű ESC ajánlás alapján MR-antagonista adása javasolt csökkent EF-jú betegeknek, akik ACE-gátló és béta-blokkoló kezelés ellenére szimptomtikusak, a hospitalizáció és a halálozás csökkentésére.
Az eplerenon, „addicionális antiadrenerg” hatása
További adalék az aldoszteron toxikus hatásához, hogy potenciálja a katekolaminok effektusát. Hátterében a noradrenalin extraneuronális reuptake gátlása áll, ily módon fokozódik annak biológiai hozzáférhetősége. A noradrenalin szöveti reuptake klasszikus inhibitora a kortikoszteron, de a hasonló struktúrájú aldoszteron is effektív e vonatkozásban (35). Értelemszerűen következik ebből, hogy az MR-antagonisták a noradrenalin biohasznosulását csökkentik. Az aldoszteron-antialdoszteron hatás és a szimpatoadrenális rendszer kölcsönhatásának más komponenseiről is érdemes említést tenni. Akut miokardiális infarktusban (AMI-ban) a stresszhelyzet β2-receptor stimuláció mediáltan K+-beáramlást okozhat az intracelluláris térbe, csökkentve a szérum K+-szintjét (ez a sterssz hypokalaemia). A hypokalaemia viszont az aldoszterontermelést szupprimálja. A leírt effektus felülvezérelheti a katekolaminok azon hatását, amelynek értelmében a β1-receptor-stimuláció a reninaktivitás fokozódás útján fokozott aldoszteron-produkciót eredményez. Hypokalaemia, következményesen csökkent aldoszteronszint esetén a kompetitív aldoszteron-antagonizmusban rejlő, hypokalaemiát korrigáló potenciál beszűkül (nincs szubsztrát, amivel a kompetíció létrejönne). Az eplerenon a hypokalaemia (˂3,5 mmol/l Se K+) kockázatát felére csökkentette az EPHESUS-studyban. A hypokalaemia megelőzése azonban nem azonos a hypokalaemiában várható terápiás értékkel. Spekuláció tárgya lehet (és talán nem is öncélúan), hogy már fennálló hypokalaemia esetén a „non-kompetitív aldoszteron-antagonistáktól” (pl. triamteren, amilorid) mi várható.
Az eplereon terápia „időzítéséről”
Egy új gyógyszer kapcsán természetes törekvés, hogy feszegessük az abban rejlő lehetőségek felső határát. Racionális törekvés megtudni, hogy az eplerenon terápia által kínált előny fokozható-e, ha minél korábban kezdjük, elsősorban AMI-ban. Az EPHESUS-vizsgálat alcsoport-analízise alapján AMI-ban a BK-i szisztolés diszfunkcióban szenvedő, szívelégtelen betegeken a korábban (3-7 napon belül) indított eplerenon kezeléshez köthető a study globális pozitív eredménye (összmortalitás, CV-mortalitás, CV-hospitalizáció), a ≥7. napon indított eplereon már nem hozott szignifikáns előnyt. Kiemelendő a korai eplerenon kezelés kedvező hatása a hirtelen halál vonatkozásában, abban a gyógyszer elektromos remodellingre kifejtett effektusának tulajdonítanak elsősorban jelentőséget (36). A korábban elkezdett eplerenon kezelés a súlyos mellékhatások (hipontónia, hyperkalaemia, szérum kreatininszint-emelkedés) előfordulását nem fokozta, ugyanakkor a rizikócsökkentés már a randomizációt követő 10. napon megmutatkozott. AMI-ban az első 30 napban a legnagyobb a hirtelen halál esélye. Összevetve az eplerenonnal, a profilaktikusan implantált kardioverter-defibrillátor az összhalálozást nem csökkentette. Szignifikánsan csökkentette az aritmia halálozást, a nem aritmia eredetű halálozást viszont szignifikánsan növelte (37). Több szerző véleménye szerint is az MR-antagonista terápiában még jelentős kihasználatlan „tartalékok” vannak (38)! Első megközelítésre ellentmondásnak tűnik, hogy a RALES-vizsgálatban krónikus szívelégtelenségben szenvedő betegeken a spironolakton 30%-os mortalitáscsökkenést hozott, míg az EPHESUS-tanulmányban AMI után ≥7 nappal adott eplerenon a végpontokban nem eredményezett érdemi változást. Más volt a két tanulmány betegpopulációja, más a kórfolyamatok dinamikája, az összevetés nonkonkluzív. Nem tudjuk, mennyire magas a remodelling aldoszteron mediálta komponensének időfaktora AMI-ban. Prospektív, randomizált vizsgálat eredményére nem támaszkodhatunk abban a vonatkozásban, hogy meddig fokozható a kedvező hatás az eplerenon terápia minél koraibb elkezdésével. Felvetődhet a kérdés, hogy jelentene-e további előrelépését iv. kanrenoát bólusszal gyors antialdoszteron hatás elérése, s a kezelést eplerenonnal folytatni? AMI-ban a plazma aldoszteronszint emelkedése és a transzkardiális aldoszteron-extrakció fokozódása az első napokban, sőt, már az első órákban megindulhat, annak minden remodellingre és prognózisra gyakorolt kedvezőtlen hatásával (39, 40, 41). Azt is igazolták egy 134 beteget felölelő klinikai vizsgálatban, hogy a posztinfarktusos remodelling antagonizálására a 24 órán belül indított MR-antagonizmus terápiás értékű (42).
Milyen mechanizmussal csökkentheti a vesefunkciót az eplerenon?
Míg ACE-gátlók és ARB-k esetén e kérdés fel sem merül, mert a glomerulus fliltrációs ráta (GFR) csökkentése a vas efferens dilatáció következménye, az aldoszteron-antagonisták esetén e mellékhatás létrejöttének lehetséges oka első megközelítésben elgondolkodtatásra késztet. (Az MR-antagonisták szérum K+-szintet emelő hatásának mechanizmusa a Na+-K+-ioncsere gátlása.) Az MR-antagonisták GFR csökkentő hatásának hátterében négy potenciális okot lehet felsorolni, valamennyi felsorolt tényező GFR-csökkentő hatása reverzibilis.

- Hipotónizáló hatás: 25-50 mg eplerenontól nem várható drasztikus vérnyomáscsökkentés, de e tényező – mint GFR-csökkentő (minor) hatásösszetevő – adott esetben nem zárható ki. A spironolakton kardioprotektív hatása is már abban a dózisban várható, amikor antihipertenzív hatása kérdéses. (Érdemes megjegyezni azonban, hogy 2018. ESC/ESH guideline már 50-100 mg eplerenonról beszél rezisztens artériás hipertóniában.)
- Volumendepléció: lényege, hogy az a BK-i töltőnyomás-tartomány, amelyben, a tüdőben a transszudáció már létrejön (filtrációs tartomány), a bal kamrai Starling-görbe felhágó szárának vetületébe esik (eltekintve a kritikusan súlyos BK-elégtelenségtől, ahol a Starling-görbe a vízszintest közelíti) (5. ábra). Amikor diuretikumot adunk, csökkentjük a BK-i töltőnyomást, „kompenzáljuk a beteget”, bal szívfél lökettérfogatát csökkent(het)jük, s csökkent(het)jük a vese perfúzióját is! Ennek ellentettje történik, amikor volumenreszponzív szív esetén a beteget hidráljuk, s a vesefunkció javulását észleljük. Bár napi 25-50 mg eplerenon nem fejt ki jelentős diuretikus hatást (nem is elsősorban azzal a terápiás intencióval adjuk), e hatásösszetevőnek lehet relevanciája a GFR-csökkenésben. Az MR-antagonisták diuretikus hatásával kapcsolatban egy további megjegyzést érdemes tenni. Fiziológiásan az aldoszteron, illetve MR-antagonisták renális támadáspontján a Na+-oknak csak kb. 1%-a reabszorbeálódik (a napi hozzávetőleg 100-150 liter primer szűrlet mellett az is jelentős mennyiség). Ha azonban proximálisan a Na+-reabszorpciót pl. furosemiddel, tiazidokkal, főként, ha azok kombinációjával gátoljuk, e tubulusszakaszon a ko-transzportereket nagyobb Na+-expozíció éri. Az említett 1% akár közel 20-szorosára nőhet, felvetve annak lehetőségét, hogy az ioncsere és az azt blokkoló MR-antagonisták effektusa is fokozódhat.
- Utalva a reciprok reinforcement és a feedback emplifying szövevényes összefüggésrendszereire az aldoszteron triggert jelent az angiotenzin-II szintéziséhez, illetve hatásának fokozódásához (4). Az aldoszteron amellett, hogy elősegíti a vaszkuláris szöveti ACE aktivitását, fokozza az angiotenzin-II-receptorok szubsztrátkötését és reaktivitását is (3. ábra). Az aldoszteron stimulust jelent az AT1-típusú angiotenzin-II-receptorok expressziójára is a szívben (43, 2). A fent elmondottak tükrében az aldoszteron-antagonista gyógyszerek hatása addicionális ACE-gátlónak (is) tekinthető. A hangsúly az ACE-gátláson van, nem az addicionális jelzőn! ACE-gátló hatás esetén már nem merül fel a kérdés, hogy milyen mechanizmussal csökkenti a GFR-t.
- A tubulo-glomeruláris feedback mehanizmus lényege, hogy a disztális tubulus fokozott Na+-, Cl–- és volumenterhelése az azonos nefron vas afferensének konstrikciója útján a GFR-t csökkenti (negatív feedback mechanizmus). Több szerző abban a Cl–-terhelés szerepét tartja a legfontosabbnak (44, 45), más szerzők a NaCl-szintet (46). Ha a macula densa – mint szenzor – magas Cl–-koncentrációt detektál (amely a magas GRF indikátora), vas afferens konstrikció jön létre, ha macula densa alacsony Cl–-szintet detektál, úgy a vas afferens ditatáció jön létre, illetve a vas afferens fiziológiás dilatált állapota intakt marad. Az aldoszteton ezen autoregulációs negatív visszacsatolást antagonizálja, tehát vas afferens dilatátornak tekinthető. Ismeretes a gyűjtőcsatornából induló negatív feedback mechanizmus is, amelynek szenzora a gyűjtőcsatornákban a Na+-koncentráció, amelynek emelkedése (bekoncentrált vizelet) vas afferens dilatációt vált ki. E mechanizmust viszont az aldoszteron (az angiotenzin-II szintén) potencírozza (47). Az aldoszteron tehát egy vas afferens konstriktor mechanizmust gátol, egy vas afferens dilatátor mechanizmust aktivál (48). Az MR-antagonisták mindkét vas afferens dilatációra vezető effektust gátolják, ily módon a GRF-t csökkenthetik. A 3-4. pont tömény esszenciája a következőkben foglalható össze: Az MR-antagonisták az intraglomeruláris nyomást csökkenthetik: vas afferens konstrikció és vas efferens dilatáció útján. Ennek egyrészt renoprotektív, másrészt GFR-csökkentő, Se kreatininszint emelő hatása lehet.
A torasemid és a finerenon, mint MR-antagonisták
A TORIC-vizsgálatban (publikálva: 2002) kongesztív szívelégtelenségben szenvedő betegeken hasonlították össze napi 40 mg furosemid, és diuretikus hatás vonatkozásában azzal kb. ekvipotens 8 mg torasemid hatását (49). Az utóbbi vegyület mortalitási és morbiditási előnyt nyújtott a furosemidhez képest. Szembetűnő volt a különbség, hogy a furosemidet szedők csoportjában a sinus coronariusban az aldoszteronszint szignifikánsan alacsonyabb volt, mint az aortában, míg a torasemid alcsoportban e különbséget detektálni nem tudták. A torasemidet szedő betegpopulációban a PIIIAP-szintje is alacsonyabb volt, a szérum kálium pedig szignifikánsan magasabb. Mindezek alapján vonták le azt a következtetést, hogy a torasemid MR-antagonista hatást fejt ki. A torasemid szteroid vázat nem tartalmaz, mint a spironolakton vagy az eplerenon akár az első, nem szteroid szerkezetű, eredményesen tesztelt MR-blokkolónak tekinthető. Több mint 10 év elteltével (2015), az ARTS-HF-vizsgálatban értékelték a szteroidvázat nem tartalmazó finerenon hatását vs. eplerenon 2-es típusú diabéteszben szenvedő, szívelégtelen, és/vagy krónikus vesebetegségben szenvedő betegeken. Nagyobb relatív szív/vesekötődési arányt vártak a finerenontól, és annak folyományaként a hyperkalaemia és a vesefunkció romlásának kisebb veszélyét, azaz szelektívebb kardioprotektív hatást. Az eplerenon szelektív MR-antagonista, de receptorkötődése gyengébb a spironolaktonénál. Míg a spironolakton mellékhatásai látványosak és elsősorban férfi betegeken nemegyszer intolerábilisak, az eplerenon gyengébb receptorkötése a klinikumban nehezen „érhető tetten”. Mindkét „hiányosság” (mellékhatások, illetve gyengébb receptorkötés) korrekcióját várták a finerenontól (50). A finerenon valamennyi alkalmazott dózisban előnyt mutatott a kompozit végpontban (összmortalitás, CV-hospitalizáció, illetve sürgősségi ellátást igénylő, szívelégtelenséggel összefüggő állapotromlás), de nem volt kedvezőbb hatása az NT-ProBNP változása terén és a mellékhatások vonatkozásában sem az eplerenonhoz képest.
Utószó
Egy gondolatot még érdemes felvetni, amely nemcsak patofiziológiai, farmakodinamikai, hanem logisztikai vonatkozásokkal is bír. Megváltoztatná-e az antihipertenzív kezelés napi gyakorlatát egy adminisztratív vonatkozásaiban könnyen, olcsón elérhető MR-antagonista, amely férfi betegeken intolerábilis mellékhatások nélkül hosszú távon adható? A PATHWAY2-vizsgálatban a spironolakton kedvező hatása rezisztens hipertóniában trendszinten ebbe az irányba mutat. A primer-, illetve szekunder hiperaldoszteronizmus (akár antihipertenzívumként adott diuretikum terápia nyomán) releváns faktorok lehetnek.
Irodalom
1. Krug AW, Allenhöfer L, Monticone R, et al. Elevated mineralocorticoid receptor activity in aged rat vascular smooth muscle cells promotes a proinflammatory phenotype via extracellular signal-regulated kinase 1/2 mitogen-activated protein kinase and epidermal growth factor receptor-dependent pathways. Hypertension 2010; 55: 1476–1483. doi: https://doi.org/10.1161/HYPERTENSIONAHA.109.148783
2. White PC. Aldosterone: Direct Effects on and Production by the Heart. JCEM 2003; 88: 2376–2383. doi: https://doi.org/10.1210/jc.2003-030373
3. Rocha R, Rudolph AE, Frierdich GE, et al. Aldosterone induces a vascular inflammatory phenotype in the rat heart. Am J Physiol 2002; 283: H1802–H1810. 10.1152/ajpheart.01096.2001
4. Sthruters AD. Impact of Aldosterone on Vascular Pathophysiology. Heart Fail 2002; 8(1): 18–22. doi: https://doi.org/10.1111/j.1527-5299.2002.00722.x
5. Farquharson C, Struthers AD. Spironolactone increases NO bioactivity, improves endothelial dysfunction and suppresses vascular AI/AII conversion in chronic heart failure. Circulation 2000; 101: 594–597.
6. Host NB, Jensen LT, Bendixen PM, et al. The aminoterminal propeptide of type III procollagen provides new information on prognosis after acute myocardial infarction. Am J Cardiol 1995; 76: 869–873. doi: https://doi.org/10.1016/S0002-9149(99)80251-3
7. Peuhkurinen KJ, Risteli L, Melkko J, et al.Thrombolysis therapy with streptokinase stimulates collagen break down. Circulation 1991; 83: 1969–1975. doi: https://doi.org/10.1161/01.CIR.83.6.1969
8. Eschailer R, McMurray JJV, Swedberg K, et al. Safety and Efficacy of Eplerenone in Patients at High Risk for Hyperkalemia and/or Worsening Renal Function. JACC 2016; 62: 1585–1593. doi: https://doi.org/10.1016/j.jacc.2013.04.086
9. MacFadyen RJ, Barr CS, Struthers AD. Aldosterone blockade reduces vascular collagen turnover, improves heart rate variability and reduces early morning rise in heart rate in heart failure patients. Cardiovasc Res 1997; 35: 30–34.
10. Chowdhary S, Ng GA, Nuttall SL, Coote JH, et al. Acute aldosterone antagonism improves cardiac vagal control in humans. J Am Coll Cardiol 43: 1270–1275.
11. Chowdhary S, Townend JN. Role of NO in the regulation of cardiovascular autonomic control. Clin Sci 1999;97:5–17.
12. Chowdhary S, Vaile JC, Farmer MR, et al. Cardiac vagal modulation by endogenous nitric oxide in human. Eur Heart J 1999; 20(Suppl): 132. doi: https://doi.org/10.1042/cs0970005
13. Holstetter TH, Ibrahim HR, et al. Feature Editor Aldosterone in Chronic Kidney and Cardiac Disease. J Am Soc Nephr 2003; 14: 2395–2401. doi: https://doi.org/10.1097/01.ASN.0000086472.65806.73
14. Tsutamoto T, Wada A, Maeda K, et al. Spironolactone inhibits the transcardiac extraction of aldosterone in patients with congestive heart failure. J Am Coll Cardiol 2000; 36: 838–844. doi: https://doi.org/10.1016/S0735-1097(00)00796-8
15. Hayashi M, Tsutamoto T, Wada A, et al. Relationship between transcardiac extraction of aldosterone and left ventricular remodeling in patients with first acute myocardial infarction: extracting aldosterone through the heart promotes ventricular remodeling after acute myocardial infarction. J Am Coll Cardiol 2001; 38: 1375–1382. doi: https://doi.org/10.1016/S0735-1097(01)01539-X
16. Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction Circulation 1990; 81: 1161–1172.
17. Rouleau JL, de Champlain J, Klein M. Activation of neurohumoral systems in postinfarction left ventricular dysfunction. J Am Coll Cardiol 1993; 22: 390–398. doi: https://doi.org/10.1016/0735-1097(93)90042-Y
18. Multicenter Postinfarction Research Group Risk stratification and survival after myocardial infarction. N Engl J Med1983; 309: 231–236. doi: https://doi.org/10.1056/NEJM198308113090602
19. Rouleau JL, Packer M, Moye L, et al. Prognostic value of neurohumoral activation in patients with an acute myocardial infarction: effect of captopril. J Am Coll Cardiol 1994; 24: 583–591. doi: https://doi.org/10.1016/0735-1097(94)90001-9
20. Weber KT, Sun Y, Campbell SE, et al. Chronic mineralocorticoid excess and cardiovascular remodeling Steroids. 1995; 60: 125–132. doi: https://doi.org/10.1016/0039-128X(94)00030-G
21. Hayashi M, Tsutamoto T, Wada A, et al. Intravenous atrial natriuretic peptide prevents left ventricular remodeling in patients with first anterior acute myocardial infarction. J Am Coll Cardiol 2001; 37: 1820–1826. doi: https://doi.org/10.1016/S0735-1097(01)01233-5
22. Modena M G, Aventa P, Menozzi M, et al. Aldosterone inhibits collagen synthesis and progressive left ventricular enlargement after myocardial infarction. Am Heart J 2001; 141: 41–46. doi: https://doi.org/10.1067/mhj.2001.111258
23. MacFadyen RJ, Lee AF, Morton C, et al. How often are angiotensin II and aldosterone concentrations raised during chronic ACE. J J inhibitor treatment in cardiac failure? 1999; 82(1): 57–61. doi: https://doi.org/10.1136/hrt.82.1.57
24. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999 Sep 2; 341(10): 709–17. doi: https://doi.org/10.1056/NEJM199909023411001
25. Vardeny O, Wu DH, Desai A, et al. Influence of baseline and worsening renal function on efficacy of spironolactone in patients with severe heart failure. J Am Coll Cardiol 2012; 60: 2082–9. doi: https://doi.org/10.1016/j.jacc.2012.07.048
26. Zannad F, Alla F, Dousset B, et al. Limitation of excessive extracellular matrix turnover may contribute to survival benefit of spironolactone therapy in patients with congestive heart failure: insights from the randomized aldactone evaluation study (RALES). Circulation 2000; 102: 2700–2706.
27. Caballero R, Moreno I, Gonzalez T, et al. Spironolactone and its main metabolite, canrenoic acid, block human ether-a-go-go-related gene channels. Circulation 2003; 107: 889–895. doi: https://doi.org/10.1161/01.CIR.0000048189.58449.F7
28. Pitt B, Remme W, Zannad F, et al. Eplererone,a Selective Aldosterone Blocker,in Patients with Left Ventricular Dysfunction after Myocardial Infarction. N Engl J Med 2003; 348: 1309–1321. doi: https://doi.org/10.1056/NEJMoa030207
29. Bauersachs J, Heck M, Fraccarollo D, et al. Addition of spironolactone to angiotensin-converting enzyme inhibition in heart failure improves endothelial vasomotor dysfunction: role of vascular superoxide anion formation and endothelial nitric oxide synthase expression. J Am Coll Cardiol 2002; 39: 351–358. doi: https://doi.org/10.1016/S0735-1097(01)01729-6
30. Rajagopalan S, Duquaine D, King S, Pitt B, Patel P. Mineralocorticoid receptor antagonism in experimental atherosclerosis. Circulation 2002; 105: 2212–2216.
31. Korkmaz ME, Muderrisoglu H, Ulucam M, Ozin B. Effects of spironolactone on heart rate variability and left ventricular systolic function in severe ischemic heart failure. Am J Cardiol 2000; 86: 649–653. doi: https://doi.org/10.1016/S0002-9149(00)01046-8
32. Zannad F, McMurray JJ, Drexler H, et al. Rationale and design of the Eplerenone in Mild Patients Hospitalization And SurvIval Study in Heart Failure (EMPHASIS-HF). Eur J Heart Fail 2010; 12: 617–622. doi: https://doi.org/10.1093/eurjhf/hfq049
33. Johnson ES, Weinstein JR, Thorp ML, et al. Predicting the risk of hyperkalemia in patients with chronic kidney disease starting lisinopril. Pharmacoepidemiol Drug Saf 2010; 19: 266–72. doi: https://doi.org/10.1002/pds.1923
34. Ahmed A, Zannad F, Love TE, et al. A propensity-matched study of the association of low serum potassium levels and mortality in chronic heart failure. Eur Heart J 2007; 28: 1334–1343. doi: https://doi.org/10.1093/eurheartj/ehm091
35. Struthers AD. Why does spironolactone improve mortality over and above an ACE inhibitor in chronic heart failure? BJCP 1999; 47(5): 479–482. doi: https://doi.org/10.1046/j.1365-2125.1999.00954.x
36. Adamopoulos C, Ahmed A, Fay R, et al. Timing of eplerenone initiation and outcomes in patients with heart failure after myocardial infarction complicated by left ventricular systolic dysfunction: insights from the EPHESUS trial. Eur J Heart Fail 2009; 11: 1099–1105. doi: https://doi.org/10.1093/eurjhf/hfp136
37. Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med 2004; 351: 2481–2488. doi: https://doi.org/10.1056/NEJMoa041489
38. Abuannadi M, O’Keefe JH. Review Article: Eplerenone: An Underused Medication? J Card Pharm Ther 2010; 15(4): 318–25. doi: https://doi.org/10.1177/1074248410371946
39. Beygui F, Collet JP, Benoliel JJ, et al. High plasma aldosterone levels on admission are associated with death in patients presenting with acute ST-elevation myocardial infarction. Circulation 2006; 114: 2604–2610. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.634626
40. Hayashi M, Tsutamoto T, Wada A, et al. Relationship between transcardiac extraction of aldosterone and left ventricular remodeling in patients with first acute myocardial infarction: extracting aldosterone through the heart promotes ventricular remodeling after acute myocardial infarction. J Am Coll Cardiol 2001; 38: 1375–1382. doi: https://doi.org/10.1016/S0735-1097(01)01539-X
41. Palmer BR, Pilbrow AP, Frampton CM, et al. Plasma aldosterone levels during hospitalization are predictive of survival post-myocardial infarction. Eur Heart J 2008; 29: 2489–2496. doi: https://doi.org/10.1093/eurheartj/ehn383
42. Hayashi M, Tsutamoto T, Wada A, et al. Immediate administration of mineralocorticoid receptor antagonist spironolactone prevents post-infarct left ventricular remodeling associated with suppression of a marker of myocardial collagen synthesis in patients with first anterior acute myocardial infarction. Circulation 2003; 107: 2559–2565. doi: https://doi.org/10.1161/01.CIR.0000068340.96506.0F
43. Robert V, Heymes C, Silvestre JS, et al. Angiotensin AT1 receptor subtype as a cardiac target of aldosterone: role in aldosterone-salt-induced fibrosis. Hypertension 1999; 33:981–986.
44. Ryu H, Layton AT (March). Tubular fluid flow and distal NaCl delivery mediated by tubuloglomerular feedback in the rat kidney. Journal of Mathematical Biology 2014; 68 (4): 1023–49. doi: https://doi.org/10.1007/s00285-013-0667-5
45. Ren Y, Janic B, Kristopher K, et al. Mechanisms of connecting tubule glomerular feedback enhancement by aldosterone. Am J Phys-Ren Phys 2016; 311: 1182–1188. doi: https://doi.org/10.1152/ajprenal.00076.2016
46. Ren Y, Carretero O A, Garvin JL. Role of mesangial cells and gap junctions in tubuloglomerular feedback Kidney International 2002; (632): 525-531. doi: https://doi.org/10.1046/j.1523-1755.2002.00454.x
47. Ren Y, Janic B, Kutskill K, et al. Mechanisms of connecting tubule glomerular feedback enhancement by aldosterone American Journal of Physiology. Renal Physiology 2016; 311(6): 1182–1188. doi: https://doi.org/10.1152/ajprenal.00076.2016
48. Vallon V, Osswald H. Adenosine receptors and the kidney. Handbook of Experimental Pharmacology. 2009; 193: 443–70. doi: https://doi.org/10.1007/978-3-540-89615-9_15
49. Tsutamoto T, Sakai H, Wada A, et al. Torasemide inhibits transcardiac extraction of aldosterone in patients with congestive heart failure. JACC 2004; 44: 2247–2258. doi: https://doi.org/10.1016/j.jacc.2004.09.009
50. Filippatos G, Anker SD, Böhm M, et al. A randomized controlled study of finerenone vs. eplerenone in patients with worsening chronic heart failure and diabetes mellitus and/or chronic kidney disease. Eur Heart J 2016 Jul 14; 37(27): 2105–14. doi: https://doi.org/10.1093/eurheartj/ehw132.