Efficacy of SLGT-2 inhibitors in patients with heart failure or at high risk for cardiovascular events – a systematic review
█ Review
DOI: 10.26430/CHUNGARICA.2022.52.2.142
Authors:
Merkel Eperke Dóra, Masszi Richárd, Behon Anett, Kosztin Annamária*, Merkely Béla*
Semmelweis Egyetem, Városmajori Szív- és Érgyógyászati Klinika, Budapest
Levelezési cím:
Dr. Merkely Béla PhD, DSc, Semmelweis Egyetem, Városmajori Szív- és Érgyógyászati Klinika
1122 Budapest, Varosmajor 68. E-mail: merkely.study@gmail.com
Summary
Background: Heart failure patients present a highly frail patient population disposing of great cardiovascular mortality. A shift can be observed in the treatment of heart failure patients owed to sodium-glucose co-transporter 2 inhibitors (SGLT-2), due to their ability to successfully decrease the risk of cardiovascular and heart failure events.
Methods: We have screened and collected into our systematic review those multicentric, randomized controlled trials (RCT) and meta-analyses that studied SGLT-2 inhibitors regarding all-cause mortality and heart failure hospitalizations as endpoints.
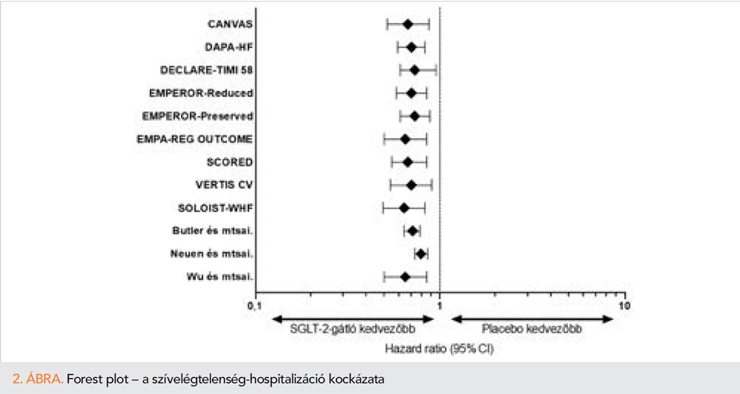
Results: Based on our search, we included 12 RCTs and 3 meta-analyses. Altogether 5 RCTs analyzed diabetic patients with high cardiovascular risk, 3 trials were conducted with chronic and 3 with acute heart failure, with only one with diabetes as a criterion. The studied drugs (canagliflozin, dapagliflozin, empagliflozin, ertugliflozin,sotagliflozin) decreased heart failure hospitalizations by 27-33% when compared to placebo. In respect of all-cause mortality, dapagliflozin significantly lowered the risk in heart failure patients with reduced ejection fraction regardless of diabetes (HR=0.83; 95% CI: 0.71–0.97), furthermore, empagliflozin showed similar results in high risk, diabetic patients (HR=0.68; 95% CI: 0.57–0.82). As for side effects, SGLT-2 inhibitors can be used safely in heart failure patients. Renal endpoints also show favourable outcome, since SGLT-2 inhibitors slow the progression of renal function deterioration compared to placebo.
Conclusion: Prior RCTs concordantly demonstrate the efficacy of SGLT-2 inhibitors in the reduction of heart failure events, especially in high-risk patients. Besides them being safe in heart failure patients, its effectiveness was also observed in regards to all-cause mortality and the preservation of renal function.
ISSUE: CARDIOLOGIA HUNGARICA | 2022 | VOLUME 52, ISSUE 2
Összefoglalás
Háttér: A szívelégtelenségben szenvedő betegek egy igen fragilis betegcsoport, akik nagy kardiovaszkuláris (KV) mortalitási rizikóval rendelkeznek. Gyógyszeres kezelésükben paradigmaváltást hozott a nátrium-glükóz-kotranszporter-2 (SGLT2) gátlók alkalmazása, mivel csökkenteni tudta a kardiovaszkuláris és szívelégtelenség események rizikóját.
Módszerek: Jelen szakirodalmi összefoglalónkban azokat az SGLT2-gátlókkal végzett nagy, multicentrikus, randomizált vizsgálatokat (RCT) és metaanalíziseket gyűjtöttük össze, amelyek az összmortalitást és szívelégtelenség-hospitalizációt végpontként vizsgálták.
Eredmények: A PubMed-en történt szelekciónk alapján, 12 RCT-t, valamint 3 metaanalízist vontunk be. Összesen 5 RCT vizsgálta a diabéteszes, nagy KV-rizikóval rendelkező betegeket, emellett 3 krónikus- és 3 akut szívelégtelen betegcsoportot vizsgáló RCT-t találtunk, amelyekből csupán 1 esetben volt kritérium a diabétesz jelenléte. A vizsgálatok mindegyike (canagliflozin, dapagliflozin, empagliflozin, ertugliflozin, sotagliflozin) egybehangzóan igazolta a szívelégtelenség miatti hospitalizáció rizikójának csökkenését, 27-33%-kal csökkentette a szívelégtelenség miatti kórházi kezelések kockázatát placebóval szemben. Ugyanakkor az összmortalitás tekintetében a dapagliflozin a csökkent ejekciós frakcióval rendelkező szívelégtelen betegekben diabétesztől függetlenül (HR=0,83; 95% CI: 0,71–0,97), az empagliflozin a nagy kockázatú, diabéteszes betegcsoportban (HR=0,68; 95% CI: 0,57–0,82) szignifikánsan csökkentette az események előfordulását. Mellékhatások tekintetében az SGLT2-inhibitorok biztonságosan alkalmazhatók. A renális végpontok tekintetében még kedvezőbb kimenetel várható, mivel csökkenti a vesefunkció-romlás progressziójának mértékét placebóhoz képest.
Következtetés: A korábbi RCT-k eredményei alapján az SGLT2-inhibitorok effektivitása a szívelégtelenség-események rizikójának csökkenésében egybehangzóan megmutatkozott, különösen a nagy kockázatú betegcsoportokban. Ezen felül hatékonysága az összmortalitás tekintetében, valamint a vesefunkció romlásának lassabb progressziójában is látható, amellett, hogy biztonságosan alkalmazható.
Bevezetés
A szívelégtelenség (SZE) és diabetes mellitus (DM) globálisan jelentős terhet ró az egészségügyre. Mind a SZE, mind a DM prevalenciája magas, az életkor előrehaladtával nő, a SZE prevalenciája 70 éves kor felett elérheti a 10%-ot, a diabétesz esetében a 18%-ot 65 év felett (1, 2). Prediabétesz és dysglykaemia gyakran figyelhető meg a szívelégtelen betegekben függetlenül a bal kamrai ejekciós frakciótól (EF), 20 és 22%-os előfordulást figyeltek meg csökkent ejekciós frakciójú (heart failure with reduced ejection fraction – HFrEF) és megtartott ejekciós frakciójú szívelégtelen (heart failure with preserved ejection fraction – HFpEF) betegeknél (3). Emellett a diabéteszes vagy hyperglykaemiával rendelkező betegekben a myocardiumra kifejtett kedvezőtlen hatás miatt igen gyakori a szívelégtelenség előfordulása, a diabéteszes betegek negyedénél alakul ki szívelégtelenség (4). A DM-betegek azon csoportjánál, akiknél SZE is jelentkezik a legkedvezőtlenebb prognózis tapasztalható, az átlagos 5 éves mortalitási rizikó elérheti a 47%-ot (5, 6).
A kimenetel mindkét betegség fennállása esetén igen kedvezőtlen. A DM jelenléte mellett jelentősen emelkedik a kardiovaszkuláris (KV) halálozás és SZE-hospitalizáció rizikója megtartott (7) és csökkent bal kamrai ejekciós frakciójú szívelégtelen betegeknél is (8).
Az orális antidiabetikumok (OAD) között több sikeres, új farmakon jelent meg az elmúlt években, amelyek a diabéteszes betegek kimenetelét, mortalitását jelentősen csökkentette. Ezek között is kiemelkedő a nátrium-glükóz-kotranszporter-2 (SGLT2) gátlók csoportja (1). Bár elsőként OAD-terápiaként vizsgálták, 2015-ben nagy multicentrikus, randomizált (RCT) vizsgálat, az EMPAREG-OUTCOME hívta fel a figyelmet a diabéteszes betegpopulációban tapasztalható kardiovaszkuláris mortalitás jelentős, 40%-os csökkenésére (1, 9). Azóta több, SGLT2-gátló, így az empagliflozinról és dapagliflozinról is bebizonyosodott; a HFrEF-betegekben a kardiovaszkuláris mortalitást és szívelégtelenség eseményeket közel 25%-kal csökkentette, ráadásul a 2-es típusú diabetes mellitus jelenlététől függetlenül (10, 11). Ennek köszönhetően a terápia az ESC 2021-es és az ACC 2022-es SZE-ajánlása alapján IA indikációval javasolt SZE- és DM-betegekben (1, 12).
Irodalmi szisztematikus összefoglalónkban bemutatjuk az SGLT2-gátlók alkalmazásával végzett nagy RCT-k és legutóbbi metaanalízisek eredményeit SZE-betegeknél.
Módszerek
Szakirodalmi áttekintésünkbe azon cikkeket választottuk be, amelyekben RCT-k eredményét publikálták szívelégtelenség és az SGLT2-gátlók kapcsolatát feldolgozó témában. Továbbá beválasztottuk a nagy elemszámú (n >15 000) az előbb említett témában végzett metaanalíziseket, amelyek az összmortalitást és szívelégtelenség-hospitalizációt vizsgálták.
Vizsgálatunkból kizártuk a kis esetszámú, nem randomizált vizsgálatokat, egyéb irodalmi áttekintéseket, illetve azon vizsgálatokat, amelyeknek végpontjai eltértek az általunk választottaktól. Vizsgálatunk fókuszpontjában keményvégpontként az összmortalitás és a szívelégtelenség miatti hospitalizáció álltak.
Az irodalomkutatást az első (MED), harmadszerző (BA) egymástól függetlenül végezte. A kiválasztott cikkeket az utolsó szerző tekintette át (KA).
A kutatást a PubMed-en (https://pubmed.ncbi.nlm.nih.gov) végeztük. Kulcsszavaink a „szívelégtelenség” és az „SGLT2-inhibitorok” voltak; amelyet kiegészítettünk az „összmortalitás” és a „szívelégtelenség-hospitalizáció” szavakkal.
Kutatásunk során a Pubmed-en: „szívelégtelenség” és „SGLT2-inhibitor” és „mortalitás” kulcsszavakra 113 találat; „szívelégtelenség” és „SGLT2-inhibitor és „szívelégtelenség-hospitalizáció” kulcsszavakra 105 találat érkezett (1. ábra), amelyből kiszelektáltuk az RCT-ket, valamint a metaanalíziseket.
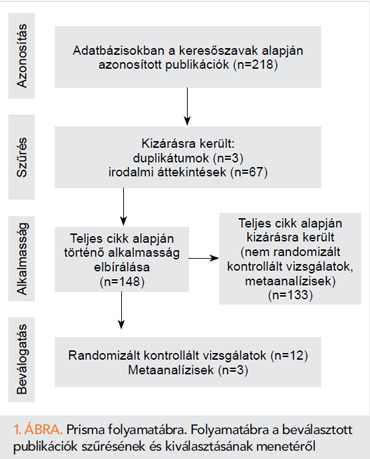
Eredmények
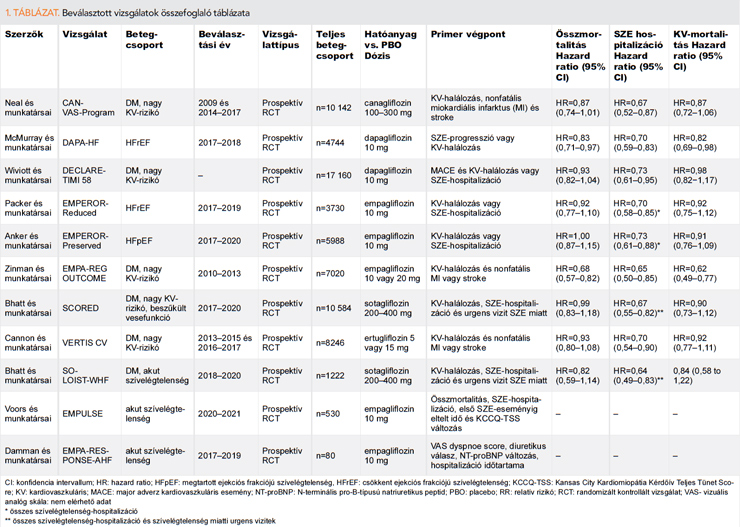
Jelen összefoglalónkba 12 RCT-t, valamint 3 metaanalízist vontunk be (1–2. táblázat), amelyekben vizsgálták külön az összmortalitást és szívelégtelenség-eseményeket is. Összesen 5 RCT vizsgálta a diabéteszes, nagy KV-rizikóval rendelkező betegeket, emellett 3 krónikus- és 3 akut szívelégtelen betegcsoportot vizsgáló RCT-t találtunk, amelyekből csupán 1 esetben volt kritérium a diabétesz jelenléte.
Hatékonyság
Diabéteszes, nagy kardiovaszkuláris rizikóval rendelkező betegcsoport
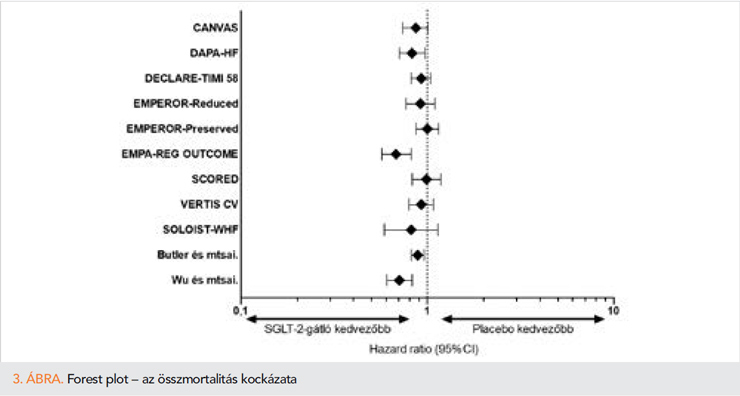
A „CANVAS Program”-ban egyesítették a CANVAS- és CANVAS-R-vizsgálatok eredményeit, a canagliflozin hatóanyag hatását kutatták nagy KV-rizikójú diabéteszes betegekben. A canagliflozin az említett betegcsoportban csökkentette a KV-halálozás, nonfatális miokardiális infarktus (MI) és stroke rizikóját (HR=0,86; 95% CI: 0,75–0,97; p=0.02). Továbbá 33%-kal csökkentette a SZE miatti hospitalizációk arányát (HR=0,67; 95% CI: 0,52–0,87), azonban összmortalitás tekintetében szignifikáns különbség nem volt kimutatható placebóval szemben (szuperioritás p=0,24). Kiemelkedően jó eredményt írtak le a renális végpont vonatkozásában, a canagliflozin hatására lelassult az albuminuria és a vesefunkció romlásának progressziója és csökkent a vesepótló kezelés szükségessége (13).
A dapagliflozint és az empaglifozint szintén vizsgálták DM-betegpopulációban. Kiemelendő különbség a két alábbiakban részletezett vizsgálatban, hogy a DECLARE-TIMI-58-vizsgálatban nagy KV-rizikójú és KV-betegséggel diagnosztizált betegeket is beválasztottak, míg az EMPA-REG OUTCOME-vizsgálatban csak KV-betegséggel rendelkező betegek voltak.
Előbbi a DECLARE-TIMI 58 vizsgálatban nem csökkentette szignifikánsan a major adverz KV-eseményeket (HR=0,93; 95% CI: 0,4–1,03; p=0,17), a KV-mortalitást (HR=0,98; 95% CI: 0,82–1,17) vagy az összmortalitást (HR=0,93; 95% CI: 0,82–1,04) placebóhoz képest. Azonban 17%-kal csökkentette a KV-halálozás és SZE-hospitalizációból álló kompozit végpontot placebóhoz képest (HR=0,83; 95% CI: 0,73–0,95; p=0,005), amely elsősorban a SZE-hospitalizáció miatt volt megfigyelhető (HR=0,73; 95% CI: 0,61–0,88) (14).
Az EMPA-REG OUTCOME-vizsgálatban, nagy KV-rizikójú DM-betegeket randomizáltak empagliflozin- vagy placebokezelésre. Az empagliflozinnal kezelt betegekben szignifikánsan csökkent a KV-halálozás, nonfatális MI és nonfatális stroke előfordulása (HR=0,86; 95,02% CI: 0,74–0,99; p=0,04) placebóval szemben, emellett összmortalitásbeli (HR=0,68; 95% CI: 0,57–0,82; p<0,001) és a SZE-hospitalizáció rizikójának csökkentésében (HR=0,65; 95% CI: 0,50–0,85; p=0,002) találtak szignifikáns előnyt a placebocsoporttal összehasonlítva (9).
A SCORED-vizsgálatba olyan krónikus veseelégtelenségben szenvedő, DM-betegeket vontak be, akiknek nagy KV-rizikójuk volt. A beválasztott betegek 31%-ának volt szívelégtelensége. A sotagliflozin 26%-kal csökkentette a primer kompozit végpontot, amely a KV-halálozás, SZE-hospitalizáció és SZE miatti urgens vizitek együttese volt (HR=0,74; 95% CI: 0,3–0,88; p<0,001) (15).
Az ertugliflozint a VERTIS-vizsgálaton belül az ateroszklerotikus KV-betegségben szenvedő, 2-es típusú DM-betegekben vizsgálták; szuperioritást placebóval szemben nem sikerült kimutatni a primer kompozit végpont tekintetében (KV-halálozás, nonfatális MI és nonfatális stroke) (HR=0,97; 95% CI: 0,85–1,11; inferioritás p<0,001 és szuperioriás p=0,11), azonban megemlítendő, hogy csökkentette a SZE-hospitalizációt (HR=0,70; 95% CI: 0,54–0,90) (16).
Krónikus szívelégtelen betegcsoport diabétesztől függetlenül
A DAPA-HF-ben, a dapagliflozin hatását vizsgálták HFrEF-betegekben (n=4744), diabétesszel vagy anélkül. A betegek 42%-ánál diagnosztizáltak 2-es típusú DM-et mind a dapagliflozin, mind a placebocsoportban. Ebben a betegcsoportban a dapagliflozin csökkentette a primer kompozit végpontot; a KV-halálozást és SZE-progressziót (HR=0,74; 95% CI: 0,65–0,85; p<0,001), emellett az összmortalitási rizikóját (HR=0,83; 95% CI: 0,71–0,97) és a SZE-hospitalizációt (HR=0,70; 95% CI: 0,59–0,83) DM-státusztól függetlenül (11).
A DELIVER-vizsgálat a dapagliflozint vizsgálja HFpEF-betegekben, amely vizsgálat jelenleg követési szakaszban van. Összesen 6263 beteget randomizáltak napi 10 mg dapagliflozinra vagy placebóra. A betegek 45%-ának volt 2-es típusú cukorbetegsége. A vizsgálat eredményeit 2022 második felére várhatjuk (17).
A dapagliflozin mellett az empagliflozin alkalmazására adott evidenciát az EMPEROR-Reduced és -Preserved-vizsgálat, előbbiben HFrEF, utóbbi esetben HFpEF SZE-betegeket választottak be. A DM jelenléte nem volt beválasztási kritérium, előfordulása a teljes betegcsoportban 50% (EMPEROR-Reduced) és 49% (EMPEROR-Preserved) volt.
A HFrEF-betegekben az empagliflozin jelentősen mérsékelte a SZE-hospitalizációt és KV-halálozást (HR=0,75; 95% CI: 0,65–0,86; p<0,001), 31%-kal csökkentette a SZE-hospitalizációt önmagában (HR=0,69; 95% CI: 0,59–0,81) (10).
A HFpEF-betegeknél hasonló eredményekről számoltak be (EMPEROR-Preserved), sikeresen csökkentette a KV-halálozást és SZE-hospitalizációt (HR=0,79; 95% CI: 0,69–0,90; p<0,001). Azonban ezen betegcsoportban nem volt kimutatható összmortalitási előny (HR=1,00; 95% CI: 0,87–1,15). Jelenleg az empagliflozin az első és egyetlen olyan SGLT2-gátló, amelynek szedése bizonyítottan kardiovaszkuláris előnnyel jár a HFpEF-betegcsoportban.
Akut szívelégtelen betegcsoport
Akut szívelégtelenségben megkezdett empagliflozin terápiával két randomizált vizsgálat foglalkozott. Az EMPA-RESPONSE-AHF-vizsgálatban 30 napig részesültek vagy empagliflozin- vagy placeboterápiában, akut SZE esetén is csökkentette a SZE progresszióból, rehospitalizációból és összmortalitásból álló kompozit végpontot 60 napnál (10% empagliflozin- vs. 33% placebocsoport; p=0,014) (18).
Az EMPULSE-vizsgálatban a 90 napos záróviziten a KV-halálozás és szívelégtelenség incidenciája empagliflozinnal kezelt betegeknél 12,8% volt, míg placebo esetében 18,5% (HR=0,69; 95% CI: 0,45–1,08) (19).
Az akut szívelégtelen betegcsoportban a SOLOIST-WHF- vizsgálta a sotagliflozin hatékonyságát, amely vizsgálatba olyan DM-betegeket választottak be, akik szívelégtelenség miatt hospitalizációra, illetve intravénás diuretikumra szorultak. Ebben a betegcsoportban a sotagliflozin csökkentette a KV-halálozást és a SZE-hospitalizációt (20).
Metaanalízisek eredményei
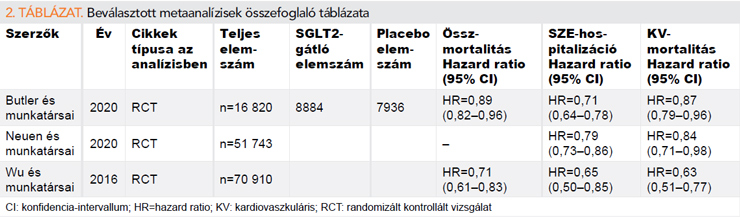
Az általunk vizsgált 3 metaanalízis megerősítette a randomizált vizsgálatok eredményeit, összefoglalva több SGLT2-gátló farmakont.
Butler és munkatársai egy 16 820 betegből álló kohorszot hoztak létre, csökkent és megtartott ejekciós frakciójú SZE-betegekkel, összesen 7 RCT bevonásával. Eredményeik alapján az SGLT2-gátlók sikeresen csökkentették a KV-halálozás és SZE-hospitalizációt (RR= 0,71; 95% CI: 0,61–0,84; p<0.001; I2=0%), az összmortalitást (HR=0,89; 95% CI: 0,82–0,96; p=0,004; I2=0%) ejekciós frakciótól függetlenül a krónikus szívelégtelen betegcsoportban (21).
Neuen és munkatársai 51 743 betegből álló metaanalízisükbe 6 RCT-t választottak be, amelyek az SGLT2-gátlók hatását vizsgálták metforminkezelés mellett és anélkül. Mind a SZE-hospitalizációt mind a KV-halálozást szignifikánsan csökkentették az SGLT2-gátlók (HR=0,79, 95% CI: 0,73–0,86 és HR=0,74, 95% CI: 0,63–0,87; P-heterogenitás=0,48) a metforminkezeléstől függetlenül. Az SGLT2-gátlókkal kezelt betegeknél alacsonyabb összmortalitási rizikót figyeltek meg, amely független volt a metforminszedéstől (P-heterogenitás = 0,57) (22).
Wu és munkatársai egy több mint 70 000 fős kohorszot hozott létre, hasonlóan a fentebb említett vizsgálatok eredményeihez, az általuk végzett metaanalízisben az SGLT2-gátlók szignifikánsan csökkentették a szívelégtelenség események rizikóját (HR=0,65; 95% CI: 0,50–0,85; p=0,002), és az összmortalitást (HR=0,71; 95% CI: 0,61–0,83; p<0,0001) (23).
Renális kimenetel
Az SGLT2-gátlók effektivitását és kedvező mellékhatásprofilját a veseelégtelenség progressziójának késleltetésével is jellemezhetjük. Jelenleg renoprotektívnak véleményezik, krónikus veseelégtelenségben is IB-ajánlással javasolt használatuk diabétesz kezelésére, amennyiben a glomeruláris filtrációs ráta (eGFR) meghaladja a 30 ml/min/1,73 m2-t (24). Alkalmazása 20 ml/min/1,73 m2 eGFR-értékig lehetséges empagliflozin esetén, 30 ml/min/1,73 m2 eGFR-értékig dapagliflozin esetén a szívelégtelen betegcsoportban az Európai Gyógyszerügynökség alkalmazási leirata alapján. Ugyanakkor a MANET ajánlása alapján az empagliflozin 30 ml/min/1,73 m2 eGFR-érték alatt, a dapagliflozin esetében 25 ml/min/1,73 m2 eGFR-érték alatt nem adható (25). Az általunk beválasztott vizsgálatokban, a renális kimenetel szekunder végpontként szerepelt, amit változó feltételekkel határoztak meg. Az 50%-os tartós eGFR-csökkenést tekintették szekunder végpontnak a DAPA-HF- és SCORED-vizsgálatokban, 40%-os csökkenést az EMPEROR-Reduced-vizsgálatban. Vizsgálatonként változott, hogy figyelembe vették-e a renális kompozit végpontban a veseelégtelenségből fakadó halálozást, amely jelen volt a DAPA-HF- és DECLARE-TIMI 58 tanulmányokban. Megemlítendő, hogy a dapagliflozint vizsgálták krónikus veseelégtelen populációban, a DAPA-CKD-vizsgálatban is (eGFR 25–75 ml/min/1,73 m2), az aktív ágon szignifikánsan, 46%-kal csökkent a primer renális, kompozit végpont placebóval szemben (HR=0,56; 95% CI: 0,45–0,68; p<0,001) (26). Szintén ebben a betegpopulációban végzett EMPA-KIDNEY-vizsgálat eredményei várhatóak a közeljövőben, a vizsgálatot idő előtt leállították mivel szignifikánsan csökkentette a primer kompozit végpontot (25, 27). Hasonlóan szignifikáns csökkentést tapasztaltak a DECLARE-TIMI 58 vizsgálatban (HR=0,53; 95% CI: 0,43–0,60) (14); azonban a DAPA-HF-vizsgálatban nem volt ennyire kifejezett a renális kompozit végpontbeli különbség (HR=0,71; 95% CI: 0,44–1,16) (11). Az empagliflozin tekintetében, HFrEF-betegekben szignifikánsan csökkent a renális kompozit végpontok előfordulásának rizikója (HR=0,50; 95% CI: 0,32–0,77) (10). HFpEF-betegekben ezt nem észlelték (HR=0,95; 95% CI: 0,73–1,24) (28).
Biztonságosság
A fenti eredmények megerősítik az SGLT2-gátlók használatának fontosságát, azonban megemlítendők a vizsgálatok során észlelt mellékhatások is.
Húgyúti fertőzések 0,5–11,5%-ban fordultak elő (11, 15, 16), továbbá genitális traktus infekciókra (férfiaknál) és gombás fertőzésekre fogékonnyá válhatnak a betegek (13–15). Canagliflozint szedőknél gyakrabban fordultak elő a csonttörések (p=0,02) és gyakoribbak voltak az amputációk (p<0,001) placebóhoz képest (13).
Antidiabetikus kezelésnél gyakran felmerül a diabetikus ketoacidózis, amit a DECLARE-TIMI 58 vizsgálatban nagyobb arányban írták le placebóval szemben (0,3% vs. 0,1%; p=0,002), azonban ezt a DAPA-HF nem erősítette meg (11, 14). Hasonlóan, magasabb arányban észlelték a szövődményt a sotagliflozinnal a SCORED-vizsgálatban (15). Az EMPEROR-Reduced-vizsgálatban diabetikus ketoacidózis nem fordult elő sem a kezelt, sem a kontrollcsoportban.
Az SGLT2-gátlók biztonságosságát metaanalízisek szintén vizsgálták, ez alapján a hipotónia, hyperkalaemia, major hypoglykaemia, csonttörések és húgyúti fertőzések nem fordultak elő szignfikánsan gyakrabban placebóval szemben (24). Ellentmondásba ütközik a fentiekkel Wu és munkatársai által közölt eredmény, amely szerint a genitális infekciók gyakrabban fordultak elő SGLT2 alkalmazásakor placebóval szemben (RR=4,75; 95% CI: 4,00–5,63; I2 59%).
Megbeszélés
A diabétesz egy kiemelkedő rizikófaktor a szívelégtelen betegek kimenetelében (29); az eredetileg nem szívelégtelen diabéteszes betegeknél 2-5-ször nagyobb eséllyel alakul ki végül a kórállapot (30), emellett a krónikus szívelégtelen betegek mortalitását a diabétesz 16%-kal emeli (31).
Ezen nagy kockázatú betegcsoport gyógyszeres kezelésében hozott paradigmaváltást az SGLT2-gátlók csoportja, mivel az elmúlt évek multicentrikus, randomizált vizsgálataiban szignifikánsan javította a szívelégtelen betegek kimenetelét. A 2021-es ESC szívelégtelenség-ajánlásban IA indikációval a dapagliflozin és empagliflozin a HFrEF-betegekben alkalmazandók, azaz a bázisterápia részévé váltak. A 2022-es ACC szívelégtelenség-ajánlásban HFpEF-betegek esetében 2a B-indikációval az SGLT2-gátlók (empagliflozin) alkalmazhatók (12).
Az eredetileg orális antidiabetikumként alkalmazott SGLT2-gátlók hatékonysága nagy kardiovaszkuláris, diabéteszes betegcsoportban a CANVAS-vizsgálatban mutatkozott meg elsőként, ahol a szívelégtelenség-hospitalizáció rizikóját 33%-kal csökkentette (13). Ezután empagliflozin (9) és sotagliflozin (15) esetében is közel 30-35%-os rizikócsökkenést mutattak az SGLT2-gátlók. Minél nagyobb kockázatú betegcsoportot vizsgáltak (így diabéteszes vagy akut szívelégtelen betegcsoportot), ahol magas eseményrátával számolhatunk, annál kifejezettebb előny volt megfigyelhető (20). De ugyancsak igaz ez pl. a HFrEF-betegcsoportban végzett DAPA-HF-vizsgálat alcsoport-analízisére is, nagyobb arányú rizikócsökkenés volt megfigyelhető a primer végpontban azoknál a betegeknél, akiknél a beválasztás előtt 1 évben volt szívelégtelenség miatti hospitalizációjuk (11).
Az általunk is összefoglalt összes randomizált, multicentrikus vizsgálatban, azaz az SGLT2-gátlók teljes csoportjában (ahol az empagliflozin, dapagliflozin, sotagliflozin, ertugliflozin és canagliflozin hatását placebóval szemben vizsgálták) csökkent a szívelégtelenség események rizikója, függetlenül a diabétesz jelenlététől, hatékony volt HFrEF- és HFpEF-betegcsoportban – empagliflozin esetében –, valamint akut szívelégtelenségben is, amely utóbbi két betegcsoportban további vizsgálati eredmények várhatók. A DELIVER-vizsgálat (17) eredményeinek publikálása várhatók, amelyben a dapagliflozint vizsgálták HFpEF-betegcsoportban; egy hivatalos, előzetes tájékoztatás alapján annak sikerességére számíthatunk (32).
A korábbi, nagy mérföldkő vizsgálatok közül hasonló, keményvégpontokban mérhető eredményeket a sacubitril/valsartan esetében láthattunk. Bár ezen gyógyszerkomplex aktív komparátorral került összehasonlításra, a szívelégtelenség eseményeket összevethető mértékben, 23%-kal csökkentette HFrEF-betegekben (33).
A szívelégtelenség események mellett összefoglalónkban az összmortalitást vizsgáltuk. Ezen keményvégpont vonatkozásában az EMPAREG OUTCOME nagy KV-rizikóval rendelkező diabéteszes betegekben (9), a DAPA-HF (11) pedig a HFrEF-betegcsoportban diabétesztől függetlenül 32%-os, illetve 17%-os rizikócsökkenést mutatott. A dapagliflozin effektivitása összevethető volt ismét a sacubitril/valsartannal a krónikus szívelégtelen betegcsoportban, ahol 17% vs. 16%-os mortalitáscsökkenést írtak le (igaz, utóbbinál enalaprillal szemben) (33).
A HFrEF-betegcsoportban ugyancsak a terápia effektivitását mutatja a kardiorenális szindróma javulása miatt, ha a veseelégtelenség progressziója kedvezőbben alakul, mint placebóval történne. A legtöbb SGLT2-inhibitorral végzett vizsgálatban szekunder végpontként meghatározott renális kimenetellel kapcsolatban kedvező hatásokat írtak le, csökkentette a vesefunkció romlásának progresszióját, végstádiumú vesebetegséget és a renális halálozás kockázatát is. A renoprotektív hatás a krónikus veseelégtelenségben, dapagliflozinnal végzett vizsgálatban is igazolódott szívelégtelenségtől, diabétesztől függetlenül (26).
Összefoglalónk ugyancsak alátámasztotta, hogy a randomizált vizsgálatok eredményei alapján, az SGLT2-gátlók biztonsággal használhatók a szívelégtelen populációban, illetve krónikus vesebetegség esetén is. Bár gyakrabban észlelt mellékhatás a húgyivari fertőzések voltak bizonyos diabéteszes betegcsoportban, valamint ellentmondásos eredmények születtek a diabetikus ketoacidózis tekintetében a DECLARE-TIMI 58- (14) és a SCORED-vizsgálatokban (15), más esetben ezen mellékhatások gyakoribb előfordulását nem erősítették meg.
Így amellett, hogy biztonsággal alkalmazható, a legújabb ESC által kiadott konszenzusdokumentum alapján a szívelégtelenség gyógyszeres rezsim feltitrálása során észlelhető mellékhatásprofil is kedvezőbben alakul elsőkénti vagy mielőbbi bevezetése esetén a HFrEF-betegekben. Az SGLT2-gátlók esetében titrálás nem szükséges, míg a többi hatóanyagcsoport esetében a maximálisan tolerált dózis elérése kulcsfontosságú. Az SGLT2-gátlók korai bevezetésével, csökkenthető a béta-blokkoló által okozott kardiális dekompenzáció (34). McMurray és munkatársai egy új bevezetési javaslatot állítottak fel, miszerint a béta-blokkoló és SGLT2-gátló bevezetése az első lépés, majd az ARNI (angiotenzinreceptor-neprilizin-gátló), majd az MRA (mineralokortikoid-receptor-antagonista) bevezetése következzen; mindezt 4 hét alatt, a dózisok feltitrálása csak ezután következzen (35).
Következtetések
A szívelégtelenségben szenvedő betegek egy igen fragilis betegcsoport, nagy kardiovaszkuláris mortalitási rizikóval rendelkeznek. Az újonnan megjelent nemzetközi randomizált vizsgálatok eredményei alapján egy paradigmaváltás figyelhető meg ezen betegcsoport gyógyszeres kezelésében az eredetileg orális antidiabetikumként ismert SGLT2-inhibitorok csoportjának köszönhetően. Ezek közül jelenleg a dapagliflozin és empagliflozin a diabétesztől függetlenül javítja a csökkent ejekciós frakcióval rendelkező, krónikus szívelégtelen betegek kimenetelét. A terápia hatékonysága nemcsak a keményvégpontokban, így a kardiovaszkuláris mortalitás és szívelégtelenség események rizikójának csökkenésében, de a vesefunkció romlásának lassabb progressziójában is megmutatkozik, amellett, hogy biztonságosan alkalmazható.
Anyagi támogatás
Jelen tanulmány megjelenését a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal támogatta (NKFIA; NVKP_16-1-2016-0017 Nemzeti Szívprogram). A kutatást az Innovációs és Technológiai Minisztérium Tématerületi Kiválósági Programja (2020-4.1.1.-TKP2020) finanszírozta, a Semmelweis Egyetem Terápiás Fejlesztés és Bioimaging tématerületi programjai keretében.
Kosztin Annamáriát támogatta a Magyar Tudományos Akadémia Bólyai János Kutatási Ösztöndíja.
Érdekeltségek
Merkel Eperke Dóra, MD, támogatásban részesült a Novartis vállalattól. Kosztin Annamária, MD, PhD, támogatásban részesült a Medtronic, Novartis, Bayer, Boehringer-Ingelheim és AstraZeneca vállalatoktól. Merkely Béla, MD, PhD, DSc, támogatásban részesült a Biotronik, Medtronic, Abbott, AstraZeneca, Boehringer-Ingelheim és Novartis vállalatoktól, továbbá a Boston Institutional Grant-ben részesül.
A többi szerző kijelenti, hogy anyagi támogatásban nem részesült.
IRODALOM
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal 2021.
https://doi.org/10.1093/eurheartj/ehab368
2. Longo M, Bellastella G, Maiorino MI, et al. Diabetes and Aging: From Treatment Goals to Pharmacologic Therapy. Frontiers in Endocrinology 2019; 10. https://doi.org/10.3389/fendo.2019.00045
3. Kristensen SL, Jhund PS, Lee MMY, et al. Prevalence of Prediabetes and Undiagnosed Diabetes in Patients with HFpEF and HFrEF and Associated Clinical Outcomes. Cardiovasc Drugs Ther 2017; 31(5–6): 545–9. https://doi.org/10.1007/s10557-017-6754-x
4. Rosano GM, Vitale C, Seferovic P. Heart Failure in Patients with Diabetes Mellitus. Card Fail Rev. 2017; 3(1): 52–5. https://doi.org/10.15420/cfr.2016:20:2
5. Bertoni AG, Hundley WG, Massing MW, et al. Heart failure prevalence, incidence, and mortality in the elderly with diabetes. Diabetes Care 2004; 27(3): 699–703. https://doi.org/10.2337/diacare.27.3.699
6. Zareini B, Blanche P, D’Souza M, et al. Type 2 Diabetes Mellitus and Impact of Heart Failure on Prognosis Compared to Other Cardiovascular Diseases. Circulation: Cardiovascular Quality and Outcomes 2020; 13(7): e006260. https://doi.org/10.1161/CIRCOUTCOMES.119.006260
7. MacDonald MR, Petrie MC, Varyani F, et al. Impact of diabetes on outcomes in patients with low and preserved ejection fraction heart failure: an analysis of the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur Heart J 2008; 29(11): 1377–85. https://doi.org/10.1093/eurheartj/ehn153
8. Pavlović A, Polovina M, Ristić A, et al. Long-term mortality is increased in patients with undetected prediabetes and type-2 diabetes hospitalized for worsening heart failure and reduced ejection fraction. Eur J Prev Cardiol 2019; 26(1): 72–82. https://doi.org/10.1177/2047487318807767
9. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. New England Journal of Medicine 2015; 373(22): 2117–28. https://doi.org/10.1056/NEJMoa1504720
10. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. New England Journal of Medicine 2020; 383(15): 1413–24. https://doi.org/10.1056/NEJMoa2022190
11. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. New England Journal of Medicine 2019; 381(21): 1995–2008. https://doi.org/10.1056/NEJMoa1911303
12. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022; 145(18): e895–e1032. https://doi.org/10.1161/CIR.0000000000001063
13. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. New England Journal of Medicine 2017; 377(7): 644–57. https://doi.org/10.1056/NEJMoa1611925
14. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. New England Journal of Medicine 2018; 380(4): 347–57. https://doi.org/10.1056/NEJMoa1812389
15. Bhatt DL, Szarek M, Pitt B, et al. Sotagliflozin in Patients with Diabetes and Chronic Kidney Disease. New England Journal of Medicine 2020; 384(2): 129–39. https://doi.org/10.1056/NEJMoa2030186
16. Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. New England Journal of Medicine 2020; 383(15): 1425–35. https://doi.org/10.1056/NEJMoa2004967
17. Solomon SD, Vaduganathan M, Claggett BL, et al. Baseline Characteristics of Patients With HF With Mildly Reduced and Preserved Ejection Fraction. JACC: Heart Failure 2022; 10(3): 184–97. https://doi.org/10.1016/j.jchf.2021.11.006
18. Damman K, Beusekamp JC, Boorsma EM, et al. Randomized, double-blind, placebo-controlled, multicentre pilot study on the effects of empagliflozin on clinical outcomes in patients with acute decompensated heart failure (EMPA-RESPONSE-AHF). Eur J Heart Fail 2020; 22(4): 713–22. https://doi.org/10.1002/ejhf.1713
19. Voors AA, Angermann CE, Teerlink JR, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nature Medicine 2022; 28(3): 568–74. https://doi.org/10.1038/s41591-021-01659-1
20. Bhatt DL, Szarek M, Steg PG, et al. Sotagliflozin in Patients with Diabetes and Recent Worsening Heart Failure. New England Journal of Medicine 2020; 384(2): 117–28. https://doi.org/10.1056/NEJMoa2030183
21. Butler J, Usman MS, Khan MS, et al. Efficacy and safety of SGLT2 inhibitors in heart failure: systematic review and meta-analysis. ESC Heart Fail 2020; 7(6): 3298–309. https://doi.org/10.1002/ehf2.13169
22. Neuen BL, Arnott C, Perkovic V, et al. Sodium-glucose co-transporter-2 inhibitors with and without metformin: A meta-analysis of cardiovascular, kidney and mortality outcomes. Diabetes Obes Metab 2021; 23(2): 382–90. https://doi.org/10.1111/dom.14226
23. Wu JH, Foote C, Blomster J, et al. Effects of sodium-glucose cotransporter-2 inhibitors on cardiovascular events, death, and major safety outcomes in adults with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2016; 4(5): 411–9. https://doi.org/10.1016/S2213-8587(16)00052-8
24. Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). European Heart Journal 2020; 41(2): 255–323. https://doi.org/10.1093/eurheartj/ehz486
25. [Available from: http://www.nephrologia.hu/upload/nephrologia/document/az_emmi_egeszsegugyi_szakmai_iranyelve_a_
felnottkori_idult_vesebetegseg_diagnozisarol_es_kezeleserol.pdf?web_id=.
26. Heerspink HJL, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou F-F, et al. Dapagliflozin in Patients with Chronic Kidney Disease. New England Journal of Medicine 2020; 383(15): 1436–46. https://doi.org/10.1056/NEJMoa2024816
27. Herrington WG, Preiss D, Haynes R, et al. The potential for improving cardio-renal outcomes by sodium-glucose co-transporter-2 inhibition in people with chronic kidney disease: a rationale for the EMPA-KIDNEY study. Clin Kidney J 2018; 11(6): 749–61. https://doi.org/10.1093/ckj/sfy090
28. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. New England Journal of Medicine 2021; 385(16): 1451–61. https://doi.org/10.1056/NEJMoa2107038
29. Gottdiener JS, Arnold AM, Aurigemma GP, et al. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study. J Am Coll Cardiol 2000; 35(6): 1628–37. https://doi.org/10.1016/s0735-1097(00)00582-9
30. Nichols GA, Hillier TA, Erbey JR, Brown JB. Congestive heart failure in type 2 diabetes: prevalence, incidence, and risk factors. Diabetes Care 2001; 24(9): 1614–9. https://doi.org/10.2337/diacare.24.9.1614
31. Raghavan S, Vassy JL, Ho YL, et al. Diabetes Mellitus–Related All Cause and Cardiovascular Mortality in a National Cohort of Adults. Journal of the American Heart Association 2019; 8(4): e011295.
32. Farxiga met primary endpoint in DELIVER Phase III trial, reducing risk of cardiovascular death or worsening heart failure in patients with preserved ejection fraction 2022 [Available from: https://www.astrazeneca.com/media-centre/press-releases/2022/farxiga-hfpef-phase-iii-trial-met-primary-endpoint.html.
33. McMurray JJV, Packer M, Desai AS, et al. Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure. New England Journal of Medicine 2014; 371(11): 993–1004. https://doi.org/10.1056/NEJMoa1409077
34. Rosano GM, Moura B, Metra M, et al. Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. European journal of heart failure 2021; 23(6): 872–81. https://doi.org/10.1002/ejhf.2206
35. McMurray JJV, Packer M. How Should We Sequence the Treatments for Heart Failure and a Reduced Ejection Fraction? Circulation 2021; 143(9): 875–7. https://doi.org/10.1161/CIRCULATIONAHA.120.052926