New proarrhythmia model based on reduced repolarization reserve in isolated guinea pig hearts
█ Original article
DOI: 10.26430/CHUNGARICA.2017.47.suG.15
Authors:
Papp Henriett1, Sarusi Annamária1, Farkas Attila2, Polyák Alexandra2, Papp Gyula1, Varró András1, Farkas András2
1Szegedi Tudományegyetem, Általános Orvostudományi Kar, Farmakológiai és Farmakoterápiai Intézet, Szeged
2SZTE, Általános Orvostudományi Kar, II. sz. Belgyógyászati Klinika és Kardiológiai Központ, Szeged
Summary
Aims: Specific and sensitive experimental models are needed for testing the proarrhythmic liability of newly developed drugs. Recently, we found that reduced repolarization reserve sensitized isolated, Langendorff perfused rabbit hearts to development of drug-induced torsades de pointes type ventricular tachycardia (TdP). Ion channel constitution of the guinea pig heart may make it more suitable for proarrhythmia development than the rabbit heart. Thus, aim of the present study was to investigate if reduced repolarisation reserve can sensitize guinea pig heart to development of drug-induced torsades de pointes.
Methods: The proarrhythmic activity of the selective IKr K+ current inhibitor dofetilide was tested in Langendorff perfused, isolated guinea pig hearts. Repolarization reserve was reduced by the selective IKs K+ current inhibitor HMR 1556. Three groups of hearts were tested: (1) Control (n=7 hearts), (2) hearts perfused with HMR 1556 (n=6 hearts), (3) hearts perfused with dofetilide+HMR 1556 (n=7 hearts). The incidences of arrhythmias were determined as primary endpoints. Also, the rate corrected QT (QTc) interval was measured.
Results: No TdP developed in any of the groups. Dofetilide+HMR 1556 perfusion did not influence significantly the incidence of ventricular tachycardias, but it significantly increased the incidence of conduction blocks as an indication of development of extreme repolarization prolongation. (Control: 0%, HMR 1556: 0%, dofetilide+HMR 1556: 100%). Reduction of repolarization reserve synergistically increased the QTc prolonging effect of dofetilide (QTc prolongation: HMR 1556: 14%, dofetilide: 20%, dofetilide+HMR 1556: 95%)
Conclusions: Reduced repolarisation reserve did not sensitize guinea pig heart to development of drug-induced torsades de pointes. However, drug-induced QTc prolongation can be tested as a sensitive proarrhythmia endpoint in the model, as reduced repolarization reserve synergistically increases the QTc prolonging effect of the test drug.
ISSUE: CARDIOLOGIA HUNGARICA | 2017 | VOLUME 47, SUPPLEMENTUM G
Összefoglalás
Célkitűzés: A gyógyszerek proaritmiás aktivitásának vizsgálatához szükség van szenzitív és megbízható experimentális modellekre. Korábbi vizsgálatunkban a repolarizációs tartalék szűkítése izolált, Langendorff-perfundált nyúlszív-modellben rendkívüli módon érzékenyítette a szíveket a gyógyszer okozta torsades de pointes kamrai tachycardia (TdP) kialakulására. Ioncsatorna összetétele alapján elképzelhető, hogy a tengerimalac-szív még érzékenyebb lehet a proaritmiás hatásokra. Ezért célkitűzésünk volt megvizsgálni, vajon a repolarizációs tartalék szűkítése érzékenyíti-e a tengerimalac-szíveket a gyógyszer okozta TdP kialakulására.
Módszerek: Az IKr-káliumáramot szelektíven gátló dofetilid proaritmiás aktivitását teszteltük izolált, Langendorff-perfundált tengerimalac-szívben. A repolarizációs tartalékot IKs káliumáramot gátló HMR 1556-tal csökkentettük. A szíveket három csoportba soroltuk: (1) kontroll (n=7 szív); (2) HMR 1556 perfúzió (n=6 szív); (3) dofetilid+HMR 1556 perfúzió (n=7 szív). Elsődleges végpontként meghatároztuk az aritmiák gyakoriságát, valamint megmértük a frekvencia korrigált QT-szakasz (QTc) hosszát.
Eredmények: TdP nem jelentkezett egyik csoportban sem. Dofetilid+HMR 1556 perfúzió a kamrai tachyarrhythmiák gyakoriságát szignifikánsan nem befolyásolta, de az extrém mértékű repolarizáció nyújtás jeleként szignifikánsan megnövelte a vezetési zavarok gyakoriságát (kontroll: 0%, HMR 1556: 0%, dofetilid+HMR 1556: 100%). A repolarizációs tartalék szűkítése szinergista hatással fokozta a dofetilid QTc nyújtó hatását (QTc-megnyúlás: HMR 1556: 14%, dofetilid: 20%, dofetilid+HMR 1556: 95%).
Következtetések: A repolarizációs tartalék szűkítése nem érzékenyítette a Langendorff-perfundált tengerimalac-szíveket a gyógyszer okozta TdP kialakulására. Érzékeny proaritmia végpontként a szerek QTc nyújtó hatása alkalmazható a modellben, mivel a repolarizációs tartalékszűkítés szinergista hatással fokozza a szer által okozott QTc-megnyúlást.
Bevezetés
Proaritmiának tekintjük a gyógyszer által okozott ritmuszavarokat, amely számos mechanizmus útján alakulhat ki. Bizonyos gyógyszerek gátolják a késői egyenirányító (delayed rectifier) K+-áram gyors komponensét (IKr), amely a repolarizációért felelős fő áram, ezáltal sérül a repolarizáció, és életveszélyes ritmuszavarok alakulhatnak ki (1). Ilyen aritmia például a gyógyszer okozta torsades de pointes típusú kamrai tachycardia (TdP), amely korábbi in vitro kísérleteink alapján izolált, Langendorff-perfundált nyúlszív-modellben gyakran előfordul. TdP számos szer súlyos mellékhatásaként jelentkezhet (2). Gyakran az EKG QT-szakaszának megnyúlása előzi meg, ez azonban nem teljesen megbízható prediktora a TdP kialakulásának (3). Egyes antidepresszánsok, antihisztaminok, antibiotikumok, antiaritmikumok, de számos más osztályba tartozó szer is rendelkezik QT-szakaszt nyújtó hatással, és képes TdP-t okozni (4).
Repolarizációs tartalék alatt a szívizom repolarizációjáért felelős mechanizmusainak összességét értjük. Ismert, hogy egyetlen K+-csatorna gátlása még nem feltétlenül okoz olyan mértékű repolarizáció-gyengülést, hogy ez aritmiához vezethessen. Ha viszont egy időben több K+-csatorna is gátlás alá kerül, már nagy valószínűséggel alakulhatnak ki súlyos aritmiák (5). Az irodalomból ismert, hogy az IKr-áram valamilyen szerrel történő gátlása esetén a késői egyenirányító (delayed rectifier) K+-áram lassú komponense (IKs) részben kompenzálja a repolarizáló áramban bekövetkező csökkenést, így még nem feltétlenül alakul ki aritmia (6). Repolarizációs tartalék hiányában azonban az IKr K+-áram gátló szerek nagy valószínűséggel ritmuszavarokat válthatnak ki (1). A repolarizációs tartalék fogalma lehetőséget ad arra, hogy a proaritmiára hajlamosító tényezőket és azok klinikai mechanizmusait együttesen vizsgálhassuk (7).
Mivel szinte minden hatástani csoportban találtak olyan gyógyszereket, amelyeknek mellékhatásaként megfigyeltek TdP-t, ezért a ma érvényes ajánlások szerint minden egyes, fejlesztés alatt álló, új gyógyszernek szükséges felmérni a proaritmiás aktivitását a klinikai használatba kerülés előtt (2). Ezért a gyógyszerek proaritmiás hatásának vizsgálatához megbízható és szenzitív experimentális modellekre van szükség. A tengerimalac a legkisebb faj, amelynek szívizmában már található működő IKr-áram, ennek tekintetében a faj hasonlít az emberre, és így megfelelő fajnak tűnik kardiovaszkuláris biztonság-farmakológiai vizsgálatokhoz. Korábbi vizsgálatainkban már validáltunk egy, a repolarizációs tartalék csökkentésén alapuló in vitro perfundált nyúlszív-modellt (8), azonban néhány szempont miatt úgy gondoltuk, hogy előnyösebb lenne egy hasonló elven működő tengerimalac-modell beállítása. Az egyik és talán legfontosabb szempont a tengerimalac szívének IKs/IKr aránya. Tengerimalacban ez az arány jóval nagyobb, mint a nyúlban és az emberben mért arány, ugyanis a tengerimalac-szívében sokkal több a funkcionális IKs-áram (6, 9), míg a nagyobb emlősökben alacsonyabb az IKs-denzitás (1). Ez viszont azt sugallja, hogy ha tengerimalac-szívben a nyúlmodellben alkalmazott farmakológiai módszerrel, a szelektív IKs-gátló HMR 1556-tal gátoljuk az IKs-t, akkor jelentősebb repolarizációs tartalékszűkítést tudunk elérni, mint a nyúlban. Ezek alapján a repolarizációs tartalékszűkítésen alapuló tengerimalac-modell nagyon nagy érzékenységgel jelezheti az IKr-gátló vegyületek repolarizációra kifejtett hatását.
Jelen munkánkban célunk volt megvizsgálni, hogy a repolarizációs tartalék szűkítése érzékenyíti-e a tengerimalac-szíveket a gyógyszer okozta torsades de pointes típusú kamrai tachycardia kialakulására a korábbi, nyúlszívvel végzett kísérleteinkben tapasztaltakhoz hasonlóan (8).
Módszerek
Kísérleti preparátum
Kísérleteinket izolált, Langendorff-perfundált tengerimalac-szíveken végeztük. A 250-650 g tömegű nőstény tengerimalacokat thiopentállal (~3,2 ml/állat, ~470 mg/kg ip.) túlaltattuk; az altatószerrel együtt ip. 1000 NE Na-heparint adtunk. A szívet kimetszettük, az aortát kanüláltuk, és Langendorff perfúziós rendszerre helyeztük. A kanülön keresztül az aortát retrográd módon perfundáltuk, az EKG-t folyamatosan regisztráltuk, a koronária-áramlást 5 percenként mértük.
Kísérleti protokoll
A kísérleti protokollt az 1. ábra szemlélteti. A kísérlet elején a szíveket 20 percig csak módosított Krebs-oldattal perfundáltuk (stabilizációs időszak). Az 1. és 2. csoportban a 20. perctől kezdve a szíveket a dofetilid és a HMR 1556 oldószerével, dimetil-szulfoxiddal (DMSO), a 3. csoportban pedig 100 nM dofetiliddel perfundáltuk. A 40. perctől kezdve a 2. és 3. csoportban a perfúziót kiegészítettük 700 nM HMR 1556-tal. A kísérlet utolsó 10 percében, a 60. perctől a perfúziós oldat minden csoportban 100 nM noradrenalint és 25 nM adrenalint is tartalmazott. A szeradás kezdetétől (20. perctől) a kísérlet végéig konstans oldószer koncentrációt alkalmaztunk minden kísérletben. Az 1. csoport szolgált kontrollcsoportként. A 2. csoportban („HMR 1556” csoportban) vizsgáltuk az önmagában adott IKs-gátló HMR 1556 hatását a kísérleti végpontjainkra (QTc-nyújtás, aritmiák megjelenése). A 3. csoportban („Dofetilid+HMR 1556” csoportban) vizsgáltuk, hogy az IKr-gátló dofetilid hatásait fokozza-e a szelektív IKs-gátló HMR 1556-tal történt a repolarizációs tartalék szűkítése. A kísérlet utolsó 10 percében (60-70. percben) azt vizsgáltuk, hogy a katekolamin perfúzióval szimulált szimpatikus aktivitás hogyan befolyásolja az egyes szerek hatását a kísérleti végpontjainkra.
A fentiek alapján 3 csoportot vizsgáltunk (kontrollcsoport: n=7, HMR 1556 csoport: n=6, Dofetilid+HMR 1556 csoport: n=7). A kísérleteket randomizálva, vakpróbás módon végeztük.
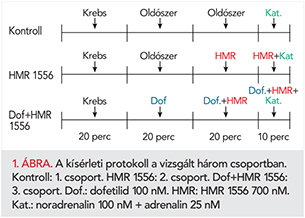
Alkalmazott szerek és oldószereik
A dofetilid egy szelektív, III. osztályú antiaritmiás szer, potens IKr-gátló, jelentős proaritmiás hatása ismert magasabb koncentrációkban alkalmazva. Az IKr K+-áram gátlását tekintve az IC50 értéke 10–15 nM (10). Az előkísérleteinkben tapasztaltak alapján kísérleteinkben 100 nM dofetilidet alkalmaztunk.
A HMR 1556 egy szelektív IKs-gátló szer. IC50 értéke kb. 70-100 nM (11). Munkánkban célunk volt az IKs szinte teljes gátlása, ezért kísérleteinkben 700 nM HMR 1556 koncentrációt alkalmaztunk.
Katekolamin perfúzió során a perfundáló oldat 25 nM adrenalint és 100 nM noradrenalint tartalmazott.
EKG-analízis
EKG-szakaszok mérése sinusritmusban
Előre meghatározott kísérleti időpontokban, kizárólag szabályos sinusütéseket tartalmazó 7 másodperces intervallumokban az RR-ciklusokból átlagolt EKG-jelet készítettünk. Az átlagolt EKG-jelből meghatároztuk az EKG-szakaszokat. A valós mérési időpont a pontosan megadott időponttól ±0,5 perccel térhetett el, ha ez aritmia vagy technikai okok miatt indokolt volt. Ahol az adott időpontban nem volt megfelelő számú sinusütés, az értékelésben ott hiányzó adat szerepel. Adott csoportnál, adott időpontban csak akkor ábrázoltuk az eredményeket, ha ott legalább öt kísérletben kaptunk adatot. A mérést egy kísérleten belül konzekvensen egy, a legjobb zajmentességet mutató elvezetésben végeztük.
RR-intervallum korrigált QT-szakasz (QTc) számítás
Mivel a szívfrekvencia (és az RR-intervallum) befolyásolja a QT-szakasz hosszát, megvizsgáltuk az RR- és QT-szakaszok közötti összefüggést a Krebs-perfúzió alatt. A húsz izolált Langendorff-perfundált szív mindegyikében egymás után mért 40-40 QT- és RR-szakasz összefüggését vizsgáltuk a tesztszer adása előtti utolsó percben Farkas AS és munkatársai által használt metodikát követve (12). A lineáris regresszióanalízis szignifikáns összefüggést igazolt az RR- és QT-szakaszok között (QTx=0,404RRX-1+39,455). Az egyenletet átalakítottuk, hogy megkapjuk a frekvenciára korrigált QT (QTc) értékét 240/perc átlagos szívfrekvencia (RR=250 ms) értékre korrigálva: QTc=QTX-0,404(RRX-1-250). Az így kapott egyenletbe behelyettesítve az összetartozó QT- és RR-szakaszok hosszait, kiszámoltuk a QTc-értékeket, majd ábrázoltuk a QTc-szakasz hosszát az RR-intervallum függvényében. A lineáris regresszió 0 meredekségű egyenest mutatott, amely igazolja, hogy a korrekció eltávolította az RR-intervallum hatását a QTc-szakasz hosszára. A fenti egyenlettel kiszámítottuk a QTc-értékeket minden egyes kísérlet sinusritmus alatti mérési időpontjaiban, és összehasonlítás céljából statisztikai analízist végeztünk az egyes kezelési csoportok között.
Aritmiaanalízis
A kísérletek mindhárom szakaszában külön meghatároztuk a nem TdP típusú kamrai tachycardia, a TdP és a kamrafibrilláció jelentkezési idejét és gyakoriságát, valamint meghatároztuk a vezetési blokkok gyakoriságát is. A blokkok gyakoriságának számításakor nem tettünk különbséget a különböző típusú vezetési blokkok között, egy kategóriába soroltuk az atrioventricularis (AV)-blokkokat (1., 2., 3. fokú AV-blokkokat) és a kamrai vezetési zavarokat (jobb és bal Tawara-szár-blokkot, és a nem specifikus intraventricularis blokkokat). Az EKG-értékelés minden esetben vakpróbás módon történt.
Statisztikai értékelés
A csoportok közötti aritmiák gyakoriságának összehasonlítására Fisher-féle egzakt tesztet alkalmaztunk Bonferoni-korrekcióval. Az egymástól független mintákból (csoportokból) származó minden egyéb változót Kruskall–Wallis-teszttel hasonlítottunk össze, és átlag±standard error formában ábrázoltuk. p<0,05 érték esetén tekintettük a különbségeket szignifikánsnak.
Eredmények
Aritmia gyakoriságok
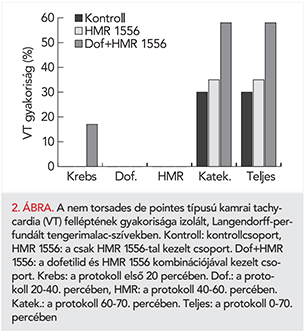
Jelen kísérletsorozatunkban izolált tengerimalac-szívben TdP, valamint az ennek következményeként potenciálisan kialakuló kamrafibrilláció egyáltalán nem jelentkezett.
A protokoll 20-60. percében sem a dofetilid, sem a HMR 1556, sem a két szer együtt adva nem okozott kamrai tachycardiát. A protokoll utolsó időszakában (60-70. percben) a katekolaminok hozzáadásának hatására átmenetileg gyakorivá váltak a ritmuszavarok minden csoportban kezeléstől függetlenül. A legkomplexebb aritmia azonban csak a nem TdP típusú kamrai tachycardia volt, ennek gyakoriságát azonban sem a dofetilid, sem a HMR 1556, sem a két szer együttes alkalmazása nem növelte; a csoportok nem különböztek egymástól szignifikánsan (2. ábra).
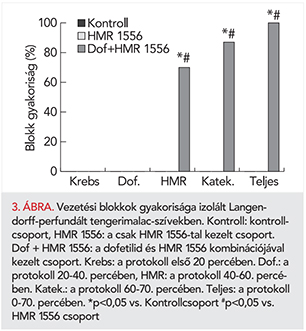
Vezetési blokkok
Vezetési blokkok csak a kombinációs csoportban jelentkeztek. A 40. perctől kezdődően, amikor a szívek az IKr-gátló dofetilidet és az IKs-gátló HMR 1556-ot együtt kapták, szignifikánsan megnőtt a vezetési blokkok előfordulási gyakorisága (3. ábra), amely extrém mértékű repolarizáció gátlásra utal a két szer együttes adásakor. A kísérlet végén lévő 10 perces katekolamin időszak alatt ugyanez a hatás figyelhető meg a kombinációs csoportban (3. ábra).
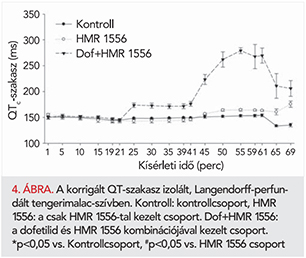
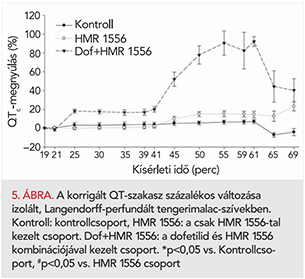
Frekvencia korrigált QT-szakasz (QTc)
A csoportok között az első 20 percben (stabilizációs időszak) nem volt szignifikáns különbség a QTc-paraméterben. Az IKr-gátló dofetilid már önmagában alkalmazva szinte azonnal szignifikánsan megnyújtotta a QTc-szakaszt, a szeradás első 20 perce alatt körülbelül 20%-os QTc-nyúlást okozott a kiindulási (19. percben mért) értékhez viszonyítva (4–5. ábra). Az IKs-gátló HMR 1556 önmagában adva is szignifikánsan nyújtotta a QTc-szakaszt (4–5. ábra). A HMR 1556 a szeradás első 20 perce alatt körülbelül 10%-os QTc-nyúlást okozott (4–5. ábra). A dofetilid és a HMR 1556 együttes adásakor masszív QTc-megnyúlás jött létre, amely azt mutatja, hogy a HMR 1556 potencírozta a dofetilid QTc-nyújtó hatását. A katekolaminok hozzáadása a HMR 1556 QTc-nyújtó hatását tovább fokozta. A HMR 1556 és a dofetilid együttes adásakor viszont a katekolaminok által okozott QTc-szakasz rövidülés ellenére is nyilvánvaló maradt a HMR 1556 potencírozó hatása, a dofetilid markánsan nyújtotta a QTc-t (4–5. ábra).
Megbeszélés
Kísérleteinkben az IKr-gátló dofetilid az IKs-gátló HMR 1556-tal történt repolarizációs tartalékszűkítés ellenére sem okozott TdP-t vagy egyéb komplex aritmiát izolált, Langendorff-perfundált tengerimalac-szívben. Az aritmiák hiánya nem a szerek teljes hatástalanságának következménye, mivel a repolarizáció drasztikus módon megnyúlt a dofetilid és a HMR 1556 együttes adása mellett, amelyet direkt módon a nagyarányú QTc-megnyúlás, indirekt módon pedig a vezetési zavarok nagy gyakorisággal történő megjelenése jelez. Az IKs-gátló HMR 1556-tal történt repolarizációs tartalékszűkítés szinergista módon fokozta a dofetilid QTc-szakaszt nyújtó hatását. Ez arra utal, hogy az izolált tengerimalacszív-modellben az aritmiák helyett a szerek QTc-nyújtó hatását használhatjuk érzékeny, proaritmiás aktivitásra utaló végpontnak.
Izolált tengerimalac-szív alacsony érzékenysége TdP-re
A ma érvényes ajánlások szerint minden egyes fejlesztés alatt álló, új gyógyszernek szükséges vizsgálni a proaritmiás hatását a klinikai használatba kerülés előtt (2). A gyógyszer-biztonságossági vizsgálatban használatosak mind in vivo, mind in vitro TdP-modellek, de széles körben nem terjedtek el, mert vagy nagyon komplikáltak vagy költségesek. Ezért jelen munkánk célja volt, hogy munkacsoportunk korábbi sikeres, izolált nyúlszív-kísérleteire alapozva beállítsunk egy érzékeny, egyszerű és költséghatékony izolált tengerimalacszív-modellt, amelyben a gyógyszerek okozta TdP megjelenése direkt módon vizsgálható.
Izolált, Langendorff-perfundált nyúlszívben a dofetilidet 20 nM feletti koncentrációban alkalmazva megfigyelhetjük a TdP megjelenését, valamint a szer szignifikáns QTc-nyújtó hatását (12–14). A nyúlszívvel szemben a tengerimalac-szív érzékenysége aritmiák kialakulására nagyon alacsonynak tűnik. Eredményeink szerint a kombinált IKr- és IKs-gátlás hatására sem alakultak ki komplex aritmiák izolált tengerimalac-szívben. Ennek oka nagy valószínűséggel nem az, hogy az IKr-gátló dofetilidet vagy az IKs-gátló HMR 1556-ot alacsony koncentrációban adtuk volna, mivel a két szer együttadásakor jelentősen megnyúlt a QTc-szakasz hossza és nagy gyakorisággal kamrai vezetési blokkok alakultak ki, amelyek drasztikus repolarizáció gátlásra utalnak.
Michael és munkatársai in vivo pentobarbitállal altatott tengerimalac-modellen vizsgálta a TdP megjelenését. Már az előkísérleteik során szignifikáns QT-nyúlást figyeltek meg, de TdP nem jelentkezett, ezért a szereket később magasabb dózisban alkalmazták. Az α1-adrenoceptor serkentő fenilefrinnel stimulált altatott tengerimalacokban nem jelentkezett TdP, viszont az IKr- és IKs-áramok együttes gátlása szignifikáns QT-nyúlást eredményezett, és minden állatban 2:1 AV-blokk jelentkezett. Ezzel szemben, amikor adrenalinnal stimulálták a tengerimalacokat, az IKr- és IKs-áramok együttes gátlása az állatok 75%-ában TdP-t okozott (15). Ezek szerint lehetséges TdP-t kiváltani repolarizációs tartalékszűkítéssel és katekolaminok alkalmazásával tengerimalacban is. Ezekkel az in vivo eredményekkel ellentétben a mi in vitro kísérleteinkben nem alakult ki TdP, ami arra utal, hogy valószínűleg valamilyen hormonális vagy vegetatív idegrendszeri stimulus vagy a kamrai falfeszülés hiányzott, ami in vivo körülmények között érzékenyítette volna a szíveket a TdP kialakulására. Tekintettel arra, hogy nyúlban az IKr- és IKs-áramok együttes gátlása nagy gyakorisággal TdP-t okoz in vivo (3) és in vitro (8) körülmények között is, míg tengerimalacban ez a hatás csak in vivo körülmények között jelentkezik, megállapítható, hogy a tengerimalacban a TdP kialakulása sokkal jobban függ egyes, csak in vivo-ban megtalálható, eddig pontosan nem tisztázott faktoroktól.
A QTc-szakasz érzékeny proaritmia biomarker tengerimalac-szívben, a repolarizációs tartalékszűkítés potencírozó hatása
Az ICH S7B-ajánlás szerint a késleltetett kamrai repolarizációnak és a megnyúlt QT-szakasznak kockázatnövelő hatása van a kamrai tachyarrhythmiákra, beleértve a TdP-t is. Ez a rizikó tovább nő, ha más kockázati faktorok is társulnak mellé, például bradycardia, hypokalaemia stb. (2, 16, 17). Az ICH S7B-ajánlás szerint humánban a QT-szakasz megnyúlása káros, ezért előírja a szerek ilyen irányú tesztelésének szükségességét azok forgalomba hozatala előtt. Az ajánlás szerint elengedhetetlen a gyógyszerek QT-szakaszt nyújtó hatását in vivo éber vagy altatott állatban vizsgálni (16). Mivel a QT-szakasz hossza függ a ciklushossztól, ezért szükséges a QT matematikai korrekciója, amely kiküszöböli a QT-szakasz szívfrekvencia-függését. Erre azonban nincs általánosan elfogadott módszer, és gyakran az alkalmazott QT korrekciós módszerek nem validáltak. Az általunk alkalmazott QT korrekciós módszer eltávolítja a QT-szakasz frekvenciafüggését izolált tengerimalac-szívben, ezért alkalmasnak tűnik a gyógyszerek frekvenciától függetlenül jelentkező QT-szakaszt nyújtó hatásának vizsgálatára tengerimalac-szívben.
Az irodalom alapján a frekvencia korrigált QT (QTc) azonban egy elég ellentmondásos proaritmia biomarker, mert kicsi a szenzitivitása és a specificitása. Nem minden QT-nyújtó szer okoz TdP-t ugyanolyan rizikóval, és nem minden szer nyújtja a QT-szakaszt, ami TdP-t vált ki. A klinikumban sok páciens esetében regisztráltak már gyógyszer-indukált TdP-t a vártnál jóval kisebb mértékű QT-nyúlás esetén, valamint gyógyszer okozta proaritmia előfordulását leírták már normál vagy megrövidült QT esetén is (18). Továbbá a QT-szakasz, vagyis az akciós potenciál időtartamának megnyúlása antiaritmiás hatású is lehet, ha instabilitás, trianguláció és reverse use dependencia nem áll fenn (19).
Mivel az IKs-gátló HMR 1556-tal történt repolarizációs tartalékszűkítés szinergista módon fokozta a dofetilid QTc-szakaszt nyújtó hatását, ez arra utal, hogy az alkalmazott izolált tengerimalacszív-modellben a szerek QTc-nyújtó hatását használhatjuk érzékeny, proaritmiás aktivitásra utaló végpontnak. Egy másik experimentális munkánkban szintén izolált, Langendorff perfundált tengerimalac-szívben vizsgáltuk a repolarizációs tartalék szűkítés hatását IKr-gátlók QTc-szakasz nyújtó hatására. Abban a vizsgálatunkban viszont kifejezetten alacsony koncentrációban alkalmaztuk az IKr-gátló dofetilidet és cizapriddot az IKs-gátló HMR 1556 mellett, hogy teljes mértéken elkerüljük a gyógyszer okozta ritmuszavarok keletkezését, és csak a QTc-szakasz változásait tudjuk vizsgálni. Ennek ellenére a repolarizációs tartalékszűkítés ugyanolyan szinergista módon fokozta az IKr-gátlók QTc-nyújtó hatását, amely a modellünk nagy szenzitivitására utal (20).
Chen és munkatársainak eredményei szerint a dofetilid koncentráció-függő módon, szignifikánsan nyújtja a QT-szakasz hosszát, így a modellünk bár még validálásra vár, alkalmas lehet arra, hogy a szerek QT-szakaszt nyújtó hatását teszteljék vele (21). Tabo és munkatársai egy másik tanulmányban in vitro Langendorff-perfundált tengerimalac-szívben a késleltetett kamrai repolarizáció és a ciklushossz kapcsolatát vizsgálták a modell szenzitivitásának és megbízhatóságának tesztelése mellett. A modellt ismerten a QT-szakasz nyúlását okozó és nem okozó szerekkel tesztelték, és megállapították, hogy a modell elég szenzitív, hogy alkalmazni lehessen a szerek korai fejlesztési stádiumában a QT-intervallumot nyújtó hatás vizsgálatára (22). Ezek az eredmények megegyeznek a mi adatainkkal, de az általunk kidolgozott modell a repolarizációs tartalék IKs-blokkolással történő beszűkítése miatt azonban valószínűleg sokkal szenzitívebb lehetőséget biztosít a szerek QT-nyújtó hatásának kimutatására; az alkalmazott IKs-gátlás potencírozza a vizsgált szer QT-nyújtó hatását, ezáltal a szerek látens repolarizáció gátló hatása is kimutatható. Ennek bizonyításához azonban egy validációs vizsgálat elvégzése szükséges további referenciaszerekkel. Ennek ellenére a jelen és a korábbi vizsgálatok eredményei alapján megállapítható, hogy az in vitro Langendorff-perfundált tengerimalac-szív alkalmas a tesztelésre váró szerek QT-nyújtó hatásának vizsgálatára.
Következtetések
Az új gyógyszerek kardiovaszkuláris biztonság-farmakológiai vizsgálataiban az egyik legkeményebb végpont az aritmiák keletkezése. Jelen munkánkban bár magas koncentrációban alkalmaztuk a dofetilidet, direkt proaritmiás hatást nem láttunk. Mivel az IKs-gátlás szinergista módon fokozta az IKr-gátló dofetilid QTc-nyújtó hatását, ezért az általunk kifejlesztett, repolarizációs tartalékszűkítésen alapuló, izolált tengerimalacszív-modell mégis alkalmasnak tűnik a gyógyszerek kardiovaszkuláris biztonságosságának vizsgálatára, mert a fontos proaritmiás végpontként tekintett QTc-nyújtó hatást rendkívüli érzékenységgel és költséghatékonyan képes kimutatni.
Támogatók, köszönetnyilvánítás
Munkánkat az EFOP-3.6.1-16-2016-00008, az EFOP-3.6.2-16-2017-00006, NKFI -K119992 és az Emberi Erőforrások Minisztériuma UNKP-17- 4 kódszámú Új Nemzeti Kiválóság Programjának támogatásával készült.
Irodalom
1. Jost N, Virág L, Bitay M, et al. Restricting excessive cardiac action potential and QT prolongation: a vital role for IKs in human ventricular muscle. Circulation 2005; 112: 1392–1399. https://doi.org/10.1161/CIRCULATIONAHA.105.550111
2. Farkas AS, Nattel S. Minimizing repolarization-related proarrhythmic risk in drug development and clinical practice. Drugs 2010; 70: 573–603. https://doi.org/10.2165/11535230-000000000-00000
3. Lengyel C, Varró A, Tábori K, et al. Combined pharmacological block of I(Kr) and I(Ks) increases short-term QT interval variability and provokes torsades de pointes. Br J Pharmacol 2007; 151: 941–951. https://doi.org/10.1038/sj.bjp.0707297
4. Woosley RL, Black K, Heise CW, et al. CredibleMeds.org: What does it offer? Trends Cardiovasc Med 2017. https://doi.org/10.1016/j.tcm.2017.07.010
5. Roden DM. Repolarization reserve: a moving target. Circulation 2008; 118: 981–982. https://doi.org/10.1161/CIRCULATIONAHA.108.798918
6. Roden DM, Yang T. Protecting the heart against arrhythmias: potassium current physiology and repolarization reserve. Circulation 2005; 112: 1376–1378. https://doi.org/10.1161/CIRCULATIONAHA.105.562777
7. Roden DM. Long QT syndrome: reduced repolarization reserve and the genetic link. J Intern Med 2006; 259: 59–69. https://doi.org/10.1111/j.1365-2796.2005.01589.x
8. Sarusi A, Farkas AS, Orosz S, et al. Validation of a new in vitro proarrhythmia model based on reduced repolarization reserve. Cardiovasc Res 2012; 93: S104.
9. Lu Z, Kamiya K, Opthof T, et al. Density and kinetics of I(Kr) and I(Ks) in guinea pig and rabbit ventricular myocytes explain different efficacy of I(Ks) blockade at high heart rate in guinea pig and rabbit: implications for arrhythmogenesis in humans. Circulation 2001; 104: 951–956. https://doi.org/10.1161/hc3401.093151
10. Ollerstam A, Visser SA, Duker G, et al. Comparison of the QT interval response during sinus and paced rhythm in conscious and anesthetized beagle dogs. J Pharmacol Toxicol Methods 2007; 56: 131–144. https://doi.org/10.1016/j.vascn.2007.05.002
11. Towart R, Linders JT, Hermans AN, et al. Blockade of the I(Ks) potassium channel: an overlooked cardiovascular liability in drug safety screening? J Pharmacol Toxicol Methods 2009; 60: 1–10. https://doi.org/10.1016/j.vascn.2009.04.197
12. Farkas AS, Makra P, Csík N, et al. The role of the Na+/Ca2+ exchanger, I(Na) and I(CaL) in the genesis of dofetilide-induced torsades de pointes in isolated, AV-blocked rabbit hearts. Br J Pharmacol. 2009; 156: 920-932. https://doi.org/10.1111/j.1476-5381.2008.00096.x
13. Farkas AS, Acsai K, Tóth A, et al. Importance of extracardiac alpha1-adrenoceptor stimulation in assisting dofetilide to induce torsade de pointes in rabbit hearts. Eur J Pharmacol 2006; 537: 118–125. https://doi.org/10.1016/j.ejphar.2006.03.014
14. Dhein S, Perlitz F, Mohr FW. An in vitro model for assessment of drug-induced torsade de pointes arrhythmia: effects of haloperidol and dofetilide on potential duration, repolarization inhomogeneities, and torsade de pointes arrhythmia. Naunyn Schmiedebergs Arch Pharmacol 2008; 378: 631–644. https://doi.org/10.1007/s00210-008-0329-0
15. Michael G, Kane KA, Coker SJ. Adrenaline reveals the torsadogenic effect of combined blockade of potassium channels in anaesthetized guinea pigs. Br J Pharmacol 2008; 154: 1414–1426. https://doi.org/10.1038/bjp.2008.169
16. ICH. International Conference on Harmonisation; guidance on S7B Nonclinical Evaluation of the Potential for Delayed Ventricular Repolarization (QT Interval Prolongation) by Human Pharmaceuticals; availability. Notice Fed Regist 2005; 70: 61133–61134.
17. Thomsen MB, Matz J, Volders PG, et al. Assessing the proarrhythmic potential of drugs: current status of models and surrogate parameters of torsades de pointes arrhythmias. Pharmacol Ther 2006; 112: 150–170. https://doi.org/10.1016/j.pharmthera.2005.04.009
18. Shah RR, Hondeghem LM. Refining detection of drug-induced proarrhythmia: QT interval and TRIaD. Heart Rhythm 2005; 2: 758–772. https://doi.org/10.1016/j.hrthm.2005.03.023
19. Hondeghem LM, Carlsson L, Duker G. Instability and triangulation of the action potential predict serious proarrhythmia, but action potential duration prolongation is antiarrhythmic. Circulation 2001; 103: 2004–2013. https://doi.org/10.1161/01.CIR.103.15.2004
20. Kui P, Orosz S, Takács H, et al. New in vitro model for proarrhythmia safety screening: IKs inhibition potentiates the QTc prolonging effect of IKr inhibitors in isolated guinea pig hearts. J Pharmacol Toxicol Methods 2016; 80: 26–34. https://doi.org/10.1016/j.vascn.2016.04.005
21. Cheng HC, Incardona J, McCullough B. Isolated perfused and paced guinea pig heart to test for drug-induced changes of the QT interval. J Pharmacol Toxicol Methods 2006; 54: 278–287. https://doi.org/10.1016/j.vascn.2006.01.002
22. Tabo M, Komatsu R, Isobe T, et al. Accurate detection of drug-induced delayed ventricular repolarization with a suitable correction formula in Langendorff guinea pig heart. J Toxicol Sci 2010; 35: 687–698.