Current issues
Current issues ISSUE
Identification of a titin and desmoplakin double gene mutation in peripartum cardiomyopathy: genetic analysis of the first patient with heart transplantation performed in Szeged
█ Case report
DOI: 10.26430/CHUNGARICA.2020.50.2.132
Authors:
Csányi Beáta1, Bogáts Gábor1, Rudas László2, Babik Barna2, Nagy Viktória1, Tringer Annamária1, Hategan Lidia1, Borbás János1, Hegedűs Zoltán3,4,
Nagy István5,6, Sepp Róbert1
1Szegedi Tudományegyetem, II. sz. Belgyógyászati Klinika és Kardiológiai Központ, Szeged
2Szegedi Tudományegyetem, Aneszteziológiai és Intenzív Terápiás Intézet, Szeged
3Biofizikai Intézet, Szegedi Biológiai Központ, Szeged
4Pécsi Tudományegyetem, Biokémiai és Orvosi Kémiai Intézet, Pécs
5Biokémiai Intézet, Szegedi Biológiai Központ, Szeged
6Seqomics Biotechnológiai Kft.
Summary
Peripartum cardiomyopathy (PPC) is an idiopathic cardiomyopathy presenting with heart failure secondary to left ventricular systolic dysfunction towards the end of pregnancy or in the months following delivery, when no other cause of heart failure is found. Data support the observation that PPC and dilated cardiomyopathy (DCM) share a similar genetic background in a number of cases.
We performed genetic analysis of a 36-years-old female patient who underwent heart transplantation due to PPC in Szeged. The patient, with her second pregnancy, was admitted to our Institution at 38 weeks of gestation because of dyspnea. Echocardiography showed a dilated left ventricle with reduced left ventricular ejection fraction (EF: 30%). Symptoms of heart failure progressed despite of intensive treatment including levosimendan, dopamine, dobutamine and IABP support. The left ventricular function further deteriorated (EF: 14%), low cardiac output syndrome (CI: 1.4 l/min/m2, SV: 21 ml) developed, and mechanical ventilation was necessary because of hypoxia. Due to the life-threatening clinical situation, the only solution was urgent heart transplantation, which was carried out in Szeged, as the patient was unsuitable for transport. Family screening revealed that her mother had dilated cardiomyopathy. Based on this, familial cardiomyopathy was suspected, and genetic screening was performed.
Genotyping was performed by next generation sequencing, with a platform including 103 causative cardiomyopathy genes. Genetic screening detected 5 variants, and two of them were pathogenic with a truncation effect, one in the titin gene (TTN p.Arg13527Stop) and another in the desmoplakin gene (DSP p.Arg2284Stop). The pathogenic variants predispose to lose normal protein function either by protein truncation or nonsense-mediated mRNA decay. The p.Arg13527Stop variant in the TTN gene has been reported in association with DCM and the p.Arg2284Stop variant in the DSP gene has been published previously in association with ARVD/C and Carvajal-syndrome. So far, no case of these two pathogenic variants occurring together has been published.
Our case highlights the fact that some of the PPCs may have genetic origin. A family screening should be performed in each patient and genetic screening when suspicion arises.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
A peripartum cardiomyopathia (PPC) a terhesség végső időszakában vagy a szülést követő hónapokban kialakuló, balkamra-diszfunkció miatti szívelégtelenség képében megjelenő idiopathias cardiomyopathia, amelynek hátterében a szívelégtelenség más okai kizárhatók. Adatok utalnak arra, hogy a PPC-t az esetek egy részében genetikai eltérések okozzák, és ez a genetikai háttér átfedést mutat a dilatatív cardiomyopathiában (DCM) megfigyeltekkel.
Munkánkban PPC miatt Szegeden szívtranszplantáción átesett 36 éves nőbeteg genetikai analízisét végeztük el. A második terhességét viselő beteg terhessége 38. hetében került észlelésre nehézlégzés miatt, amelynek hátterében az echokardiográfiás vizsgálat tágult bal kamrát, csökkent balkamra-funkciót (EF: 30%) írt le. A szívelégtelenség tünetei levosimendan, dopamin, dobutamin adása, IABP keringéstámogatás ellenére progrediáltak, a balkamra-funkció tovább romlott (EF: 14%), alacsony perctérfogat (CI: 1,4 l/min/m2, SV: 21 ml) szindróma alakult ki, hypoxia miatt gépi lélegeztetés vált szükségessé. A válságos állapot miatt egyedüli megoldásként urgens szívtranszplantáció jött szóba, amelyet a beteg szállíthatatlan állapota miatt Szegeden végeztek el. Családszűrése során derült fény arra, hogy édesanyja dilatatív cardiomyopathiában szenved, amely alapján familiáris cardiomyopathia merült fel, és genetikai vizsgálat történt.
A genetikai vizsgálat újgenerációs szekvenálással történt, 103 cardiomyopathia-gént tartalmazó panel célzott újraszekvenálásával. A genetikai vizsgálat során összesen 5 variánst detektáltunk, amelyek közül a titingén (TTN) p.Arg13527Stop és a dezmoplakingén (DSP) p.Arg2284Stop variánsa bizonyult kóroki mutációnak. Mindkét variáns ismert a szakirodalomban, a TTN p.Arg13527Stop variáns DCM-ben szerepelt kóroki variánsként, míg a DSP p.Arg2284Stop variánst ARVC-vel és Carvajal-szindrómával hozták kapcsolatba. Eddig még nem publikáltak olyan estet, ahol ez a két patogén variáns együtt jelent volna meg.
Esetünk felhívja a figyelmet arra, hogy a peripartum cardiomyopathia az esetek egy részében genetikai eredetű lehet, ezért a PPC-betegek családszűrése és adott esetben genetikai vizsgálata lehet indokolt.
Bevezetés
A peripartum cardiomyopathia (PPC) az ESC Heart Failure Association legutóbbi definíciója szerint „a terhesség végső időszakában vagy a szülést követő hónapokban kialakuló, balkamra-diszfunkció miatti szívelégtelenség képében megjelenő idiopathiás cardiomyopathia, amelynek hátterében a szívelégtelenség más okai kizárhatók. A diagnózis kizáráson alapul. A bal kamra nem mindig tágult, de a bal kamrai ejekciós frakció majdnem minden esetben 45% alá csökken” (1). Bár a betegség az egész világon ismert, a világ egyes területein, pl. Nigériában és Haitin különösen magas az incidenciája. A betegség kialakulása szempontjából további rizikófaktort jelent a pre-eclampsia előfordulása és az előrehaladott anyai életkor. Bár a PPC patofiziológiája továbbra sem tisztázott részleteiben, a legutóbbi évtizedek kutatása a PPC-re hajlamos egyénekben vaszkulohumorális folyamatok jelentőségét hangsúlyozzák. Az érintett nők több mint felében a balkamra-diszfunkció normalizálódik, néhányukban krónikus cardiomyopathia alakul ki, és az eseteként kialakuló refrakter szívelégtelenség miatt mechanikus keringéstámogatás és/vagy szívtranszplantáció válik szükségessé. További potenciális komplikációként tromboembólia vagy ritmuszavar fordulhat elő. A PPC kezelése megegyezik a csökkent ejekciós frakciójú szívelégtelenség kezelésével, adott esetben a magzat jelentette kontraindikációk figyelembevételével. A PPC-ben specifikusan alkalmazható bromocriptinterápia jelenleg vizsgálatok tárgya (2, 3).
Adatok utalnak arra, hogy a peripartum cardiomyopathia és a dilatatív cardiomyopathia (DCM) esetek egy részében átfedés észlelhető. Erre utal egyrészt az a megfigyelés, hogy a DCM öröklődő formájában, a familiáris DCM által érintett egyes családtagokban PPC kialakulását észlelték, másrészt a PPC által érintett nőbetegek családszűrésénél DCM-es betegeket lehetett igazolni a családtagok között (4–6). Egyes PPC-betegek genetikai szűrése olyan genetikai mutációkat igazolt, amelyek DCM-ben is előfordulnak, mint pl. a béta-miozin (MYH7) és troponin C (TNNC1) géneket érintő mutációk. Egy nemrégi vizsgálat szerint mind a PPC-t, mind a DCM-et okozó genetikai eltérések között a titin (TTN) gén érintettsége a leggyakoribb, amely közös genetikai prediszponáltságra utal (7, 8). Ezen adatok alapján a PPC egyes esetei terhesség alatt manifesztáló, larvált DCM-eseteket jelentenek, és olyan öröklődő, monogénes betegségnek felelnek meg, mint a familáris cardiomyopathiák (9–11), cardiomyopathia fenokópiák (12, 13) vagy a familiáris ioncsatorna-betegségek (14–17).
Közleményünkben egy ilyen peripartum cardiomyopathia esetet mutatunk be, amelynek hátterében genetikai vizsgálattal kettős, titin és desmoplakin génmutációt lehetett kimutatni. Az eset további érdekességét az adja, hogy a válságos klinikai kép sürgős szívtranszplantációt tett szükségessé, amelyet Szegeden végeztek el, mint az első és mind ez idáig egyetlen, vidéken végzett szívtranszplantációt.
Beteg és módszer
Esetismertetés
Az észlelésekor 36 éves, második terhességét viselő nőbeteg terhessége 38. hetében, 2005. 05. 02-án kerül az SBO-ra nehézlégzés miatt, amelynek hátterében az echokardiográfiás vizsgálat tágult bal kamrát, csökkent balkamra-funkciót (EF: 30%) írt le II. fokú mitrális inszufficiencia mellett. 2005. 05. 03-án az Aneszteziológiai és Intenzív Terápiás Intézet Intenzív Osztályára került, ahol nyugalmi dyspnoét, lábszárödémát észleltek, enyhén emelkedett májfunkciós értékek mellett. Az ott készült echokardiográfia súlyosan csökkent balkamra-funkciót (EF: 19%), III-as fokú mitrális inszufficienciát, emelkedett pulmonalis nyomást írt le (PAP: 60 Hgmm), mellkaröntgenen jelentős cardiomegaliával (1. ábra). A vérgáz vizsgálata respiratórikusan kompenzált metabolikus acidózist igazolt. A fentiek alapján peripartum cardiomyopathiát véleményeztünk. Dobutamin, diuretikum mellett az állapota stabilizálható volt. 2005. 05. 04-én sectio caesarea útján egészséges kislánynak adott életet, a műtét közben hemodinamikailag stabil volt. Belgyógyászati ITO-ra való visszavétele után kamrai aritmiák miatt amiodaront kapott, majd 2005. 05. 05-én súlyos szívelégtelenség tünetei miatt levosimendanterápia indult intraaortikus ballonpumpa behelyezése mellett. A következő héten levosimendan, IABP, dopamin, dobutamin mellett állapota hemodinamikailag viszonylag stabil volt, de a terápia csökkentését nem tolerálta. 2005. 05. 12-én kapcsolatfelvétel történt a transzplantációs központtal, 05. 19-én negatív eredményű koronarográfia és szívizom-biopszia történt. 2005. 05. 24-én fokozódó fulladás, hypoxia miatt respirátorkezelés vált szükségessé, a balkamra-diszfunkció tovább súlyosbodott (EF 14%). Jobb szívfél katéterezése alacsony perctérfogat-szindrómát igazolt (CI: 1,4 l/min/m2, SV: 21 ml, SVRI: 3590 dynes/sec/cm–5/m2, PVRI: 58 dynes/sec/cm–5/m2, PAP: 23 Hgmm). A válságos állapot miatt egyedüli megoldásként sürgős szívtranszplantáció jött szóba, amelyet a beteg szállíthatatlan állapota miatt Szegeden végeztek el 2005. 05. 25-én a budapesti Városmajori Ér- és Szívsebészeti Klinika transzplantációs teamje közreműködésével. A perfúziós idő 112 perc, a graft iszkémiás idő 3 óra 16 perc volt.
A beteg családszűrése során derült fény arra, hogy édesanyja dilatatív cardiomyopathiában szenved. Utóbbi alapján familiáris cardiomyopathia merült fel, és genetikai vizsgálat történt a beteg tájékoztatása és beleegyezése alapján.
A vizsgálatot a Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ Regionális Humán Orvosbiológiai Tudományo és Kutatásetikai Bizottsága a 165/2016-SZTE számon engedélyezte.

Genetikai vizsgálat
A genetikai vizsgálat során célzott újraszekvenálással 103, ismert cardiomyopathiát okozó gént vizsgáltunk. Utóbbi az Agilent „SureSelect” technológiát használja egyedi tervezésű, célrégió-specifikus 120 bp. hosszú RNS „bait”-ekkel (Agilent Technologies, Santa Clara, CA, United States). A sokszorosított DNS szekvenálását SOLiD 5500xl Systemmel (Life Technologies, Grand Island, NY, United States) végeztük. A SOLiD readek mappingjét a Genomic Workbench ver 7.0.3-mal (CLC Bio, Qiagen) végeztük, a Human Genome Assembly hg19-et mint referenciaszekvenciát használva. A variánslehívás és variánsannotáció ugyanezzel a szoftverrel készült. A misszensz mutációk által okozott aminosavcserék funkcionális hatását a SIFT és PROVEAN predikciós programokkal elemeztük.
Az azonosított genetikai variánsok validálásra kerültek direkt kapilláris szekvenálás által (BigDye Terminator v3.1 Cycle Sequencing Kit, Applied Biosystems), amely során a titin- (TTN) és desmoplakin- (DSP) gének kódoló szakaszainak szekvenálása történt meg ABI Prism 310 Genetic Analyzeren (Applied Biosystems). Az elektroferogramokat a gyártó Sequencing Analyzer v5.4 szoftverével analizáltuk.
Eredmények
A genetikai vizsgálat során összesen 5 variánst detektáltunk. A variánsok közül kettő, a titingén (TTN) p.Arg13527Stop variánsa (rs374140736); és a desmoplakingén (DSP) p.Arg2284Stop (rs794728130) variánsa bizonyult kóroki variánsnak (2. ábra). Mindkét variáns patogén-besorolással szerepel a ClinVar adatbázisban. További három variáns (TTN p.Glu22041Gln, p.Thr18440Ile; JUP p.Val456Ile) bizonytalan jelentőségű variáns (VUS) megjelöléssel szerepel az adatbázisokban. A feltételezetten kóroki variánsok közül mindkét esetben csonkoló hatású, a fehérje tekintetében funkcióvesztéses mutációt jelentenek.
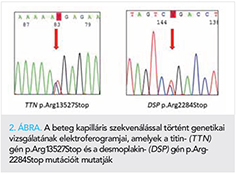
Megbeszélés
Munkánkban egy kettős, TTN p.Arg13527Stop és DSP p.Arg2284Stop mutációt azonosítottunk súlyos klinikai megjelenésű peripartum cardiomyopathia hátterében, amely sürgős szívtranszplantációt tett szükségessé.
A PPC családi halmozódása ismert jelenség, egy német vizsgálat az általuk vizsgált betegcsoport 15%-ában észlelte a cardiomyopathia valamilyen formájú familiáris megjelenését (6). Családi halmozódást mutató tizennyolc eset közül Spaendonck-Zwarts és munkatársai 4 esetben (22%) találtak patogén genetikai mutációt, amelyek közül három esetben a titingén volt érintett. A 20 PPC-beteg közül mindössze kettőben normalizálódott a bal kamrai ejekciós frakció (7). Egy másik, családi halmozódás szempontjából nem szelektált csoportban 172 PPC-eset genetikai vizsgálatakor 15%-ban találtak patogén genetikai eltérést, amelyek 2/3 része a titingént érintette. A mutációk nagy része a titinfehérjének a sarcomer A sávjában lokalizálódó aminosavjait érintette, hasonlóan a DCM-et okozó titinmutációkhoz. Érdekes módon a titinmutációk mind kaukázusi, mind afroamerikai etnikumban előfordultak, és a titinvariánsok jelenléte összefüggött az 1 éves utánkövetéskor mért alacsonyabb bal kamrai ejekciós frakcióval (8).
Az általunk észlelt mindkét variánst közölték már korábban a szakirodalomban, mint kóroki variánst. A TTN p.Arg13527Stop variánst DCM-ben írták le kóroki variánsként. Norton és munkatársai egy DCM-es család hat családtagjában észlelték, amelyek közül három családtag DCM-ben, egy családtag pedig balkamra-megnagyobbodás nélküli szisztolés diszfunkcióban szenvedett (18). Chanavat és munkatársai egy sporadikus DCM-esetben írták le fenti TTN-mutáció jelenlétét (19). A TTN p.Arg13527Stop-mutáció – a DCM-et okozó TTN-mutációkhoz hasonlóan – a titingén a sarcomer A sávjában lokalizálódó aminosavját érinti. A DSP p.Arg2284Stop variánst aritmogén jobb kamrai cardiomyopathiával (ARVD) és Carvajal-szindrómával (gyapjas haj, palmoplantaris keratoderma és DCM triásza) hozták kapcsolatba (20, 21). Mindkét mutáció funkcióvesztő mutációnak tartható, vagy a stop kodon miatt átíródó csonkolt fehérje keletkezése, vagy a „nonsense mediated mRNA decay” miatt lebomló fehérje miatt kialakuló haploinszufficiencia miatt. Esetünk érdekessége, hogy eddig még nem publikáltak olyan esetet, ahol ez a két patogén variáns együtt jelent volna meg.
Következtetés
Esetünk felhívja a figyelmet arra, hogy a peripartum cardiomyopathia az esetek egy részében genetikai eredetű, ezért a PPC-betegek családszűrése és adott esetben genetikai vizsgálata javasolt.
Köszönetnyilvánítás
A szerzők köszönetüket fejezik ki prof. dr. Szabolcs Zoltán profilvezető szívsebésznek és a Városmajori Szív- és Érgyógyászati Klinika általa vezetett szívtranszplantációs munkacsoportjának a szívtranszplantációban nyújtott önzetlen szakmai segítségükért és elévülhetetlen érdemeikért. A munka a „Ritka betegségek patogenezisének kutatása, új diagnosztikai és terápiás eljárásokat megalapozó fejlesztések” (GINOP-2.3.2-15-2016-00039), az „Életet veSzélyezTető Akut megbetegedések súlYossági és hALálozási mutatóinak jaVítása transzlációs orvostudományi mEgközelítésben – STAY ALIVE” (GINOP-2.3.2-15-2016-00048) és a Szegedi Tudományegyetem ÁOK Kari Kutatási Alap „Hetényi Géza” pályázatának támogatásával készült.
Irodalom
1. Sliwa K, Hilfiker-Kleiner D, Petrie MC, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. European Journal of Heart Failure 2010; 12: 767–778. https://doi.org/10.1093/eurjhf/hfq120
2. Honigberg MC, Givertz MM. Peripartum cardiomyopathy. BMJ 2019; 364:k5287. https://doi.org/10.1136/bmj.k5287
3. Arany Z, Elkayam U. Peripartum Cardiomyopathy. Circulation 2016; 133: 1397–1409. https://doi.org/10.1161/CIRCULATIONAHA.115.020491.
4. Pearl W. Familial occurrence of peripartum cardiomyopathy. Am Heart J 1995; 129: 421–422.
5. Pierce JA, Price BO, Joyce JW. Familial occurrence of postpartal heart failure. Arch Intern Med 1963; 111: 651–655.
6. Haghikia A, Podewski E, Libhaber E, et al. Phenotyping and outcome on contemporary management in a German cohort of patients with peripartum cardiomyopathy. Basic Res Cardiol 2013; 108: 366. https://doi.org/10.1007/s00395-013-0366-9.
7. van Spaendonck-Zwarts KY, Posafalvi A, van den Berg MP, et al. Titin gene mutations are common in families with both peripartum cardiomyopathy and dilated cardiomyopathy. Eur Heart J 2014; 35: 2165–2173. https://doi.org/10.1093/eurheartj/ehu050.
8. Ware JS, Li J, Mazaika E, Yasso CM, et al. Shared genetic predisposition in peripartum and dilated cardiomyopathies. N Engl J Med 2016; 374: 233–241. https://doi.org/10.1056/NEJMoa1505517.
9. Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733–2779. https://doi.org/10.1093/eurheartj/ehu284.
10. Toth T, Nagy V, Faludi R, et al. The Gln1233ter mutation of the myosin binding protein C gene: Causative mutation or innocent polymorphism in patients with hypertrophic cardiomyopathy? Int J Cardiol 2011; 153(2): 216–9. https://doi.org/10.1016/j.ijcard.2011.09.062.
11. Orosz A, Baczko I, Nagy V, et al. Short-term beat-to-beat variability of the QT interval is increased and correlates with parameters of left ventricular hypertrophy in patients with hypertrophic cardiomyopathy. Can J Physiol Pharmacol 2015; 93(9): 765–72. https://doi.org/10.1139/cjpp-2014-0526.
12. Csanyi B, Popoiu A, Hategan L, et al. Identification of two novel LAMP2 gene mutations in Danon disease. Can J Cardiol 2016; 32(11): 1355.e23–1355.e30. https://doi.org/10.1016/j.cjca.2016.02.071.
13. Csányi B, Hategan L, Nagy V, et al. Identification of a Novel GLA Gene Mutation, p.Ile239Met, in Fabry Disease with a Predominant Cardiac Phenotype. Int Heart J 2017; 58(3): 454–458. https://doi.org/10.1536/ihj.16-361
14. Csanády M, Kiss Z. Az elektrokardiogram QT-távolságának örökletes megnyúltsága, veleszületett süketség nélkül (Romano-Ward-syndroma). Orv Hetil 1972; 47: 2840–2843.
15. Sepp R, Hategan L, Bácsi A, et al. Timothy Syndrome 1 Genotype without Syndactyly and Major Extracardiac Manifestations. Am J Med Genet A 2017; 173(3): 784–789. https://doi.org/10.1002/ajmg.a.38084.
16. Hategan L, Csányi B, Ördög B, et al. A novel ‘splice site’ HCN4 gene mutation, c.1737+1 G>T, causes familial bradycardia, reduced heart rate response, impaired chronotropic competence and increased short-term heart rate variability. Int J Cardiol 2017; 241: 364–372. https://doi.org/10.1016/j.ijcard.2017.04.058.
17. Ördög B, Hategan L, Kovács M, et al. Identification and functional characterisation of a novel KCNJ2 mutation, Val302del, causing Andersen-Tawil syndrome. Can J Physiol Pharmacol 2015; 93(7): 569–75. https://doi.org/10.1139/cjpp-2014-0527.
18. Norton N, Li D, Rampersaud E, et al. Exome sequencing and genome-wide linkage analysis in 17 families illustrate the complex contribution of TTN truncating variants to dilated cardiomyopathy. Circ Cardiovasc Genet 2013; 6: 144–53. https://doi.org/10.1161/CIRCGENETICS.111.000062.
19. Chanavat V, Janin A, Millat G. A fast and cost-effective molecular diagnostic tool for genetic diseases involved in sudden cardiac death. Clin Chim Acta. 2016; 453: 80–5. https://doi.org/10.1016/j.cca.2015.12.011.
20 Fressart V, Duthoit G, Donal E, et al. Desmosomal gene analysis in arrhythmogenic right ventricular dysplasia/cardiomyopathy: spectrum of mutations and clinical impact in practice. Europace 2010; 12: 861–8. https://doi.org/10.1093/europace/euq104.
21. Antonov NK, Kingsbery MY, Rohena LO, et al. Early-onset heart failure, alopecia, and cutaneous abnormalities associated with a novel compound heterozygous mutation in desmoplakin. Pediatr Dermatol 2015; 32: 102–8. https://doi.org/10.1111/pde.12484.
Direct anticoagulants in the daily practice. Results of the ARISTOPHANES study
█ Review
DOI: 10.26430/CHUNGARICA.2020.50.2.126
Authors:
Komócsi András
Pécsi Tudományegyetem Klinikai Központ, Szívgyógyászati Klinika, Pécs
Summary
The ARISTOPHANES retrospective observational study compared stroke / systemic embolization and severe bleeding in a large number of patients treated with direct, non-vitamin K antagonist oral anticoagulants or warfarin using an extentensive set of data sources. In the largest observational study to date with DOACs and warfarin, lower stroke / SE and variable bleeding rates were confirmed with DOACs compared to warfarin. These provide additional data to balance the risk of thromboembolism and bleeding in therapeutic decision-making.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
Az ARISTOPHANES retrospektív, megfigyeléses vizsgálatban számos adatforrás felhasználásával, nagyszámú nonvalvuláris pitvarfibrillációban szenvedő, nem K-vitamin-antagonista típusú orális antikoagulánst vagy warfarint szedő betegnél hasonlították össze a stroke/szisztémás embolizáció és a súlyos vérzés gyakoriságát. A DOAC-okkal és warfarinnal ez idáig végzett legnagyobb obszervációs vizsgálatban a stroke/SE alacsonyabb és a súlyos vérzés változó gyakorisága igazolódott DOAC-ok alkalmazása mellett a warfarinhoz képest, további adatokat szolgáltatva a tromboembóliás és a vérzéses kockázatok közötti egyensúly mérlegeléséhez a terápiás döntéshozatalban.
A stroke és a perifériás embolizáció megelőzése a pitvarfibrilláló betegek kezelésében kiemelt prioritású feladat. A stroke-rizikót jelző rizikófaktorok fennállása esetén orális antikoaguláns-kezelés folytatása javasolt, ami az embóliás események és a halálozás kockázatának csökkentését eredményezi. Az első nem K-vitamin-antagonista, direkt orális antikoaguláns (DOAC) piacra kerülése óta több mint tíz év telt el. A DOAC-okkal kapcsolatos klinikai vizsgálatok és az egyre szélesedő gyakorlati tapasztalatok egyértelműen alátámasztják, hogy ezek a szerek kifejezetten hatásos, megbízható véralvadásgátlást biztosítanak. A véralvadási kaszkád közvetlen gátlásán alapuló gyógyszerek mára már széles körben elfogadottak, a fejlett országokban, több indikációban gyakorlatilag leváltották a K-vitamin-antagonistákat (KVA). Szemben a szűk terápiás ablakú KVA-val a DOAC-ok alkalmazása néhány klinikai paramétert figyelembe vevő, egyszerű dozírozási protokollokkal végezhető, és nem igényli az elért hatás laboratóriumi monitorozását, valamint az ennek alapján történő dóziskorrekciókat. DOAC-ok esetében kevésbé jelentősek a KVA-ra jellemző gyakori gyógyszer- és élelmiszer-kölcsönhatások (1).
A hagyományos alvadásgátló-kezeléssel összevetve több indikációs területen a DOAC-ok hatékonysága hasonló, vagy meghaladja a KVA-val elért hatékonyságot. Ide tartozik a pulmonalis embólia (PE), mélyvénás trombózis (DVT) kezelése és a szisztémás embolizáció és a stroke megelőzése pitvarfibrillációban (PF) szenvedő betegeknél, valamint a DVT megelőzése nagy ortopédiai műtét után.
A pitvarfibrilláló betegek közt végzett nagy létszámú, véletlen besorolású klinikai vizsgálatok során a warfarin kontrollcsoportban észlelthez képest mindegyik DOAC-szer és dózis mellett csökkent az iszkémiás események száma (2). A csökkenés mértéke azonban különböző volt az egyes szerek és dózisok használata esetén. A DOAC-ok megváltoztatták a PF-ben az antikoaguláció használatát, de hasonlóságaik mellett számos különbség is jellemzi ezeket a gyógyszereket. Ezek közé a különbségek közé tartoznak olyan farmakológiai eltérések, amelyek érintik a hatásmechanizmust, a felszívódás táplálkozástól való függését és a vesén keresztül történő kiválasztás mértékét (3).
A biztonságosság tekintetében a forgalombahozatal előtti, III. fázisú vizsgálatok eredményei még vegyesebb eredményeket mutattak. Általánosságban elmondható, hogy a DOAC-gyógyszerek mellett ritkábban jelentkezett életveszélyes és intracranialis vérzés. Bizonyos esetekben azonban a gasztrointesztinális vérzések száma magasabb volt (2).
A DOAC-szerek piacra kerülését megalapozó klinikai vizsgálatok számos kérdésre nem adtak megfelelő választ. Fontos hangsúlyozni, hogy a randomizált vizsgálatok hasonló összeállítási szerkezet követésével kerültek kivitelezésre, de a bevont betegcsoport különbözőségei és a vizsgálatok közti módszertani különbségek miatt a DOAC-ok közti összehasonlítást nem teszik lehetővé (4). Eddig ezeknek a hatóanyagoknak közvetlen, véletlen besorolású vizsgálatból származó összehasonlítása nem áll rendelkezésre. A vizsgálat költségei és megvalósítási nehézségei miatt nem is várható, hogy ilyen összetételű randomizált vizsgálat belátható időn belül segíteni fogja a gyógyszerválasztást. A gyógyszerek hatékonyságának és biztonságosságának forgalomba kerülés utáni követését ezzel szemben több obszervációs vizsgálat is célul tűzte ki. Ezek általában egyetlen adatforrás felhasználásával értékelték a DOAC-ok használata melletti adverz események gyakoriságát. Az obszervációs vizsgálatok további bizonyítékokat nyújtottak az DOAC-ok hatékonyságára, és kiegészítve a randomizált vizsgálatok adatait, lehetővé tették – még ha korlátos formában is – a gyógyszerek megegyező körülmények közötti összehasonlító elemzését. Az alkalmazott módszertanból adódó korlátok és az alcsoportok közötti teljes körű értékelés hiánya azonban csökkenti az ezekben a vizsgálatokban észleltek általánosíthatóságát.
ARISTOPHANES-vizsgálat
Az ARISTOPHANES-vizsgálat nagyszámú pitvarfibrillációs beteg között, több adatforrást felhasználva célozta meg a stroke/szisztémás embólia (SE) és a súlyos vérzés (major vérzés, MV) összehasonlítását a nem K-vitamin-antagonista orális antikoagulánsok vagy warfarin használata esetén (5).
A vizsgálat összeállítása retrospektív, obszervációs jellegű volt. Az adatgyűjtés során azon betegek adatait szűrték le, akik a nem valvularis pitvarfibrilláció miatt szorultak antikoagulálásra, és az USA Medicare és Medicaid központjai, valamint 4 amerikai kereskedelmi gyógyszerelési adatbázis alapján 2013. január 1-jétől 2015. szeptember 30-áig apixaban-, dabigatran-, rivaroxaban- vagy warfarinkezelést kezdtek. A vizsgált adatbázisok évente több mint 180 millió kedvezményezett egészségügyi ellátását fedik le, ami az Egyesült Államok népességének 56%-át jelenti.
Az egyes gyógyszerekkel való kezelés valószínűségét elemezték, majd a klinikai jellemzőkből adódó különbségeket az egyes adatbázisokban valószínűségi pontszám (propensity score, PS) alapú párosítással egyensúlyozták ki. A PS kiszámításához a betegek demográfiai adatai, a Charlson Komorbiditási Index pontszám, a kiindulási vérzés és a stroke/SE-előzmények, a társbetegségek és a betegek által szedett egyéb gyógyszerek is felhasználásra kerültek. A párosításokat adatbázisonként külön végezték el, majd az így kapott kohorszokat összevonták. Az így kialakított kezelési csoportok között Cox-modellek felhasználásával végezték el a stroke/SE és az MV kockázatának kiértékelését.
A vizsgálat adatait feldolgozó közleményben először 321 182 beteg adatait ismertették. A cikk megjelenését követően észlelték, hogy abban az eredeti adatforrások közt szerepelő CMS Medicare adatai nem kerültek be. Ezért az eredeti közlemény adatait korrigálták, és így 466 991 antikoagulált beteg adatai állnak rendelkezésre. A kéziratot közlő Stroke honlapján is a korrigált adatokat tartalmazó közlemény érthető el, így jelen összefoglalóban is ennek az adatait ismertetjük.
Eredmények
A 466 991 betegből a gyógyszerelés alapján kialakított 6 párosított csoportban elemezték a klinikai események és a mortalitás alakulását. 100 977 apixaban-warfarin, 36 990 dabigatran-warfarin, 125 068 rivaroxaban-warfarin, 37 314 apixaban-dabigatran, 107 236 apixaban-rivaroxaban és 37 693 dabigatran-rivaroxaban betegpár adatai kerültek kiértékelésre.
A warfarinhoz képest mindhárom DOAC-szer alkalmazása jelentősen csökkentette a stroke/SE előfordulását. A kockázati arány [HR] apixaban esetében 0,64; 95% CI: 0,58–0,70 (1. ábra), a dabigatran mellett HR: 0,82; 95% CI: 0,71–0,95 (2. ábra) és a rivaroxaban esetén HR: 0,79; 95% CI: 0,73–0,85 (3. ábra) volt.



Az összes DOAC-ok esetében alacsonyabb volt a vérzéses stroke gyakorisága, míg az apixabannal és a rivaroxaban kezeltek közt alacsonyabb iszkémiás stroke előfordulást mutattak ki, mint a warfarinnal kezeltek közt.
A súlyos vérzések kockázata warfarinhoz képest az apixabannal (HR: 0,60; 95% CI: 0,56–0,63) (1. ábra) és a dabigatrannal kezeltek közt (HR: 0,71; 95% CI: 0,65–0,58) (2. ábra) alacsonyabb volt. A rivaroxaban esetében a warfarinhoz képest magasabb volt az MV gyakorisága (HR: 1,06; 95% CI: 1,02–1,10) (3. ábra). Mindhárom DOAC alkalmazása alacsonyabb intracranialis vérzés kockázattal járt a warfarinhoz viszonyítva. A gasztrointesztinális vérzés aránya alacsonyabb volt apixaban (HR: 0,60; 95% CI: 0,55–0,65) (1. ábra), és magasabb rivaroxaban alkalmazása esetén (HR: 1,24; 95% CI: 1,17–1,31) (3. ábra) a warfarinhoz képest.
Mind a stroke/SE és az MV-arány alacsonyabb volt az apixabannal kezeltek közt a dabigatranhoz (stroke/SE: HR: 0,72; 95% CI: 0,60–0,85; MV: HR 0,78; 95% CI: 0,70–0,87) (4. ábra) és rivaroxabanhoz képest (stroke/SE: HR 0,80; 95%; CI: 0,73–0,89; MV: HR, 0,55; 95% CI: 0,53–0,59) (5. ábra). A dabigatran alacsonyabb vérzésarányt (HR, 0,71; 95% CI: 0,65–0,78) mutatott a rivaroxabanhoz képest, hasonló mértékű stroke/SE-arány mellett (HR: 1,10; 95% CI: 0,95–1,23) (6. ábra).



A vizsgálat alcsoportelemzései a korosztályra, a nemre és a CHA2DS2-VASc-pontszámra, a HAS-BLED-pontszámra, a pangásos szívelégtelenségre, a koszorúér-betegségre, a perifériás artériás betegségre, a cukorbetegségre, a vesebetegségre és a korábbi stroke/SE-re vonatkozó eredmények tekintetében általában konzisztensek voltak a főbb eredményekkel. Kiemelendő, hogy a stroke/SE kockázatcsökkenés nagysága az apixabannal, szemben a warfarinnal, nagyobb volt a nőbetegek közt, valamint azoknál, akiknél a kiinduló CHA2DS2-VASc-pontszám magas volt.
A súlyos vérzések esetében szingnifikáns interakciót észleltek a DOAC-warfarin összevetésekben a kor a nem és a stroke-rizikót felmérő CHA2DS2-VASc-pontszámmal. Ezekben az összevetésekben alacsonyabb rizikóarány volt kimutatható a fiatalabb, a férfi és az alacsony CHA2DS2-VASc-pontszámú betegek közt.
A vizsgálatba a Medicare keretében ellátást kapó betegek közt – alcsoportelemzés formájában – lehetőség nyílt a mortalitási adatok elemzésére is. Ennek során alacsonyabb halálozási mutatókat észleltek az összes DOAC esetében a warfarinnal összehasonlítva. Az apixabannal kezeltek halálozási aránya alacsonyabb volt, mint a dabigatrannal és a rivaroxabannal kezelteké.
Megbeszélés
Összefoglalva, az ARISTOPHANES az eddigi legnagyobb retrospektív megfigyeléses vizsgálat, amely a stroke/SE és az MV kockázatát vizsgálta a DOAC-kezelést kezdő PF-betegek körében. A tanulmány megerősítette, hogy az apixaban, a dabigatran és a rivaroxaban csökkenti a stroke/SE-arányt a warfarinnal összehasonlítva. Emellett rámutatott, hogy a DOAC-okkal kapcsolatos biztonságossági eredmények jelentős különbségeket mutatnak.
Az ARISTOPHANES-vizsgálat eredményei fontos kiegészítő adatokat nyújtanak a klinikai vizsgálatok eredményeinek értelmezéséhez. A gyógyszerek forgalombahozatalát megelőző randomizált klinikai vizsgálatok mindegyik DOAC esetében bizonyították, hogy az általuk biztosított antikoaguláns hatás stroke-prevenció és major vérzések tekintetében nem alacsonyabb értékű, mint a warfariné. Az apixaban és a warfarin összehasonlításának eredményei hasonlóak voltak az ARISTOTLE-vizsgálat eredményeihez, ahol az apixaban hatékonyabb volt a warfarinnál a stroke/SE megelőzésében és az MV kockázatának csökkentésében. A RE-LY-vizsgálatban a 150 mg dabigatran alacsonyabb stroke/SE-kockázattal és hasonló MV-kockázattal társult; az ARISTOPHANES-tanulmányban azt tapasztalták, hogy a dabigatran esetében jelentősen csökkent mind a stroke/SE, mind az MV kockázata. A ROCKET-AF-vizsgálatban rivaroxaban mellett mind a stroke/SE, mind az MV esetében noninferioritás igazolódott; az ARISTOPHANES szignifikánsan alacsonyabb stroke/SE-kockázatot, viszont statisztikailag szignifikánsan emelkedett vérzési kockázatot mutatott.
Az ARISTOPHANES-vizsgálat nyilvánvaló erősségei mellett, amelyek a korábbi forgalomba hozatalt követő obszervációs vizsgálatokkal történő összevetésben a jelentős létszámból és a vizsgálati metodika alaposságából adódnak, meg kell említenünk, hogy az mint retrospektív obszervációs tanulmány számos korláttal is rendelkezik. Először is, a tanulmány egészségügyi finanszírozási adatok visszamenőleges analízisén alapul. Mivel ezen adatok gyűjtésének célja és módszere nem vethető össze a klinikai vizsgálatok hasonló adataival, ezért ilyen értelemben az analízis eredményeit sem értékelhetjük a klinikai vizsgálatokkal egy szinten. Statisztikai értelemben a kiértékelések csak bizonyos faktorok kapcsolódását, asszociációját alkalmasak kimutatni, és nem alkalmasak okozati összefüggések meghatározására. A kohorszokat kezelési valószínűségen alapuló párosítással illesztették, ami a vizsgált paraméterek megfelelő kiegyensúlyozásához vezetett, azonban ez a módszer nem váltja ki a valódi, véletlenszerű besorolást, a randomizációt. A PS-illesztés során nem tudjuk kizárni olyan fennmaradó, zavaró tényezők létezését, amelyek nem kerülnek kiegyensúlyozásra, de az eredményeket befolyásolhatták. A klinikai gyakorlatban a különböző DOAC-okat kapó betegek szisztematikusan eltérőek lehetnek, és amennyiben ezek a különbségek nem kerülnek észlelésre, ez a vizsgálati eredmények torzulásához vezethet. Ez a korlátozó szempont különösen fontos azokban az összehasonlításokban, amelyek során az egyes DOAC-okat egymással vetik össze. Figyelembe véve ezeket a szempontokat, az obszervációs, és különösen a retrospektív adatfeldolgozáson alapuló obszervációs vizsgálatok során észlelt eltérések elsősorban feltételezések generálására tekinthetők alkalmasnak.
Következtetések
A tanulmány eredményei segíthetik az előnyök és a kockázatokkal kapcsolatos párbeszédet az egészségügyi szolgáltatók, az egészségügyi személyzet és a pitvarfibrilláló betegek között. Ebben a stroke-megelőzéssel kapcsolatos közös döntéshozatali folyamatban az ARISTOPHANES-vizsgálat további adatokkal szolgál a tromboembóliás és a vérzési kockázatok közötti egyensúly mérlegeléséhez.
Nyilatkozat
A cikk megjelenését a Pfizer Gyógyszerkereskedelmi Kft. támogatta. A referenciadokumentumok a szerzőnél megtalálhatók.
Lezárás dátuma: 2020. 02. 18.
PP-ELI-HUN-0175
Irodalom
1. Komócsi A. Antitrombotikus és antikoaguláns-kezelés szívbetegségekben. Magy Belorv Arch 2018; 71(5): 229–39.
2. Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet (London, England) 2014 Mar 15; 383(9921): 955–62. https://doi.org/10.1016/S0140-6736(13)62343-0
3. Steffel J, Verhamme P, Potpara TS, Albaladejo P, Antz M, Desteghe L, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-Vitamin K antagonist oral anticoagulants in patients with atrial fibrillation: Executive summary. Europace 2018. https://doi.org/10.1093/eurheartj/ehy136.
4. Camm AJ, Fox KAA, Peterson E. Challenges in comparing the non-vitamin K antagonist oral anticoagulants for atrial fibrillation-related stroke prevention. Europace 2018 Jan 1; 20(1): 1–11. https://doi.org/10.1093/europace/eux086.
5. Lip GYH, Keshishian A, Li X, Hamilton M, Masseria C, Gupta K, et al. Effectiveness and Safety of Oral Anticoagulants Among Nonvalvular Atrial Fibrillation Patients. Stroke 2018 Dec; 49(12): 2933–44. https://doi.org/10.1161/STROKEAHA.118.020232.0
Modern (up-to-date) imaging techniques to evaluate cardiac chambers by transthoracic echocardiography
█ Review
DOI: 10.26430/CHUNGARICA.2020.50.2.118
Authors:
Kovács Attila1, Ágoston Gergely2
1Semmelweis Egyetem, Városmajori Szív- és Érgyógyászati Klinika, Budapest
2Szegedi Tudományegyetem, Általános Orvostudományi Kar, Családorvosi Intézet, Szeged
Summary
Left atrial (LA) longitudinal strain is a novel parameter used for the evaluation of LA function with demonstrated prognostic value in several cardiac diseases. Its ability to quantify myocardial deformation accurately reflects the degree of structural alterations, myocardial fibrosis and chamber stiffness. The same benefits of longitudinal strain apply for the right ventricle as well. However, the complex geometry of the chamber often requires the use of 3D imaging. Left ventricular global longitudinal strain (GLS) detects subtle changes in myocardial function, often not quantifiable by left ventricular ejection fraction (LVEF) alone. It has been recently recognized that GLS has greater prognostic value than LVEF in several conditions like elevated LV filling pressure, heart failure and valvular heart diseases. The GLS derived parameter mechanical dispersion (MD) might indicate LV myocardial fibrosis, substrate for malignant arrhythmias. Of note, the highly accurate measurement of LV volumes and ejection fraction by 3D echocardiography may provide not just added diagnostic and prognostic value, but may be more cost-effective through the proper indication of specific cardiac therapies.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
A longitudinális strain mérése egy viszonylag új és megalapozott technika a bal pitvar vizsgálatában, valamint prognosztikus értékű számos kardiológiai kórképben. A bal pitvar funkciójáról kvantitatív adattal szolgál, így pontosabban leírhatók a strukturális eltérések, a fibrosis súlyossága vagy a bal pitvar merevségének mértéke. A jobb kamra esetében is nagyon hasonló hozzáadott értékről beszélhetünk a longitudinális strain esetében, azonban a kamra komplex geometriája folytán a 3D-echokardiográfia használata még inkább felértékelődik. A bal kamrai globális logitudinális strain (GLS) alkalmas a szubklinikus balkamra-diszfunkció kimutatására akkor is, amikor az ejekciós frakció normál értéket mutat. Az elmúlt években egyre több adat jelent meg a GLS erős prognosztikus értékével kapcsolatban, ilyen kórállapotok az emelkedett bal kamrai töltőnyomás, a szívelégtelenség vagy a billentyűbetegségek. A GLS-ből számított mechanikai diszperzió szintén ígéretes paraméter, a myocardium fibrosisának, hegesedésének korai indikátora lehet, így segítségével a kamrai ritmuszavarok szubsztrátja felismerhetővé válhat. Ugyanakkor meg kell jegyezni, hogy egy rendkívül pontos volumetrikus mérés és ejekciósfrakció-számítás 3D-echokardiográfia segítségével nemcsak diagnosztikus és prognosztikus haszonnal, hanem a különböző beavatkozások helyesebb indikációján keresztül egészséggazdasági haszonnal is járhat.
A bal és jobb pitvar vizsgálata modern echokardiográfiás technikákkal
A szívciklus során a bal és jobb pitvar aktívan részt vesz a perctérfogat fenntartásában. A kamrák korai diasztolés szívó hatása előtt a rezervoár fázisban a pitvarok tágulnak, feszülnek, igyekeznek alkalmazkodni a telődés okozta térfogat- és nyomásterheléshez. A konduit fázis alkalmával, amikor mindkét atrioventrikuláris billentyű nyitva van, a kamrák telődése zajlik, majd a pitvarok aktív kontrakciójukkal segítik a kamrák telődését, és ez által a perctérfogat fenntartását. Az életkor előrehaladtával, már akár 40 éves kor felett a pitvarok aktív pumpafunkciója fokozódik. Mindezek a dinamikus és fázisosan ismétlődő pitvari működések teszik optimálissá a pitvarok és kamrák telődését, ürülését és patológiás körülmények között kompenzáló mechanizmusokkal igyekeznek fenntartani az egyensúlyt.
A napi rutinban az echokardiográfiás vizsgálat során általában csak a bal pitvar átmérőjét, szerencsésebb esetben a térfogatát határozzuk meg a rendelkezésre álló 2D-módszerek segítségével. Lehetőségünk van azonban a pitvari volumenek 3D-szemiautomatikus mérésére is. A 3D-méréssel meghatározott bal pitvari volumenek szignifikánsan nagyobbak a 2D-méréshez viszonyítva, ezért a korábban meghatározott patológiás értékhatárok nem használhatóak, amennyiben 3D-mérést alkalmazunk. Ugyanakkor a 3D-technikával mért volumenek jobb egyezést mutatnak a szív-MR-rel meghatározott értékekkel, és reprodukálhatóságuk is jobb (1). A térfogatok (főként, ha EKG-kapuzással mérjük a maximális, minimális és a pitvari kontrakció előtti térfogatot) fontos, sok szempontból prediktív paraméterek, azonban nem adnak információt a pitvarban a szívciklus során történő, finom mechanikai változásokról (2).
Ezzel szemben a speckle tracking alapú straintechnikával egy metszetből és szívciklusból meghatározható a pitvar rezervoár, konduit és aktív pumpafunkciója (1. ábra A és B panel) (3). Attól függően, hogy a szívciklus melyik pillanatától (referenciapont/nulla strain) végezzük a speckle tracking alapú strainanalízist, a pitvarok eltérő funkciójáról kapunk információt.

Amennyiben az analízist a diasztolé végétől (a mitrális billentyű záródásának időpontjában) indítjuk (ez a mitrális beáramlás A hullámának végére, EKG-n legtöbbször az R hullám csúcsára esik) a pitvar rezervoár (LASr, korábbi terminológiával PALS: peak atrial longitudinal strain) funkciójáról kapunk kvantitatív információt, amelynek értéke fiziológiásan átlagosan 39,4% (3, 4). A pitvari kontrakció kezdetétől (mitrális beáramlás A hullámának kezdete, EKG-n a P hullám kezdete) történő analízis során a pitvar konduit funkciójáról (LAScd) kapunk információt a pozitív kitérés abszolút értéke alapján, amelynek átlagos értéke egészséges egyéneknél –23%. Szintén ettől a referenciaponttól állapítható meg sinusritmus esetén a pitvari kontrakció által létrehozott negatív strainkitérés (LASct), amelynek átlagos referenciaértéke –17,4%. Mivel a konduit fázis és a kontrakció ideje alatt a pitvar fala rövidül, ezért a két értéket egységesen negatív számmal jelöljük. A két kapuzási módszerrel (eltérő referencia vagy „nulla” pont) eltérő straineredményeket kaphatunk, ezért a referenciapont feltüntetése a mérés során mindenképpen indokolt.
A gyakorlatban leggyakrabban a rezervoár funkciót jellemző, LASr strainértéket alkalmazzuk. Ez a legkönnyebben reprodukálható, sinusritmus és pitvarfibrilláció esetén is alkalmazható. Az aktuális konszenzusdokumentum is ennek a használatát javasolja, referenciapontként pedig a diasztolé végét tanácsos választani (3).
Az LASr prognosztikus értékével áll rendelkezésre a legtöbb evidencia. Az LASr-érték szoros összefüggést mutat a pitvari fibrosis súlyosságával, az eredmény patohisztológiai feldolgozáson alapul (5). Az emelkedett töltőnyomás és a diasztolés diszfunkció súlyossági fokának becslésére is alkalmas a bal pitvari rezervoár strain (6). Singh és munkatársainak eredménye alapján a 20% alatti LASr-érték magas bal kamrai töltőnyomásra utal (AUC: 0,76), vizsgálatukban az emelkedett töltőnyomást balszívfél-katéterezéssel, direkt nyomásméréssel támasztották alá (7). Megtartott ejekciós frakció mellett kialakult szívelégtelenségben (HFpEF), a dyspnoés panaszok megjelenésekor gyakran a bal pitvari strain az első paraméter, amely kóros értéket mutat, a szívelégtelenség-terápia hatására pedig a strainparaméterek javulása figyelhető meg (8). A bal pitvari rezervoár és kontrakciós strain értéke szoros összefüggést mutat az invazív módon mért éknyomással (nyugalomban és terhelésre egyaránt). A ≤33% rezervoár strainérték 88%-os szenzitivitással és 77%-os specificitással segített a HFpEF diagnózisában (9). Az LASr-érték hipertóniás betegekben a bal pitvar tágulata és a diasztolés diszfunkció kialakulása előtt jelzi a bal pitvar diszfunkcióját (10). Aszimptomatikus mitrális regurgitáció esetén a regurgitáció súlyosságát az LASr strainérték pontosabban tükrözi, mint a bal kamrai globális longitudinális strainérték (11).
Pitvarfibrillációban szintén számos értékes eredmény áll rendelkezésre a bal pitvari rezervoár funkciót leíró strainparaméterrel. Elektromos kardioverzió 6 hónapos utánkövetése során, a rezervoár funkció javulása a sinusritmus fennmaradása mellett szól (12). Az LASr főként abláció esetén rendelkezik erős prediktor értékkel. Régóta ismert tény, hogy a bal pitvari remodelling súlyossága (fibrosis mértéke) szorosan összefügg az abláció sikerességével (13). Ebből következik, hogy mivel az abláció előtti betegszelekció alapvető jelentőségű, ebben segíthet a bal pitvari strainanalízis is. Az abláció előtt mért LASr-érték független prediktora a bal pitvari reverz remodellingnek, amennyiben értéke az abláció előtt alacsony, a fibrosis annál kifejezettebb, és várhatóan az ablációt követően sem javul (14). Hasonlóan az elektromos kardioverziót követően megfigyelt jelenséghez, paroxizmális és perzisztens pitvarfibrilláció ablációja után, amennyiben a rezervoár strainértéke nem emelkedik szignifikánsan, rövid időn belül újabb pitvarfibrillációs epizód várható (15, 16). Kimutatták továbbá, hogy a bal pitvar aszimmetrikus alakja a pitvari volumentől és a diasztolés diszfunkció mértékétől független prediktora a pitvarfibrilláció rekurrenciájának (17). A fentieket összefoglalva, a bal pitvar fázikus funkciójának mérése speckle tracking technikával szenzitívebben jelezheti az adott folyamat progresszióját, illetve akár regresszióját, mint szimplán a pitvari térfogat mérése, mivel a reverz remodelling egy jóval lassabb, sokszor inkomplett folyamat (18).
Ugyan kevesebb irodalmi adat áll rendelkezésre, de a jobb pitvar esetében is kivitelezhető 3D volumetriás analízis, amelyre vonatkozóan a normálértékek is meghatározásra kerültek (19). A jobb pitvari strain prognosztikus értékével kapcsolatban azonban számos adat áll rendelkezésre. Pulmonalis hipertóniában a jobb pitvari rezervoár és konduit strainértéke csökkent, függetlenül a jobb pitvar nagyságától és a pitvari nyomásemelkedéstől, így megfelelően tükrözi a jobb kamrai nyomásterhelést és diszfunkciót (20). Primer pulmonalis hipertóniában a jobb pitvari longitudinális strain csúcsértéke, valamint a pitvari kontrakciót jellemző strain független prediktora a mortalitásnak és az alapbetegség progressziójából adódó hospitalizációnak (21). Szklerodermában szenvedő betegeknél a jobb pitvari strain szubklinikus diszfunkciója észlelhető nyugalomban és terhelés hatására kialakult pulmonalis nyomásemelkedéskor, akkor is, amikor a PAH diagnózisa még nem állítható fel (22). Szintén szklerodermában a jobb pitvar merevségének magasabb értéke (stiffness), amelyet a rezervoár strain és a jobb kamrai E/E’ hányadosából számíthatunk, meghatározta a betegek funkcionális állapotát. A jobb pitvari rezervoár és konduit funkció ezekben a betegekben is szignifikánsan alacsonyabb volt a kontrollszemélyekhez viszonyítva (23).
A jobb kamra vizsgálata modern echokardiográfiás technikákkal
A jobb kamra morfológiájának és funkciójának megítélésében a modern technikáknak kitüntetett szerep juthat, hiszen összetett anatómiája és kétdimenziós echokardiográfiával való nehézkes vizsgálata miatt kevés szenzitív és/vagy prediktív hagyományos paraméterrel rendelkezünk (24).
A 3D transztorakális echokardiográfia fejlődése új távlatokat nyitott a jobb kamra funkciójának megítélésében. Nem csupán az utóelemző szoftverek fejlődése, hanem a mind jobb térbeli és időbeli felbontással rendelkező transzducerek is nélkülözhetetlen részei ennek a folyamatnak. Legújabban már nincs szükség több szívciklusból való rekonstrukcióra, mivel az „élő” képnek is megfelelő az időbeli felbontása. Így tehát a technika még inkább gyorsult, nincs szükség a beteg légzésvisszatartására, és aritmia esetén is alkalmazható, mivel az összeillesztési (ún. stitch) műtermékek problémája nem merül fel. Egyre több gyártó rendelkezik saját, magán az ultrahanggépen is elérhető 3D rekonstrukciós szoftverrel.
Egyre több adattal rendelkezünk a 3D-echokardiográfiával meghatározott jobb kamrai EF prognosztikus értékével kapcsolatban. Nochioka és munkatársai 1004 beteg felvételeit elemezték az ARIC-tanulmány részeként (25). Az ARIC egy nagy, átfogó epidemiológiai vizsgálat, amelynek keretében középkorú, illetve idősebb amerikaiakat vizsgáltak különböző modalitásokkal, majd természetesen utánkövetést is végeztek. Jelen tanulmány eredményei alapján a szívelégtelenségben a vizsgálatkor nem szenvedő páciensek esetén is a rosszabb jobb kamrai EF összefüggést mutatott a jövőbeli szívelégtelenség-eseményekkel és a mortalitással, függetlenül a bal kamrai EF, az NT-proBNP és a bal kamrai töltőnyomás értékeitől. Mindezen prognosztikus értékkel a hagyományos jobbkamra-funkciós paraméterek (fractional area change, s’ szöveti Dopplerrel meghatározva) nem rendelkeztek. Hasonló, a bal kamrai EF-től független prognosztikus jelentőséget mutattak ki Surkova és munkatársai. Az olasz munkacsoport egy majd 400 főből álló, vegyes kardiális betegségekkel terhelt populációt vizsgált és követett átlagosan 3,7 évig (26). A balkamra-diszfunkciót 50%, a jobbkamra-diszfunkciót 45% EF-érték alatt definiálták. A betegeket négy kategóriára osztották:
1. egyaránt megtartott bal- és jobbkamra-funkció,
2. csökkent bal-, de megtartott jobbkamra-funkció,
3. csökkent jobb-, de megtartott balkamra-funkció,
4. egyaránt csökkent bal- és jobbkamra-funkció.
A jobb kamrai EF összefüggést mutatott mind a kardiális okból bekövetkező, mind az összmortalitással, a csoportok túlélését vizsgálva pedig megállapították, hogy a csökkent jobbkamra-funkcióval, de megtartott balkamra-funkcióval rendelkező csoport hasonlóan rossz kimenetellel bír, mint az egyaránt csökkent bal- és jobbkamra-funkcióval rendelkező csoport. A hagyományos kétdimenziós paraméterek jelen tanulmányban sem bizonyultak prediktívnek. Továbbgondolva az eredményeiket meghatározták azokat a vágópontokat, amelyeket a kimenetel különbsége alapján a klinikumban is érdemes használni, és ezeket validálták is egy japán munkacsoport hasonló populációja segítségével (27). Mindezek alapján a 45% feletti jobb kamrai EF tekinthető normálisnak, míg a 40 és 45% között az enyhén, 30 és 40% között a közepesen, míg 30% alatt a súlyosan csökkent kategória különíthető el.
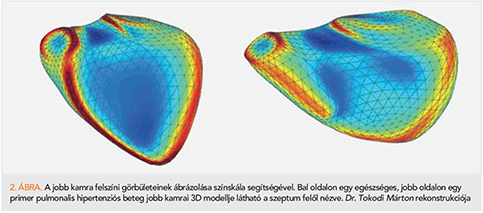
A jobb kamra szempontjából is érdekes populációt képviselnek az élsportolók, akiknél gyakran mérhetünk csökkent nyugalmi jobb kamrai EF-értéket. A kontrakció mintázata is megváltozik, a longitudinális rövidülés relatív jelentősége növekszik, míg a radiális, ún. fújtató effektus jelentősége csökken (28). Érdekes módon azonban ez az adaptív remodelling a globális funkció csökkenésével és a kontrakciós mintázat változásával független prediktora a spiroergometria során mért jobb aerob teljesítménynek (29). A modern 3D elemző technikák nem csupán a jobb kamra mozgásmintája, de komplex morfológiája alapján is új és jelentős (kór)élettani összefüggésekre világíthatnak rá (30). Lehetőség van immáron a jobb kamra regionális „görbületeinek” elemzésére is (2. ábra) (31).
A 2D speckle tracking esetében az első fontos kérdés rögtön a megfelelő nézet kiválasztása. Lang professzor kutatócsoportja megállapította, hogy a klasszikus apikális négyüregi- és a jobb kamrára fókuszált nézetek egymással nem felcserélhetők: utóbbi esetén a lineáris átmérők konzekvensen nagyobbak, sőt a speckle tracking technikával mért szabad fali, illetve globális longitudinális strain is jobb funkcióra utal (az értékek negatívabbak). Mind a morfológiai, mind a funkcionális paraméterek reprodukálhatósága konzekvensen jobb volt a jobb kamrára fókuszált nézet esetén (32).
A speckle tracking technikával mért jobb kamrai szegmentális és globális longitudinális strain a bal kamrához hasonlóan jelentős hozzáadott értékkel rendelkezik a szisztolés vagy akár a diasztolés diszfunkció kimutatásában (33). Egy olasz munkacsoport 200, csökkent ejekciós frakciójú szívelégtelenségben szenvedő, azonban megtartott (>16 mm) TAPSE-vel rendelkező beteget vizsgált és követett átlagosan több mint két évig. A jobb kamra szabad fali longitudinális strain független prediktora volt a mortalitást vagy szívelégtelenség miatti hospitalizációt magában foglaló elsődleges végpontnak (34). Ugyanezen munkacsoport azt a fontos kérdést is vizsgálta ugyanezen a mintán, hogy vajon a szeptumot is magában foglaló globális, vagy csupán a szabadfali longitudinális straint érdemes-e inkább mérni. Eredményeik alapján mindkettőnek van prognosztikus értéke, azonban mivel a bal kamrai diszfunkció kevésbé befolyásolja, ezért a szabad fali mérés tűnik célszerűbbnek (35). Ugyanakkor arra is van adat, hogy a reprodukálhatóság szempontjából a globális mérés a kedvezőbb, de mindenesetre az bizonyosan kijelenthető, hogy a kétféle módszer közé egyenlőségjelet tenni hiba (36).
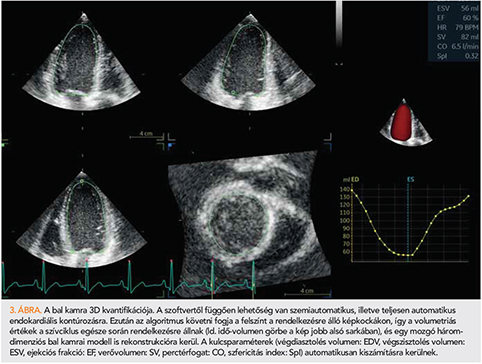
Újdonságok a bal kamra 3D képalkotása területén
A 3D-echokardiográfia tekintetében is természetesen a bal kamra kvantifikációja a legkiforrottabb a klinikai felhasználás szempontjából. Legújabban már nemcsak szemiautomatikus (néhány anatómiai referenciapont kézi kijelölését igénylő), hanem teljesen automatikus szoftveres megoldások is rendelkezésünkre állnak a bal kamrai endokardiális felszín felismerésére és követésére (3. ábra). Egy metaanalízis eredményei alapján a 3D-echokardiográfiás kvantifikáció kismértékben, de továbbra is alulbecsüli a bal kamrai volumeneket a goldstandard szív-MR-hez viszonyítva, ugyanakkor az ejekciós frakció (EF) tekintetében gyakorlatilag nincs különbség (37). Érdekesség, hogy a szemiautomata és a teljesen automata szoftveres megoldások közül az utóbbiak által generált eredmények bizonyultak pontosabbnak és jobban reprodukálhatónak. Felmerülhet a kérdés, hogy miért is fontos az ilyen mértékű pontosság ezekben a mérésekben. Egy olasz munkacsoport 172 balkamra-diszfunkcióval (döntően iszkémiás etiológiával) rendelkező beteget vizsgált. Eredményeik alapján a 3D-echokardiográfiával meghatározott bal kamrai EF az esetek 20%-ában változtatta volna meg az implantálható kardioverter defibrillátor indikációját (38). A medián 56 hónapos utánkövetés során a betegek 30%-ában jelentkeztek major ritmuszavarok, amelyek fellépésének egyetlen független prediktora a 3D-echokardiográfiával meghatározott EF volt. Jelen tanulmány kiváló példa arra, hogy a pontosabb mérések nem csupán diagnosztikus és prognosztikus haszonnal, hanem egyben akár nagyobb költséghatékonysággal is járhatnak.
Újdonságok a bal kamrai globális longitudinális strain területén
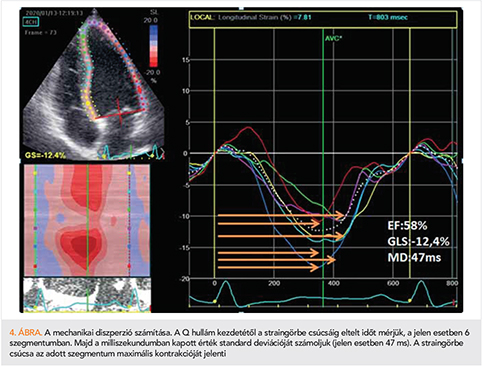
A bal kamrai globális longitudinális strain számos kórképben rendelkezik diagnosztikus értékkel, és segít a diagnózis felállításában (39). Az elmúlt években a kutatás fő irányvonalát elsősorban a bal kamrai GLS prognosztikus értékének megállapítása jelentette. Heveny szívelégtelenségben a GLS jelentősebb prognosztikus értékkel bír, mint az ejekciós frakció. Park és munkatársai 4172 akut szívelégtelen beteget vontak be vizsgálatukba, ahol a beteg kórházi felvételekor mért GLS és ejekciós frakció hatását vizsgálták a túlélésre. Az 5 éves utánkövetés során a károsodott GLS magasabb mortalitással járt, minden 1%-os GLS-csökkenés 5%-os mortalitásemelkedést jelentett (40). Nem találtak összefüggést az ejekciós frakció és a mortalitás között. Lassen és munkatársai a Copenhagen City Heart Study 6238 egyénének adatait dolgozták fel. A kombinált végpontok (kardiovaszkuláris halálozás, szívelégtelenség miatti hospitalizáció, miokardiális infarktus) tekintetében a 11 éves utánkövetés során a koradiasztolés longitudinális strainből számolt E/E’ érték szoros összefüggést mutatott a végpontokkal, míg a hagyományos E/E’ nem bizonyult prognosztikusnak (41). A miokardiális fibrosis az életkor előrehaladtával progrediál, és a jelenség összefüggésben áll az emelkedett töltőnyomással. A miokardiális fibrosis kihat az ingerületvezetésre és a kontraktilitásra, ezt a hatást jellemezhetjük a mechanikai diszperzióval (MD). Az MD a bal kamra 17 szegmentumában a longitudinális strain csúcsáig eltelt idő standard deviációját jelenti (4. ábra). Modin és munkatársai az MD átlagos értékeit állapították meg több mint ezer beteg esetében. Az MD átlagértéke a populációban 45 ± 38 ms-nak bizonyult, és minden 10 ms-os MD-növekedés lineáris összefüggést mutatott a kardiovaszkuláris halálozással (42). Csökkent ejekciós frakciójú betegekben (EF ≤45%) az MD a kamrai ritmuszavarok és a hirtelen szívhalál tekintetében prediktív értékű, míg a GLS vagy az ejekciós frakció nem mutatott ilyen prognosztikus jelentőséget (43). Az MD a későbbiekben akár segíthet a primer, profilaktikus ICD-beültetés indikációjának finomításában. A billentyűbetegségek területén szintén meghatározó a GLS értéke, például tünetmentes, súlyos aortastenosisban az ejekciós frakciónál szenzitívebb, és korábban jelzi a bal kamrai diszfunkciót. A –18,2%-nál rosszabb GLS-érték az utánkövetés során korábban és gyakrabban jelentkező panaszokkal és gyakoribb billentyűcserével járt együtt, mint a –18,2%-nál jobb GLS (44).
A 3D speckle tracking echokardiográfia esetében is rendelkezünk már a normálértékeket meghatározni igyekvő metaanalízissel (45). Ugyanakkor meg kell jegyezni, hogy jelenleg még az aktuálisan alkalmazott 3D speckle tracking szoftver alapján érdemes definiálni a kórosság határát, univerzális normálértékekről nem beszélhetünk. Mindazonáltal a globális longitudinális és globális area strainek viszonylag jó egyezést mutatnak a különböző szoftvergyártók termékei között. Egyre több adattal rendelkezünk a 3D speckle tracking hozzáadott prognosztikus értékéről is, akár a 2D globális longitudinális strainen felül is (46).
Következtetések
A bal pitvari deformáció analízise a hagyományos echokardiográfiás technikáknál szenzitívebb, független és additív prognosztikai jelentőséggel bír. Segítségével a pitvari funkció finom eltérései is leírhatóak, amellyel korábban, a pitvar tágulásának megjelenése előtt diagnosztizálható már a pitvar diszfunkciója. A jobb kamrai longitudinális strain és a 3D-echokardiográfiával meghatározott volumenek és ejekciós frakció a bal kamrától független, hozzáadott prognosztikus értékkel bírnak számos kórkép esetén, sőt akár tünetmentes egyénekben is. A bal kamrai GLS szintén prognosztikus jelentőséggel bír számos kardiovaszkuláris betegségben, és egyre több adatunk van arra, hogy az ejekciós frakciónál megbízhatóbb paraméter. Ugyanakkor az is jól látható, hogy ha megfelelő, nagy pontosságú, 3D-technikával mérjük a hagyományos 2D-mérésekkel szemben, akkor az ejekciós frakció is szenzitívebb. A szívüregek deformációs és 3D-analízise tanulási periódust igényel, és megalapozott standardok mentén szükséges a méréseket végezni. A technikák egyre szélesebb körben elérhetőek, egyre több kardiovaszkuláris kórképben alkalmazzuk őket, a mérések pedig egyre egyszerűbben kivitelezhetőek és jól reprodukálhatóak, így várhatóan a klinikai gyakorlatban is jól használható, megalapozott és nagy jelentőségű módszerek lesznek.
Nyilatkozat
A szerzők kijelentik, hogy az összefoglaló közlemény megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amelyek befolyásolhatják a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Badano LP, Miglioranza MH, Mihaila S, et al. Left Atrial Volumes and Function by Three-Dimensional Echocardiography: Reference Values, Accuracy, Reproducibility, and Comparison With Two-Dimensional Echocardiographic Measurements. Circulation Cardiovasc Imaging 2016; 9(7). https://doi.org/10.1161/CIRCIMAGING.115.004229.
2. Tadic M. The right atrium, a forgotten cardiac chamber: An updated review of multimodality imaging. Journal of Clinical Ultrasound:2015; 43(6): 335–345. https://doi.org/10.1002/jcu.22261.
3. Badano LP, Kolias TJ, Muraru D, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. European Heart Journal Cardiovascular Imaging 2018; 19(6): 591–600. https://doi.org/10.1093/ehjci/jey042.
4. Pathan F, D’Elia N, Nolan MT, Marwick TH, Negishi K. Normal Ranges of Left Atrial Strain by Speckle-Tracking Echocardiography: A Systematic Review and Meta-Analysis. Journal of the American Society of Echocardiography: official publication of the American Society of Echocardiography 2017; 30(1): 59–70 e58. https://doi.org/10.1016/j.echo.2016.09.007.
5. Cameli M, Lisi M, Righini FM, et al. Usefulness of atrial deformation analysis to predict left atrial fibrosis and endocardial thickness in patients undergoing mitral valve operations for severe mitral regurgitation secondary to mitral valve prolapse. The American Journal of Cardiology 2013; 111(4): 595–601. https://doi.org/10.1016/j.amjcard.2012.10.049.
6. Singh A, Addetia K, Maffessanti F, Mor-Avi V, Lang RM. LA Strain for Categorization of LV Diastolic Dysfunction. JACC Cardiovascular Imaging 2017; 10(7): 735–743. https://doi.org/10.1016/j.jcmg.2016.08.014.
7. Singh A, Medvedofsky D, Mediratta A, et al. Peak left atrial strain as a single measure for the non-invasive assessment of left ventricular filling pressures. The International Journal of Cardiovascular Imaging 2019; 35(1): 23–32. https://doi.org/10.1007/s10554-018-1425-y.
8. Sanchis L, Gabrielli L, Andrea R, et al. Left atrial dysfunction relates to symptom onset in patients with heart failure and preserved left ventricular ejection fraction. European Heart Journal Cardiovascular Imaging 2015; 16(1): 62–67. https://doi.org/10.1093/ehjci/jeu165.
9. Telles F, Nanayakkara S, Evans S, et al. Impaired left atrial strain predicts abnormal exercise haemodynamics in heart failure with preserved ejection fraction. European Journal of Heart Failure 2019; 21(4): 495–505. https://doi.org/10.1002/ejhf.1399.
10. Cameli M, Ciccone MM, Maiello M, et al. Speckle tracking analysis: a new tool for left atrial function analysis in systemic hypertension: an overview. Journal of Cardiovascular Medicine 2016; 17(5): 339–343. https://doi.org/10.2459/JCM.0000000000000073.
11. Cameli M, Mandoli GE, Nistor D, et al. Left heart longitudinal deformation analysis in mitral regurgitation. The International Journal of Cardiovascular Imaging 2018; 34(11): 1741–1751. https://doi.org/10.1007/s10554–018–1391–4.
12. Shaikh AY, Maan A, Khan UA, et al. Speckle echocardiographic left atrial strain and stiffness index as predictors of maintenance of sinus rhythm after cardioversion for atrial fibrillation: a prospective study. Cardiovascular Ultrasound 2012; 10: 48. https://doi.org/10.1186/1476–7120–10–48.
13. Oakes RS, Badger TJ, Kholmovski EG, et al. Detection and quantification of left atrial structural remodeling with delayed-enhancement magnetic resonance imaging in patients with atrial fibrillation. Circulation 2009; 119(13): 1758–1767. https://doi.org/10.1161/CIRCULATIONAHA.108.811877.
14. Tops LF, Delgado V, Bertini M, et al. Left atrial strain predicts reverse remodeling after catheter ablation for atrial fibrillation. Journal of the American College of Cardiology 2011; 57(3): 324–331. https://doi.org/10.1016/j.jacc.2010.05.063.
15. Motoki H, Negishi K, Kusunose K, et al. Global left atrial strain in the prediction of sinus rhythm maintenance after catheter ablation for atrial fibrillation. Journal of the American Society of Echocardiography: official publication of the American Society of Echocardiography. 2014; 27(11): 1184–1192. https://doi.org/10.1016/j.echo.2014.08.017.
16. Sarvari SI, Haugaa KH, Stokke TM, et al. Strain echocardiographic assessment of left atrial function predicts recurrence of atrial fibrillation. European Heart Journal Cardiovascular Imaging 2016; 17(6): 660–667. https://doi.org/10.1093/ehjci/jev185.
17. Nedios S, Koutalas E, Sommer P, et al. Asymmetrical left atrial remodelling in atrial fibrillation: relation with diastolic dysfunction and long-term ablation outcomes. Europace 2017; 19(9): 1463–1469. https://doi.org/10.1093/europace/euw225.
18. Thomas L, Marwick TH, Popescu BA, Donal E, Badano LP. Left Atrial Structure and Function, and Left Ventricular Diastolic Dysfunction: JACC State-of-the-Art Review. Journal of the American College of Cardiology 2019; 73(15): 1961–1977. https://doi.org/10.1016/j.jacc.2019.01.059.
19. Peluso D, Badano LP, Muraru D, et al. Right atrial size and function assessed with three-dimensional and speckle-tracking echocardiography in 200 healthy volunteers. European Heart Journal Cardiovascular Imaging 2013; 14(11): 1106–1114. https://doi.org/10.1093/ehjci/jet024.
20. Querejeta Roca G, Campbell P, Claggett B, Solomon SD, Shah AM. Right Atrial Function in Pulmonary Arterial Hypertension. Circulation. Cardiovascular Imaging 2015; 8(11): e003521;discussion e003521. https://doi.org/10.1161/CIRCIMAGING.115.003521.
21. Alenezi F, Mandawat A, Il’Giovine ZJ, et al. Clinical Utility and Prognostic Value of Right Atrial Function in Pulmonary Hypertension. Circulation Cardiovascular Imaging 2018; 11(11): e006984. https://doi.org/10.1161/CIRCIMAGING.117.006984.
22. D’Andrea A, D’Alto M, Di Maio M, et al. Right atrial morphology and function in patients with systemic sclerosis compared to healthy controls: a two-dimensional strain study. Clinical Rheumatology. 2016; 35(7): 1733–1742. https://doi.org/10.1007/s10067-016-3279-9.
23. Nogradi A, Porpaczy A, Porcsa L, et al. Relation of Right Atrial Mechanics to Functional Capacity in Patients With Systemic Sclerosis. The American Journal of Cardiology 2018; 122(7): 1249–1254. https://doi.org/10.1016/j.amjcard.2018.06.021.
24. Kovacs A, Lakatos B, Tokodi M, Merkely B. Right ventricular mechanical pattern in health and disease: beyond longitudinal shortening. Heart Failure Reviews 2019; 24(4): 511–520. https://doi.org/10.1007/s10741-019-09778-1.
25. Nochioka K, Querejeta Roca G, Claggett B, et al. Right Ventricular Function, Right Ventricular-Pulmonary Artery Coupling, and Heart Failure Risk in 4 US Communities: The Atherosclerosis Risk in Communities (ARIC) Study. JAMA Cardiology 2018; 3(10): 939–948. https://doi.org/10.1001/jamacardio.2018.2454.
26. Surkova E, Muraru D, Genovese D, Aruta P, Palermo C, Badano LP. Relative Prognostic Importance of Left and Right Ventricular Ejection Fraction in Patients With Cardiac Diseases. Journal of American Society Echocardiography 2019; 32(11): 1407–1415 e1403. https://doi.org/10.1016/j.echo.2019.06.009.
27. Muraru D, Badano LP, Nagata Y, et al. Development and prognostic validation of partition values to grade right ventricular dysfunction severity using 3D echocardiography. European Heart Journal Cardiovasc Imaging 2020; 21(1): 10–21. https://doi.org/10.1093/ehjci/jez233.
28. Lakatos BK, Kiss O, Tokodi M, et al. Exercise-induced shift in right ventricular contraction pattern: novel marker of athlete’s heart? American Journal of Physiology Heart Circulation Physiology 2018; 315(6): H1640–H1648. https://doi.org/10.1152/ajpheart.00304.2018.
29. Lakatos BK, Molnar AA, Kiss O, et al. Relationship between Cardiac Remodeling and Exercise Capacity in Elite Athletes: Incremental Value of Left Atrial Morphology and Function Assessed by Three-Dimensional Echocardiography. Journal of the American Society of Echocardiography: official publication of the American Society of Echocardiography. 2019 https://doi.org/10.1016/j.echo.2019.07.017.
30. Lakatos BK, Tokodi M, Assabiny A, et al. Dominance of free wall radial motion in global right ventricular function of heart transplant recipients. Clinical Transplant 2018; 32(3): e13192. https://doi.org/10.1111/ctr.13192.
31. Addetia K, Maffessanti F, Muraru D, et al. Morphologic Analysis of the Normal Right Ventricle Using Three-Dimensional Echocardiography-Derived Curvature Indices. Journal of the American Society of Echocardiography 2018; 31(5): 614–623. https://doi.org/10.1016/j.echo.2017.12.009.
32. Genovese D, Mor-Avi V, Palermo C, et al. Comparison Between Four-Chamber and Right Ventricular-Focused Views for the Quantitative Evaluation of Right Ventricular Size and Function. Journal of American Society of Echocardiography 2019; 32(4): 484–494. https://doi.org/10.1016/j.echo.2018.11.014.
33. Matyas C, Kovacs A, Nemeth BT, et al. Comparison of speckle-tracking echocardiography with invasive hemodynamics for the detection of characteristic cardiac dysfunction in type-1 and type-2 diabetic rat models. Cardiovascular Diabetology 2018; 17(1): 13. https://doi.org/10.1186/s12933-017-0645-0.
34. Carluccio E, Biagioli P, Alunni G, et al. Prognostic Value of Right Ventricular Dysfunction in Heart Failure With Reduced Ejection Fraction: Superiority of Longitudinal Strain Over Tricuspid Annular Plane Systolic Excursion. Circulation Cardiovascular Imaging 2018; 11(1): e006894. https://doi.org/10.1161/CIRCIMAGING.117.006894.
35. Carluccio E, Biagioli P, Lauciello R, et al. Superior Prognostic Value of Right Ventricular Free Wall Compared to Global Longitudinal Strain in Patients With Heart Failure. Journal of American Society of Echocardiography 2019; 32(7): 836–844 e831. https://doi.org/10.1016/j.echo.2019.02.011.
36. Sanz-de la Garza M, Giraldeau G, Marin J, et al. Should the septum be included in the assessment of right ventricular longitudinal strain? An ultrasound two-dimensional speckle-tracking stress study. International Journal of Cardiovasc Imaging 2019; 35(10): 1853–1860. https://doi.org/10.1007/s10554-019-01633-6.
37. Kitano T, Nabeshima Y, Otsuji Y, Negishi K, Takeuchi M. Accuracy of Left Ventricular Volumes and Ejection Fraction Measurements by Contemporary Three-Dimensional Echocardiography with Semi- and Fully Automated Software: Systematic Review and Meta-Analysis of 1,881 Subjects. Journal of American Society of Echocardiography 2019; 32(9): 1105–1115 e1105. https://doi.org/10.1016/j.echo.2019.04.417.
38. Rodriguez-Zanella H, Muraru D, Secco E, et al. Added Value of 3-Versus 2-Dimensional Echocardiography Left Ventricular Ejection Fraction to Predict Arrhythmic Risk in Patients With Left Ventricular Dysfunction. JACC Cardiovasc Imaging 2019; 12(10): 1917–1926. https://doi.org/10.1016/j.jcmg.2018.07.011.
39. Kovács Attila ÁG. Speckle-tracking echocardiography in clinical practice. Cardiologia Hungarica. 2018; 1(48.1): 58. https://doi.org/10.26430/CHUNGARICA.2018.48.1.58.
40. Park JJ, Park JB, Park JH, Cho GY. Global Longitudinal Strain to Predict Mortality in Patients With Acute Heart Failure. Journal of the American College of Cardiology 2018; 71(18): 1947–1957. https://doi.org/10.1016/j.jacc.2018.02.064.
41. Lassen MCH, Biering-Sorensen SR, Olsen FJ, et al. Ratio of transmitral early filling velocity to early diastolic strain rate predicts long-term risk of cardiovascular morbidity and mortality in the general population. European Heart Journal 2019; 40(6): 518–525. https://doi.org/10.1093/eurheartj/ehy164.
42. Modin D, Biering-Sorensen SR, Mogelvang R, Jensen JS, Biering-Sorensen T. Prognostic Importance of Left Ventricular Mechanical Dyssynchrony in Predicting Cardiovascular Death in the General Population. Circulation; Cardiovascular Imaging 2018; 11(10): e007528. https://doi.org/10.1161/CIRCIMAGING.117.007528.
43. Perry R, Patil S, Marx C, et al. Advanced Echocardiographic Imaging for Prediction of SCD in Moderate and Severe LV Systolic Function. JACC; Cardiovascular Imaging 2019 https://doi.org/10.1016/j.jcmg.2019.07.026.
44. Vollema EM, Sugimoto T, Shen M, et al. Association of Left Ventricular Global Longitudinal Strain With Asymptomatic Severe Aortic Stenosis: Natural Course and Prognostic Value. JAMA cardiology 2018; 3(9): 839–847. https://doi.org/10.1001/jamacardio.2018.2288.
45. Truong VT, Phan HT, Pham KNP, et al. Normal Ranges of Left Ventricular Strain by Three-Dimensional Speckle-Tracking Echocardiography in Adults: A Systematic Review and Meta-Analysis. Journal of American Society of Echocardiography 2019; 32(12): 1586–1597 e1585. https://doi.org/10.1016/j.echo.2019.07.012.
46. Coutinho Cruz M, Moura Branco L, Portugal G, et al. Three-dimensional speckle-tracking echocardiography for the global and regional assessments of left ventricle myocardial deformation in breast cancer patients treated with anthracyclines. Clinical Research in Cardiology 2019 https://doi.org/10.1007/s00392-019-01556-1
Modified mRNA as a therapeutic option in cardiac regeneration
█ Review
DOI: 10.26430/CHUNGARICA.2020.50.2.111
Authors:
Szabó Gábor Tamás
Debreceni Egyetem, Kardiológiai és Szívsebészeti Klinika, Debrecen
Summary
Cardiovascular diseases including heart failure are the leading causes of death in the industrialized countries and their prevention and treatment are one of the challenging tasks for cardiologists. In spite of the significant effort to improve both life expectancy and quality of life of patients suffering from these diseases, no widely available and effective treatment exists for the replacement of lost cardiomyocytes. The adult human heart has a very low regenerative capacity. In the past years, data had surfaced from various experimental and clinical research indicating that cardiomyocyte protection, angioneogenesis, as well as cardiomyocyte proliferation are all feasible via the modification of different signaling mechanisms. Observations deriving from stem cell experiments highlighted the advantages of cell-free therapies. For instance, gene therapy is a great avenue to replace proteins necessary for cardiac regeneration at a desired concentration. Delivery of genetic information to the appropriate cells with modified mRNA is a promising and safe way to ensure transient and well-controlled protein secretion and immunogenicity.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
A világ fejlett országaiban amellett, hogy vezetik a halálozási statisztikákat, nagy kihívást jelent a kardiovaszkuláris megbetegedések és köztük a szívizom-károsodás következtében kialakuló szívelégtelenség (SZE) kezelése. Ugyan az elmúlt években jelentős előrelépések történtek, amelyek segítségével mind a várható élettartam, mind az életminőség javítható ezen kórképekben, az SZE hátterében álló ok megszüntetésére és a betegség során elvesztett cardiomyocyták pótlására széles körben elérhető megoldás egyelőre nem áll rendelkezésre. A felnőtt emberi szív saját regeneratív képessége igen alacsony, azonban az elmúlt években szerzett molekuláris biológiai ismeretek több esetben igazolták, hogy a különböző szabályozási mechanizmusok módosításával lehetséges a cardiomyocyta-protekció, az érújdonképződés, sőt a cardiomyocyta-proliferáció elérése is. Az őssejtterápiákkal végzett kísérletekből származó tapasztalatok rávilágítottak a nem sejtalapú megoldások előnyeire. Ezek között a genetikai terápia alkalmasnak bizonyul a kardiális regenerációban szerepet játszó, fehérjetermészetű szabályozó elemek celluláris, vagy extracelluláris jelenlétének biztosítására. Ígéretes a módosított messenger RNS alkalmazása, amely segítségével a genetikai információ a megfelelő sejtekhez juttatható el biztonságos módon. Az így termelődő proteinek jól kiszámítható időbeni és mennyiségi dinamika mellett jelennek meg.
Bevezetés
A szív igen komplex, diverz sejtekből felépülő szerv, amely már az intrauterin 3-4. héten működni kezd, és folyamatos működése elengedhetetlen mind a fötális fejlődéshez, mind a teljes posztnatális élethez. Elfogadott az a tény, hogy a felnőtt emberi szervezet szívizomsejtjei csak minimális mértékben képesek megújulni. A születés után bármely okból történő jelentősebb szívizomterület-elhalás teljes spontán pótlódása funkcionáló szívizomszövettel nem várható (5, 6).
Emiatt is kiemelten fontosak a rendkívüli előrelépések a kardiológiában, amelyek az iszkémiás szívbetegség, az akut szívizominfarktus és a következményes szívelégtelenség (SZE) kórformák megelőzésére és kezelésére irányulnak. Az elmúlt évek jelentős eredményei dacára a fejlett országokban továbbra is az említett kórképek vezetik a haláloki statisztikákat. Sőt az aktuális adatok alapján az SZE kialakulása és halálozása az elmúlt években az intervenciós és gyógyszeres stratégiák optimalizálása és szélesebb körű alkalmazása ellenére is növekedést mutat (1, 2, 3, 30).
Az SZE kezelése nagy kihívást jelent, főként progresszív lefolyás, valamint az előrehaladott, illetve végstádiumú állapotok esetén (4). A szervpótlást biztosító, Magyarországon kimondottan jól szervezett és világviszonylatban is kiemelkedő eredményeket felmutató szívtranszplantációs program sem tud minden betegnek megfelelő megoldást nyújtani. Egyéb terápia, amely a betegség hátterében álló, az elvesztett funkcionáló szívizomsejttömegek pótlását célozná, nem elérhető.
Az elmúlt évtizedekben a molekuláris biológiai technikák robbanásszerű fejlődése vezetett oda, hogy számos, a szív kialakulásában és az életkorhoz, vagy a különböző betegségekhez kapcsolódó változásokban szerepet játszó, többszörös szabályozó útvonalak, az ezekben részt vevő különböző sejttípusok, valamint a szabályozást irányító transzkripciós faktorok és mediátorok felismerésre és leírásra kerültek.
Nem vitatható a jelentősége azoknak a vizsgálatoknak, amelyek a komplett kardiális regenerációra képes halak és kétéltűek szabályozási folyamatainak megértésére irányultak. A főként zebrahallal, szalamandrával és tarajos gőtével történt kísérletek eredményei nagyban segítették a magasabb osztályba sorolt gerincesek kardiális regenerációjának, illetve ezen képesség elvesztésének megértését is (57, 34).
Emlősökön végzett kutatások között mérföldkőnek számított az a közlemény, amely egerekben vizsgálta a születés utáni szívizomsejt-proliferációt. Ebből a tanulmányból vált egyértelművé, hogy a cardiomyocyták regenerációs potenciálja a születés utáni 7. napon szűnik meg (7). A további emlősfajokban, az infarktus esetén létrejövő génexpressziós válasz pontosabb leírása mutatott rá a szabályozó folyamatok hasonlóságára (63, 64).
A kutatásokból származó ismeretek szintézise nyitotta meg az utat a kardiális regeneráció lehetősége előtt is, rámutatva, hogy a különböző sejtek és azok változásai, valamint a háttérben álló szabályozó útvonalak elemei mind potenciális targetként szerepelhetnek a sejt- és szövetpótló terápiák számára.
A regeneráció megoldási alternatívái
Mivel SZE során meghatározó és kedvezőtlen folyamat a nagy mennyiségű, funkcionáló cardiomyocyta elvesztése, reális alternatíva lehet ezen sejtek pótlása sejtterápiás eljárással. A transzplantált sejt forrása, differenciálásának technikája, a bejuttatás helye és módja számos megoldandó problémát vetett fel. Köztük első számú annak megítélése és vizsgálata volt, hogy önmagában a sejtek vagy egy sejttípus bejuttatása elegendő-e. Egyik legfontosabb szempont, hogy a kialakuló új szövetnek mind anatómiai értelemben, mind pedig a nehezebben modellezhető elektromechanikai asszociáció mentén is tökéletesen illeszkednie kell a szív teljes szövetéhez.
Számos próbálkozás és vizsgálat történt az optimális cardiomyocyta-forrás megtalálása érdekében (8). Ezek között szomatikus ős- és progenitor sejtekkel, de kardiális rezidens C-kit (+) őssejtekkel történt számos preklinikai és később humán vizsgálat is. A nagy várakozás ellenére egyértelmű, konzekvensen pozitív, meggyőző eredmények nem születtek (65). Ugyan a vizsgálatokban kimutatható volt a balkamra-funkció javulása, ennek hátterében a bejuttatott őssejtek traszdifferenciációja nem volt egyértelműen igazolható. Bár a korábban alkalmazott sejttípusok kiválasztásánál számos érv felsorakoztatható volt, a jelenlegi eredmények birtokában az indukált pluripotens őssejtek alkalmazása tűnik optimálisnak.
A sejtterápiás eljárások eredményeit és következményeit elemezve került mindinkább egy másik fontos ismeret a vizsgálatok középpontjába, miszerint a bejuttatott őssejtek különböző parakrint szabályozó faktorok kibocsátásával alakítják a mikrokörnyezetet (42). Emellett az immunválasz centrális szerepére mutat rá egy tanulmány, amely az őssejtek intramiokardiális bejuttatása során a kialakuló kedvező klinikai paraméterváltozásokat az akut immunválasz során az aktivált makrofágok által az infarktus széli zónában indukált hatásaival magyarázza (43).
A parakrinfaktorok identifikálása, szerepüknek pontosabb megértése összekapcsolódott a szív szöveti fejlődésének, valamint a különböző kórképekben jelentkező eltérések molekuláris alapjainak részletes feltérképezésével. Az ismeretek felhasználásával az ún. nem celluláris alapú kardiális regenerációs technikák előtt nyílt meg az út.
A sejtterápiás módszerekkel végzett kutatások és ezen eljárásokból szerzett tapasztalatok igazolták különböző SZE-modellekben, hogy több növekedési faktor, illetve peptid bejuttatásával a felnőtt szívben jelenlévő, érett cardiomyocyta-proliferáció és endothelregeneráció, valamint angioneogenezis és vaszkulogenezis érhető el. A nem celluláris alapú megoldások tehát a szívben lejátszódó folyamatok szabályozásában részt vevő faktorok bejuttatása lett, amelyekkel a fő cél a cardiomyocyták proliferációjának, az angioneogenezisnek és a vaszkuloneogenezisnek, a cardiomyocyta-apoptózis gátlásnak, valamint a cardiomyocyta-elhalás következtében kialakuló immunválasz modulálásának elérése.
Lehetetlen volna az eddig leírt összes szabályozó út és target részletes ismertetése az összefoglaló közlemény keretei között, így az alábbiakban a legrészletesebben vizsgált, több esetben humán tanulmányban is szereplő faktorok kerülnek említésre.
A legelső sikeres próbálkozások a sejtciklus szabályozásában részt vevő ciklinekkel és ciklindependens kinázokkal (CDK) történtek. Több faktor (ciklin-B1, ciklin-D1, CDK1, CDK4) overexpresszálásával cardiomyocyta-proliferáció volt elérhető (56).
Biztató eredmények születtek többek között IGF-1 (insuline-like growth factor1) alkalmazásával, amely növekedési faktor a szívizomsejtekben részt vesz a növekedés és metabolizmus irányításában. Felismerték, hogy myocytaproliferációt biztosító hatása a MAPK- (mitogen-activated protein kinase) és a PI3K- (phosphatidyl-inositol 3-kinase) útvonalak és az ERK- (extracellular signal-regulated kinase) tengely aktiválásához kötődik. Remodellinggátló hatását, valamint progenitorsejt-aktivációs képességét nagy, szívizom-iszkémiás állatmodellben sikerült igazolni (59).
Több tanulmány irányult az NRG1 (neuregulin-1) hatásának megértésére. Ezek között rekombináns fehérjeként alkalmazva több humánvizsgálat is történt, amelyek eredményei megfelelő tolerálhatóságról számoltak be krónikus szívelégtelen betegpopulációban remodellinggátlással és következményes javuló kardiális funkcióval (44, 60).
Az FGF-1 (acidic fibroblast growth factor-1) egy, a szívizom, endothelsejtek, makrofágok és fibroblastok által is szekretált peptid. Szívizom-iszkémia esetén a szekréció mértéke emelkedik. Vizsgálatok a kardiális regeneráció vonatkozásában pozitív hatását igazolták, amelyet az apoptózis gátlása révén ér el.
Az extracelluláris mátrix fehérjék között a periostin, az agrin és az epikardiális eredetű FSTL-1 (follistatin-related protein 1) alkalmazása mellett myocytaproliferációt sikerült kimutatni. A vizsgálatokban elért különböző hatások a fenti proteinek funkciójának különbözőségére utal az újszülött, illetve felnőtt szívizom-károsodás esetén (45, 46, 47, 52).
A cardiomyocyta-sejtosztódás elérése mellett a kardiális regeneráció szempontjából a vaszkulogenezisnek és angiogenezisnek is kitüntetett szerepe van. Ezen a területen a VEGF (vascular endothelial growth factor) szignalizációs fehérjék hatásainak feltérképezése történt meg legrészletesebben. Az angioneogenezis irányításában emellett a korábban már a myocytaproliferáció során is említett IGF-1 és FGF, továbbá SDF-1α (stromal cell-derived factor 1α) és TGF-β (transforming growth factor β) szerepét is igazolták iszkémiás modellekben (58).
Az endotheliális növekedési faktorok között a VEGF-A-ről rendelkezünk a legtöbb ismerettel. A pontos kardiális hatás igazolására számos iszkémiás állatmodellben, később humán fázisvizsgálatban is vizsgálták az angiogén faktor szerepét. A VEGF-A rekombináns protein formájában és génterápiás eljárások segítségével is alkalmazásra került, a bejuttatást pedig intravénás, intramiokardiális, peritoneális és intrakoronáriás út mellett biodegradábilis scaffold segítségével is megpróbálták optimalizálni. A vizsgálatok jelentős különbségeket mutattak az érújdonképződés és következményes kardiálisfunkció-javulás vonatkozásában (49, 50).
Természetesen adódik a lehetőség, amelyek több kísérletben alkalmaztak is, hogy a celluláris, azaz sejttranszplantáció kombinálható a nem celluláris faktorok adásával.
Sőt elegáns megoldásként merült fel a szívben jelenlévő, nem cardiomyocyták és nem endothelsejtek különböző transzkripciós faktorokkal történő újraprogramozása. Egyik legalkalmasabb jelöltnek a nagy arányban jelenlévő fibroblastok bizonyultak. Jelentőségüket tovább fokozza, hogy szívinfarktust követően ez a sejttípus játszik elsődleges szerepet a hegszövet kialakításában is (9, 10). Az elmélet első sikeres gyakorlati megvalósítása cardiomyocyta-traszkripciós faktorok (Gata4, Mef2c, Tbx5) génterápiás adásával sikeres volt, funkcionáló szívizomsejteket sikerült létrehozni fibroblastok átprogramozásával (48).
Mivel ezek a faktorok döntően fehérjetermészetű anyagok, a megfelelő sejt eléréséhez, a szükséges koncentráció biztosításához, az immunogenitás kérdéseinek megválaszolásához sok új megoldást kellett kidolgozni. A bejuttatott protein féléletideje, instabilitása és az általa kiváltott immunválasz kritikus a vizsgálatokban. További nehézségként jelentkezik az exogén forrásból származó protein intracelluláris bejuttatása.
A fent felsorolt akadályok leküzdésére reális lehetőségként adódott a genetikai terápia. Nukleinsavak bejuttatásával biztosítható a szükséges aminosavsorrend-információ, amely a megfelelő fehérje megfelelő helyen történő szintéziséhez szükséges. A génterápia izgalmas megoldás a kardiális regenerációban is. Segítségével precízebben érhetjük el a módosítani kívánt szabályozó útvonalat.
Génterápiás lehetőségek
A génterápia lehetőséget nyújt a szervezetben lejátszódó folyamatok módosítására a DNS-ben meghatározott gén információja és expressziója révén termelődő fehérje közötti tengelyen több ponton és több módon. A bejuttatni kívánt genetikai információt szállító molekulát felépítő nukleozidok alapján DNS- (dezoxiribonukleinsav-) és RNS- (ribonukleinsav-) terápiákat különíthetünk el. A génterápia nyilvánvaló lehetőségeivel együtt újabb nehézségekre is választ kell adnia a tudománynak, amelyek között kulcskérdés lett a bejuttatni tervezett nukleinsav celluláris transzportjának megoldása.
A nukleinsavak sejtbe és sejtmagba történő bejuttatására virális és plazmid vektorokkal történt kísérlet. Ezen opciók közül az asszociált adenovírus (AAV) bizonyult a legjobbnak, mivel mind immunogenitási profilja, mind a genomba történő integrációja és ezzel onkogén hatása alacsony, mindezek mellett viszont transzdukciós kapacitása megfelelő (11, 12, 27).
A DNS stabilitása széles felhasználási lehetőséget nyitott annak alkalmazása előtt, viszont a nehezen kiszámítható, a genomba történő integrációja során kialakuló változások, esetleg nem várt késői génexpressziók megváltozása és azok monitorozásának és kontrolljának szűkös lehetőségei fókuszba helyezték egyéb alternatív megoldások fejlesztését.
A génterápia másik iránya az RNS bejuttatása vagy módosítása. Az RNS viszonylagos instabilitása sok nehézséget jelentett kezdetben. Először 1990-ben került közlésre tanulmány, ahol hírvivő (messenger – m) RNS-t használtak vektornak in vivo, amit követően funkcionális fehérjét detektáltak (13). Az első sikerek rendkívüli teret nyitottak az RNS alkalmazása előtt, számos úttörő közlemény jelent meg a legszélesebb alkalmazási körben a preventív vakcinálási kísérletektől kiindulva a malignus betegségek genetikai terápiájáig.
Az mRNS-terápia alkalmazásának nagy előnye a DNS-alapú terápiákkal szemben, hogy elegendő a citoplazmába juttatni, nem szükséges elérni a sejtmagot. Szemben a DNS korábban említett legnagyobb veszélyével, miszerint integrálódhat a genomba, mutációkat létrehozhatva ezzel, az mRNS esetén ez a veszély nem áll fent. Az előnyök között kiemelendő továbbá, hogy a genetikai információ alapján termelődő fehérje mennyisége, valamint a termelődés ideje könnyebben tervezhető és modellezhető, szemben a DNS-alapú génterápiás megoldással.
Az mRNS-sel végzett vizsgálatok újabb nehézségekre is rávilágítottak. Az exogén forrásból a szervezetbe bejuttatott mRNS-t a ribonukleáz enzimek gyorsan degradáljak, amely mechanizmus a patogének elleni védekezés egyik fontos eszköze (14). A sejtmembránon átjutó mRNS sincs biztonságban, azt az intracelluláris ribonukleázok darabolják és teszik ezzel hatástalanná (15, 18, 19). Emellett az exogén mRNS nemcsak könnyen degradálódik, hanem az általa kiváltott immunválasz is extrém mértékű, amely nagyban befolyásolja a tervezett terápia hatásosságát. Az exogén mRNS bejutása után kialakuló immunológiai folyamatoknak, az aktiválódó receptorok és útvonalak összefüggésének megértése fontos állomás volt a terápia alkalmazása szempontjából (16, 17).
A módosított mRNS
Mérföldkő volt az a kutatómunka, amely eredményei alapján született közleményekben Karikó és munkatársai először számoltak be a természetben is előforduló, módosított nukleozidok felhasználásával, in vitro szintézissel készült mRNS alkalmazásáról. Olyan konstrukciót sikerült előállítaniuk, amely módosított mRNS (mod-mRNS) minimálisan volt immunogén, és több fehérje képződését indukálta, mint a módosítás nélküli mRNS (20, 21). További vizsgálatok is igazolták a mod-mRNS stabilitásának és a transzláció mértékének fokozódását (55). Az mRNS stabilitását, in vivo biológiai hatását a transzláció effektivitásán alapulva tovább növelte számos újabb, az mRNS teljes szerkezetét érintő poszttranszkripciós módosítás is. Reális lehetőség lett mind a nagyobb szöveti méretek (pl. emberi szív) esetén is megfelelő koncentráció elérése és az immunválasz módosulásából fakadóan többszöri, vagy akár folyamatos alkalmazás. Ezen optimalizálások kiszélesítették az mRNS alkalmazási területét, így a vakcinálás és tumorterápia mellett a ritka genetikai hiánybetegségekben és a regenerációs medicinában is szerephez juthatott.
mod-mRNS alkalmazása a kardiológiában
A genetikai alapú terápiák közül a kardiológiai alkalmazást nagyban támogatta, hogy a mod-mRNS a kívánt genetikai információ bejuttatásához olyan vektort biztosíthat, amely segítségével a nem osztódó sejtekben is gyors, intenzív fehérjetermelést kiváltó, átmeneti hatást érhetünk el (28).
Kardiális regeneráció céljából adott mod-mRNS in vivo alkalmazásáról 2013-ban számoltak be először. Infarktusos egérmodellben VEGF-A mod-mRNS közvetlen intramiokardiális adásának hatására kifejezettebb VEGF-A-protein-szekréciót detektáltak nem módosított mRNS-terápiához hasonlítva. A terápia csökkentette az infarktus kiterjedését, javította a kamrafunkciót és a túlélést. Az immunválasz vizsgálata igen kedvező eredményt mutatott. A modellben megfigyelhető volt az epikardiális progenitor sejtek (WT1 progenitor cell) aktiválódása, illetve apoptózisgátlás is igazolódott. Külön kiemelendő, hogy a VEGF-A szekréciójának dinamizmusa a mod-mRNS adását követően kedvezőbb, ennek köszönhetően nem alakult ki az egyéb módon (pl. DNS, illetve rekombináns protein alkalmazásával) biztosított VEGF-A-hez képest nemkívánatos vaszkuláris permeabilitásváltozás és következményes myocardiumödéma, illetve abnormális ér újdonképződés sem (22).
A VEGF-A-t kódoló mod-mRNS alkalmazásával elérhető ún. pulzatilis fehérjeszekréció támogatja a humán multipotens Isl1-pozitív (insulin gene enhancer protein ISL-1) sejtek, a kardiális progenitor sejtek egy típusának integrálódását, proliferációját és túlélését (54).
A fenti sikerek alapozták meg a terápia alkalmazását humán vizsgálatokban is. Ezek között az első tanulmány kiváló biztonságossági és hatékonysági paramétereket igazolt diabéteszes betegeknél intradermális adás esetén (62). A kialakított konstruktummal jelenleg is végeznek humán randomizált klinikai vizsgálatot.
Infarktusos egér modellben, intramiokardiálisan injektált IGF-1 mod-mRNS transzlációjának mértéke elegendő volt a cardiomyocyták citoprotekciójára, az Akt- (protein kinase B = PKB = Akt) és Erk- (extracellular signal-regulated kinase) foszforiláció módosításával, apoptózis gátlása révén. A modellben a nanopartikulummal történő bejuttatást követően 24 órával kimutathatóak voltak a vizsgált pozitív hatások az infarktusos határterületekben (26).
A FSTL-1 fehérje kardioprotekcióban játszott szerepe myocardium iszkémiás károsodás esetén ismert volt (52). A szabályozó protein-glikoziláció jelentőségének tisztázását követően mutált hFSTL-1-t kódoló mod-mRNS bejuttatásával sikerült rágcsáló, infarktusos modellekben cardiomyocyta-proliferációt is elérni, valamint kimutatni a hegszövet méretének csökkenését és a balkamra-funkció javulását. A vizsgált modellben egyetlen dózis elegendő volt a kívánt hatások eléréséhez (29).
Egy másik állatkísérletben az infarktus során magasabb ceramidszintek esetén provokált apoptózis gátlására mod-mRNS-terápiával bejutatott ceramidáz posztinfarktusos egér modellben csökkentette az infarktusos terület nagyságát, javította a balkamra-funkciót, valamint növelte a túlélést (66).
A mod-mRNS-terápia hatékonysága a megfelelő szabályozó útvonal és annak elemének kiválasztása és az optimális konstruktum megalkotása mellett nagyban függ attól is, sikerül-e elérni a célzott sejtet.
A szívregeneráció in vivo kísérletek esetén a kiterjedten alkalmazott intramiokardiális beviteli mód mellett a különféle vaszkuláris bejuttatási formák is elérhetőek (23). Bár mindegyik alkalmazási módnak megvannak a saját előnyei, klinikai megközelítésben, a jövőbeni felhasználás érdekében a transzkatéteres, perkután megoldások tűnnek reálisnak a mindennapi gyakorlatban, természetesen az intravénás lehetőséget követve.
A szervezetbe történő bejuttatás mellett a mod-mRNS formulációja lesz meghatározó a targetsejt elérésében. A mod-mRNS-terápiák esetén nincs szükség vírusvektorra, a kódolt genetikai információ különböző pufferek és transzfekciós reagensek segítségével, vagy pozitív töltésű polimerekből és lipidekből álló nanopartikulumokba zárva érheti el a célzott sejtet. A különböző formulációs lehetőségekkel történt disztribúciós vizsgálatok alapján a nanopartikulumok alkalmazása tűnik egyelőre a leghatékonyabb megoldásnak a kardiális regeneráció esetén (24, 25).
A genetikai információ szállításának optimalizálásához szorosan kötődik az exoszómákkal folytatott megfigyelésekből és vizsgálatokból származó adatok rendszerezése. Az exoszómák, mint kisméretű extracelluláris vezikulumok fontos közvetítői a sejtek közötti kommunikációnak. Számos sejt jelentős számú exoszómát szekretál, amelyeket megfelelő jelölés esetén más sejtek könnyen és gyorsan felvesznek (40, 41).
A sejtek endocitózis útján veszik fel a mod-mRNS-t, illetve az ezt szállító partikulumokat. A sejtmembránon átlépve intracelluláris endoszóma alakul ki. Az endoszóma felnyílását követően lesz hozzáférhető a mod-mRNS a citoplazmában.
A mod-mRNS segítségével történő fehérjeképződés dinamizmusát több vizsgálat részletesen elemezte. Az intrakardiális alkalmazásban az uridin módosítása esetén megfigyelhető volt egy magasabb transzlációs érték. A termelődő protein percek múlva kimutatható mind in vitro, mind pedig in vivo vizsgálatokban, a transzláció csúcsa 24 óránál figyelhető meg. Ezután a fehérje jelenléte további kb. 10 napig is észlelhető (28, 53).
Annak fényében, hogy mod-mRNS-terápia segítségével cardiomyocyta-proliferáció (29), apoptózisgátlás (26, 66), valamint angiogenezis (22) is elérhető iszkémiás emlős állatmodellekben, sőt bizonyos területen már humánadatokkal is rendelkezünk, a kardiális regeneráció ezzel a technikával nem is tűnik igazán futurisztikusnak.
Egyéb RNS-terápiák
Külön összefoglalóra lenne szükség a mod-mRNS mellett elérhető egyéb, RNS-t célzó terápiák részletezésére, itt csak rövid, említésszintű áttekintésre nyílik lehetőség. Ismert, hogy a génkifejeződés finomhangolásában több rövid RNS-szakasz is részt vesz. Az ún. nem kódoló RNS-ek, mint a mikro RNS-ek (miRNS, miR), hosszú nem kódoló RNS-ek (lncRNS), a cirkuláris RNS-ek (circRNS) és a kis interferáló RNS-ek (siRNS), valamint egyéb oligonukleotid alapú molekuláris terápiák (agomiR, ASO – antiszensz oligonukleotidok) szerepének, illetve a génexpresszió szabályozásában betöltött feladatuknak is mindinkább részletes az irodalma (31, 32, 33). Az elmúlt években igen sok ígéretes jelöltet sikerült azonosítani, amelyek akár a kardiális regenerációt is célozhatják (51).
A miRNS-terápiák között effektivitást sikerült igazolni posztinfarktusos modellekben (37, 38), hipertrófia (39), különböző aritmiák (35) és kardiális fibrózis (36) esetén is. Ezek között külön említendő egy szívelégtelenség-modellel végzett tanulmány, amelyben az intracelluláris kalciumszabályozás módosítására miRNS-25 ASO-alkalmazás során a kardiális kontraktilitás volt fokozható (61). Egy másik, igen aktuális közleményben pedig iszkémiás szívelégtelen sertésmodell alkalmazásával miR-132-inhibitorral sikerült dózisfüggően balkamra-funkciójavulást kimutatni az 56 napos követés során (67).
A miRNS-ek, vagy épp a különböző RNS-formákat módosító oligonukleotidok legfőbb veszélye egyelőre, hogy hatásuk nem specifikus, és sok esetben nem csak egy szabályozási folyamatban vesznek részt. Egy miRNS több gén expressziójára is hatással lehet. Ezekre sok esetben nem is azonnal derül fény. A hátrányok között említendő, hogy jelenleg a miRNS-terápiák tervezett hatásán kívüli változások monitorozására biztos vizsgáló módszer nem áll rendelkezésre (40).
Zárógondolat
Az összefoglaló áttekintés a kardiális regeneráció aktuális kérdéseire próbál rávilágítani. Terjedelméből fakadóan kevésbé tud koncentrálni a különböző részekben az ismeretek részletező leírására, így ezek a releváns, feltüntetett irodalomból érhetőek el. Az írás legfőbb célja a jelenleg elérhető megoldási alternatívák és a kutatási terület sokszínűségének bemutatása, egyben kiemelni a módosított mRNS-terápiával történt eddigi biztató eredményeket.
A kardiális regenerációt sok oldalról megközelítő kutatási projektek számos megoldandó problémát is fókuszba helyeznek. A nem celluláris formák rendkívüli lehetőséget jelentenek ezen nehézségek áthidalására, a szív szöveti helyreállítására. A jelenleg is folyamatban lévő humánvizsgálatok sokunkat bizakodóvá tehetnek. Remélhetőleg a közeljövőben az újabb terápiák akár a mindennapi orvosi gyakorlatba is bekerülhetnek.
Nyilatkozat
A szerző kijelenti, hogy az összefoglaló közlemény megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amelyek befolyásolhatják a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Benjamin EJ, Muntner P, Virani SS, et al. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation 2019; 139: e56–528. https://doi.org/10.1161/CIR.0000000000000659
2. Santos JV, Souza J, Freitas A, et al. The state of health in the European Union (EU-28) in 2017: an analysis of the burden of diseases and injuries. Eur J Public Health 2019. https://doi.org/10.1093/eurpub/ckz203
3. Conrad N, Judge A, Rahimi K, et al. Temporal trends and patterns in heart failure incidence: a population-based study of 4 million individuals. Lancet 2017; 391: 572–580. https://doi.org/10.1016/S0140-6736(17)32520-5
4. Severino P, Mather PJ, Fedele F, et al. Advanced Heart Failure and End-Stage Heart Failure: Does a Difference Exist Diagnostics. 2019. pii: E170. https://doi.org/10.3390/diagnostics9040170
5. Anversa P, Leri A, Kajstura J. Cardiac regeneration. J Am Coll Cardiol 2006; 47: 1769–76. https://doi.org/10.1016/j.jacc.2006.02.003
6. Bergmann O, Bhardwaj RD, Frisen J, et al. Evidence for cardiomyocyte renewal in humans. Science 2009; 324: 98–102. https://doi.org/10.1126/science.1164680
7. Porrello ER, Mahmoud AI, Sadek HA, et al. Transient regenerative potential of the neonatal mouse heart. Science 2011; 6020: 1078–1080. https://doi.org/10.1126/science.1200708
8. Balsam LB, Wager AJ, Robbins RC, et al. Haematopoietic stem cells adopt mature haematopoietic fates in ischaemic myocardium. Nature 2004; 6983; 668–673. https://doi.org/10/1038/nature02460
9. Protze S, Khattak S, Ravens U, et al. A new approach to transcription factor screening for reprogramming of fibroblasts to cardiomyocyte-like cells. J Mol Cell Cardiol 2012; 53: 323–332. https://doi.org/10.1016/j.yjmcc.2012.04.010
10. Qian L, Huang Y, Srivastava D, et al. In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes. Nature 2012; 7400: 593–598. https://doi.org/10.1038/nature11044
11. Schultz BR, Chamberlain JS. Recombinant adeno-associated virus transduction and integration. Mol Ther 2008; 16: 1189–1199. https://doi.org/10.1038/mt.2008.103
12. Wang Z, Troilo PJ, Ledwith BJ, et al. Detection of integration of plasmid DNA into host genomic DNA following intramuscular injection and electroporation. Gene Ther 2004; 11: 711–721. https://doi.org/10.1038/sj.gt.3302213
13. Wolff JA, Malone RW, FElgner PA, et al. Direct gene transfer into mouse muscle in vivo. Science 1990; 4949: 1465–8. https://doi.org/10.1126/science.1690918
14. Dyer KD, Rosenberg HF. The RNase a superfamily: generation of diversity and innate host defense. Mol Divers 2006; 10: 585–597. https://doi.org/10/1007/s11030-006-9028-2
15. Rigby RE, Rehwinkel J. RNA degradation in antiviral immunity and autoimmunity. Trends Immunol 2015; 36: 179–188. https://doi.org/10.1016/j.it.2015.02.001
16. Heil F, Hemmi H, Bauer S, et al. Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8. Science 2004; 5663: 1526–1529. https://doi.org/10.1126/science.1093620
17. Diebold SS, Kaisho T, Reis e Sousa C, et al. Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science 2004; 5663: 1529–1531. https://doi.org/10.1126/science.1093616
18. Alexopoulou L, Holt AC, Flavell RA, et al. Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3. Nature 2001; 6857: 732–738. https://doi.org/10.1038/35099560
19. Schlee M, Roth A, Hartmann G, et al. Recognition of 5′ triphosphate by RIG-I helicase requires short blunt double-stranded RNA as contained in panhandle of negative-strand virus. Immunity 2009; 31: 25–34. https://doi.org/10.1016/j.immuni.2009.05.008
20. Kariko K, Buckstein M, Weissman D, et al. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23: 165–175. https://doi.org/10/1016/j.immuni.2005.06.008
21. Kariko K, Muramatsu H, Weissman D, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 2008; 16: 1833–1840. https://doi.org/10.1038/mt.2008.200
22. Zangi L, Lui KO, Chien KR, et al. Modified mRNA directs the fate of heart progenitor cells and induces vascular regeneration after myocardial infarction. Nat Biotechnol 2013; 31: 898–907. https://doi.org/10.1038/nbt.2682
23. Katz MG, Fargnoli AS, Bridges CR, et al. The road ahead: working towards effective clinical translation of myocardial gene therapies. Ther Deliv 2014; 5: 39–51. https://doi.org/10.4155/tde.13.134
24. Islam MA, Reesor EK, Shi J, et al. Biomaterials for mRNA delivery. Biomater Sci 2015; 12: 1519–1533. https://doi.org/10.1039/c5bm00198f
25. Li L, Wei Y, Gong C. Polymeric Nanocarriers for Non-Viral Gene Delivery. J Biomed Nanotechnol 2015; 11: 739–770. https://doi.org/10.1166/jbn.2015.2069
26. Huang CL, Leblond AL, Caplice NM, et al. Synthetic chemically modified mrna-based delivery of cytoprotective factor promotes early cardiomyocyte survival post-acute myocardial infarction. Mol Pharm 2015; 12: 991–996. https://doi.org/10.1021/mp5006239
27. Ginn SL, Amaya AK, Abedi MR, et al. Gene therapy clinical trials worldwide to 2017: An update. J Gene Med 2018; 20: e3015. https://doi.org/10.1002/jgm.3015
28. Sultana N, Magadum A, Zangi L, et al. Optimizing Cardiac Delivery of Modified mRNA. Mol Ther 2017; 25: 1306–1315. https://doi.org/10.1016/j.ymthe.2017.03.016
29. Magadum A, Singh N, Zangi L, et al. Ablation of a Single N-Glycosylation Site in Human FSTL 1 Induces Cardiomyocyte Proliferation and Cardiac Regeneration. Mol Ther Nucleic Acids 2018; 13: 133–143. https://doi.org/10.1016/j.omtn.2018.08.021
30. Savarese G, Lund LH. Global Public Health Burden of Heart Failure. Card Fail Rev 2017; 3: 7–11. https://doi.org/10.15420/cfr.2016:25:2
31. Sullenger BA, NAir S. From the RNA world to the clinic. Science 2016; 6292: 1417–1420. https://doi.org/10.1126/science.aad8709
32. Devaux Y, Zangrando J, Heymans S, et al. Long noncoding RNAs in cardiac development and ageing. Nat Rev Cardiol 2015; 12: 415–425. https://doi.org/10.1038/nrcardio.2015.55
33. Thum T. Noncoding RNAs and myocardial fibrosis. Nat Rec Cardiol 2014; 11: 655–663. https://doi.org/10.1038/nrcardio.2014.125
34. Gonzales-Rosa JM, Burns CE, Burns CG. Zebrafish heart regeneration: 15 years of discoveries. Regeneration 2017; 4: 105–123. https://doi.org/10.1002/reg2.83
35. Quattrocelli M, Crippa S, Sampaolesi M, et al. Long-term miR-669a therapy alleviates chronic dilated cardiomyopathy in dystrophic mice. J. Am Heart Assoc 2013; 20: e000284 https://doi.org/10.1161/JAHA.113.000284
36. Tao L, Bei Y, Li X, et al. Crucial Role of miR-433 in Regulating Cardiac Fibrosis. Theranostics 2016; 12: 2068–2083. https://doi.org/10.7150/thno.15007
37. Wang X, Ha T, Li C, et al. Increased expression of microRNA-146a decreases myocardial ischaemia/reperfusion injury. Cardiovasc Res 2013; 97: 432–442. https://doi.org/10.1093/cvr/cvs356
38. Li Q, Xie J, Xu B, et al. Overexpression of microRNA-99a attenuates heart remodeling and improves cardiac performance after myocardial infarction. J Cell Mol Med 2014; 18: 919–928. https://doi.org/10.1111/jcmm.12242
39. Ganesan J, Ramanujam D, Engelhardt S, et al. MiR-378 controls cardiac hypertrophy by combined repression of mitogen-activated protein kinase pathway factors. Circulation 2013; 127: 2097–2106. https://doi.org/10.1161/CIRCULATIONAHA.112.000882
40. Willms E, Johansson HJ, Vader P, et al. Cells release subpopulations of exosomes with distinct molecular and biological properties. Sci Rep 2016; 6: 22519. https://doi.org/10.1038/srep22519
41. Valadi H, Ekström K, Lötvall JO, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007; 9: 654–659. https://doi.org/10.1038/ncb1596
42. Sanganalmath SK, Bolli R. Cell therapy for heart failure: a comprehensive overview of experimental and clinical studies, current challenges, and future directions. Circ res 2013; 113: 810–834. https://doi.org/10.1161/CIRCRESAHA.113.300219
43. Vaganozzi RJ, Maillet M, Molkentin JD. An acute immune response underlies the benefit of cardiac stem cell therapy. Nature 2020; 7790: 45–409. https://doi.org/10.1038/s41586-019-1802-2
44. Engel FB, Schebesta M, Keating MT, et al. p38 MAP kinase inhibition enables proliferation of adult mammalian cardiomyocytes. Genes Dev 2005; 19: 1175–1178. https://doi.org/10.1101/gad.1306705
45. Bassat E, Mutlak YE, Tzahor E, et al. The extracellular matrix protein agrin promotes heart regeneration in mice. Nature 2017; 7662: 179–184. https://doi.org/10.1038/nature22978
46. Wei K, Serpooshan V, Ruiz-Lozano P, et al. Epicardial FSTL1 reconstitution regenerates the adult mammalian heart. Nature 2015; 7570: 479–485. https://doi.org/10.1038/nature15372
47. Kühn B, del Monte F, Keating MT, et al. Periostin induces proliferation of differentiated cardiomyocytes and promotes cardiac repair. Nat Med 2007; 13: 962–969. https://doi.org/10.1038/nm1619
48. Ieda M, Fu JD, Srivastava D, et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell 2010; 142: 375–386. https://doi.org/10.1016/j.cell.2010.07.002
49. Losordo DW, Vale PR, Isner JM, et al. Gene therapy for myocardial angiogenesis: initial clinical results with direct myocardial injection of phVEGF165 as sole therapy for myocardial ischemia. Circulation 1998; 98: 2800–2804. https://doi.org/10.1161/01.CIR.98.25.2800
50. Sato K, Wu T, Post MJ, et al. Efficacy of intracoronary or intravenous VEGF165 in a pig model of chronic myocardial ischemia. J Am Coll Cardiol 2001; 37: 616–623. https://doi.org/10.1016/S0735-1097(00)01144-X
51. Eulalio A, Mano M, Giacca M, et al. Functional screening identifies miRNAs inducing cardiac regeneration. Nature 2012; 7429: 376–381. https://doi.org/10.1038/nature11739
52. Ogura Y, Ouchi N, Murohara T, et al. Therapeutic impact of follistatin-like 1 on myocardial ischemic injury in preclinical models. Circulation 2012; 126: 1728–38. https://doi.org/10.1161/CIRCULATIONAHA.112.115089
53. Turnbull IC, Eltoukhy AA, Costa KD, et al. Lipidoid mRNA Nanoparticles for Myocardial Delivery in Rodents. Methods Mol Biol 2017; 1521: 153–166. https://doi.org/10.1007/978-1-4939-6588-5_10
54. Lui KO, Zangi L, Chien KR, et al. Driving vascular endothelial cell fate of human multipotent Isl1+ heart progenitors with VEGF modified mRNA. Cell Res 2013; 23: 1172–1186. https://doi.org/10.1038/cr.2013.112
55. Svitkin YV, Chen YM, Sonenberg N, et al. N1-methyl-pseudouridine in mRNA enhances translation through eIF2α-dependent and independent mechanisms by increasing ribosome density. Nucleid Acids Res 2017; 45: 6023–6036. https://doi.org/10.1093/nar/gkx135
56. Mohamed TMA, Ang YS, Srivastava D, et al. Regulation of Cell Cycle to Stimulate Adult Cardiomyocyte Proliferation and Cardiac Regeneration. Cell 2018; 173: 104–116. https://doi.org/10.1016/j.cell.2018.02.014
57. Tzahor E, Poss KD. Cardiac regeneration strategies: Staying young at heart. Scince 2017; 6342: 1035–1039. https://doi.org/10.1126/science.aam5894
58. Hausenloy DJ, Yellon DM. Cardioprotective growth factors. Cardiovasc Res 2009; 83: 179–194. https://doi.org/10.1093/cvr/cvp062
59. Dai W, Kloner RA. Cardioprotection of insulin-like growth factor-1 during reperfusion therapy: what is the underlying mechanism or mechanisms? Circ Cardiovasc Interv 2011; 4: 311–313. https://doi.org/10.1161/CIRCINTERVENTIONS.111.964049
60. Gao R, Zhang J, Zhou M, et al. A Phase II, randomized, double- blind, multicenter, based on standard therapy, placebo-controlled study of the efficacy and safety of recombinant human neuregulin-1 in patients with chronic heart failure. J Am Coll Cardiol 2010: 55: 1907–1914. https://doi.org/10.1016/j.jacc.2009.12.044
61. Wahlquist C, Jeong D, Mercola M, et al. Inhibition of miR-25 improves cardiac contractility in the failing heart. Nature 2014; 7497: 531–535. https://doi.org/10.1038/nature13073
62. Gan LM, Langerström-Fermer M, Fritsche-Danielson R, et al. Intradermal delivery of modified mRNA encoding VEGF-A in patients with type 2 diabetes. Nat Commun 2019; 20: 871. https://doi.org/10.1038/s41467-019-08852-4
63. Wang H, Paulsen MJ, Woo YJ, et al. Natural Heart Regeneration in a Neonatal Rat Myocardial Infarction Model. Cells 2020; 16: e229. https://doi.org/10.3390/cells9010229
64. Lock MC, Tellam RL, Morrison JL, et al. Differential gene responses three days following infarction in the fetal and adolescent sheep heart. Physiol Genomics 2020. https://doi.org/10.1152/physiolgenomics.00092.2019.
65. Eschenhagen T, Bolli R, Hill JA, et al. Cardiomyocyte Regeneration: A Consensus Statement. Circulation 2017; 136: 680–686. https://doi.org/10.1161/CIRCULATIONAHA.117.029343
66. Hadas Y, Vincek AS, Zangi L. Altering Sphingolipid Metabolism Attenuates Cell Death and Inflammatory Response after Myocardial Infarction. Circulation 2020; 10: 1161. https://doi.org/10.1161/CIRCULATIONAHA.119.041882
67. Foinquinos A, Batkai S, Thum T. Preclinical development of a miR-132 inhibitor for heart failure treatment. Nat Commun 2020; 11: 633. https://doi.org/10.1038/s41467-020-14349-2
Coronary angioplasty in serious myocardial infarction with device suppported respiration and circulation
█ Original article
DOI: 10.26430/CHUNGARICA.2020.50.2.106
Authors:
Voith László, Nowotta Fanni, Skoda Réka, Merkely Béla, Becker Dávid
Semmelweis Egyetem, Városmajori Szív- és Érgyógyászati Klinika, Budapest
Summary
Aim of the study: To analyze of clinical course of pts. with acute myocardial infarction requiring respiratory and/or circulatory device help or hypothermia during primary coronary intervention.
Patients and methods: From 01. 01. 2016 to 31. 12. 2016 we performed 1435 primary percutaneous coronary intervention in 543 acute ST elevation (STEMI) and 892 non-ST elevation (NSTEMI) myocardial infarction. 158 cases (11.0% of patients, 95 male and 63 female) were unconscious after reanimation, having heart failure or being in cardiogenic shock caused by previous infarction or another kind of heart disease, or suffering from other severe disease beside AMI. These patients needed special device support in addition to PPCI, during and after the procedure, intermittent positive pressure breathing (IPPB) 93, intraaortic balloon pump (IABP) 22, IPPB + IABP 23, IPPB and/or IABP + hypothermia 13, IPPB and/or IABP + AV extracorporeal membrane oxygenator (ECMO) 7 in cases. Malignant rhythm disorders requiring direct-current (DC) shock and/or pacemaker treatment have not been separately studied. We analyzed the time intervals from onset of complaint to first ECG and to balloon inflation.
Results: Among STEMI pts the proportion of required special device support was higher than in the NSTEMI group (95 pts. 17.5% vs. 63 pts. 7.2%). Both the time from the beginning of the complaints to the first medical contact (ECG) and to the hospital and the reperfusion (complaint-balloon opening) was longer than average. Within 30 days 63 (39.9%) pts were lost, another 38 (24.0%) by the end of first year. 57 (36.1%) pts. survived more than 1 year.
Discussion: In our opinion, primary PCI should be attempted using the above-mentioned methods in AMI pts in serious condition even if the patients are admitted to the hospital over the 12 hours, which is considered acceptable. We do not have the knowledge to predict the late outcome of the intervention by the time of the admission of an AMI patient.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Összefoglalás
Célkitűzés: Akut miokardiális infarktusos, a primer perkután koronáriaintervenció (pPCI) során a légzés és/vagy a keringés eszközös támogatását, illetve hipotermiát igénylő páciensek betegségének klinikai lefolyásának elemzése.
Betegek és módszerek: 2016. 01. 01. és 12. 31. között 1435 betegben végeztünk akut miokardiális infarktusban primer koszorúér-intervenciót (543 ST-elevációs – STEMI – és 892 nem ST-elevációs – NSTEMI). Közülük 158 eset (a betegek 11,0%-a, 95 férfi és 63 nő) reanimált, illetve korábban már infarktuson átesett vagy egyéb szívizom-károsodás miatt keringési elégtelenségben, kardiogén sokkban, esetleg az akut miokardiális infarktus (AMI) mellett egyéb súlyos betegségben is szenvedett. Ezen betegeknél a perkután koronáriaintervenció (PCI) mellett egyéb eszközös segítségre is szükség volt. A beavatkozás alatt és után intermittáló pozitív nyomású lélegeztetés (IPPB) 93, intraaortikus ballonpumpa (IABP) 22, IPPB + IABP 23, IPPB és/vagy IABP + hipotermia 13, IPPB és/vagy IABP + extracorporalis membrán oxigenátort (ECMO-t) 7 esetben alkalmaztuk. Az egyenáramú (DC) sokkot és/vagy pacemakerkezelést igénylő malignus ritmuszavarokat külön nem elemeztük. Vizsgáltuk a panasz kezdetétől az első EKG-ig, illetve a ballonnyitásig eltelt időt.
Eredmények: A STEMI esetek között az eszközös támogatást igénylő betegek aránya magasabb volt, mint a NSTEMI-csoportban (95 beteg 17,5% vs. 63 beteg 7,2%). A panaszok kezdetétől az első egészségügyi kontaktusig (EKG-készítés), mind kórházi felvételtől a reperfúzióig (a koszorúér-tágító ballon nyitásáig) eltelt idő hosszabb volt az összes beteg átlagánál. 30 napon belül 63 (39,9%), egy éven belül újabb 38 (24,0%) beteget vesztettünk, 57 (36,1%) beteg egy éven túl életben volt.
Megbeszélés: Véleményünk szerint a primer PCI-t súlyos állapotú AMI-s betegekben a fenti módszerek segítségével meg kell kísérelni akkor is, ha azok a még elfogadhatónak tekintett 12 órán túl kerülnek kórházi felvételre. Nincsenek olyan ismereteink, amikkel az akut infarktusos beteg felvételekor már eldönthető lenne a beavatkozás késői kimenetele.
Az akut szívizominfarktus kezelésének két alapvető célja a beteg életben tartása és a szívizomelhalás mértékének csökkentése. Az életben tartásra több lehetőség van: az ingerképzési és vezetési zavarok kivédése defibrillátorral és pacemakerrel, az oxigénnek a szövetekhez eljuttatását javító légzés- és keringéstámogatással (gépi lélegeztetés [IPPB], intraaortikus ballonpumpa [IABP], arteriovenosus membránoxigenátor [AV ECMO], vagy egyéb, a bal kamra működését segítő eszköz [LVAD]), reanimált betegeknél az agyi anyagcsere hipotermiával történő lassítása és az agyszövet reperfúziós károsodása elleni védelem is. A szívizomkárosodás mérséklése, az elzáródott ér áramlásának rekanalizálással történő helyreállítása az utóbbi másfél évtizedben csaknem kizárólag primer perkután koronáriaintervencióval (pPCI) történik, az esetek döntő részében stentbeültetéssel. Fontos a beavatkozás alatt a megfelelő antikoaguláns- és trombocitaaggregáció-gátló-kezelés, ezt az intervenció után is folytatni kell.
Betegek és módszerek
A klinikánkon 2016. január 1. és december 31. között 1435 betegben 543 ST-elevációs (STEMI) és 892 nem ST-elevációs (NSTEMI) miokardiális infarktus miatt végzett pPCI közül 158 betegben (95 férfi és 63 nő, az összes betegek 11,0%-a) volt szükség a légzés/keringés eszközös támogatására, illetve hipotermia alkalmazására (1. és 2. táblázat).


Az adatok az Egyetem Medsol rendszerében és a Nemzeti Szívinfarktus Regiszterben általunk rögzítettek voltak. A kort és a nemet a részletes elemzés során nem vettük figyelembe. Külön tüntettük fel az összes beteg kórelőzményében szereplő jelentős alapbetegségeket (3. táblázat).
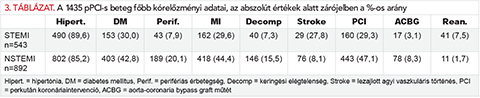
A kórelőzményi adatok mellett vizsgáltuk a panasz kezdetétől az első egészségügyi kontaktusig (EKG-készítés: P-Eü), az intervenciós központba felvételre kerülésig (F–B) és a felvételtől a ballonnyitásig terjedő időszak hosszát (F–B). Elemeztük az intervenció kivitelezésének részleteit. A DC-sokkot és/vagy pacemakerkezelést igénylő malignus ritmuszavarokat külön nem vizsgáltuk. Két esetben került sor akut koszorúérműtétre.
Eredmények
A 2016. 01. 01. – 12. 31. között STEMI miatt végzett 1435 pPCI-s beteg kórelőzményében számos már lezajlott vagy folyamatos kezelést igénylő betegség szerepel (3. táblázat).
Az akut infarktus miatt felvett, légzés- és/vagy keringéstámogatást igénylő betegeinknél számos olyan krónikus vagy akut betegség, illetve állapot volt a 3. táblázatban felsoroltak mellett – a betegek egy részénél kombinációban – amelyek az infarktus miatt kialakult állapotot súlyosbították és a kezelést nehezítették (1. ábra). Az eszközösen támogatott betegeknél a szükséges légzés/keringés támogatás aránya a STEMI csoportban magasabb volt az NSTEMI-hez viszonyítva (2. ábra).


Mivel az NSTEMI-s betegeknél a panaszok kezdete nem volt mindig definiálható, esetleg hosszú időt töltöttek más kórházban a koronáriaintervenció előtt, a panaszok kezdetétől az intervencióig eltelt időt a STEMI-csoportban hasonlítottuk össze (3. táblázat). 543 beteg közül 487-ben (432 eszközösen nem segített és 55 eszközösen segített) betegnél tudtuk az időintervallumok részleteit értékelni (4. táblázat).

Az eszközös támogatást nem igénylő betegeknél a panasz kezdete és az első EKG között eltelt idő átlaga hosszabb volt a súlyos betegekéhez képest, ugyanakkor a panasztól, illetve a kórházi felvételtől a ballonnyitásig eltelt idő rövidebb. Ez utóbbit magyarázza a gépi lélegeztetés, illetve az eszközös keringéstámogatás megkezdésének időigénye.
Az eszközösen támogatott PPCI-s betegek közül 30 napon belül 63 (39,9%), egy éven belül még 38 (24,0%) beteget vesztettünk, 57 (36,1%) beteg volt életben egy éven túl (5. táblázat).

A 6. táblázatban feltüntettük a légzés/keringés segítését nem igénylő betegeink halálozási arányait. Egyéves intervallumban a STEMI és NSTEMI között statisztikailag értékelhető különbség nincs.

Megbeszélés
Miokardiális infarktusban számos prediktív tényező határozza meg az állapot súlyosságát és későbbi kimenetelét, függ az életkortól, a szívizom korábbi állapotától, az elzáródott ér ellátási területétől, a társbetegségektől, a szövődményektől (ingerképzési-vezetési zavarok, keringési elégtelenség, kardiogén sokk következményes szervelégtelenséggel stb.), ezek mellett jelentős mértékben a panasz kezdete és az ér rekanalizációja között eltelt időtől is (1).
A kezelés során elsődleges cél az oxigénnek a szövetekhez eljutása. A légzés és a keringés javítása érdekében szükség esetén eszközös támogatást kell igénybe venni: gépi lélegeztetés, intraaortikus ballonpumpa, extracorporalis membránoxigenátor, esetleg egyéb, a bal kamra működését segítő eszköz (LVAD).
Ha a beteg hipoventilál (centrális vagy perifériás ok miatt a légzés frekvenciája jelentősen megváltozik és/vagy mélysége csökken), vagy légúti akadályozottság (asthma bronchiale, krónikus obstruktív légúti betegség stb.) miatt a gázcsere nem kielégítő, a vér pO2-szint csökkenését a belélegeztetett oxigén nem tudja megakadályozni, intermittáló pozitív túlnyomásos lélegeztetésre van szükség (2, 3).
Ezeknek a betegeknek a gépi lélegeztetése nagy körültekintést igényel. A spontán légzéshez képest megfordul a levegő beáramlási ciklusa. Az intrathoracalis nyomás növekedésekor csökken a vénás beáramlás, csökken a bal kamra telődése, ennek következtében a perctérfogat is. A betegek pulmonalis vaszkuláris rezisztenciája megnőhet, ez szintén csökkenti a bal kamra telődését és a perctérfogatot (4, 5).
A keringés romlása miatt bekövetkező kardiogén sokkban segít a régóta alkalmazott, relatíve egyszerűen behelyezhető intraaortikus ballonpumpa. Ennek az eszköznek a használata emeli a tenziót, javítja a koszorúér-keringést, azonban nem növeli a perctérfogatot, és nem csökkenti a nekrotikus terület nagyságát (6, 7, 8).
Keringési okból kritikus állapotú infarktusos betegeknél jelentős támogatás lehet az extracorporalis membránoxigenátor alkalmazása. Ez a keringéstámogató eszköz arteriovenosus extracorporalis szívmotor, aminek artériás és vénás szára éren keresztül bevezethető, emeli a perctérfogatot, és statisztikailag növeli a túlélés valószínűségét (9, 10).
A bal kamrai eszközök (LVAD) behelyezése bonyolult, és az áruk magas. Bár vannak biztató klinikai vizsgálatok, használatuk jelenleg a gyakorlatban még nem terjedt el.
A hirtelen szívhalál miatt reanimált esetekben régóta végeznek sürgős koronarográfiát, szükség esetén ilyenkor PCI is történik, aminek klinikai eredményeit az agyi anyagcsere lassítása és a reperfúziós károsodás csökkentése miatt végzett mérsékelt hipotermia alkalmazása javítja (11, 12).
AMI-ban a primer perkután koronária-angioplasztika jelenleg csaknem kizárólagosan alkalmazott rekanalizációs eljárás, az intravénás trombolitikus kezelésnél gyorsabban ér el eredményt, az infarktusért felelőssé tehető (culprit) lézióban nem marad vissza reziduális szűkület, és kisebb a szisztémás vérzés veszélye (13, 14, 15).
Betegeink közül az összes, egy év alatt miokardiális infarktussal felvett és pPCI-re került esetek 11%-ában került sor respirátor és/vagy intraaortikus ballonpumpa, 7 esetben ECMO alkalmazására is. A 40, reanimálás után felvett betegnél 13 esetben alkalmaztunk hipotermiát a pPCI-k elvégzésekor.
Az IPPB-, IABP- és hipotermiaarányunk a Nemzeti Szívinfarktus Regiszterben található tárgyévi országos adatoknál kissé magasabb volt. AV ECMO-ra vonatkozó hazai adatokat nem találtunk.
A szívizomsejtek elhalása az infarktusért felelős koszorúér culprit („tettes”) szűkületének elzáródásától számítva időarányosan nő (16, 17), fontos hogy a beteg minél rövidebb idő alatt olyan intézetbe kerüljön, ahol a fent részletezett, a légzést és keringést támogató eljárások lehetősége és alkalmazásukban gyakorlattal rendelkező személyzet rendelkezésre állnak. Ezek a szempontok máig nem vesztették el a jelentőségüket, a legutóbbi ajánlásokban is szerepelnek (18, 19, 20).
Ebben a kérdésben a jelen hazai gyakorlat nem kedvező. Az infarktussal felvett betegek magas komorbiditási aránya mellett egy részük a mellkasi fájdalom kezdetét követően már jelentős késéssel fordul orvoshoz, nem mindig kerül primeren intervenciós központba, és itt a megajánlott intervencióba való beleegyezés előtt néha jelentős késést okozva hezitál. 2016-ban az általunk felvett STEMI-s betegeknél a mellkasi fájdalomtól a reperfúzióig eltelő idő átlagosan több mint 10 óra, a medián érték 5 óra volt. A jelen közleményben analizált 55, eszközösen segített STEMI-s betegünknél ennél is hosszabb átlagos időt találtunk, ami többszöröse a szívizom megtartásának patofiziológiai szempontból kívánatos első két „arany” óránál és a mortalitást csökkentő első 3 óránál, amelyek a betegek későbbi sorsát meghatározzák. A betegek felvételétől a ballonnyitásig eltelő idő megegyezik a hazai és nemzetközi gyakorlattal.
A légzést és keringést támogató eszközök alkalmazása jelentős segítség lehet a túlélésben, de minden alkalommal meg kell vizsgálni a várható komplikáció és nyereség arányát, elsősorban az ECMO alkalmazásának tervezésekor (21).
A légzés/keringés eszközösen segített, magas rizikójú primer PCI-s betegeink közül 30 napon belül az esetek közel 40%-át, egy éven belül további 24,0%-át vesztettük el, a betegek valamivel több, mint egyharmada volt életben egy éven túl. A halál 2 esetben extrakardiális ok (malignus tumor) miatt következett be.
30 napos túlélési adataink egyeznek az irodalomban találhatóakkal (22), vegyes (STEMI-NSTEMI) anyagunkkal összevethető, egyéves túlélésre vonatkozó adatot nem találtunk.
A fent részletezett súlyosságú betegekben történő pPCI magas rizikójú, az egy éven túl életben levő betegek arányát figyelembe véve a rendelkezésre álló eszközökkel mégis meg kell kísérelni a rekanalizációt.
Az elmúlt években több kockázati pontszámot (risc score) dolgoztak ki koronáriabetegek, ezen belül akut koronáriaszindrómások kezelésére vonatkozóan (ismertebbek: GRACE, PURSUIT, TIMI, EMMACE, C-ACS, ProACS, DAPT). Ezek számszerű eredményei valószínűsítik az adott betegnél végzendő beavatkozás rizikóját, de nem adnak olyan konkrét információkat, amikkel egy adott akut miokardiális infarktusos beteg felvételekor eldönthető lenne a későbbi kimenetel.
Nyilatkozat
A szerzők kijelentik, hogy az eredeti közlemény megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amelyek befolyásolhatják a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
References
1. Acharya B. Predictors of outcomes in myocardial infarction and cardiogenic shock Cardiology in Review 2018; 26: 255–266. https://doi.org/10.1097/CRD.0000000000000190
2. Bach JR. Mechanical insufflation/exsufflation: has it come of age? A commentary. Eur Respir J 2003; 21: 385–386. https://doi.org/10.1183/09031936.03.00098702
3. Winck JC, Goncalves MR, Lourenco C, et al. Effects of mechanical insufflation-exsufflation on respiratory parameters for patients with chronic airway secretion encumbrance. Chest 2004; 126: 774–780. https://doi.org/10.1378/chest.126.3.774
4. Fessler HE. Heart-Lung interaction: applications in the critically ill. Eur Resp J 1997; 10: 226–237. https://doi.org/10.1183/09031936.97.10010226
5. Hurford WE. Cardiopulmonary interactions during mechanical ventilation. Int Anesthesiol Clin 1999; 37: 35–46.
6. Sjauw KD, Engstrom AE, Vis MM, et al. A systematic review and metaanalysis of intra-aortic balloon pump therapy in ST-elevation myocardial infarction: should we change the guidelines? Eur Heart J 2009; 30: 459–468. https://doi.org/10.1093/eurheartj/ehn602. Epub 2009 Jan 23.
7. Patel MR, Smalling RW, Thiele H, et al. Intra-aortic balloon counter pulsation and infarct size in patients with acute anterior myocardial infarction without shock: the CRISP AMI randomized trial. JAMA 2011; 306: 1329–1337. https://doi.org/10.1001/jama.2011.1280
8. Thiele H, Zeymer U, Neumann FJ, et al. IABP- SHOCK II Trial Investigators. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367: 1287–1296. https://doi.org/10.1056/NEJMoa1208410
9. Esper AS, Bermudez C, Dueweke EJ, et al. Extracorporeal membrane oxygenation support in acute coronary syndromes complicated by cardiogenic shock. Cath Cardiovasc Intervent 2015; 86(S1): S34–S54. https://doi.org/10.1002/ccd.25871. Epub 2015 Feb 25.
10. Pabst D, Foy A, Peterson B, et al. Predicting survival in patients treated with extracorporeal membrane oxygenation after myocardial infarction. Critical Care Medicine 2018; 46. e359–e363. https://doi.org/10.1097/CCM.0000000000002995.
11. Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut JF, et al. Immediate coronary angiography in survivors of out-of hospital cardiac arrest. N Engl J Med 1997; 336: 1629–633. https://doi.org/10.1056/NEJM199706053362302
12. Crisholm GE, Greais A, Thim T, et al. Safety of therapeutic hypothermia combined with primary percutaneous coronary intervention after out-of-hospital cardiac arrest. Eur Heart J Acute Cardiovasc Care 2015; 4: 60–63. https://doi.org/10.1177/2048872614540093
13. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361: 13–20. https://doi.org/10.1016/S0140-6736(03)12113-7
14. Boersma E. Primary coronary angioplasty vs. thrombolysis Group. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J 2006; 27: 779–788. https://doi.org/10.1093/eurheartj/ehi810
15. Jánosi A, Ofner P, Merkely B, et al. Szívinfarctus miatt kezelt betegek korai és késői prognózisa. Orv Hetil 2013; 154: 1297–1302. https://doi.org/10.1556/OH.2013.29679
16. Boersma E, Maas ACP, Deckers JW, et al. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996; 348: 771–775. https://doi.org/10.1016/S0140-6736(96)02514-7
17. Gersh BJ, Antman EM. Selection of the optimal reperfusion strategy for STEMI: does time matter? Eur Heart J 2006; 27: 761–763. https://doi.org/10.1093/eurheartj/ehi775
18. The Task Force of the European Society of Cardiology (ESC) 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39: 119–177. https://doi.org/10.1093/eurheartj/ehx393.
19. 2017 AHA/ACC Clinical Performance and Quality Measures for Adults With ST-Elevation and Non–ST-Elevation Myocardial Infarction A Report of the American College of Cardiology/American Heart Association Task Force on Performance Measures JACC 2017; 70: 2048–2090. https://doi.org/10.1016/j.jacc.2017.06.032.
20. Becker D, Merkely B. Akut coronaria szindróma ellátása – 2016. Orv Hetil 2016; 157: 1500–1506. https://doi.org/10.1556/650.2016.30574
21. Cheng R, Hachamovitch R, Kittleson M, et al Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. Ann Thorac Surg 2014; 97: 610–616. https://doi.org/10.1016/j.athoracsur.2013.09.008.
22. Parhar K, Millar V, Zochios V, et al. Clinical outcomes of patients undergoing primary percutaneous coronary intervention for acute myocardial infarction requiring the intensive care unit. J Intensive Care 2018; 6: 5. https://doi.org/10.1186/s40560-018-0275-y.
Treating the “Untreatable”. Recent advances in chronic thromboembolic pulmonary hypertension
█ Review
DOI: 10.26430/CHUNGARICA.2020.50.2.100
Authors:
Inbal Shafran1 and Irene Lang2
1The Pulmonary institute, Chaim Sheba Medical Center, Tel-Hashomer, Israel and the
2Department of Internal Medicine II, Division of Cardiology, Medical University of Vienna, Vienna, Austria
Correspondence: Irene Lang, Medical University of Vienna, Internal Medicine II, Division of Cardiology, Währinger Gürtel 18–20, 1090 Vienna, Austria
E-mail: irene.lang@meduniwien.ac.at
Take-home message:
Main treatment for CTEPH is Pulmonary Endarterectomy, a complex surgical procedure, that is performed in roughly half of all CTEPH patients. Refinements of Medical Treatments and Balloon Pulmonary Angioplasty have emerged as effective treatment strategies for the remaining patients who had no options in the past.
Summary
Chronic thromboembolic pulmonary hypertension (CTEPH) is thought to result from incomplete resolution of pulmonary thromboemboli that undergo organisation into fibrous tissue within pulmonary arterial branches, filling pulmonary arterial lumina with collagenous obstructions. The treatment of choice is pulmonary endarterectomy (PEA) with low post-operative mortality and good long-term survival in expert hands. Patients ineligible for PEA or who have recurrent or persistent pulmonary hypertension after surgery have been previously the “Untreatable”. Modern CTEPH management has now a solution for those previous no-option patients: balloon pulmonary angioplasty (BPA), and targeted medical therapies. Riociguat has been approved for inoperable CTEPH, and persistent-recurrent PH after PEA, and SC Treprostinil has been efficacious in a randomized controlled trial of very severe CTEPH. Observational studies report that BPA improves haemodynamic, symptoms and functional capacity in patients with CTEPH, but controlled trials with long-term follow-up are needed. Complications include haemoptysis, wire injury, vessel dissection, vessel rupture, reperfusion pulmonary oedema, pulmonary parenchymal bleeding and haemorrhagic pleural effusions. This review summarises available evidence for PEA, BPA, and medical therapy, patient selection, peri-procedural imaging and technical refinements achieved by CTEPH teams, and discusses future management of CTEPH.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Introduction
Chronic thromboembolic pulmonary hypertension (CTEPH) is a rare disease of the pulmonary vasculature which is classified as a distinct entity (Group 4) of pulmonary hypertension (PH) (1). CTEPH is believed to develop when a pulmonary embolism does not resolve and transforms into fibrous tissue that occludes major pulmonary arteries. A concomitant small-vessel arteriopathy plays an important role in the development of persistent PH after surgical pulmonary endarterectomy (PEA) and survival.
Early diagnosis and treatment by a multidisciplinary team are essential. Screening is based on ventilation/perfusion lung scanning, and diagnosis is made by imaging typical CTEPH lesions with angiography, best by invasive digital subtraction angiography or direct injection. Computed tomography is emerging to provide similar quality images as invasive angiography in the future, including parenchymal lung images as well as images of the heart and the great vessels for differential diagnoses. The CTEPH team should then address the question whether the gold-standard treatment PEA as a potentially curative intervention is feasible with an in-hospital mortality rate <5%. About 40-50% of patients with CTEPH is no surgical candidates or cannot undergo surgery at an acceptably low in-hospital mortality rate, and 17–31% of patients after PEA experience persistent/recurrent PH. Modern CTEPH management has now a solution for those previous no-option patients: balloon pulmonary angioplasty can be performed, and targeted medical therapies can be given.
Pulmonary Endarterectomy – An old technique newly stimulated
PEA remains the gold standard treatment with the option of potential cure with mortality rates as low as 2% in specialised centers (Table 1) (1, 2). Elligibility for PEA should be determined by a CTEPH team consisting of surgeons, PH specialists, radiologists and interventionists. Tradionally, PEA was limited to patients with proximal disease and localisation of most proximal clot has been the main determinant of PEA eligibility (2, 3). Experienced centers have advanced their skills to allow surgical treatment for patients with more distal disease (4). Moreover, there is a growing understanding that PEA may lead to RV afterload reduction even in patients with high PVR and distal disease, in combination with other treatments (2).
Peri-procedural complications include stroke, bleeding, arrhythmia, pericardial and pleural effusions and post-operative reperfusion pulmonary edema (5). Reperfusion edema occurs in 5–20% of patients, especially in patients with high pre-operative pulmonary pressure (2, 6, 7). When supportive treatment with mechanical ventilation, diuresis and drugs approved for PAH are not enough, ECMO may be indicated (2, 8, 9). ECMO both intra and post-operative has become standard of care in centers performing high-risk PEA (2, 8, 9).
Pre- and post-operative PVR, pulmonary vasoreactivity, as well as age, comorbidities and functional status are factors assisting in the prediction of post-operative outcomes (10, 11, 12).
Persistent/recurrent PH after PEA is a major determinant of poor prognosis and functional capacity for CTEPH patients undergoing PEA (7, 13). According to the European registry, 16.7% of patients are diagnosed with persistent/recurrent PH after PEA (14). The ability to predict which patients are prone to develop such condition is of major practical importance. A concomitant secondary microvasculopathy in addition to major pulmonary artery obstruction has been suggested as one of the mechanisms leading to persistent/recurrent PH after PEA (2). Recently Gerges et al. have confirmed the role of preoperative pulmonary artery pressure waveform analysis to predict secondary microvasculopathy and outcomes prior to PEA (15).
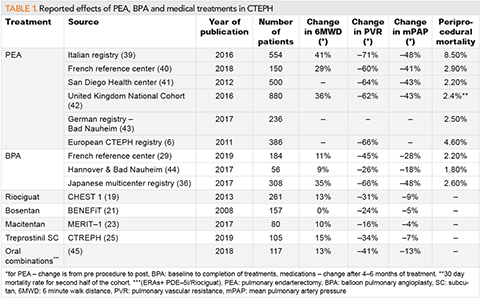
Advances in Medical Treatments for CTEPH
The initial step in the management of CTEPH is appropriate anticoagulation. Current guidelines suggest that effective anticoagulation over at least 3 months should precede a CTEPH diagnosis. 3 months is the minimal guideline-recommended treatment duration for acute pulmonary embolism. Furthermore, guidelines advise to continue lifelong anticoagulation to prevent recurrent thrombosis. While there are no large randomized trials regarding the preferable type of anticoagulation for CTEPH patients, recent registries point to beneficial effects of Vitamin K antagonists as compared with DOACs (16), despite greater safety of direct oral anticoagulants (DOACs) (17). Post-PEA functional and hemodynamic outcomes appeared unaffected by anticoagulant choice. Bleeding events were similar, but recurrent VTE rates were higher in patients receiving DOACs (16).
Medical treatment for CTEPH patients is required in many patients, particularly in those who are no candidates for PEA because of distal location of vascular disease, or because they carry an unfavorable risk-benefit ratio for major surgery. Furthermore, medical treatments are considered for patients with severe hemodynamic compromise prior to PEA or balloon pulmonary angioplasty (BPA), and after mechanical interventions in those with persistent/recurrent PH (18).
Riociguat was the first drug with clinical effectiveness to be approved for the treatment of inoperable CTEPH, or persistent/recurrent PH after PEA (19, 20). The drug is a stimulator of soluble guanylate cyclase (sGC) with both a direct effect and an indirect effect by sensitizing GC receptors to endogenous nitric oxide (NO). Improved exercise capacity (EC) and PVR were shown in the CHEST-1 and CHEST-2 trials (19).
The BENEFiT trial, (Bosentan Effects in iNopErable Forms of chronic Thromboembolic pulmonary hypertension), a randomized, placebo-controlled trial with the Endothelin receptor antagonists (ERA) Bosentan did not meet the primary combined endpoint of 6MWD and decrease in PVR (21). Positive results where demonstrated for the use of bosentan as bridging therapy before PEA (22). The MERIT-1 trial, examining the effect of macitentan in inoperable CTEPH showed improved PVR and 6MWD, however no change in WHO-FC (23). Actelion-Janssen has withdrawn their application for approval of macitentan for the treatment of CTEPH.
A significant advancement in medical treatment of CTEPH was made in the CTREPH trial, examining the effect and the safety of subcutaneous (SC) treprostinil for severe CTEPH (18, 24). Treprostinil treatment was evaluated for both inoperable CTEPH and persistent/recurrent PH after PEA. To ensure blinding of the study a high dose of the drug (uptitrated to 30 ng/kg/min) was compared with a low dose peaking at 5 ng/kg/min. About 30% of patients were treated concomitantly with other PH related oral medications, such as riociguat, ERAs and PDE5 inhibitors. The study demonstrated significant changes in 6MWD, hemodynamics and most significantly, WHO-FC (18, 25). SC treprostinil, although not officially approved for the treatment of CTEPH, is used for patients who require medical treatment and can either not tolerate riociguat or are high-risk patients, defined by a low 6MWD and unfavorable hemodynamic criteria such as a PVR >800 and dynes.s.cm–5 and mPAP ≥40 mmHg (18).
Balloon pulmonary angioplasty – a new technique changing CTEPH
BPA treatment, first introduced in 2001 (26), is a percutaneous balloon intervention breaking intraluminal webs and bands without dissecting medial vessel layers. The procedure has been improved and refined over the years with better results and safety profiles, using a sequential approach with 4-7 sessions (27, 28). Mainly developed in Japan, the procedure is now introduced and offered to European centers with favourable results (2, 29, 30, 31, 32). Current guidelines recommend BPA for patients with either inoperable disease or those with unfavourable risk-benefit ratio for PEA (1). However, more and more centers are now offering this option to patients with persistent or recurrent PH after PEA surgery and in specific cases as combined treatments, prior to, during or after PEA (33, 34).
In Japan BPA is preferred over PEA surgery. More and more data are collected regarding safety and effectiveness (30), for example in the Euroeopan BPA Registry (NCT03245268). In a recent Japanese study, BPA alone or in combination with PEA has been shown to improve prognosis when compared to patients treated with PEA alone or medical treatment alone (30). Survival of inoperable patients diagnosed in the BPA era is better than previous (35).
BPA protocols vary from one center to the other, but repeat sessions are required. The main imaging assessment used to assess the patients is pulmonary angiography, however CT scans, with 3D reconstructions and OCTs have provided important anatomic insights (2, 28). Routine use of OCT or IVUS during BPA has not been recommended.
According to a recent Japanese registry mPAP is reduced by about 20 mmHg to levels below 25 mmHg, with significant reduction in the need for other PH related medications and supplemental oxygen (36). The French BPA experience has documented improved hemodynamics as well as improved 6MWD and NYHA functional class after 5.2 ± 2.4 BPA sessions. mPAP has decreased by 26% and PVR by 43% when compared to baseline values 29. BPA has also been shown to improve comorbidities such as metabolic function and renal function in parallel to improvement in pulmonary hemodynamics (37).
Complication rates have been drastically reduced in recent years with the use of balloons that have a smaller diameter than the lumen of the target vessel, tapered balloons, soft wires, and a stepwise approach (2). Complications, including bleeding, wire-induced pulmonary artery perforation and reperfusion edema occur in up to 10% of sessions however 30-day mortality is as low as 1-2% (2, 36, 28, 38, 29).
Future perspectives for CTEPH management
Despite all advances, there are still several challenges in CTEPH management that have to be faced. First, diagnosis remains hard and best accomplished if one thinks about CTEPH in the setting of major acute pulmonary embolism. Machine learning algorithms are being developed to identify CTEPH cases as they present under the clinical picture of acute PE in emergency rooms. Once diagnosed, the next step is the CTEPH team decision. Multidisciplinary teams face challenges which are case-loads, logistics, and cost. Patient management is shifting from the simple question of PEA or no PEA to multimodality treatment choices (Figure 1). Patients who were labelled inoperable may be found operable upon a second assessment (5). Patients who are inoperable or have persistent / recurrent PH post-surgery may benefit from a multitude of interventions including BPA, oral medical treatment in different combinations and SC Treprostinil in severe cases (18). Treatment is increasingly individualised according to anatomical disease location, response to different treatments, personal preferences and treatment availabilities.
Refined BPA is a safe and effective treatment option for patients with distal disease, patients with comorbidities, as well as patients with recurrent/persistent PH after surgery (14, 33, 34). Randomized studies will have to compare the role of BPA with PEA in suitable patients.
Conflicts of Interest
IML has relationships with drug companies including AOPOrphan Pharmaceuticals AG, Actelion-Janssen, MSD, Medtronic, and Ferrer. In addition to being investigator in trials involving these companies, relationships include consultancy service, research grants, and membership of scientific advisory boards. Table 1 – Reported effects of PEA, BPA and medical treatments in CTEPH.
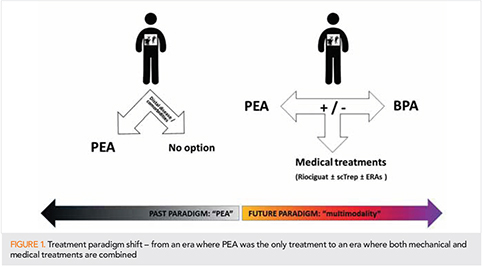
References
1. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). The European respiratory journal 2015; 46(4): 903–75. https://doi.org/10.1183/13993003.01032–2015
2. Wilkens H, Konstantinides S, Lang IM, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): Updated Recommendations from the Cologne Consensus Conference 2018. Int J Cardiol 2018; 272S: 69–78. https://doi.org/10.1016/j.ijcard.2018.08.079 [published Online First: 2018/09/10]
3. Siennicka A, Darocha S, Banaszkiewicz M, et al. Treatment of chronic thromboembolic pulmonary hypertension in a multidisciplinary team. Ther Adv Respir Dis 2019; 13: 1753466619891529. https://doi.org/10.1177/1753466619891529 [published Online First: 2019/12/28]
4. D’Armini AM, Morsolini M, Mattiucci G, et al. Pulmonary endarterectomy for distal chronic thromboembolic pulmonary hypertension. The Journal of thoracic and cardiovascular surgery 2014; 148(3): 1005–11; 12 e1–2; discussion 11–2. https://doi.org/10.1016/j.jtcvs.2014.06.052 [published Online First: 2014/08/19]
5. Ranka S, Mohananey D, Agarwal N, et al. Chronic Thromboembolic Pulmonary Hypertension-Management Strategies and Outcomes. J Cardiothorac Vasc Anesth 2019 https://doi.org/10.1053/j.jvca.2019.11.019 [published Online First: 2019/12/31]
6. Mayer E, Jenkins D, Lindner J, et al. Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry. The Journal of thoracic and cardiovascular surgery 2011; 141(3): 702–10. https://doi.org/10.1016/j.jtcvs.2010.11.024
7. Freed DH, Thomson BM, Berman M, et al. Survival after pulmonary thromboendarterectomy: effect of residual pulmonary hypertension. The Journal of thoracic and cardiovascular surgery 2011; 141(2): 383–7. https://doi.org/10.1016/j.jtcvs.2009.12.056 [published Online First: 2010/05/18]
8. Kelava M, Koprivanac M, Smedira N, et al. Extracorporeal Membrane Oxygenation in Pulmonary Endarterectomy Patients. J Cardiothorac Vasc Anesth 2019; 33(1): 60–69. https://doi.org/10.1053/j.jvca.2018.06.025 [published Online First: 2018/08/27]
9. Martin-Suarez S, Gliozzi G, Fiorentino M, et al. Role and management of extracorporeal life support after surgery of chronic thromboembolic pulmonary hypertension. Ann Cardiothorac Surg 2019; 8(1): 84–92. https://doi.org/10.21037/acs.2019.01.02 [published Online First: 2019/03/12]
10. Bonderman D, Skoro-Sajer N, Jakowitsch J, et al. Predictors of outcome in chronic thromboembolic pulmonary hypertension. Circulation 2007; 115(16): 2153–8. https://doi.org/10.1161/CIRCULATIONAHA.106.661041 [published Online First: 2007/04/11]
11. Dartevelle P, Fadel E, Mussot S, et al. Chronic thromboembolic pulmonary hypertension. The European respiratory journal 2004; 23(4): 637–48. [published Online First: 2004/04/16]
12. Skoro-Sajer N, Hack N, Sadushi-Kolici R, et al. Pulmonary vascular reactivity and prognosis in patients with chronic thromboembolic pulmonary hypertension: a pilot study. Circulation 2009; 119(2): 298–305. https://doi.org/10.1161/CIRCULATIONAHA.108.794610 [published Online First: 2009/01/02]
13. Sakurai Y, Takami Y, Amano K, et al. Predictors of Outcomes After Surgery for Chronic Thromboembolic Pulmonary Hypertension. Ann Thorac Surg 2019; 108(4): 1154–61. https://doi.org/10.1016/j.athoracsur.2019.03.100 [published Online First: 2019/05/11]
14. Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation 2011; 124(18): 1973–81. https://doi.org/10.1161/CIRCULATIONAHA.110.015008 [published Online First: 2011/10/05]
15. Gerges C, Gerges M, Friewald R, et al. Microvascular Disease in Chronic Thromboembolic Pulmonary Hypertension: Hemodynamic Phenotyping and Histomorphometric Assessment. Circulation 2020 https://doi.org/10.1161/CIRCULATIONAHA.119.041515 [published Online First: 2020/01/04]
16. Bunclark K, Newnham M, Chiu YD, et al. A multicenter study of anticoagulation in operable chronic thromboembolic pulmonary hypertension. J Thromb Haemost 2020; 18(1): 114–22. https://doi.org/10.1111/jth.14649 [published Online First: 2019/09/27]
17. Gavilanes-Oleas FA, Alves JL, Jr., Fernandes CJC, et al. Use of direct oral anticoagulants for chronic thromboembolic pulmonary hypertension. Clinics (Sao Paulo) 2018; 73: e216. https://doi.org/10.6061/clinics/2018/e216 [published Online First: 2018/05/24]
18. Sadushi-Kolici R, Lang IM. Treprostinil for the treatment of chronic thromboembolic pulmonary hypertension. Expert Rev Respir Med 2019: 1–7. https://doi.org/10.1080/17476348.2019.1652094 [published Online First: 2019/09/24]
19. Ghofrani HA, D’Armini AM, Grimminger F, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. The New England journal of medicine 2013; 369(4): 319–29. https://doi.org/10.1056/NEJMoa1209657
20. Pepke-Zaba J, Jansa P, Kim NH, et al. Chronic thromboembolic pulmonary hypertension: role of medical therapy. The European respiratory journal 2013; 41(4): 985–90. https://doi.org/10.1183/09031936.00201612 [published Online First: 2013/02/12]
21. Jais X, D’Armini AM, Jansa P, et al. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension: BENEFiT (Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension), a randomized, placebo-controlled trial. Journal of the American College of Cardiology 2008; 52(25): 2127–34. https://doi.org/10.1016/j.jacc.2008.08.059
22. Reesink HJ, Surie S, Kloek JJ, et al. Bosentan as a bridge to pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension. The Journal of thoracic and cardiovascular surgery 2010; 139(1): 85–91. https://doi.org/10.1016/j.jtcvs.2009.03.053 [published Online First: 2009/08/08]
23. Ghofrani HA, Simonneau G, D’Armini AM, et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study. Lancet Respir Med 2017; 5(10): 785–94. https://doi.org/10.1016/S2213-2600(17)30305-3 [published Online First: 2017/09/19]
24. Sadushi-Kolici R JP, Kopec G, Torbicki A, Campean IA, Hoeffken G, Skoro-Sajer N, Simkova I, Karlocai K, Steringer-Mascherbauer R, Samarzija M, Salobir B, Klepetko W, Lindner J, Lang IM. Subcutaneous treprostinil for the treatment of non-operable chronic thromboembolic pulmonary hypertension: a randomized, controlled trial (CTREPH). ESC 2017. 2017
25. Sadushi-Kolici R, Jansa P, Kopec G, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial. Lancet Respir Med 2018 https://doi.org/10.1016/S2213-2600(18)30367-9 [published Online First: 2018/11/28]
26. Feinstein JA, Goldhaber SZ, Lock JE, et al. Balloon pulmonary angioplasty for treatment of chronic thromboembolic pulmonary hypertension. Circulation 2001; 103(1): 10–3. [published Online First: 2001/01/04]
27. Mizoguchi H, Ogawa A, Munemasa M, et al. Refined balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv 2012; 5(6): 748–55. https://doi.org/10.1161/CIRCINTERVENTIONS.112.971077 [published Online First: 2012/11/30]
28. Aoki T, Sugimura K, Tatebe S, et al. Comprehensive evaluation of the effectiveness and safety of balloon pulmonary angioplasty for inoperable chronic thrombo-embolic pulmonary hypertension: long-term effects and procedure-related complications. Eur Heart J 2017; 38(42): 3152–59. https://doi.org/10.1093/eurheartj/ehx530 [published Online First: 2017/10/14]
29. Brenot P, Jais X, Taniguchi Y, et al. French experience of balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension. The European respiratory journal 2019; 53(5) https://doi.org/10.1183/13993003.02095-2018 [published Online First: 2019/04/27]
30. Kozu K, Sugimura K, Ito M, et al. Current status of long-term prognosis among all subtypes of pulmonary hypertension in Japan. Int J Cardiol 2020; 300: 228–35. https://doi.org/10.1016/j.ijcard.2019.11.139 [published Online First: 2019/12/10]
31. Kramm T, Wilkens H, Fuge J, et al. Incidence and characteristics of chronic thromboembolic pulmonary hypertension in Germany. Clin Res Cardiol 2018; 107(7): 548–53. https://doi.org/10.1007/s00392-018-1215-5 [published Online First: 2018/02/17]
32. van Thor MCJ, Lely RJ, Braams NJ, et al. Safety and efficacy of balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension in the Netherlands. Neth Heart J 2019 https://doi.org/10.1007/s12471-019-01352-6 [published Online First: 2019/11/30]
33. Wiedenroth CB, Liebetrau C, Breithecker A, et al. Combined pulmonary endarterectomy and balloon pulmonary angioplasty in patients with chronic thromboembolic pulmonary hypertension. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation 2016; 35(5): 591–6. https://doi.org/10.1016/j.healun.2015.10.030 [published Online First: 2015/11/28]
34. Araszkiewicz A, Darocha S, Pietrasik A, et al. Balloon pulmonary angioplasty for the treatment of residual or recurrent pulmonary hypertension after pulmonary endarterectomy. Int J Cardiol 2019; 278: 232–37. https://doi.org/10.1016/j.ijcard.2018.10.066 [published Online First: 2018/11/10]
35. Taniguchi Y, Jais X, Jevnikar M, et al. Predictors of survival in patients with not-operated chronic thromboembolic pulmonary hypertension. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation 2019; 38(8): 833–42. https://doi.org/10.1016/j.healun.2019.04.006 [published Online First: 2019/05/20]
36. Ogawa A, Satoh T, Fukuda T, et al. Balloon Pulmonary Angioplasty for Chronic Thromboembolic Pulmonary Hypertension: Results of a Multicenter Registry. Circ Cardiovasc Qual Outcomes 2017; 10(11) https://doi.org/10.1161/CIRCOUTCOMES.117.004029 [published Online First: 2017/11/05]
37. Tatebe S, Sugimura K, Aoki T, et al. Multiple Beneficial Effects of Balloon Pulmonary Angioplasty in Patients With Chronic Thromboembolic Pulmonary Hypertension. Circ J 2016; 80(4): 980–8. https://doi.org/10.1253/circj.CJ-15-1212 [published Online First: 2016/02/26]
38. Jin Q, Luo Q, Yang T, et al. Improved hemodynamics and cardiopulmonary function in patients with inoperable chronic thromboembolic pulmonary hypertension after balloon pulmonary angioplasty. Respir Res 2019; 20(1): 250. https://doi.org/10.1186/s12931-019-1211-y [published Online First: 2019/11/11]
39. D’Armini AM, Morsolini M, Mattiucci G, et al. Chronic thromboembolic pulmonary hypertension: From transplantation to distal pulmonary endarterectomy. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation 2016; 35(6): 827–31. https://doi.org/10.1016/j.healun.2015.12.029 [published Online First: 2016/02/10]
40. Tromeur C, Jais X, Mercier O, et al. Factors predicting outcome after pulmonary endarterectomy. PLoS One 2018; 13(6): e0198198. https://doi.org/10.1371/journal.pone.0198198 [published Online First: 2018/06/22]
41. Madani MM, Auger WR, Pretorius V, et al. Pulmonary endarterectomy: recent changes in a single institution’s experience of more than 2,700 patients. Ann Thorac Surg 2012; 94(1): 97–103; discussion 03. https://doi.org/10.1016/j.athoracsur.2012.04.004 [published Online First: 2012/05/26]
42. Cannon JE, Su L, Kiely DG, et al. Dynamic Risk Stratification of Patient Long-Term Outcome After Pulmonary Endarterectomy: Results From the United Kingdom National Cohort. Circulation 2016; 133(18): 1761–71. https://doi.org/10.1161/CIRCULATIONAHA.115.019470 [published Online First: 2016/04/08]
43. Lankeit M, Krieg V, Hobohm L, et al. Pulmonary endarterectomy in chronic thromboembolic pulmonary hypertension. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation 2017 https://doi.org/10.1016/j.healun.2017.06.011 [published Online First: 2017/07/29]
44. Olsson KM, Wiedenroth CB, Kamp JC, et al. Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension: the initial German experience. The European respiratory journal 2017; 49(6) https://doi.org/10.1183/13993003.02409-2016 [published Online First: 2017/06/10]
45. Gabrielly M, Bourlier D, Taniguchi Y, et al. Initial dual oral combination therapy in inoperable chronic thromboembolic pulmonary hypertension (CTEPH). European Respiratory Journal 2018; 52(suppl 62): PA3053. https://doi.org/10.1183/13993003.congress-2018.PA3053 %J
The year in cardiology: heart failure
█ Current opinion
Authors:
John G. F. Cleland1, 2, 3, Alexander R. Lyon2, 4,Theresa McDonagh5, 6, and John J. V. McMurray3
1Robertson Centre for Biostatistics and Clinical Trials, University of Glasgow, Glasgow G12 8QQ, UK;
2National Heart & Lung Institute, Imperial College, London, UK;
3British Heart Foundation Cardiovascular Research Centre, University of Glasgow, Glasgow G12 8QQ, UK;
4Royal Brompton Hospital, London, UK;
5King’s College Hospital, London, UK; and
6King’s College London, London, UK
Preamble
The past year has brought many new concepts and an abundance of new data on the nature, management, and outcome of heart failure. The pace of change is accelerating. We look forward to an exciting new decade of research. The prognosis of cardiovascular disease is determined to a large extent by the ability to delay or prevent the development and progression of heart failure (1). Accordingly, attention is shifting to earlier diagnosis of and intervention for heart failure. Patients with type-2 diabetes mellitus (T2DM) (2) or coronary artery disease (CAD) (3) have a relatively good prognosis unless plasma concentrations of natriuretic peptides are increased, indicating important cardiac or renal dysfunction. Adoption of a simple ‘Universal Definition’ of heart failure based on natriuretic peptides would facilitate early diagnosis and treatment but lead to an enormous increase in its prevalence and demand upon medical services (4). We need to prepare for the impending shock.
ISSUE: CARDIOLOGIA HUNGARICA | 2020 | VOLUME 50, ISSUE 2
Epidemiology and prevention
In cardiology, the term prevention is often used to mean delaying the onset of disease; in other words, procrastination. Failure to appreciate the difference between prevention and procrastination leads to problems in projecting future healthcare needs and costs. Older people have more co-morbid conditions that complicate management but may also offer more opportunities for intervention; consequently, more time and resources are required to manage older patients well.
A detailed report on heart failure in the UK shows that the median age of onset has risen to about 80 years, consistent with improvements in the treatment of hypertension and other risk factors for atherosclerosis and better management of myocardial infarction (5). Unfortunately, data on left ventricular ejection fraction (LVEF) were not available for this report. Analyses of the diagnostic pathway in primary care in the UK suggest that key investigations are often not done (6–8). Similar data from other countries are urgently required. Several large epidemiological surveys (9, 10) and analyses of large trials (11, 12) have recently been published that allow the demographics, aetiology, and management of heart failure to be compared internationally.
Mineralocorticoid receptor antagonists (MRAs) are effective anti-hypertensive agents that also improve the prognosis of patients with heart failure and a reduced (HFrEF) and possibly preserved (HFpEF) LVEF (13). Whether MRAs have specific effects on reducing other potential drivers of the progression to heart failure such as inflammation and fibrosis is currently under investigation (14, 15).
Genetic propensity to greater body fat was associated with the risk of developing heart failure in an analysis on 367,703 UK Biobank participants (16). However, the incidence of heart failure was only 1% (4,803 patients), the diagnostic criteria were not robust, and the increase in risk was modest (odds ratio 1.22; 95% CI: 1.06–1.41). Further analyses on this population showed a strong relationship between cardio-respiratory fitness and grip strength and future incidence of heart failure (17). A study of 4,403 people considered for bariatric surgery in Sweden and followed for 22 years, found that 188 (9%) of the 2003 who had surgery (25–35 kg weight loss; BMI 1 year after surgery 32 kg/m2) developed heart failure compared with 266 (13%) of 2030 who did not (BMI after 1 year observation 40 kg/m2) (18). Although these data suggest links between obesity and the risk of developing heart failure, it is possible that obesity just provokes similar symptoms. Once heart failure has developed, obesity is associated with a lower mortality, but this may also reflect earlier diagnosis rather than a protective effect (19). Randomized controlled trials (RCTs) of effective interventions for obesity are required to demonstrate whether weight loss improves symptoms (likely) and clinical outcomes (less certain).
A report from ‘the Atherosclerosis Risk in Communities’ (ARIC) study confirmed the association between influenza epidemics and hospitalizations for heart failure, reinforcing guideline-recommendations for vaccination (20) an RCT is underway (21). Extended follow-up (median 18.9 years) of the Women’s Health Initiative Hormone Therapy trials, which randomized 27,347 women to various hormone replacement regimens, showed that they had no effect on the incidence of HFrEF or pEF (22).
The ISCHEMIA trial (presented at the American Heart Association 2019) compared strategies of early coronary revascularization, predominantly percutaneous, with conservative management for stable CAD, some of whom had mild symptoms of heart failure and/or a reduced LVEF. Revascularization did not reduce the risk of myocardial infarction or death but increased the risk of stroke almost four-fold and did not reduce new-onset heart failure over the following 4 years.
Diagnosis
The Heart Failure Association of the European Society of Cardiology has proposed a new scoring system for the diagnosis of HFpEF (23). Its practical utility awaits confirmation (24). Simpler approaches may be preferred (4).
Congestion
Congestion lies at the heart of failure (25–27). Imaging has long been used to identify dilation of the atria and venous system, which might be termed haemodynamic congestion, for which natriuretic peptides are a useful biomarker (25). More recently imaging has been used to identify accumulation of fluid in tissues (tissue congestion) (25, 28–32), which may be associated with increases in the biomarker, (bio)-adrenomedullin (33). Imaging and biomarkers in combination are both sensitive and specific for detecting a failing heart, a useful guide to the severity of congestion and prognosis and a potential therapeutic target indicating successful management. Imaging remains the preferred method for identifying the cause of heart failure. If congestion is central to the management of heart failure, then better monitoring (34) and more effective (diuretic) interventions (perhaps acetazolamide?) (35) should improve outcome (Take home figure).
Age and prognosis
Analysis of a large primary care database suggested that the cardiovascular (CV) prognosis of new-onset heart failure improved substantially between 2002 and 2014 [hazard ratio (HR): 0.73; 95% CI: 0.68–0.80] for patients above and below the age of 80 years (5). However, in those aged >80 years, the fall in CV mortality was entirely offset by non-CV mortality. In other words, treatment changed the way that elderly patients died but not overall mortality (Figure 1). Unfortunately, information on LVEF was not available; many patients will have had HFpEF and, therefore, caution should be exercised in attributing the reduction in CV mortality to treatment of heart failure. A systematic review of survey and registry data also suggested that the prognosis of heart failure had improved; important determinants of outcome were age and cardiology input to management (36). Frailty, which might be considered a biological rather than chronological measure of age, may be an even more powerful predictor of disability and death (37).
Guideline-recommendations for the treatment of HFrEF do not discriminate by age. The Swedish Heart Failure Registry found that prescription of ACE inhibitors or beta-blockers to patients with HFrEF aged >80 years was associated with a lower mortality (38, 39). However, observational associations have many explanations other than a therapeutic effect (40). An individual patient-data meta-analysis of three RCTs of MRA (RALES, EMPHASIS, and TOPCAT-Americas) (13) suggested that MRAs exerted a similar reductions in mortality (by about ~25%) for patients with HFrEF above and below age 75 years but benefit was less certain for HFpEF.
The diversity of heart failure phenotypes
Precision-medicine, which should also be accurate, requires patients to be classified in a way that informs management. For oncology, this has focused on the genetic cause, tumour location, and spread. For heart failure, a multi-system disorder, it is much more complex (41–47).
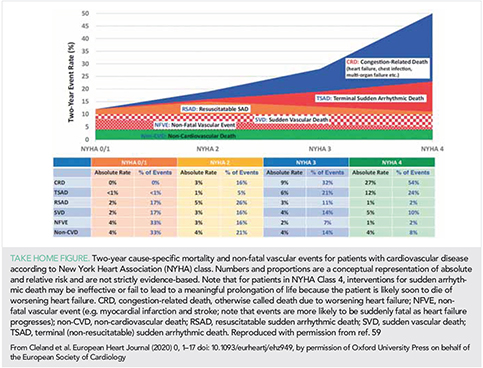
Current, therapeutically relevant classifications of heart failure include the severity of congestion (based on symptoms, signs, blood biomarkers, and imaging), CAD, heart rate and rhythm and QRS duration, blood pressure, serum potassium, renal function, indices of iron deficiency, mitral regurgitation, infiltrative myocardial disease (e.g. amyloid), and ventricular phenotype (41, 48). Optimal management of heart failure, with a few rare exceptions, requires only a modest amount of information but this still creates many thousands of patient-subgroups or clusters that might have different therapeutic needs (45, 46). Such subgroups will increase exponentially with the introduction of each new class of treatment. Despite this heterogeneity of substrate and wealth of interventions, precision-medicine is in its infancy in heart failure.
One therapeutically relevant classification of heart failure is by LVEF, a surrogate for left ventricular (LV) dilation. Prior to the 1980s, imaging of cardiac function was available only in expert centres. Clinical trials relied on the chest X-ray rather than the echocardiogram to support a diagnosis of heart failure. The success of trials such as SOLVD, MERIT, and CHARM, which all had a reduced LVEF as an inclusion criterion, led to the adoption of LVEF <40% as the European Society of Cardiology (ESC) Guideline definition for HFrEF (49). Values ≥40% were termed HFpEF, comprising patients with a mid-range or mildly-reduced (HFmrEF), normal (HFnEF) and, perhaps, supra-normal (HFsnEF) LVEF(50). Analyses of >350,000 routinely collected echocardiograms suggested that the nadir of risk, whether or not the patient has a diagnosis of heart failure, lies in the range 60–65% both for men and women. Interestingly, an LVEF of >70% was associated with similar risk as an LVEF of 30–40% (Figure 2) (50).
The ESC Guidelines of 2016 introduced the concept of HFmrEF, for two main reasons. Firstly, because of imprecision, an echocardiographic measurement could not reliably distinguish between two measurements of LVEF within 10% of each other. Creating a buffer-zone between HFrEF and HFnEF meant that misclassification was less likely. This innovation meant that a trial of HFpEF could not claim benefit for all patients with an LVEF >40% based solely on an effect in those with an LVEF 40–49%. Secondly, the introduction of HFmrEF challenged the convention that an LVEF <40% was the correct threshold for HFrEF. Some analyses subsequent to the ESC 2016 Guideline suggest that patients with an LVEF < 50% may respond to treatment similarly to those with an LVEF <40% (51). However, this interpretation could reflect confirmation-bias amongst enthusiastic proponents of HFmrEF (Table 1). The evidence is not so consistent when looked at in its entirety, especially if mortality is considered a key outcome. In the future, many trials will probably include both HFrEF and HFmrEF, others will include HFmrEF, HFnEF, and HFsnEF, but NT-proBNP should be used routinely to stratify risk and potentially exclude low-risk patients who have little to gain from yet another ‘pill’. Assuming we continue to use LVEF to classify patients, which seems likely since we cannot undo the past, then the major issue, is where to set thresholds. For HFrEF, these have ranged from < 25% in COPERNICUS, <30% in MADIT-II, and RAFT to <35–40% for the bulk of other trials (51). For HFpEF, LVEF has generally been set at >40% or >45% with no upper limit. Analyses of recent trials have led some to suggest that, for patients with an elevated NT-proBNP, the upper limit of LVEF for HFmrEF should be increased to 55% or even 60% but this seems premature until consistency is demonstrated across multiple interventions and end-points and measurement precision for LVEF improves.
In a substantial observational study of patients with HFpEF and pulmonary hypertension, progression of right rather than left ventricular dysfunction was observed and was associated with an increased risk of atrial fibrillation (AF) and death (52). Although right ventricular (RV) dysfunction is a powerful prognostic marker, remarkably few trials focusing on RV dysfunction have been done (SERENADE: https://clinicaltrials.gov/ct2/show/NCT03153111).
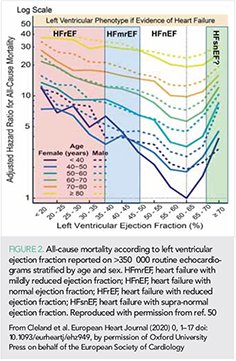
Atrial fibrillation
About a third of outpatients, perhaps more for those with HFpEF (53) and more than half of those admitted with heart failure will be in AF, which is associated with an adverse prognosis even after correcting for age and other risk factors (54). Controversy continues over whether medical management focused on rate control or restoration of sinus rhythm is the better strategy for AF and heart failure. In practice, the strategy needs to be tailored to the patient. When AF is the driver of symptoms and worsening cardiac function, restoration of sinus rhythm might be appropriate but when AF reflects the progression of underlying cardiac dysfunction, it may not (55). For new-onset or paroxysmal AF associated with a clear deterioration in symptoms, restoration of sinus rhythm may be warranted to improve symptoms. For long-standing AF and heart failure with markedly dilated atria, sustained restoration of sinus rhythm and atrial contraction is less likely. Optimal pharmacological management includes anticoagulation, avoiding toxic anti-arrhythmic agents and lenient ventricular rate control. Beta-blockers are the agent of choice for rate control, a resting day-time ventricular rate of 70–90 b.p.m. is preferred (49), which may require only modest doses; digoxin should be used sparingly, if at all. Unfortunately, RCTs of rate vs. rhythm control for AF have failed to optimize the rate control strategy in the above fashion.
A meta-analysis of RCTs of rate vs. rhythm control included four trials (n = 2,486) comparing pharmacological rhythm to rate control found no difference in mortality or thromboembolic events but an increase in hospitalizations, often due to recurrent AF, in the rhythm control group (56). Six trials (n = 1112) comparing AF ablation with rate control reported reductions in mortality (0.51; 95% CI: 0.36–0.74), hospitalizations (0.44; 95% CI: 0.26–0.76), and stroke (0.59: 95% CI: 0.23–1.51) and an improved quality of life (56). However, none of the trials individually had a robust result, patients were highly selected and the rate control strategy was not optimal. As such, this meta-analysis should be considered hypothesis generating. Further trials are required with greater involvement of heart failure physicians.
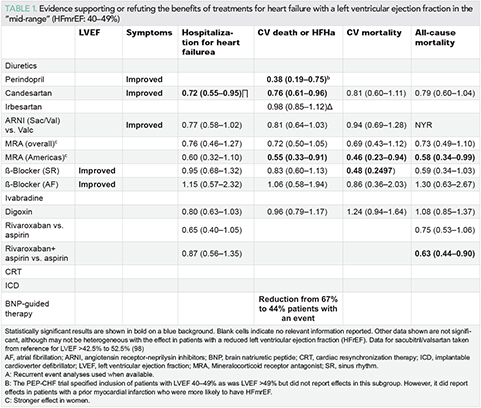
Implanted electrical devices
The controversy over the role of high-energy devices for heart failure continues. Long-term follow-up of cardiac resynchronization therapy (CRT) in a French Registry showed a low rate of sudden death amongst patients who received CRT-Pacing (without a defibrillator) (57–59). A systematic review of observational studies and RCTs reported that differences in the rate of sudden death with CRT-Pacing and CRT-D were narrowing (58). RCTs comparing CRT-Pacing and CRT-D are underway (59) (Take home figure). Whether myocardial scar found on cardiac magnetic resonance imaging identifies patients with more to gain from an implantable cardioverter defibrillator (ICD) is also under investigation (60) (CMR_GUIDE; https://clinicaltrials.gov/ct2/show/NCT01918215). Retrospective analysis of SCD-HeFT found that patients with T2DM did not benefit from an ICD (61). An individual patient-data meta-analysis confirmed a reduction in sudden death with MRA (62). A systematic review identified 22 studies with post-mortem interrogation of ICDs; the analysis suggested that 24% of sudden deaths were not arrhythmic (63). A substantial multi-point pacing trial failed, so far, to show improvements in the clinical or echocardiographic response to CRT (64).
Mitral regurgitation
COAPT suggested that a percutaneously delivered mitral clip could reduce functional (secondary) regurgitation with a subsequent substantial improvement in morbidity and mortality that was moderately cost-effective in a US healthcare context (US$ 40,361 per life-year gained and $55,600 per quality-adjusted life year) (65–68). Two-year follow-up of MITRA.fr suggested no benefit (69). A possible explanation for the apparent discrepancy could be the ratio of the severity of LV dysfunction to the severity of mitral regurgitation. When regurgitation is disproportionate to the severity of LV dysfunction it may drive disease progression and correction may improve outcome (70, 71). When regurgitation is proportionate to the severity of LV dysfunction, fixing the mitral regurgitation may be less useful because myocardial dysfunction drives disease progression. The concept is simple and plausible but application in practice may be difficult. Mitral regurgitation offloads the LV and may mask dysfunction. It is also likely that there is a spectrum of primary and secondary mitral regurgitation, with some patients having a mixed picture. More experience and further data from RCTs may improve patient selection (RESHAPE-HF2: https://clinicaltrials.gov/ct2/show/NCT02444338). However, optimizing guideline-recommended therapy, including diuretic dose, may cause mitral regurgitation secondary to dilation of the LV and mitral ring to improve or resolve. Other technologies for secondary mitral (72) and tricuspid regurgitation (73, 74) are being developed.
Coronary artery disease
In COMPASS (n = 27,395), 5,902 with CAD, in sinus rhythm and with a diagnosis of heart failure (predominantly HFpEF) were randomly assigned them to aspirin 100 mg/day, rivaroxaban 5 mg bd or aspirin and rivaroxaban 2.5 mg bd (75, 76). The study was stopped early for benefit on the primary endpoint (a composite of CV death, stroke, or myocardial infarction) with the combination compared with aspirin alone. Further analysis suggested a reduction in all-cause mortality for patients with heart failure, especially HFpEF, assigned to combination therapy (HR: 0.63; 0.44–0.90) or rivaroxaban alone (HR: 0.75; 0.53–1.06) with an estimated 4% absolute difference at 2 years; rather similar to the magnitude of effect in HFrEF for sacubitril-valsartan (77) or dapagliflozin (78). This suggests that coronary events might be an important driver of death in HFpEF (Take home figure), although effects of rivaroxaban on endothelial function, inflammation, and fibrosis should not be discounted. The analysis also suggests that those who do not have heart failure have little to gain from additional treatment with rivaroxaban.
However, for patients with HFrEF, CAD in sinus rhythm with a recent hospital discharge for worsening heart failure, addition of rivaroxaban 2.5 mg bd to background anti-platelet therapy did not improve overall prognosis, although a composite of vascular outcomes (stroke, myocardial infarction, and sudden death) was reduced, driven mainly by a reduction in stroke (79, 80). This suggests that for patients with stable CAD and more advanced heart failure, hospitalizations, and deaths due to worsening heart failure are not greatly influenced by anti-thrombotic therapy (Take home figure).
Angiotensin receptor-neprilysin inhibitors
Heart failure with reduced ejection fraction
As experience in the implementation of angiotensin receptor-neprilysin inhibitors (ARNIs) grows, both in clinical trials and in clinical practice, there is a strong argument to consider them as first-line agents, rather than angiotensin converting-enzyme inhibitors (ACEi) or angiotensin receptor blockers (ARB), for the treatment of HFrEF. In PIONEER-HF (81), 881 patients with an LVEF ≤40% who were hospitalized for worsening heart failure were randomly assigned, without a run-in period, to sacubitril/valsartan or enalapril prior to discharge and followed for 8 weeks to determine the effect on plasma concentrations of NT-proBNP; about one-third had new-onset heart failure. Sacubitril-valsartan exerted a greater reduction in NT-proBNP. Reductions in markers of myocardial injury or stress, high-sensitivity cardiac troponin-T and soluble ST2, were also observed. These effects appeared early after randomization (within 1–4 weeks). Moreover, patients assigned to sacubitril/valsartan were less likely to experience adverse outcomes within the first 8 weeks. TRANSITION (82) randomly assigned, 1002 patients to pre- or post-discharge initiation of sacubitril/valsartan, showing no adverse consequences to earlier administration.
EVALUATE (83) compared the effects of sacubitril/valsartan and enalapril on aortic stiffness in HFrEF most of whom were already chronically treated with an ACEi or ARB. After 24 weeks treatment, no differences in aortic stiffness were observed but slightly greater reductions in LV end-diastolic and systolic volumes were observed with sacubitril/valsartan compared with enalapril, although changes in LVEF were similar. Mitral E-velocity and left atrial volume declined, consistent with a fall in left atrial pressure. PROVE-HF (84), an observational study, had similar findings and showed that most of the decline in NT-proBNP occurred within 14 days consistent with the rapid onset of clinical benefit observed with sacubitril/valsartan in trials and clinical practice. PRIME (85) was an RCT (n = 118) comparing the effects of sacubitril/valsartan or valsartan on functional mitral regurgitation in patients with an LVEF between 25% and 49% who were already receiving an ACEi or ARB. Those assigned to sacubitril/valsartan had greater reductions in mitral regurgitation and LV end-diastolic and left atrial volumes but LVEF increased by a similar small amount in each group (about 2.5%).
Further reports from PARADIGM-HF suggest that, compared with enalapril, sacubitril/valsartan may improve markers of collagen metabolism, in particular, decreasing synthesis of type-I collagen, which makes an important contribution to myocardial stiffness (86). In I-PRESERVE, irbesartan (an ARB) did not affect collagen biomarkers compared with placebo (87).
Heart failure with preserved ejection fraction
PARAGON-HF investigated the effect of sacubitril/valsartan compared to valsartan alone on morbidity and mortality in patients with HFpEF (defined as an LVEF >45%) (88). It was the first RCT since PEP-CHF (89) to require patients to be treated with diuretics, the first-line treatment for the relief of symptoms and signs of congestion, and to have echocardiographic evidence of cardiac dysfunction. It was also the first large trial of HFpEF to require all patients to have raised plasma concentrations of natriuretic peptides, the most powerful, widely available prognostic marker in HFpEF. Sacubitril/valsartan was compared with valsartan rather than placebo because many patients eligible for PARAGON-HF had indications for ACE inhibitors and ARBs such as hypertension and CAD. The only trial comparing valsartan to placebo in HFpEF was of modest size and neutral (90). Previous RCTs of other ARBs, including candesartan (CHARM-Preserved) and irbesartan (I-PRESERVE) failed to show substantial benefit for HFpEF (88). Patients had to tolerate, sequentially, both valsartan and sacubitril/valsartan at half the intended target dose before randomization. This simulates clinical practice (doctors do not usually prescribe medicines to patients unwilling or unable to take them) and reduces the risk of a neutral trial-outcome due to low adherence. Of 10,539 patients screened, 4,822 were randomized.
PARAGON-HF was neutral for its primary endpoint (CV death or the total number of recurrent hospitalizations for heart failure (91). Some have argued that the P-value was very close to 0.05 and that it was ‘almost’ positive. This misses the point. The trial shows that the size of the potential benefit of sacubitril/valsartan for HFpEF is modest, regardless of the P-value and that the treatment is, overall, unlikely to be cost-effective. Accordingly, we should look for more effective treatments or, more controversially, subgroups that obtain greater benefit. After a median follow-up of 35 months, 23% of patients experienced a primary event but the annual incidence of CV and all-cause mortality were, respectively, only about 3% and 5%, which is similar to those for previous trials of HFpEF and for elderly patients with resistant hypertension assigned to placebo in HYVET (92). Although <3% of patients were reported to have heart failure in HYVET, a combination of indapamide and perindopril reduced all-cause mortality and cut the incidence of heart failure by >50%. Many of these patients probably had undiagnosed HFpEF prior to randomization. Higher rates of hospitalization for heart failure in trials of HFpEF compared to hypertension may well reflect ascertainment bias, as clinicians who are interested or expert in the management of heart failure are more likely to diagnose or report heart failure events. Overall, these trials suggest that the mortality rate and possibly the rates of cardiovascular and all-cause hospitalization may be similar in patients with and without a diagnosis of HFpEF, if they have a similar burden of co-morbidities. However, it is also likely that many patients with hypertension, CAD and T2DM have undiagnosed heart failure.
Subgroup analysis suggested that the effect of sacubitril/valsartan on the primary endpoint was greater for patients with an LVEF below the median (57%), but this was driven almost entirely by an effect on hospitalization for heart failure rather than on CV death (93). The effect of sacubitril/valsartan on the primary endpoint was also greater for women and this was true throughout the studied range of LVEF, but again this was driven by a difference in hospitalization for heart failure and not CV mortality (94). Reductions in NT-proBNP were similar for each sex. Sacubitril/valsartan appeared to have a favourable effect on quality of life for men but not for women. Patients with a recent heart failure hospitalization may also have benefited more (95). These observations should be interpreted in the light of a trial that was neutral for its primary endpoint. No effect was observed on mortality and the benefits of treatment on quality of life and hospitalizations for heart failure according to sex were inconsistent. In PARADIGM-HF, no difference in treatment effect according to sex was observed. A further sizeable RCT in HFpEF, PARALLAX-HF, investigating the effects of sacubitril/valsartan on quality of life and exercise capacity will provide more evidence in 2020 (https://clinicaltrials.gov/ct2/show/NCT03066804).
Do women and men respond differently to treatment?
An analysis of 12,058 patients with HFrEF in two large trials found that women had more severe symptoms, similar LVEF but a substantially better prognosis than men, even after adjusting for key prognostic variables including aetiology and NT-proBNP (HR: 0.68; 0.62–0.89) (96). A combined analysis of PARAGON-HF and PARADIGM-HF suggested that patients with HFrEF and HFpEF had similarly impaired quality of life but that women generally reported a worse quality of life than men (97). In an observational analysis of patients with HFrEF, the BIOSTAT survey also found that women generally had a better prognosis than men despite being prescribed lower doses of beta-blockers and ACE inhibitors (98). Interestingly, men and women had the same heart rate, the pharmacodynamic marker of beta-blocker dose. For patients with HFpEF in the TOPCAT trial, reductions in mortality, but not hospitalizations for heart failure, were greater for women, although the interaction was statistically significant only for all-cause mortality (99). In the PARAGON-HF trial (HFpEF), women obtained greater benefit than men throughout the studied range of LVEF but the difference was driven by differences in the rate of hospitalization for heart failure rather than mortality (94). One obvious difference between men and women, on average, is size. Cardiac resynchronization therapy is reputed to be more effective in women than men, but differences disappear once adjusted for height (100). Many medicines are cleared by the kidney. Estimated glomerular filtration rate (eGFR) is indexed to body surface area (BSA) but doses of treatment are usually not. A woman (or small man) weighing 64 kg and 160 cm tall has BSA of 1.67 m2 using the Dubois formula and a man (or large woman) weighing 85 kg and 180 cm tall has a BSA 2.05 m². If both have an eGFR of 60 mL/kg/m2, then the woman (or small man) has an un-indexed eGFR of 100 mL/min and the man (or large woman) has an un-indexed eGFR of 123 mL/min. If a medicine is cleared by the kidney then perhaps smaller people require lower doses to achieve the same plasma therapeutic concentration and clinical benefit?
Sodium-glucose cotransporter-2 inhibitors
Sodium-glucose cotransporter protein-2 (SGLT2) is found mainly in the proximal renal tubule and to a lesser extent in other organs. SGLT1 is abundant in the intestine and myocardium. SGLT2 inhibitors (SGLT2i) cause glycosuria, improving glycaemia, which led to their development for the treatment of T2DM, and an osmotic diuresis, leading to a contraction of plasma volume (101, 102). SGLT1 inhibitors reduce intestinal glucose absorption, which can cause diarrhoea but might have favourable effects on myocardial energy-utilization (103). Most SGLT2i are highly selective, including dapagliflozin and empagliflozin, but sotagliflozin is less selective (103).
EMPA-REG enrolled 7020 patients with T2DM, about 10% of whom had heart failure (LVEF was not measured) and showed that empagliflozin reduced the risk of hospitalization for heart failure and mortality (104). Within a few weeks of initiating empagliflozin, body weight, and blood pressure fell and haematocrit rose, consistent with a diuretic effect. Subsequent RCTs of other SGLT2i in T2DM had similar findings. Meta-analyses suggested that SGLT2i were the hypoglycaemic agents most likely to reduce incident heart failure,105–107 whilst observational data raises concerns about insulin therapy (108). A meta-analysis of RCTs of empagliflozin, canagliflozin, and dapagliflozin for T2DM, including >30,000 patients, showed benefit, at least for those with established CV disease (109). For the outcome of hospitalization for heart failure or CV death, the annual rate was about 0.6% for the 13,672 patients with multiple risk factors but without established CV disease, about 3% for the 20,650 patients with established atherosclerotic disease and about 6% for 3891 patients with heart failure at baseline; the relative risk reductions with SGLT2i in these populations were 16%, 24%, and 29%, respectively, without evidence of heterogeneity amongst agents. The largest of these trials, DECLARE (110), included 17,160 patients of whom 671 had HFrEF and 1,316 had HFpEF or an unspecified LVEF. In a subgroup analysis (111), dapagliflozin reduced hospitalizations for heart failure and CV mortality for HFrEF but not for other patient-groups (Figure 5).
DAPA-HF (78, 112) enrolled 4,744 patients and followed them for a median of 18.3 months, demonstrating that addition of dapagliflozin to guideline-recommended therapy for HFrEF-reduced hospitalizations for heart failure by 30% and mortality (mainly cardiovascular) by 18%, preventing 3–5 hospitalizations and 1–2 deaths per 100 patients treated per year (Figure 6). Patients were somewhat less likely to experience serious adverse events, especially renal, with dapagliflozin compared with placebo. The benefits appeared consistent across subgroups, although patients with evidence of more severe congestion (worse NYHA class or higher NT-proBNP) may have received less benefit. Importantly, benefits were similar for those with and without T2DM and regardless of age (113). Dapagliflozin also improved quality of life (114), an effect that was confirmed in a smaller RCT (DEFINE) (115) that followed 263 patients for 12 weeks; about one in six patients got a meaningful benefit, either prevention of worsening or an improvement in symptoms, compared with placebo.
In DAPA-HF, the placebo-corrected decline in weight between baseline and 8 months was 0.87 kg and this was associated with a small fall in NT-proBNP and systolic blood pressure and a small increase in haematocrit and serum creatinine. These findings are again consistent with the belief that SGLT2i exert at least some of their benefits by enhancing diuresis, either through an osmotic effect of glycosuria or by interfering with sodium-hydrogen exchange in the nephron (116). The effects of SGLT2i appear early, consistent with an immediate haemodynamic effect. However, alternative or additional explanations for the effect of SGLT2i have been proposed. A small RCT suggested that empagliflozin stimulated production of erythropoietin leading to a rise in haematocrit and a fall in ferritin, a marker of inflammation and iron deficiency, although not transferrin saturation, a marker of iron deficiency alone (117). However, administration of exogenous erythropoietin did not reduce morbidity or mortality in the RED-HF trial (118). Others have suggested that SGLT2i increase the production of ketones, which may be a more efficient myocardial energy substrate, or block myocardial sodium–hydrogen exchanger-3, which may improve myocardial function and reduce fibrosis (119, 120). An RCT of empagliflozin in patients with T2DM but not heart failure (121) suggested little effect on cardiac function or remodelling; RCTs of the effects of SGLT2i on cardiac function in patients with HFrEF and HFpEF are awaited. Future trials will confirm whether the benefit observed in DAPA-HF is a class effect and whether they are effective for HFpEF or when congestion is severe (122, 123).
Acute heart failure
Two large RCTs of serelaxin failed to confirm the results of the original RELAX-AHF trial. RELAX-AHF-EU (124), an open-label RCT (n = 2,688), reported a similar and low rate for mortality (≤2%) and re-admissions for heart failure (<1%) at 14 days for patients assigned placebo or serelaxin, despite a reduction in worsening heart failure at day 5 [6.7–4.5% (P <0.008)]. The RELAX-AHF-2 trial (125), a double-blind RCT (n = 6545), reported that the rates of worsening heart failure in the first 5 days (about 7%) and 180-day mortality (about 11%) were similar for placebo and serelaxin. The failure of so many short-term interventions for AHF may reflect failed therapeutic concepts, ineffective interventions, or problems with trial design. RCTs of AHF are difficult to implement, especially if conducted double-blind. Indeed, GALACTIC, a trial of personalized, early intensive and sustained vasodilation with nitrates and hydralazine, also failed to show benefit, calling into question the concept of vasodilator therapy for the routine management of acute heart failure (126). Many patients present with acute breathlessness in the middle of the night. It is difficult to have research staff available ‘24/7’ when there is no ‘gateway’ similar to a coronary care unit or catheter laboratory. Compassionate investigators may also be unwilling to enroll frail elderly patients who are most at risk of adverse outcomes. Moreover, breathlessness usually responds to oxygen and diuretics within hours (127), especially for patients with a systolic blood pressure ≥125 mmHg, as required in the serelaxin trials. On the other hand, patients with extensive peripheral oedema (26), renal dysfunction, and a low blood pressure, who often do not constitute an acute emergency have a poor prognosis and an unmet need for more effective interventions; pharmacological, or device (127, 128).
Stem cell therapy
Intra-myocardial injection of stem cells failed to improve weaning from left ventricular assist devices (130).
Heart failure in patients with cancer
Interest in cardio-oncology reflects increasing survival after treatment for cancer, growing awareness of the CV toxicity associated with both established and new treatments for cancer, and interest in personalized risk-profiling prior to chemotherapy. People with cardiomyopathy-related gene mutations may be more prone (7.5% of those with compared to 1.1% of those without a titin gene mutation) to develop ventricular dysfunction after the administration of chemotherapy (131).
Interruption of trastuzumab is associated with a higher risk of cancer recurrence in women with early invasive HER2+ve breast cancer; about 60% of interruptions are for cardiotoxicity (132). An observational study showed that of 30 women receiving HER2-targeted therapies who developed an LVEF of 40–49% and were treated prospectively with beta-blockers and ACE inhibitors, only three went on to develop severe heart failure or a LVEF <35% (133). Cardiac function rarely returned to normal after completion of treatment, challenging the view that trastuzumab-related LV dysfunction is usually reversible. A recent study reported high rates of CV events, especially heart failure, amongst patients with multiple myeloma receiving potent proteasome inhibitors, such as carfilzomib and bortezomib (134), which were associated with much poorer survival. Risk factors for developing a CV event included elevated pre-treatment NT-proBNP or an increase during treatment. A systematic review of prophylactic use of renin–angiotensin–aldosterone antagonists and beta-blockers identified 22 relevant RCTs, of which the largest had only 206 patients (135, 136), but found no convincing evidence of clinical efficacy.
Implementation of therapy
Analyses of administrative data from primary care in the UK suggest that implementation of therapy has improved substantially over the last decade, with 72% now prescribed a beta-blocker, although many patients remain on less than target doses (6). Amongst hospital discharges in England and Wales, 89% of those with HFrEF were discharged on a beta-blocker (https://www.nicor.org.uk/wp-content/uploads/2019/09/Heart-Failure-2019-Report-final.pdf), which is very similar to that observed in patients with HFrEF selected for enrolment in the ESC-EURObservational Heart Failure Long-Term Registry (137). However, an analysis of Medicare beneficiaries in the USA found that only 51% of patients with HFrEF were prescribed a beta-blocker after a first or recurrent hospitalization for heart failure and only 12% received at least ≥50% of the target dose by 1 year (138). This suggests that the organization of care for HFrEF makes an important difference to treatment and, consequently, outcome. However, a cluster RCT (n = 2,494) of service redesign aiming to improve hospital-to-home transition, which included self-care education, a structured hospital discharge summary, family physician follow-up within 1 week, and, for high-risk patients, home-visits, did not substantially improve patient well-being or outcome (139). An RCT (n = 110) showed that frequent (several times per month) visits to participating community pharmacies could improve medication adherence and well-being (140). An RCT of 450 patients found benefits of e-Health intervention on self-care behaviour and quality of life in the first 3 months after initiation but not thereafter (141), with no effect on hospitalizations or mortality. There are many reasons why RCTs of complex interventions fail including inadequate power, suboptimal trial design, already excellent or unintended improvements in care for the control group, lack of long-term engagement and motivation of staff and patients, inclusion of patients for whom pharmacological intervention is largely ineffective (e.g. HFpEF) but sometimes we just have to admit that what should work does not. More evidence is required; learning from past experience (142).
Rehabilitation
Systematic reviews suggest that exercise-based rehabilitation can improve patients’ well-being and exercise capacity and reduce heart failure-related and all-cause hospitalization but may not reduce mortality, despite potentially improving adherence to treatment (143–147). The best and most cost-effective service-model is a topic of active research (148, 149).
Palliative care
Morphine relieves chronic breathlessness in patients with chronic lung disease but data for heart failure are sparse. An RCT of 45 patients failed to demonstrate important clinical benefits of morphine administration to patients with HFrEF or HFpEF predominantly in NYHA functional class III (150).
Withdrawing treatment for heart failure after recovery
Withdrawing treatment from patients with idiopathic or genetically determined dilated cardiomyopathy who have experienced full recovery of ventricular function should be done with great caution if at all (151). Although patients with a recovered LVEF (HFrcEF) may have a better prognosis, it may still not be good (152). Further research is required for peripartum and other specific types of cardiomyopathy. A recent report from an old trial (DIG), suggested that withdrawal of digoxin was associated with an increased risk of hospitalization for heart failure but did not affect mortality (153). An RCT of 188 patients with stable heart failure from Brazil suggested that 75% of patients could be withdrawn from loop diuretics for at least 90 days without deterioration in symptoms, need for reinstitution of diuretic therapy, or a rise in plasma NT-proBNP (154). This is in stark contrast to a smaller RCT from the UK, where withdrawal of diuretics and other therapies for 48 h led to a doubling of plasma concentrations of NT-proBNP, an increase in LV and left atrial volumes and worsening symptoms (155).
Conclusion
Great progress in the understanding and management of heart failure has been made over the last year. New controversies and new evidence challenge many old assumptions. As ever, some will resist progress and others will embrace it. You, the reader, must help our professions and patients find the correct balance between reckless enthusiasm and diagnostic and therapeutic inertia.
Funding
The British Heart Foundation Cardiovascular Research Centre at the University of Glasgow is supported by a Centre of Research Excellence grant from the British Heart Foundation (RE/18/6/34217).
Conflict of interest: Dr. J.G.C. reports grants and personal fees from Amgen, Bayer, Novartis, Vifor, and Pharmacosmos; personal fees and non-financial support from Medtronic; personal fees from Abbott, outside the submitted work. Dr. A.R.L. reports personal fees from Servier, Novartis, Roche, Takeda, Boehringer Ingelheim, Amgen, Clinigen Group, Ferring Pharmaceuticals, Eli Lily, Bristol Myers Squibb, and Eisai Ltd; grants and personal fees from Pfizer, outside the submitted work. T.M. reports honoraria from Vifor. J.J.M. reports non-financial support and other from AstraZeneca, during the conduct of the study; other from Bayer, non-financial support and other from Cardiorentis, non-financial support and other from Amgen, non-financial support and other from Oxford University/Bayer, non-financial support and other from The racos, non-financial support and other from Abbvie, other from DalCor, other from Pfizer, other from Merck, non-financial support and other from Novartis, non-financial support and other from Glaxo Smith Kline (GSK), other from Bristol Myers Squibb (BMS), non-financial support and other from Vifor-Fresenius, non-financial support and other from Kidney Research UK (KRUK), non-financial support and other from Novartis, outside the submitted work.
References
1. Torabi A, Rigby AS, Cleland J. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. J Am Coll Cardiol 2009; 55: 79–81.
2. Scirica BM, Braunwald E, Raz I, Cavender MA, Morrow DA, Jarolim P, Udell JA, Mosenzon O, Im K, Umez-Eronini AA, Pollack PS, Hirshberg B, Frederich R, Lewis BS, McGuire DK, Davidson J, Steg PG, Bhatt DL. Heart failure, saxagliptin, and diabetes mellitus: observations from the SAVOR-TIMI 53 randomized trial. Circulation 2014; 130: 1579–1588.
3. Zhang C, Jiang L, Xu L, Tian J, Liu J, Zhao X, Feng X, Wang D, Zhang Y, Sun K, Xu B, Zhao W, Hui R, Gao R, Yuan J, Song L. Implications of N-terminal pro-B-type natriuretic peptide in patients with three-vessel disease. Eur Heart J 2019; 40: 3397–3405.
4. Cleland JGF, Pellicori P, Clark AL. Prevention or procrastination for heart failure? Why we need a universal definition of heart failure. J Am Coll Cardiol 2019; 73: 2398–2400.
5. Conrad N, Judge A, Canoy D, Tran J, Pinho-Gomes AC, Millett ERC, Salimi-Khorshidi G, Cleland JG, McMurray JJV, Rahimi K. Temporal trends and patterns in mortality after incident heart failure: a longitudinal analysis of 86,000 individuals. JAMA Cardiol 2019; 4: 1102.
6. Conrad N, Judge A, Canoy D, Tran J, O’Donnell J, Nazarzadeh M, Salimi-Khorshidi G, Hobbs FDR, Cleland JG, McMurray JJV, Rahimi K. Diagnostic tests, drug prescriptions, and follow-up patterns after incident heart failure: a cohort study of 93,000 UK patients. PLoS Med 2019; 16: e1002805.
7. Bottle A, Kim D, Aylin P, Cowie MR, Majeed A, Hayhoe B. Routes to diagnosis of heart failure: observational study using linked data in England. Heart 2018; 104: 600–605.
8. Kim D, Hayhoe B, Aylin P, Majeed A, Cowie MR, Bottle A. Route to heart failure diagnosis in English primary care: a retrospective cohort study of variation. Br J Gen Pract 2019; 69: e697–e705.
9. Filippatos G, Angermann CE, Cleland JGF, Lam CSP, Dahlström U, Dickstein K, Ertl G, Hassanein M, Hart KW, Hu D, Lindsell CJ, Perrone SV, Guerin T, Ghadanfar M, Schweizer A, Obergfell A, Collins SP. Global differences in acute heart failure patient characteristics, precipitants, point of hospital entry and inpatient management: an analysis from REPORT-HF, a worldwide, prospective heart failure disease registry. JAMA Cardiol 2019; in press.
10. Dokainish H, Teo K, Zhu J, Roy A, AlHabib KF, ElSayed A, Palileo-Villaneuva L, Lopez-Jaramillo P, Karaye K, Yusoff K, Orlandini A, Sliwa K, Mondo C, Lanas F, Prabhakaran D, Badr A, Elmaghawry M, Damasceno A, Tibazarwa K, Belley-Cote E, Balasubramanian K, Islam S, Yacoub MH, Huffman MD, Harkness K, Grinvalds A, McKelvie R, Bangdiwala SI, Yusuf S; INTER-CHF Investigators. Global mortality variations in patients with heart failure: results from the International Congestive Heart Failure (INTER-CHF) prospective cohort study. Lancet Glob Health 2017; 5: e665–e672.
11. Dewan P, Rorth R, Jhund PS, Ferreira JP, Zannad F, Shen L, Kober L, Abraham WT, Desai AS, Dickstein K, Packer M, Rouleau JL, Solomon SD, Swedberg K, Zile MR, McMurray J. Income inequality and outcomes in heart failure: a global between-country analysis. JACC Heart Fail 2019; 7: 336–346.
12. Dewan P, Jhund PS, Shen L, Petrie MC, Abraham WT, Atif AM, Chen CH, Desai AS, Dickstein K, Huang J, Kiatchoosakun S, Kim KS, Kober L, Lai WT, Liao Y, Mogensen UM, Oh BH, Packer M, Rouleau JL, Shi V, Sibulo ASJr, Solomon SD, Sritara P, Swedberg K, Tsutsui H, Zile MR, McMurray J. Heart failure with reduced ejection fraction: comparison of patient characteristics and clinical outcomes within Asia and between Asia, Europe and the Americas. Eur J Heart Fail 2019; 21: 577–587.
13. Ferreira JP, Rossello X, Eschalier R, McMurray JJV, Pocock S, Girerd N, Rossignol P, Pitt B, Zannad F. MRAs in elderly HF patients: individual patient-data meta-analysis of RALES, EMPAHSIS-HF, and TOPCAT. JACC Heart Fail 2019; 7: 1012–1021.
14. Ferreira JP, Rossignol P, Pizard A, Machu JL, Collier T, Girerd N, Huby AC, Gonzalez A, Diez J, Lopez B, Sattar N, Cleland JG, Sever PS, Zannad F. Potential spironolactone effects on collagen metabolism biomarkers in patients with uncontrolled blood pressure. Heart 2019; 105: 307–314.
15. Pellicori P, Ferreira JP, Mariottoni B, Brunner-La Rocca H-P, Ahmed FZ, Verdonschot J, Collier T, Cuthbert JJ, Petutschnigg J, Mujaj B, Girerd N, González A, Clark AL, Cosmi F, Staessen JA, Heymans S, Latini R, Rossignol P, Zannad F, Cleland JGF. Effects of spironolactone on serum markers of fibrosis in people at high risk of developing heart failure: rationale, design and baseline characteristics of a proof-of-concept, randomised, precision-medicine, prevention trial. The Heart OMics in AGing (HOMAGE) trial. Eur J Heart Failure 2019; in press.
16. Larsson SC, Back M, Rees JMB, Mason AM, Burgess S. Body mass index and body composition in relation to 14 cardiovascular conditions in UK Biobank: a Mendelian randomization study. Eur Heart J 2019; https://doi.org/10.1093/eurheartj/ehz388.
17. Sillars A, Celis-Morales CA, Ho FK, Petermann F, Welsh P, Iliodromiti S, Ferguson LD, Lyall DM, Anderson J, Mackay DF, Pellicori P, Cleland J, Pell JP, Gill JMR, Gray SR, Sattar N. Association of fitness and grip strength with heart failure: findings from the UK biobank population-based study. Mayo Clin Proc 2019; 94: 2230–2240.
18. Jamaly S, Carlsson L, Peltonen M, Jacobson P, Karason K. Surgical obesity treatment and the risk of heart failure. Eur Heart J 2019; 40: 2131–2138.
19. Zhang J, Begley A, Jackson R, Harrison M, Pellicori P, Clark AL, Cleland J. Body mass index and all-cause mortality in heart failure patients with normal and reduced ventricular ejection fraction: a dose-response meta-analysis. Clin Res Cardiol 2019; 108: 119–132.
20. Kytomaa S, Hegde S, Claggett B, Udell JA, Rosamond W, Temte J, Nichol K, Wright JD, Solomon SD, Vardeny O. Association of influenza-like illness activity with hospitalizations for heart failure: the atherosclerosis risk in communities study. JAMA Cardiol 2019; 4: 363–369.
21. Loeb M, Dokainish H, Dans A, Palileo-Villanueva LM, Roy A, Karaye K, Zhu J, Liang Y, Goma F, Damasceno A, AlHabib KF, Yonga G, Mondo C, Almahmeed W, Al MA, Yusuf S. Randomized controlled trial of influenza vaccine in patients with heart failure to reduce adverse vascular events (IVVE): rationale and design. Am Heart J 2019; 212: 36–44.
22. Liu L, Klein L, Eaton C, Panjrath G, Martin LW, Chae CU, Greenland P, Lloyd-Jones DM, Wactawski-Wende J, Manson JE. Menopausal hormone therapy and risks of first hospitalized heart failure and its subtypes during the intervention and extended postintervention follow-up of the women’s health initiative randomized trials. J Card Fail 2019; https://doi.org/10.1016/j.cardfail.2019.09.006.
23. Pieske B, Tschope C, de Boer RA, Fraser AG, Anker SD, Donal E, Edelmann F, Fu M, Guazzi M, Lam CSP, Lancellotti P, Melenovsky V, Morris DA, Nagel E, Pieske-Kraigher E, Ponikowski P, Solomon SD, Vasan RS, Rutten FH, Voors AA, Ruschitzka F, Paulus WJ, Seferovic P, Filippatos G. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J 2019; 40: 3297–3317.
24. Ho JE, Zern EK, Wooster L, Bailey CS, Cunningham T, Eisman AS, Hardin KM, Zampierollo GA, Jarolim P, Pappagianopoulos PP, Malhotra R, Nayor M, Lewis GD. Differential clinical profiles, exercise responses, and outcomes associated with existing HFpEF definitions. Circulation 2019; 140: 353–365.
25. Pellicori P, Shah P, Cuthbert J, Urbinati A, Zhang J, Kallvikbacka-Bennett A, Clark AL, Cleland J. Prevalence, pattern and clinical relevance of ultrasound indices of congestion in outpatients with heart failure. Eur J Heart Fail 2019; 21: 904–916.
26. Shoaib A, Mamas MA, Ahmad QS, McDonagh TM, Hardman SMC, Rashid M, Butler R, Duckett S, Satchithananda D, Nolan J, Dargie HJ, Clark AL, Cleland J. Characteristics and outcome of acute heart failure patients according to the severity of peripheral oedema. Int J Cardiol 2019; 285: 40–46.
27. Shoaib A, Farag M, Nolan J, Rigby A, Patwala A, Rashid M, Kwok CS, Perveen R, Clark AL, Komajda M, Cleland J. Mode of presentation and mortality amongst patients hospitalized with heart failure? A report from the First Euro Heart Failure Survey. Clin Res Cardiol 2019; 108: 510–519.
28. Platz E, Solomon SD, McMurray J. Lung ultrasound: monitoring congestion in patients with heart failure. Eur J Heart Fail 2019; https://doi.org/10.1002/ejhf.1636.
29. Platz E, Campbell RT, Claggett B, Lewis EF, Groarke JD, Docherty KF, Lee MMY, Merz AA, Silverman M, Swamy V, Lindner M, Rivero J, Solomon SD, McMurray J. Lung ultrasound in acute heart failure: prevalence of pulmonary congestion and short- and long-term outcomes. JACC Heart Fail 2019; 7: 849–858.
30. Platz E, Jhund PS, Girerd N, Pivetta E, McMurray JJV, Peacock WF, Masip J, Martin-Sanchez FJ, Miro O, Price S, Cullen L, Maisel AS, Vrints C, Cowie MR, DiSomma S, Bueno H, Mebazaa A, Gualandro DM, Tavares M, Metra M, Coats AJS, Ruschitzka F, Seferovic PM, Mueller C; on behalf of the Study Group on Acute Heart Failure of the Acute Cardiovascular Care Association and the Heart Failure Association of the European Society of Cardiology. Expert consensus document: reporting checklist for quantification of pulmonary congestion by lung ultrasound in heart failure. Eur J Heart Fail 2019; 21: 844–851.
31. Pivetta E, Goffi A, Nazerian P, Castagno D, Tozzetti C, Tizzani P, Tizzani M, Porrino G, Ferreri E, Busso V, Morello F, Paglieri C, Masoero M, Cassine E, Bovaro F, Grifoni S, Maule MM, Lupia E; on behalf of the Study Group on Lung Ultrasound from the Molinette and Careggi Hospitals. Lung ultrasound integrated with clinical assessment for the diagnosis of acute decompensated heart failure in the emergency department: a randomized controlled trial. Eur J Heart Fail 2019; 21: 754–766.
32. Rivas-Lasarte M, Álvarez-García J, Fernández-Martínez J, Maestro A, López-López L, Solé-González E, Pirla MJ, Mesado N, Mirabet S, Fluvià P, Brossa V, Sionis A, Roig E, Cinca J. Lung ultrasound-guided treatment in ambulatory patients with heart failure: a randomized controlled clinical trial (LUS-HF study). Eur J Heart Fail 2019; https://doi.org/10.1002/ejhf.1604.
33. Ter Maaten JM, Kremer D, Demissei BG, Struck J, Bergmann A, Anker SD, Ng LL, Dickstein K, Metra M, Samani NJ, Romaine SPR, Cleland J, Girerd N, Lang CC, Van Veldhuisen DJ, Voors AA. Bio-adrenomedullin as a marker of congestion in patients with new-onset and worsening heart failure. Eur J Heart Fail 2019; 21: 732–743.
34. Abraham J, Bharmi R, Jonsson O, Oliveira GH, Artis A, Valika A, Capodilupo R, Adamson PB, Roberts G, Dalal N, Desai AS, Benza RL. Association of ambulatory hemodynamic monitoring of heart failure with clinical outcomes in a concurrent matched cohort analysis. JAMA Cardiol 2019; 4: 556–563.
35. Verbrugge FH, Martens P, Ameloot K, Haemels V, Penders J, Dupont M, Tang WHW, Droogne W, Mullens W. Acetazolamide to increase natriuresis in congestive heart failure at high risk for diuretic resistance. Eur J Heart Fail 2019; 21: 1415–1422.
36. Jones NR, Roalfe AK, Adoki I, Hobbs FDR, Taylor CJ. Survival of patients with chronic heart failure in the community: a systematic review and meta-analysis. Eur J Heart Fail 2019; 21: 1306–1325.
37. Kwok CS, Zieroth S, Van Spall HGC, Helliwell T, Clarson L, Mohamed M, Mallen C, Duckett S, Mamas MA. The Hospital Frailty Risk Score and its association with in-hospital mortality, cost, length of stay and discharge location in patients with heart failure short running title: frailty and outcomes in heart failure. Int J Cardiol 2019; https://doi.org/10.1016/j.ijcard.2019.09.064.
38. Savarese G, Dahlstrom U, Vasko P, Pitt B, Lund LH. Association between renin-angiotensin system inhibitor use and mortality/morbidity in elderly patients with heart failure with reduced ejection fraction: a prospective propensity score-matched cohort study. Eur Heart J 2018; 39: 4257–4265.
39. Stolfo D, Uijl A, Benson L, Schrage B, Fudim M, Asselbergs FW, Koudstaal S, Sinagra G, Dahlstrom U, Rosano G, Savarese G. Association between beta-blocker use and mortality/morbidity in older patients with heart failure with reduced ejection fraction. A propensity score-matched analysis from the Swedish Heart Failure Registry. Eur J Heart Fail 2019; https://doi.org/10.1002/ejhf.1615.
40. Rush CJ, Campbell RT, Jhund PS, Petrie MC, McMurray J. Association is not causation: treatment effects cannot be estimated from observational data in heart failure. Eur Heart J 2018; 39: 3417–3438.
41. Triposkiadis F, Butler J, Abboud FM, Armstrong PW, Adamopoulos S, Atherton JJ, Backs J, Bauersachs J, Burkhoff D, Bonow RO, Chopra VK, de Boer RA, de WL, Hamdani N, Hasenfuss G, Heymans S, Hulot JS, Konstam M, Lee RT, Linke WA, Lunde IG, Lyon AR, Maack C, Mann DL, Mebazaa A, Mentz RJ, Nihoyannopoulos P, Papp Z, Parissis J, Pedrazzini T, Rosano G, Rouleau J, Seferovic PM, Shah AM, Starling RC, Tocchetti CG, Trochu JN, Thum T, Zannad F, Brutsaert DL, Segers VF, De Keulenaer GW. The continuous heart failure spectrum: moving beyond an ejection fraction classification. Eur Heart J 2019; 40: 2155–2163.
42. de Boer RA, De KG, Bauersachs J, Brutsaert D, Cleland JG, Diez J, Du XJ, Ford P, Heinzel FR, Lipson KE, McDonagh T, Lopez-Andres N, Lunde IG, Lyon AR, Pollesello P, Prasad SK, Tocchetti CG, Mayr M, Sluijter JPG, Thum T, Tschope C, Zannad F, Zimmermann WH, Ruschitzka F, Filippatos G, Lindsey ML, Maack C, Heymans S. Towards better definition, quantification and treatment of fibrosis in heart failure. A scientific roadmap by the Committee of Translational Research of the Heart Failure Association (HFA) of the European Society of Cardiology. Eur J Heart Fail 2019; 21: 272–285.
43. Packer M. The epicardial adipose inflammatory triad: coronary atherosclerosis, atrial fibrillation, and heart failure with a preserved ejection fraction. Eur J Heart Fail 2018; 20: 1567–1569.
44. Pellicori P, Zhang J, Cuthbert J, Urbinati A, Shah P, Kazmi S, Clark AL, Cleland JGF. High sensitivity C-reactive protein in chronic heart failure: patient characteristics, phenotypes and mode of death. Cardiovasc Res 2020; 116: 91–100.
45. Tromp J, Ouwerkerk W, Demissei BG, Anker SD, Cleland JG, Dickstein K, Filippatos G, van der Harst P, Hillege HL, Lang CC, Metra M, Ng LL, Ponikowski P, Samani NJ, Van Veldhuisen DJ, Zannad F, Zwinderman AH, Voors AA, van der Meer P. Novel endotypes in heart failure: effects on guideline-directed medical therapy. Eur Heart J 2018; 39: 4269–4276.
46. Kao DP, Lewsey JD, Anand IS, Massie BM, Zile MR, Carson PE, McKelvie RS, Komajda M, McMurray JJ, Lindenfeld J. Characterization of subgroups of heart failure patients with preserved ejection fraction with possible implications for prognosis and treatment response. Eur J Heart Fail 2015; 17: 925–935.
47. Cao TH, Jones DJL, Voors AA, Quinn PA, Sandhu JK, Chan DCS, Parry HM, Mohan M, Mordi IR, Sama IE, Anker SD, Cleland JG, Dickstein K, Filippatos G, Hillege HL, Metra M, Ponikowski P, Samani NJ, Van Veldhuisen DJ, Zannad F, Lang CC, Ng LL. Plasma proteomic approach in patients with heart failure: insights into pathogenesis of disease progression and potential novel treatment targets. Eur J Heart Fail 2019; https://doi.org/10.1002/ejhf.1608.
48. Cleland JGF, Van Veldhuisen DJ, Ponikowski P. The year in cardiology 2018: heart failure. Eur Heart J 2019; 40: 651–661.
49. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, Gonzalez-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37: 2129–2200.
50. Wehner GJ, Jing L, Haggerty CM, Suever JD, Leader JB, Hartzel DN, Kirchner HL, Manus JNA, James N, Ayar Z, Gladding P, Good CW, Cleland JGF, Fornwalt BK. Routinely reported ejection fraction and mortality in clinical practice: where does the nadir of risk lie? Eur Heart J 2019; https://doi.org/10.1093/eurheartj/ehz550.
51. Seferovic PM, Ponikowski P, Anker SD, Bauersachs J, Chioncel O, Cleland JGF, Boer RA, Drexel H, Ben Gal T, Hill L, Jaarsma T, Jankowska EA, Anker MS, Lainscak M, Lewis BS, McDonagh T, Metra M, Milicic D, Mullens W, Piepoli MF, Rosano G, Ruschitzka F, Volterrani M, Voors AA, Filippatos G, Coats AJS. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of The Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2019; 21: 1169–1186.
52. Obokata M, Reddy YNV, Melenovsky V, Pislaru S, Borlaug BA. Deterioration in right ventricular structure and function over time in patients with heart failure and preserved ejection fraction. Eur Heart J 2019; 40: 689–697.
53. Pellicori P, Urbinati A, Kaur K, Zhang J, Shah P, Kazmi S, Capucci A, Cleland JGF, Clark AL. Prevalence and incidence of atrial fibrillation in ambulatory patients with heart failure. Am J Cardiol 2019; 124: 1554–1560.
54. Anderson SG, Shoaib A, Myint PK, Cleland JG, Hardman SM, McDonagh TA, Dargie H, Keavney B, Garratt CJ, Mamas MA. Does rhythm matter in acute heart failure? An insight from the British Society for Heart Failure National Audit. Clin Res Cardiol 2019; 108: 1276–1286.
55. Packer M. Effect of catheter ablation on pre-existing abnormalities of left atrial systolic, diastolic, and neurohormonal functions in patients with chronic heart failure and atrial fibrillation. Eur Heart J 2019; 40: 1873–1879.
56. Chen S, Purerfellner H, Meyer C, Acou WJ, Schratter A, Ling Z, Liu S, Yin Y, Martinek M, Kiuchi MG, Schmidt B, Chun KRJ. Rhythm control for patients with atrial fibrillation complicated with heart failure in the contemporary era of catheter ablation: a stratified pooled analysis of randomized data. Eur Heart J 2019; https://doi.org/10.1093/eurheartj/ehz443.
57. Barra S, Duehmke R, Providencia R, Narayanan K, Reitan C, Roubicek T, Polasek R, Chow A, Defaye P, Fauchier L, Piot O, Deharo JC, Sadoul N, Klug D, Garcia R, Dockrill S, Virdee M, Pettit S, Agarwal S, Borgquist R, Marijon E, Boveda S. Very long-term survival and late sudden cardiac death in cardiac resynchronization therapy patients. Eur Heart J 2019; 40: 2121–2127.
58. Barra S, Providencia R, Narayanan K, Boveda S, Duehmke R, Garcia R, Leyva F, Roger V, Jouven X, Agarwal S, Levy WC, Marijon E. Time trends in sudden cardiac death risk in heart failure patients with cardiac resynchronization therapy: a systematic review. Eur Heart J 2019; https://doi.org/10.1093/eurheartj/ehz773.
59. Cleland JGF, Hindricks G, Petrie M. The shocking lack of evidence for implantable cardioverter defibrillators for heart failure; with or without cardiac resynchronization. Eur Heart J 2019; 40: 2128–2130.
60. Halliday BP, Baksi AJ, Gulati A, Ali A, Newsome S, Izgi C, Arzanauskaite M, Lota A, Tayal U, Vassiliou VS, Gregson J, Alpendurada F, Frenneaux MP, Cook SA, Cleland JGF, Pennell DJ, Prasad SK. Outcome in dilated cardiomyopathy related to the extent, location, and pattern of late gadolinium enhancement. JACC Cardiovasc Imaging 2019; 12: 1645–1655.
61. Rorth R, Dewan P, Kristensen SL, Jhund PS, Petrie MC, Kober L, McMurray J. Efficacy of an implantable cardioverter-defibrillator in patients with diabetes and heart failure and reduced ejection fraction. Clin Res Cardiol 2019; 108: 868–877.
62. Rossello X, Ariti C, Pocock SJ, Ferreira JP, Girerd N, McMurray JJV, Van Veldhuisen DJ, Pitt B, Zannad F. Impact of mineralocorticoid receptor antagonists on the risk of sudden cardiac death in patients with heart failure and left-ventricular systolic dysfunction: an individual patient-level meta-analysis of three randomized-controlled trials. Clin Res Cardiol 2019; 108: 477–486.
63. Nikolaidou T, Johnson MJ, Ghosh JM, Marincowitz C, Shah S, Lammiman MJ, Schilling RJ, Clark AL. Postmortem ICD interrogation in mode of death classification. J Cardiovasc Electrophysiol 2018; 29: 573–583.
64. Leclercq C, Burri H, Curnis A, Delnoy PP, Rinaldi CA, Sperzel J, Lee K, Calo L, Vicentini A, Concha JF, Thibault B. Cardiac resynchronization therapy non-responder to responder conversion rate in the more response to cardiac resynchronization therapy with MultiPoint Pacing (MORE-CRT MPP) study: results from Phase I. Eur Heart J 2019; 40: 2979–2987.
65. Asch FM, Grayburn PA, Siegel RJ, Kar S, Lim DS, Zaroff JG, Mishell JM, Whisenant B, Mack MJ, Lindenfeld J, Abraham WT, Stone GW, Weissman NJ. Echocardiographic outcomes after transcatheter leaflet approximation in patients with secondary mitral regurgitation: the COAPT trial. J Am Coll Cardiol 2019; 74: 2969–2979.
66. Baron SJ, Wang K, Arnold SV, Magnuson EA, Whisenant B, Brieke A, Rinaldi M, Asgar AW, Lindenfeld J, Abraham WT, Mack MJ, Stone GW, Cohen DJ; On behalf of the COAPT Investigators. Cost-effectiveness of transcatheter mitral valve repair versus medical therapy in patients with heart failure and secondary mitral regurgitation: results from the COAPT trial. Circulation 2019; 140: 1881–1891.
67. Arnold SV, Chinnakondepalli KM, Spertus JA, Magnuson EA, Baron SJ, Kar S, Lim DS, Mishell JM, Abraham WT, Lindenfeld JA, Mack MJ, Stone GW, Cohen DJ. Health status after transcatheter mitral-valve repair in heart failure and secondary mitral regurgitation: COAPT trial. J Am Coll Cardiol 2019; 73: 2123–2132.
68. Stone GW, Lindenfeld J, Abraham WT, Kar S, Lim DS, Mishell JM, Whisenant B, Grayburn PA, Rinaldi M, Kapadia SR, Rajagopal V, Sarembock IJ, Brieke A, Marx SO, Cohen DJ, Weissman NJ, Mack MJ. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med 2018; 379: 2307–2318.
69. Iung B, Armoiry X, Vahanian A, Boutitie F, Mewton N, Trochu JN, Lefèvre T, Messika-Zeitoun D, Guerin P, Cormier B, Brochet E, Thibault H, Himbert D, Thivolet S, Leurent G, Bonnet G, Donal E, Piriou N, Piot C, Habib G, Rouleau F, Carrié D, Nejjari M, Ohlmann P, Saint Etienne C, Leroux L, Gilard M, Samson G, Rioufol G, Maucort-Boulch D, Obadia JF, Obadia JF; on behalf of the MITRA-FR Investigators. Percutaneous repair or medical treatment for secondary mitral regurgitation: outcomes at 2 years. Eur J Heart Fail 2019; https://doi.org/10.1002/ejhf.1616.
70. Grayburn PA, Sannino A, Packer M. Proportionate and disproportionate functional mitral regurgitation: a new conceptual framework that reconciles the results of the MITRA-FR and COAPT trials. JACC Cardiovasc Imaging 2019; 12: 353–362.
71. Packer M, Grayburn PA. Contrasting effects of pharmacological, procedural, and surgical interventions on proportionate and disproportionate functional mitral regurgitation in chronic heart failure. Circulation 2019; 140: 779–789.
72. Witte KK, Lipiecki J, Siminiak T, Meredith IT, Malkin CJ, Goldberg SL, Stark MA, von Bardeleben RS, Cremer PC, Jaber WA, Celermajer DS, Kaye DM, Sievert H. The REDUCE FMR trial: a randomized sham-controlled study of percutaneous mitral annuloplasty in functional mitral regurgitation. JACC Heart Fail 2019; 7: 945–955.
73. Nickenig G, Weber M, Lurz P, von Bardeleben RS, Sitges M, Sorajja P, Hausleiter J, Denti P, Trochu JN, Nabauer M, Dahou A, Hahn RT. Transcatheter edge-to-edge repair for reduction of tricuspid regurgitation: 6-month outcomes of the TRILUMINATE single-arm study. Lancet 2019; 394: 2002–2011.
74. Taramasso M, Benfari G, van der Bijl P, Alessandrini H, Attinger-Toller A, Biasco L, Lurz P, Braun D, Brochet E, Connelly KA, de BS, Denti P, Deuschl F, Estevez-Loureiro R, Fam N, Frerker C, Gavazzoni M, Hausleiter JR, Ho E, Juliard JM, Kaple R, Besler C, Kodali S, Kreidel F, Kuck KH, Latib A, Lauten A, Monivas V, Mehr M, Muntane-Carol G, Nazif T, Nickening G, Pedrazzini G, Philippon F, Pozzoli A, Praz F, Puri R, Rodes-Cabau J, Scha FU, Schofer J, Sievert H, Tang GHL, Thiele H, Topilsky Y, Rommel KP, Delgado V, Vahanian A, von Bardeleben RS, Webb JG, Weber M, Windecker S, Winkel M, Zuber M, Leon MB, Hahn RT, Bax JJ, Enriquez-Sarano M, Maisano F. Transcatheter versus medical treatment of symptomatic severe tricuspid regurgitation. J Am Coll Cardiol 2019; 74: 2998–3008.
75. Branch KR, Probstfield JL, Eikelboom JW, Bosch J, Maggioni AP, Cheng RK, Bhatt DL, Avezum A, Fox KAA, Connolly SJ, Shestakovska O, Yusuf S. Rivaroxaban with or without aspirin in patients with heart failure and chronic coronary or peripheral artery disease: the COMPASS trial. Circulation 2019; 140: 529–537.
76. Cleland JGF, Pellicori P. Myocardial dysfunction and coronary artery disease as therapeutic targets in heart failure. Circulation 2019; 140: 538–541.
77. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
78. McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Bělohlávek J, Böhm M, Chiang C-E, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukát A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Merkely B, Nicolau JC, O’Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjöstrand M, Langkilde A-M; DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995–2008.
79. Greenberg B, Neaton JD, Anker SD, Byra WM, Cleland JGF, Deng H, Fu M, La Police DA, Lam CSP, Mehra MR, Nessel CC, Spiro TE, Van Veldhuisen DJ, Vanden Boom CM, Zannad F. Association of rivaroxaban with thromboembolic events in patients with heart failure, coronary disease, and sinus rhythm: a post hoc analysis of the COMMANDER HF trial. JAMA Cardiol 2019; 4: 515.
80. Mehra MR, Vaduganathan M, Fu M, Ferreira JP, Anker SD, Cleland JGF, Lam CSP, Van Veldhuisen DJ, Byra WM, Spiro TE, Deng H, Zannad F, Greenberg B. A comprehensive analysis of the effects of rivaroxaban on stroke or transient ischaemic attack in patients with heart failure, coronary artery disease, and sinus rhythm: the COMMANDER HF trial. Eur Heart J 2019; 40: 3593–3602.
81. Morrow DA, Velazquez EJ, DeVore AD, Prescott MF, Duffy CI, Gurmu Y, McCague K, Rocha R, Braunwald E. Cardiovascular biomarkers in patients with acute decompensated heart failure randomized to sacubitril-valsartan or enalapril in the PIONEER-HF trial. Eur Heart J 2019; 40: 3345–3352.
82. Wachter R, Senni M, Belohlavek J, Straburzynska-Migaj E, Witte KK, Kobalava Z, Fonseca C, Goncalvesova E, Cavusoglu Y, Fernandez A, Chaaban S, Bohmer E, Pouleur AC, Mueller C, Tribouilloy C, Lonn E, Buraiki AL, Gniot J, Mozheiko M, Lelonek M, Noe A, Schwende H, Bao W, Butylin D, Pascual-Figal D. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019; 21: 998–1007.
83. Desai AS, Solomon SD, Shah AM, Claggett BL, Fang JC, Izzo J, McCague K, Abbas CA, Rocha R, Mitchell GF. Effect of sacubitril-valsartan vs enalapril on aortic stiffness in patients with heart failure and reduced ejection fraction: a randomized clinical trial. JAMA 2019; https://doi.org/10.1001/jama.2019.12843.
84. Januzzi JLJr, Prescott MF, Butler J, Felker GM, Maisel AS, McCague K, Camacho A, Pina IL, Rocha RA, Shah AM, Williamson KM, Solomon SD. Association of change in N-terminal pro-B-type natriuretic peptide following initiation of sacubitril-valsartan treatment with cardiac structure and function in patients with heart failure with reduced ejection fraction. JAMA 2019; https://doi.org/10.1001/jama.2019.12821.
85. Kang DH, Park SJ, Shin SH, Hong GR, Lee S, Kim MS, Yun SC, Song JM, Park SW, Kim JJ. Angiotensin receptor neprilysin inhibitor for functional mitral regurgitation. Circulation 2019; 139: 1354–1365.
86. Zile MR, O’Meara E, Claggett B, Prescott MF, Solomon SD, Swedberg K, Packer M, McMurray JJV, Shi V, Lefkowitz M, Rouleau J. Effects of sacubitril/valsartan on biomarkers of extracellular matrix regulation in patients with HFrEF. J Am Coll Cardiol 2019; 73: 795–806.
87. óKrum H, Elsik M, Schneider HG, Ptaszynska A, Black M, Carson PE, Komajda M, Massie BM, McKelvie RS, McMurray JJ, Zile MR, Anand IS. Relation of peripheral collagen markers to death and hospitalization in patients with heart failure and preserved ejection fraction: results of the I-PRESERVE collagen substudy. Circ Heart Fail 2011; 4: 561–568.
88. Solomon SD, Rizkala AR, Lefkowitz MP, Shi VC, Gong J, Anavekar N, Anker SD, Arango JL, Arenas JL, Atar D, Ben-Gal T, Boytsov SA, Chen CH, Chopra VK, Cleland J, Comin-Colet J, Duengen HD, Echeverria Correa LE, Filippatos G, Flammer AJ, Galinier M, Godoy A, Goncalvesova E, Janssens S, Katova T, Kober L, Lelonek M, Linssen G, Lund LH, O’Meara E, Merkely B, Milicic D, Oh BH, Perrone SV, Ranjith N, Saito Y, Saraiva JF, Shah S, Seferovic PM, Senni M, Sibulo ASJr, Sim D, Sweitzer NK, Taurio J, Vinereanu D, Vrtovec B, Widimsky JJr, Yilmaz MB, Zhou J, Zweiker R, Anand IS, Ge J, Lam CSP, Maggioni AP, Martinez F, Packer M, Pfeffer MA, Pieske B, Redfield MM, Rouleau JL, Van Veldhuisen DJ, Zannad F, Zile MR, McMurray JJV. Baseline characteristics of patients with heart failure and preserved ejection fraction in the PARAGON-HF trial. Circ Heart Fail 2018; 11: e004962.
89. Cleland JGF, Tendera M, Adamus J, Freemantle N, Polonski L, Taylor J; on behalf of PEP-CHF Investigators. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27: 2338–2345.
90. Parthasarathy HK, Pieske B, Weisskopf M, Andrews CD, Brunel P, Struthers AD, MacDonald TM. A randomized, double-blind, placebo-controlled study to determine the effects of valsartan on exercise time in patients with symptomatic heart failure with preserved ejection fraction. Eur J Heart Fail 2009; 11: 980–989.
91. Solomon SD, McMurray JJV, Anand IS, Ge J, Lam CSP, Maggioni AP, Martinez F, Packer M, Pfeffer MA, Pieske B, Redfield MM, Rouleau JL, Van Veldhuisen DJ, Zannad F, Zile MR, Desai AS, Claggett B, Jhund PS, Boytsov SA, Comin-Colet J, Cleland J, Dungen HD, Goncalvesova E, Katova T, Kerr Saraiva JF, Lelonek M, Merkely B, Senni M, Shah SJ, Zhou J, Rizkala AR, Gong J, Shi VC, Lefkowitz MP. Angiotensin-neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019; 381: 1609–1620.
92. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, Stoyanovsky V, Antikainen RL, Nikitin Y, Anderson C, Belhani A, Forette F, Rajkumar C, Thijs L, Banya W, Bulpitt CJ. Treatment of hypertension in patients 80 years of age or older. N Engl J Med 2008; 358: 1887–1898.
93. Solomon SD, Vaduganathan M, Claggett BL, Packer M, Zile M, Swedberg K, Rouleau J, Pfeffer MA, Desai A, Lund LH, Koeber L, Anand I, Sweitzer NK, Linssen G, Merkely B, Arango JL, Vinereanu D, Chen CH, Senni M, Sibulo A, Boytsov S, Shi V, Rizkala A, Lefkowitz M, McMurray J. Sacubitril/valsartan across the spectrum of ejection fraction in heart failure. Circulation 2019; https://doi.org/10.1161/CIRCULATIONAHA.119.044586.
94. McMurray JJV, Jackson AM, Lam CSP, Redfield MM, Anand IS, Ge J, Lefkowitz MP, Maggioni AP, Martinez F, Packer M, Pfeffer MA, Pieske B, Rizkala AR, Sabarwal SV, Shah AM, Shah SJ, Shi VC, Van Veldhuisen DJ, Zannad F, Zile MR, Cikes M, Goncalvesova E, Katova T, Kosztin A, Lelonek M, Sweitzer NK, Vardeny O, Claggett B, Jhund PS, Solomon SD. Effects of sacubitril-valsartan, versus valsartan, in women compared to men with heart failure and preserved ejection fraction: insights from PARAGON-HF. Circulation 2019; https://doi.org/10.1161/CIRCULATIONAHA.119.044491.
95. Vaduganathan M, Claggett BL, Desai AS, Anker SD, Perrone SV, Janssens S, Milicic D, Arango JL, Packer M, Shi VC, Lefkowitz MP, McMurray JJV, Solomon SD. Prior heart failure hospitalization, clinical outcomes, and response to sacubitril/valsartan compared with valsartan in HFpEF. J Am Coll Cardiol 2019 Nov 6. pii: S0735-1097(19)38299-3. https://doi.org/10.1016/j.jacc.2019.11.003. [Epub ahead of print].
96. Dewan P, Rorth R, Jhund PS, Shen L, Raparelli V, Petrie MC, Abraham WT, Desai AS, Dickstein K, Kober L, Mogensen UM, Packer M, Rouleau JL, Solomon SD, Swedberg K, Zile MR, McMurray J. Differential impact of heart failure with reduced ejection fraction on men and women. J Am Coll Cardiol 2019; 73: 29–40.
97. Chandra A, Vaduganathan M, Lewis EF, Claggett BL, Rizkala AR, Wang W, Lefkowitz MP, Shi VC, Anand IS, Ge J, Lam CSP, Maggioni AP, Martinez F, Packer M, Pfeffer MA, Pieske B, Redfield MM, Rouleau JL, Van Veldhuisen DJ, Zannad F, Zile MR, McMurray JJV, Solomon SD. Health-related quality of life in heart failure with preserved ejection fraction: the PARAGON-HF trial. JACC Heart Fail 2019; 7: 862–874.
98. Santema BT, Ouwerkerk W, Tromp J, Sama IE, Ravera A, Regitz-Zagrosek V, Hillege H, Samani NJ, Zannad F, Dickstein K, Lang CC, Cleland JG, Ter Maaten JM, Metra M, Anker SD, van der Harst P, Ng LL, van der Meer P, van Veldhuisen DJ, Meyer S, Lam CSP, Voors AA, Richards AM, Lam CSP, Anand I, Hung C-L, Ling LH, Liew HB, Narasimhan C, Ngarmukos T, Park SW, Reyes E, Siswanto BB, Shimizu W, Zhang S. Identifying optimal doses of heart failure medications in men compared with women: a prospective, observational, cohort study. Lancet 2019; 394: 1254–1263.
99. Merrill M, Sweitzer NK, Lindenfeld J, Kao DP. Sex differences in outcomes and responses to spironolactone in heart failure with preserved ejection fraction: a secondary analysis of TOPCAT trial. JACC Heart Fail 2019; 7: 228–238.
100. Linde C, Cleland JGF, Gold MR, Claude DJ, Tang ASL, Young JB, Sherfesee L, Abraham WT. The interaction of sex, height, and QRS duration on the effects of cardiac resynchronization therapy on morbidity and mortality: an individual-patient data meta-analysis. Eur J Heart Fail 2018; 20: 780–791.
101. Eickhoff MK, Dekkers CCJ, Kramers BJ, Laverman GD, Frimodt-Moller M, Jorgensen NR, Faber J, Danser AHJ, Gansevoort RT, Rossing P, Persson F, Heerspink H. Effects of dapagliflozin on volume status when added to renin-angiotensin system inhibitors. J Clin Med 2019; 8: E779.
102. Dekkers CCJ, Sjostrom CD, Greasley PJ, Cain V, Boulton DW, Heerspink H. Effects of the sodium-glucose co-transporter-2 inhibitor dapagliflozin on estimated plasma volume in patients with type 2 diabetes. Diabetes Obes Metab 2019; 21: 2667–2673.
103. Cefalo CMA, Cinti F, Moffa S, Impronta F, Sorice GP, Mezza T, Pontecorvi A, Giaccari A. Sotagliflozin, the first dual SGLT inhibitor: current outlook and perspectives. Cardiovasc Diabetol 2019; 18: 20.
104. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2117–2128.
105. Yang DY, He X, Liang HW, Zhang SZ, Zhong XB, Luo CF, Du ZM, He JG, Zhuang XD, Liao XX. Comparative outcomes of heart failure among existent classes of anti-diabetic agents: a network meta-analysis of 171, 253 participants from 91 randomized controlled trials. Cardiovasc Diabetol 2019; 18: 47.
106. Zelniker TA, Wiviott SD, Raz I, Im K, Goodrich EL, Furtado RHM, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Sabatine MS. Comparison of the effects of glucagon-like peptide receptor agonists and sodium-glucose cotransporter 2 inhibitors for prevention of major adverse cardiovascular and renal outcomes in type 2 diabetes mellitus. Circulation 2019; 139: 2022–2031.
107. Kristensen SL, Rorth R, Jhund PS, Docherty KF, Sattar N, Preiss D, Kober L, Petrie MC, McMurray J. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019; 7: 776–785.
108. Shen L, Rorth R, Cosmi D, Kristensen SL, Petrie MC, Cosmi F, Latini R, Kober L, Anand IS, Carson PE, Granger CB, Komajda M, McKelvie RS, Solomon SD, Staszewsky L, Swedberg K, Huynh T, Zile MR, Jhund PS, McMurray J. Insulin treatment and clinical outcomes in patients with diabetes and heart failure with preserved ejection fraction. Eur J Heart Fail 2019; 21: 974–984.
109. Zelniker TA, Wiviott SD, Raz I, Im K, Goodrich EL, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Furtado RHM, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Sabatine MS. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393: 31–39.
110. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS; DECLARE–TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019; 380: 347–357.
111. Kato ET, Silverman MG, Mosenzon O, Zelniker TA, Cahn A, Furtado RHM, Kuder J, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Bonaca MP, Ruff CT, Desai AS, Goto S, Johansson PA, Gause-Nilsson I, Johanson P, Langkilde AM, Raz I, Sabatine MS, Wiviott SD. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus. Circulation 2019; 139: 2528–2536.
112. McMurray JJV, DeMets DL, Inzucchi SE, Kober L, Kosiborod MN, Langkilde AM, Martinez FA, Bengtsson O, Ponikowski P, Sabatine MS, Sjostrand M, Solomon SD; on behalf of the DAPA-HF Committees and Investigators. The Dapagliflozin And Prevention of Adverse-outcomes in Heart Failure (DAPA-HF) trial: baseline characteristics. Eur J Heart Fail 2019; 21: 1402–1411.
113. Martinez FA, Serenelli M, Nicolau JC, Petrie MC, Chiang CE, Tereshchenko S, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Ponikowski P, Sabatine MS, DeMets DL, Dutkiewicz-Piasecka M, Bengtsson O, Sjostrand M, Langkilde AM, Jhund PS, McMurray J. Efficacy and safety of dapagliflozin in heart failure with reduced ejection fraction according to age: insights from DAPA-HF. Circulation 2019; https://doi.org/10.1161/CIRCULATIONAHA.119.044133.
114. Kosiborod MN, Jhund P, Docherty KF, Diez M, Petrie MC, Verma S, Nicolau JC, Merkely B, Kitakaze M, DeMets DL, Inzucchi SE, Koeber L, Martinez FA, Ponikowski P, Sabatine MS, Solomon SD, Bengtsson O, Lindholm D, Niklasson A, Sjostrand M, Langkilde AM, McMurray J. Effects of dapagliflozin on symptoms, function and quality of life in patients with heart failure and reduced ejection fraction: results from the DAPA-HF trial. Circulation 2019; https://doi.org/10.1161/CIRCULATIONAHA.119.044138.
115. Nassif ME, Windsor SL, Tang F, Khariton Y, Husain M, Inzucchi SE, Mc-Guire DK, Pitt B, Scirica BM, Austin B, Drazner MH, Fong MW, Givertz MM, Gordon RA, Jermyn R, Katz SD, Lamba S, Lanfear DE, LaRue SJ, Lindenfeld J, Malone M, Margulies K, Mentz RJ, Mutharasan RK, Pursley M, Umpierrez G, Kosiborod M; On behalf of the DEFINE-HF Investigators. Dapagliflozin effects on biomarkers, symptoms, and functional status in patients with heart failure with reduced ejection fraction: the DEFINE-HF trial. Circulation 2019; 140: 1463–1476.
116. Packer M, Anker SD, Butler J, Filippatos G, Zannad F. Effects of sodium-glucose cotransporter 2 inhibitors for the treatment of patients with heart failure: proposal of a novel mechanism of action. JAMA Cardiol 2017; 2: 1025–1029.
117. Mazer CD, Hare GMT, Connelly PW, Gilbert RE, Shehata N, Quan A, Teoh H, Leiter LA, Zinman B, Juni P, Zuo F, Mistry N, Thorpe KE, Goldenberg RM, Yan AT, Connelly KA, Verma S. Effect of empagliflozin on erythropoietin levels, iron stores and red blood cell morphology in patients with type 2 diabetes and coronary artery disease. Circulation 2019; https://doi.org/10.1161/CIRCULATIONAHA.119.044235.
118. Swedberg K, Young JB, Anand S, Cheng S, Desai AS, Diaz R, Maggioni AP, McMurray JJ, O’Connor CM, Pfeffer MA, Solomon SD, Sun Y, Tendera M, Van Veldhuisen DJ; RED-HF Committees, RED-HF Investigators. Treatment of anemia with darbepoetin alfa in systolic heart failure. N Engl J Med 2013; 368: 1210–1219.
119. Packer M. Do sodium-glucose co-transporter-2 inhibitors prevent heart failure with a preserved ejection fraction by counterbalancing the effects of leptin? A novel hypothesis. Diabetes Obes Metab 2018; 20: 1361–1366.
120. Nielsen R, Møller N, Gormsen LC, Tolbod LP, Hansson NH, Sorensen J, Harms HJ, Frøkiær J, Eiskjaer H, Jespersen NR, Mellemkjaer S, Lassen TR, Pryds K, Bøtker HE, Wiggers H. Cardiovascular effects of treatment with the ketone body 3-hydroxybutyrate in chronic heart failure patients. Circulation 2019; 139: 2129–2141.
121. Verma S, Mazer CD, Yan AT, Mason T, Garg V, Teoh H, Zuo F, Quan A, Farkouh ME, Fitchett DH, Goodman SG, Goldenberg RM, Al-Omran M, Gilbert RE, Bhatt DL, Leiter LA, Juni P, Zinman B, Connelly KA; For the EMPA-HEART CardioLink-6 Investigators. Effect of empagliflozin on left ventricular mass in patients with type 2 diabetes mellitus and coronary artery disease: the EMPA-HEART cardiolink-6 randomized clinical trial. Circulation 2019; 140: 1693–1702.
122. Packer M, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, Kimura K, Zeller C, George J, Brueckmann M, Anker SD, Zannad F; on behalf of the EMPEROR-Reduced Trial Committees and Investigators. Evaluation of the effect of sodium-glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality of patients with chronic heart failure and a reduced ejection fraction: rationale for and design of the EMPEROR-Reduced trial. Eur J Heart Fail 2019; 21: 1270–1278.
123. Anker SD, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, Kimura K, Zeller C, George J, Brueckmann M, Zannad F, Packer M; on behalf of the EMPEROR-Preserved Trial Committees and Investigators. Evaluation of the effects of sodium-glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality in patients with chronic heart failure and a preserved ejection fraction: rationale for and design of the EMPEROR-Preserved Trial. Eur J Heart Fail 2019; 21: 1279–1287.
124. Maggioni AP, Lopez-Sendon J, Nielsen OW, Hallen J, Aalamian-Mattheis M, Wang Y, Ertl G. Efficacy and safety of serelaxin when added to standard of care in patients with acute heart failure: results from a PROBE study, RELAX-AHF-EU. Eur J Heart Fail 2019; 21: 322–333.
125. Metra M, Teerlink JR, Cotter G, Davison BA, Felker GM, Filippatos G, Greenberg BH, Pang PS, Ponikowski P, Voors AA, Adams KF, Anker SD, Arias-Mendoza A, Avendano P, Bacal F, Bohm M, Bortman G, Cleland JGF, Cohen-Solal A, Crespo-Leiro MG, Dorobantu M, Echeverria LE, Ferrari R, Goland S, Goncalvesova E, Goudev A, Kober L, Lema-Osores J, Levy PD, McDonald K, Manga P, Merkely B, Mueller C, Pieske B, Silva-Cardoso J, Spinar J, Squire I, Stepinska J, van MW, von LD, Wikstrom G, Yilmaz MB, Hagner N, Holbro T, Hua TA, Sabarwal SV, Severin T, Szecsody P, Gimpelewicz C; RELAX-AHF-2 Committees Investigators. Effects of serelaxin in patients with acute heart failure. N Engl J Med 2019; 381: 716–726.
126. Kozhuharov N, Goudev A, Flores D, Maeder MT, Walter J, Shrestha S, Gualandro DM, de Oliveira Junior MT, Sabti Z, Müller B, Noveanu M, Socrates T, Ziller R, Bayés-Genís A, Sionis A, Simon P, Michou E, Gujer S, Gori T, Wenzel P, Pfister O, Conen D, Kapos I, Kobza R, Rickli H, Breidthardt T, Münzel T, Erne P, Mueller C; GALACTIC Investigators. Effect of a strategy of comprehensive vasodilation vs usual care on mortality and heart failure rehospitalization among patients with acute heart failure: The GALACTIC Randomized Clinical Trial. JAMA 2019; 322: 2292–2302.
127. Mebazaa A, Pang PS, Tavares M, Collins SP, Storrow AB, Laribi S, Andre S, Courtney DM, Hasa J, Spinar J, Masip J, Peacock WF, Sliwa K, Gayat E, Filippatos G, Cleland JGF, Gheorghiade M. The impact of early standard therapy on dyspnoea in patients with acute heart failure: the URGENT-dyspnoea study. Eur Heart J 2010; 31: 832–841.
128. Biegus J, Zymlinski R, Siwolowski P, Testani J, Szachniewicz J, Tycińska A, Banasiak W, Halpert A, Levin H, Ponikowski P. Controlled decongestion by reprieve therapy in acute heart failure: results of the TARGET-1 and TARGET-2 studies. Eur J Heart Fail 2019; 21: 1079–1087.
129. Keeble TR, Karamasis GV, Rothman MT, Ricksten SE, Ferrari M, Hullin R, Schersten F, Reitan O, Kirking ST, Cleland JGF, Smith EJ. Percutaneous haemodynamic and renal support in patients presenting with decompensated heart failure: a multi-centre efficacy study using the Reitan Catheter Pump (RCP). Int J Cardiol 2019; 275: 53–58.
130. Yau TM, Pagani FD, Mancini DM, Chang HL, Lala A, Woo YJ, Acker MA, Selzman CH, Soltesz EG, Kern JA, Maltais S, Charbonneau E, Pan S, Marks ME, Moquete EG, O’Sullivan KL, Taddei-Peters WC, McGowan LK, Green C, Rose EA, Jeffries N, Parides MK, Weisel RD, Miller MA, Hung J, O’Gara PT, Moskowitz AJ, Gelijns AC, Bagiella E, Milano CA; for the Cardiothoracic Surgical Trials Network. Intramyocardial injection of mesenchymal precursor cells and successful temporary weaning from left ventricular assist device support in patients with advanced heart failure: a randomized clinical trial. JAMA 2019; 321: 1176–1186.
131. Garcia-Pavia P, Kim Y, Restrepo-Cordoba MA, Lunde IG, Wakimoto H, Smith AM, Toepfer CN, Getz K, Gorham J, Patel P, Ito K, Willcox JA, Arany Z, Li J, Owens AT, Govind R, Nunez B, Mazaika E, Bayes-Genis A, Walsh R, Finkelman B, Lupon J, Whiffin N, Serrano I, Midwinter W, Wilk A, Bardaji A, Ingold N, Buchan R, Tayal U, Pascual-Figal DA, de MA, Ahmad M, Garcia-Pinilla JM, Pantazis A, Dominguez F, John BA, O’Regan DP, Rosen SD, Prasad SK, Lara-Pezzi E, Provencio M, Lyon AR, Alonso-Pulpon L, Cook SA, DePalma SR, Barton PJR, Aplenc R, Seidman JG, Ky B, Ware JS, Seidman CE. Genetic variants associated with cancer therapy-induced cardiomyopathy. Circulation 2019; 140: 31–41.
132. Yu AF, Yadav NU, Lung BY, Eaton AA, Thaler HT, Hudis CA, Dang CT, Steingart RM. Trastuzumab interruption and treatment-induced cardiotoxicity in early HER2-positive breast cancer. Breast Cancer Res Treat 2015; 149: 489–495.
133. Lynce F, Barac A, Geng X, Dang C, Yu AF, Smith KL, Gallagher C, Pohlmann PR, Nunes R, Herbolsheimer P, Warren R, Srichai MB, Hofmeyer M, Cunningham A, Timothee P, Asch FM, Shajahan-Haq A, Tan MT, Isaacs C, Swain SM. Prospective evaluation of the cardiac safety of HER2-targeted therapies in patients with HER2-positive breast cancer and compromised heart function: the SAFE-HEaRt study. Breast Cancer Res Treat 2019; 175: 595–603.
134. Cornell RF, Ky B, Weiss BM, Dahm CN, Gupta DK, Du L, Carver JR, Cohen AD, Engelhardt BG, Garfall AL, Goodman SA, Harrell SL, Kassim AA, Jadhav T, Jagasia M, Moslehi J, O’Quinn R, Savona MR, Slosky D, Smith A, Stadtmauer EA, Vogl DT, Waxman A, Lenihan D. Prospective study of cardiac events during proteasome inhibitor therapy for relapsed multiple myeloma. J Clin Oncol 2019; 37: 1946–1955.
135. Abuosa AM, Elshiekh AH, Qureshi K, Abrar MB, Kholeif MA, Kinsara AJ, Andejani A, Ahmed AH, Cleland J. Prophylactic use of carvedilol to prevent ventricular dysfunction in patients with cancer treated with doxorubicin. Indian Heart J 2018; 70(Suppl. 3): S96–S100.
136. Li X, Li Y, Zhang T, Xiong X, Liu N, Pang B, Ruan Y, Gao Y, Shang H, Xing Y. Role of cardioprotective agents on chemotherapy-induced heart failure: a systematic review and network meta-analysis of randomized controlled trials. Pharmacol Res 2020; 151: 104577.
137. Kapelios CJ, Lainscak M, Savarese G, Laroche C, Seferovic P, Ruschitzka F, Coats A, Anker SD, Crespo-Leiro MG, Filippatos G, Piepoli MF, Rosano G, Zanolla L, Aguiar C, Murin J, Leszek P, McDonagh T, Maggioni AP, Lund LH. Sacubitril/valsartan eligibility and outcomes in the ESC-EORP-HFA Heart Failure Long-Term Registry: bridging between European Medicines Agency/Food and Drug Administration label, the PARADIGM-HF trial, ESC guidelines, and real world. Eur J Heart Fail 2019; 21: 1383–1397.
138. Loop MS, van Dyke MK, Chen L, Safford MM, Kilgore ML, Brown TM, Durant RW, Levitan EB. Low utilization of beta-blockers among medicare beneficiaries hospitalized for heart failure with reduced ejection fraction. J Card Fail 2019; 25: 343–351.
139. Van Spall HGC, Lee SF, Xie F, Oz UE, Perez R, Mitoff PR, Maingi M, Tjandrawidjaja MC, Heffernan M, Zia MI, Porepa L, Panju M, Thabane L, Graham ID, Haynes RB, Haughton D, Simek KD, Ko DT, Connolly SJ. Effect of patient-centered transitional care services on clinical outcomes in patients hospitalized for heart failure: the PACT-HF randomized clinical trial. JAMA 2019; 321: 753–761.
140. Schulz M, Griese-Mammen N, Anker SD, Koehler F, Ihle P, Ruckes C, Schumacher PM, Trenk D, Böhm M, Laufs U; for the PHARM-CHF Investigators. Pharmacy-based interdisciplinary intervention for patients with chronic heart failure: results of the PHARM-CHF randomized controlled trial. Eur J Heart Fail 2019; 21: 1012–1021.
141. Wagenaar KP, Broekhuizen BDL, Jaarsma T, Kok I, Mosterd A, Willems FF, Linssen GCM, Agema WRP, Anneveldt S, Lucas C, Mannaerts HFJ, Wajon E, Dickstein K, Cramer MJ, Landman MAJ, Hoes AW, Rutten FH. Effectiveness of the European Society of Cardiology/Heart Failure Association website ‘heartfailurematters.org’ and an e-health adjusted care pathway in patients with stable heart failure: results of the ‘e-Vita HF’ randomized controlled trial. Eur J Heart Fail 2019; 21: 238–246.
142. Shanbhag D, Graham ID, Harlos K, Haynes RB, Gabizon I, Connolly SJ, Van Spall H. Effectiveness of implementation interventions in improving physician adherence to guideline recommendations in heart failure: a systematic review. BMJ Open 2018; 8: e017765.
143. Taylor RS, Long L, Mordi IR, Madsen MT, Davies EJ, Dalal H, Rees K, Singh SJ, Gluud C, Zwisler AD. Exercise-based rehabilitation for heart failure: Cochrane systematic review, meta-analysis, and trial sequential analysis. JACC Heart Fail 2019; 7: 691–705.
144. Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, Whellan D, O’Connor C, Keteyian SJ, Coats A, Davos CH, Dalal HM, Dracup K, Evangelista LS, Jolly K, Myers J, Nilsson BB, Passino C, Witham MD, Yeh GY. Impact of exercise rehabilitation on exercise capacity and quality-of-life in heart failure: individual participant meta-analysis. J Am Coll Cardiol 2019; 73: 1430–1443.
145. Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, O’Connor C, Whellan D, Keteyian SJ, Coats A, Davos CH, Dalal HM, Dracup K, Evangelista L, Jolly K, Myers J, McKelvie RS, Nilsson BB, Passino C, Witham MD, Yeh GY, Zwisler AO; on behalf of the ExTraMATCH II Collaboration. Impact of exercise-based cardiac rehabilitation in patients with heart failure (ExTraMATCH II) on mortality and hospitalisation: an individual patient data meta-analysis of randomised trials. Eur J Heart Fail 2018; 20: 1735–1743.
146. Long L, Mordi IR, Bridges C, Sagar VA, Davies EJ, Coats AJ, Dalal H, Rees K, Singh SJ, Taylor RS. Exercise-based cardiac rehabilitation for adults with heart failure. Cochrane Database Syst Rev 2019; 1: CD003331.
147. Takeda A, Martin N, Taylor RS, Taylor SJ. Disease management interventions for heart failure. Cochrane Database Syst Rev 2019; 1: CD002752.
148. Taylor RS, Sadler S, Dalal HM, Warren FC, Jolly K, Davis RC, Doherty P, Miles J, Greaves C, Wingham J, Hillsdon M, Abraham C, Frost J, Singh S, Hayward C, Eyre V, Paul K, Lang CC, Smith K. The cost effectiveness of REACH-HF and home-based cardiac rehabilitation compared with the usual medical care for heart failure with reduced ejection fraction: a decision model-based analysis. Eur J Prev Cardiol 2019; 26: 1252–1261.
149. Wingham J, Frost J, Britten N, Greaves C, Abraham C, Warren FC, Jolly K, Miles J, Paul K, Doherty PJ, Singh S, Davies R, Noonan M, Dalal H, Taylor RS. Caregiver outcomes of the REACH-HF multicentre randomized controlled trial of home-based rehabilitation for heart failure with reduced ejection fraction. Eur J Cardiovasc Nurs 2019; 18: 611–620.
150. Johnson MJ, Cockayne S, Currow DC, Bell K, Hicks K, Fairhurst C, Gabe R, Torgerson D, Jefferson L, Oxberry S, Ghosh J, Hogg KJ, Murphy J, Allgar V, Cleland JGF, Clark AL. Oral modified release morphine for breathlessness in chronic heart failure: a randomized placebo-controlled trial. ESC Heart Fail 2019; https://doi.org/10.1002/ehf2.12498.
151. Halliday BP, Wassall R, Lota AS, Khalique Z, Gregson J, Newsome S, Jackson R, Rahneva T, Wage R, Smith G, Venneri L, Tayal U, Auger D, Midwinter W, Whiffin N, Rajani R, Dungu JN, Pantazis A, Cook SA, Ware JS, Baksi AJ, Pennell DJ, Rosen SD, Cowie MR, Cleland JGF, Prasad SK. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet 2019; 393: 61–73.
152. Ghimire A, Fine N, Ezekowitz JA, Howlett J, Youngson E, McAlister FA. Frequency, predictors, and prognosis of ejection fraction improvement in heart failure: an echocardiogram-based registry study. Eur Heart J 2019; 40: 2110–2117.
153. Aguirre DL, Weber K, Bavendiek U, Bauersachs J, Wittes J, Yusuf S, Koch A. Digoxin-mortality: randomized vs. observational comparison in the DIG trial. Eur Heart J 2019; 40: 3336–3341.
154. Rohde LE, Rover MM, Figueiredo Neto JA, Danzmann LC, Bertoldi EG, Simoes MV, Silvestre OM, Ribeiro ALP, Moura LZ, Beck-da-Silva L, Prado D, Sant’Anna RT, Bridi LH, Zimerman A, Raupp da RP, Biolo A. Short-term diuretic withdrawal in stable outpatients with mild heart failure and no fluid retention receiving optimal therapy: a double-blind, multicentre, randomized trial. Eur Heart J 2019; 40: 3605–3612.
155. Dovancescu S, Pellicori P, Mabote T, Torabi A, Clark AL, Cleland J. The effects of short-term omission of daily medication on the pathophysiology of heart failure. Eur J Heart Fail 2017; 19: 643–649.
The year in cardiology 2016: coronary interventions
█ Current Opinion
Authors:
|
click here to read the summary |
click here to read the pdf |
The change in hospital care of patients suffering from acute myocardial infarction with ST elevation during the last decades in the county hospital, Gyula – from „armchair” to the hemodynamic laboratory
█ Original article
DOI: 10.26430/CHUNGARICA.2017.47.5.329
Authors:
|
click here to read the summary |
click here to read the pdf |
Myocardial infarction – 2016: frequency, medical care, prognosis
█ Registry
DOI: 10.26430/CHUNGARICA.2017.47.5.336
Authors:
|
click here to read the summary |
click here to read the pdf |
Transcarotid transcatheter aortic valve implantation: TC-TAVI
█ Case report
DOI: 10.26430/CHUNGARICA.2017.47.5.341
Authors:
|
click here to read the summary |
click here to read the pdf |
Balloon Pulmonary Angioplasty Chronic Thromboembolic Pulmonary Hypertension
█ Case report
DOI: 10.26430/CHUNGARICA.2017.47.5.345
Authors:
|
click here to read the summary |
click here to read the pdf |
Laser angioplasty in coronary chronic total occlusion (CTO). First hungarian experiences
█ Case report
DOI: 10.26430/CHUNGARICA.2017.47.5.351
Authors:
|
click here to read the summary |
click here to read the pdf |
Renal denervation: past, today, future?
█ Review
DOI: 10.26430/CHUNGARICA.2017.47.5.355
Authors:
|
click here to read the summary |
click here to read the pdf |
Thoughts about radiocontrast-induced nephropathy from the aspect of cardiology
█ Review
DOI: 10.26430/CHUNGARICA.2017.47.5.360
Authors:
|
click here to read the summary |
click here to read the pdf |
Revascularization or optimal medical therapy in stable coronary artery disease. Which strategy to follow?
█ Review
DOI: 10.26430/CHUNGARICA.2017.47.5.369
Authors:
|
click here to read the summary |
click here to read the pdf |
Myocardial metabolic support in patients with coronary disease treated by percutaneous interventions
█ Review
DOI: 10.26430/CHUNGARICA.2017.47.5.375
Authors:
|
click here to read the summary |
click here to read the pdf |